El linfoma de Hodgkin (LH) corresponde al 9% de todas las neoplasias en pacientes pediátricos. Es más frecuente en el género masculino y tiene 2 picos de presentación, el primero es entre la segunda y tercera década de la vida, y el segundo es aproximadamente a los 60 años. La mayor parte de esta neoplasia está constituida por un infiltrado de células inflamatorias y fibrosis, mientras que las células malignas, representan sólo del 0.1% al 10% de la población celular. Las células de Reed-Sternberg son un hallazgo clásico en el LH.
Se reporta el caso de una adolescente femenina, que debutó con insuficiencia renal aguda obstructiva secundaria a un conglomerado ganglionar retroperitoneal diagnosticado como LH, variedad celularidad mixta. En este paciente se encontró una asociación con síndrome hipereosinofílico. Aproximadamente un tercio de los pacientes con LH presentan tumor primario abdominal al diagnóstico. El síndrome hipereosinofílico como síndrome paraneoplásico, se puede encontrar en aproximadamente un 15% de todos los casos. Para poder realizar el diagnóstico, se deben descartar la presencia de leucemia, enfermedades alérgicas e infecciones parasitarias. En nuestro paciente, el tratamiento con esteroides y quimioterapia específico para LH produjo una respuesta satisfactoria, tanto en la reducción de la cuenta de eosinófilos como en el tamaño de las adenopatías. La insuficiencia renal aguda se resolvió mediante diálisis peritoneal, sin afección renal tisular por el síndrome hipereosinofílico. El involucro renal tisular no se describe como un hallazgo típico del síndrome hipereosinofílico.
Hodgkin lymphoma (Hl) accounts for 9% of malignancies in pediatric patients. it is more frequent in males and its clinical presentation has 2 peaks. The first one is between the second and third decade, and the second peak is around 60 years old. Most of the neoplastic mass is constituted by an infiltrate of inflammatory cells and fibrosis, while malignant cells represent only 0.1% to 10% of the cell population. The Reed Sternberg cell is a classic finding in Hl.
We report a case of a female teenager who develops an obstructive acute renal failure due to a retroperitoneal nodal conglomerate which was identified as mixed cellularity subtype of HL (MCHL). In this patient the association with hypereosinophilic syndrome (HES) was also found. A third of patients with HL initially presents as an abdominal primary tumor. Hypereosinophylic syndrome as a paraneoplastic disorder is found in 15% of all cases. in order to make this diagnosis, leukemia, allergic diseases and parasitic infections must be excluded. In our patient the management with steroids and HL specific chemotherapy resulted in a satisfactory response observed in the reduction of the eosinophil count and size of linfadenopathies. The acute renal failure was resolved with peritoneal dialysis without tissue injury of the kidney so, it was not affected by the hypereosinophylic syndrome. Renal tissue involvement is not described as a typical finding in HES.
Introducción
El linfoma de Hodgkin (LH) representa aproximadamente el 9% de todos los cánceres pediátricos1,2 y, aproximadamente el 0.6% de todos los cánceres diagnosticados en el mundo desarrollado cada año1,3. la incidencia es de 4 por cada 100,000 niños menores de 15 años3. En México en el 2001, se reportaron 102,657 casos de tumores malignos, de los cuales 800 correspondieron a LH4. Con pico máximo de incidencia entre 10 y 20 años, identificándose un segundo pico en pacientes por arriba de los 50 años4,5. Existe ligero predominio en hombres que en mujeres, con una relación de 1.1-1.4:1. Es más frecuente en blancos que en raza negra o asiáticos6,7.
Existen factores de riesgo descritos en la literatura como son: ambiente socioeconómico bajo, infecciosos como el virus de Epstein Barr8-10, virus linfotrópico humano tipo 1 (HTLV1) y herpes virus humano 8 (HHV-8).
Los virus de varicela, sarampión, parotiditis, rubéola y tos ferina se asocian negativamente9.
De acuerdo a la Organización Mundial de la Salud (OMS), el LH se clasifica en 1) nodular de predominio linfocítico y 2) clásico; el LH clásico incluye las variedades: esclerosis nodular, celularidad mixta, rico en linfocitos y depleción linfocitaria10. El subtipo histológico predominante también difiere según la ubicación geográfica y el progreso económico. Según la literatura internacional, el subtipo más frecuente es la esclerosis nodular, seguida por la celularidad mixta; sin embargo, en México no existe información estadística en cuanto a los subtipos de LH8.
La mayoría de los enfermos presentan adenopatías supradiafragmáticas, y sólo un tercio presentan enfermedad infradiafragmática. Pueden existir síntomas B (diaforesis nocturna, pérdida inexplicable del 10% del peso en los últimos 6 meses, y fiebre inexplicable de 38°C medida oralmente por más de 3 días6,7.
La forma habitual de diseminación es por vía linfática a zonas vecinas. El compromiso de sitios extraganglionares es raro, se presenta en menos del 5% y se da en presencia de enfermedad avanzada o muy agresiva. En aproximadamente 30% a 40% de los casos, ocurre compromiso de un sitio extra-ganglionar asociado con compromiso de ganglios linfáticos limitado a un grupo ganglionar6,11.
Para la estadificación del LH se utiliza la estadificación de Ann-Arbor-Costwold10.
La presentación clínica puede ser favorable o desfavorable. Se considera favorable cuando hay una afectación extraganglionar localizada en la ausencia de síntomas B y adenopatías de más de 10 cm a nivel mediastinal (esto es ocupar más del 33% en una radiografía de tórax)10,11. se considera desfavorable: la presencia de síntomas B, adenopatías de más de 10 cm de diámetro, linfadenopatías mediastínicas o periféricas, la extensión extranodal de la enfermedad y estadio avanzado (estadio IIIB a IV)10,12.
Los síndromes paraneoplásicos (SP) se caracterizan por patogénesis y manifestaciones clínicas diferentes asociados a neoplasias, pero que no son debidos al efecto local del tumor, ni de sus metástasis13. Estos síndromes son poco frecuentes en niños y distintos de los que se observan en los adultos con cáncer. Estas diferencias probablemente se deban a factores propios del huésped, a los distintos tipos de neoplasias o a ambos hechos. El reconocimiento de las manifestaciones paraneoplásicas es muy importante ya que permiten establecer el diagnóstico de cáncer o de recaída en forma temprana14. Los SP se clasifican como endocrinometabólicos, hematológicos, gastrointestinales, renales, cutáneos, neurológicos y otros (como osteoartropatía hipertrófica, fiebre, etc.)15.
El 15% de los pacientes con LH y el 5% con linfoma no Hodgkin de células B, pueden presentar en sangre periférica moderada eosinofilia12. Es más común en la esclerosis nodular y se ha correlacionado con la expresión de IL-5 mRNA por células Reed-Sternberg, llegando a condicionar la presencia de un síndrome eosinofílico11 caracterizados por la sobreproducción sostenida de los eosinófilos, en los que la infiltración eosinofílica y la liberación de mediadores (IL-1, IL 5 y FCGM)14-16 causan daño a múltiples órganos. Los principales órganos afectados en el síndrome hiperesinofílico son: cutáneo 58%, cardiaco 56%, neurológico 54%, digestivo 23%, pulmonar 49%, bazo 43%, hígado 30% y ojo 23%14. los criterios diagnósticos del síndrome hipereosinofílico son: a) eosinofilia en sangre periférica ≥ 1,500/microlitro de más de 6 meses, b) no hay otras causas aparentes de eosinofilia, como una infección parasitaria o una enfermedad alérgica y, c) signos o síntomas de compromiso orgánico14,17-19.
Presentación del caso
Adolescente femenina de 12 años de edad, sin antecedentes de importancia para el padecimiento actual.
Inicia 2 meses previos con vómitos, distensión abdominal, rechazo a la vía oral y anuria de 8 días de evolución, motivo de ingreso a hospital de segundo nivel de atención.
A la exploración física se encuentra con adenopatías cervicales, axilares, supraclaviculares e inguinales no dolorosas, adheridas a planos profundos, bordes delimitados, consistencia ahulada entre 1-2 cm y presencia de masa palpable en mesogastrio a expensas de conglomerado ganglionar.
Los estudios paraclínicos reportan urea de 323, creatinina 23.8 mg/dL, potasio 8.2 mEq/L, leucocitos de 32,800/mm3, 84% eosinófilos (totales de 27,552), fosfatasa alcalina 114 UI/L, colesterol 125 mg/dL, triglicéridos 162 mg/dL, cloro 110 mEq/L, sodio 146 mEq/L, calcio 8.2 mg/dL, magnesio 1.6 mg/dL, fósforo 3.5 mg/dL, ácido úrico 4.8 mg/dL, deshidrogenasa láctica 110 UI/L.
Se coloca catéter de Tenckhoff realizándose diálisis peritoneal en hospital de origen, con último reporte de laboratorio con urea de 15.6 y creatinina de 1.16, con uresis horaria de 60.5 mL/m2sc/h; se realiza biopsia ganglionar cervical izquierda con diagnóstico histopatológico de LH, por lo que se envía a Unidad de tercer nivel.
A su ingreso a la Unidad con eosinófilos totales de 8,000/mm3, se descartan causas alérgicas y parasitarias de eosinofilia y se inicia tratamiento con prednisona por 5 días a 0.2 mg/Kg/día.
Posterior al tratamiento con esteroide, la biometría hemática reporta leucocitos de 6,620, hemoglobina 12.2 g/dL, plaquetas 165,000/mm3, neutrófilos 3,500/mm3, eosinófilos 1,530/mm3, creatinina 1.18 mg/dL, urea 15.3, cloro 100.9 mEq/L, potasio 4 mEq/L, sodio 133 mEq/L, magnesio 1.6 mg/dL, fósforo 3.2 mg/dL, TGO 13 UI/L, TGP 6 UI/L, fosfatasa alcalina 100 UI/L.
La tomografía de cuello con conglomerado ganglionar bilateral de 7 a 13 cm; tomografía de tórax normal.
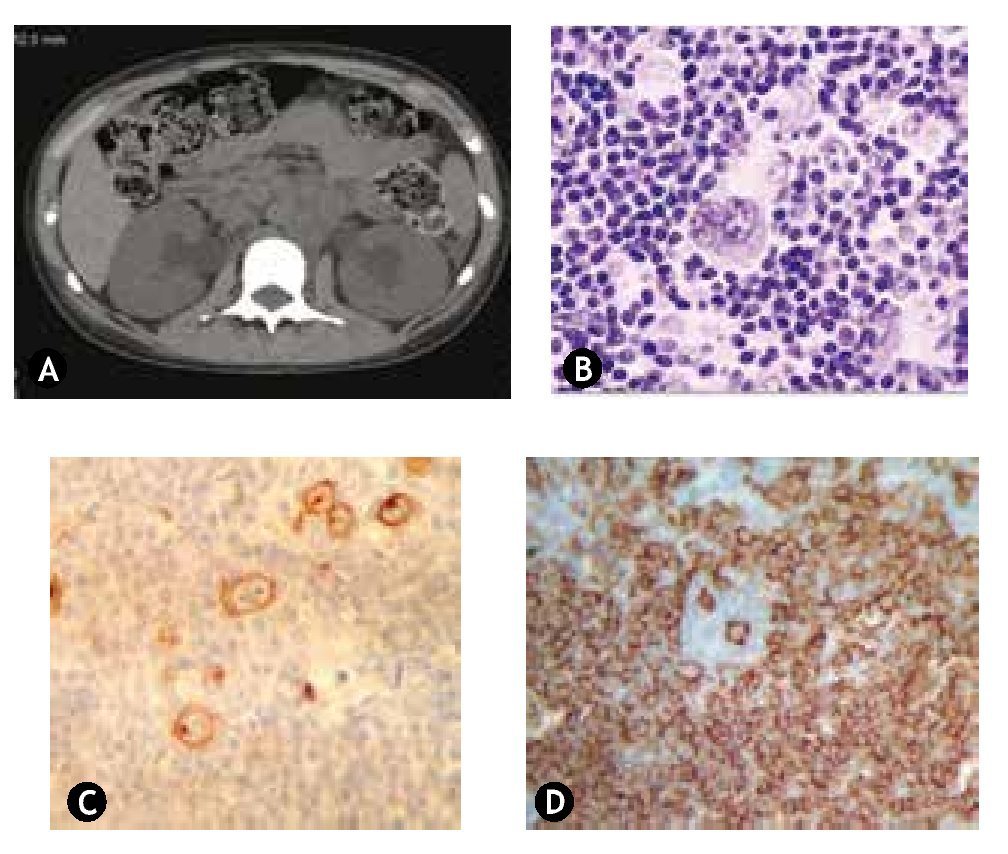
La tomografía de abdomen con conglomerado ganglionar retroperitoneal de 7.6 x 12.5 cm de longitud que comprime ambos uréteres con dilatación de sistema pielocalicial, sin hepatoesplenomegalia. Riñón izquierdo de 11.6 cm de longitud y riñón derecho de 11.9 cm de longitud (fig. 1A).
Figura 1 A) Tomografía simple de abdomen con conglomerado retroperitoneal de 7.6 x 12.5 cm de longitud, que obstruye ambos ureteros y tomografía con dilatación del sistema pielocalicial. b) Tinción de hematoxilina & eosina, en la cual se identifica los linfocitos plasmáticos y células de Reed-Sternberg de ganglio cervical derecho. c) Tinción de inmunohistoquímica marcador CD 30+, con células de Reed-Sternberg. D) Tinción de inmunohistoquímica CD 20-.
Aspirado de médula ósea con abundantes eosinófilos, normoblastos 5%, eosinófilos 65%, granulocitos jóvenes y adultos 29%, linfocitos 1%.
Se confirma el diagnóstico de LH de tipo nodular, de predominio linfocítico de ganglio cervical derecho (fig. 1B), la inmunohistoquímica reporta CD 20-, CD 30+, CD45+, CD 15+, CD 57+ (figs. C y D).
Por diagnóstico oncológico de base recibe quimioterapia con esquema AVBD convencional (doxorrubicina, bleomicina, vinblastina y dacarbacina), con disminución importante de las adenopatías cervicales, inguinales, axilares y el conglomerado abdominal, y disminución en las cifras de eosinófilos en sangre periférica hasta 23% (totales de 1,329).
Un control posterior de laboratorio a las 4 semanas del primer ciclo de quimioterapia demostró leucocitos de 4,820, hemoglobina 12.8 g/dL plaquetas 230,000/mm3, neutrófilos 4,500/mm3, eosinófilos 830/mm3, creatinina 0.50 mg/dL, urea 12, cloro 103 mEq/L, potasio 3.9 mEq/L, sodio 139 mEq/L, magnesio 1.2 mg/dL, fósforo 4.6 mg/dL, TGO 15 UI/L, TGP 12 UI/L, fosfatasa alcalina 135 UI/L.
Discusión
Este es el caso de una adolescente con diagnóstico de LH quien debuta con insuficiencia renal aguda, secundaria a compresión mecánica por conglomerado ganglionar a nivel de hilio renal bilateral.
La afección aislada de LH a nivel retroperitoneal es rara11, su forma de presentación es como masas solitarias o múltiples (como este caso), con afectación perirrenal o como enfermedad infiltrativa difusa12. En el 3% se presenta una insuficiencia renal secundaria, como se presentó en la paciente donde se aprecia en la tomografía una masa retroperitoneal que envuelve los vasos renales e invade el hilio renal, provocando hidronefrosis por atrapamiento de los uréteres. En la mayoría de los pacientes la arteria y vena renal son permeables a pesar de estar envueltos por el linfoma, lo que es un hallazgo característico de linfoma13,16,20.
Diez por ciento de las hipereosinofilias son paraneoplásicas, considerándose como un signo de mal pronóstico21, pueden encontrarse reacciones leucemoides con hipereosinofilia y prurito como parte de las manifestaciones hematológicas de los sP22. Dentro de las neoplasias en que puede aparecer eosinofilia se encuentran principalmente el LH (hasta en un 15% de casos)23 y otras neoplasias hematológicas, en concreto leucemias (sobre todo con fenotipo M4) y linfomas (no Hodgkin) (sobre todo de estirpe B24. la morfología que se observa en la médula ósea son eosinófilos con variación de tamaño celular, distribución y número de granulocitos, lo que confirmaría la causa primaria de la eosinofilia21,22,23, esto se debe a una alteración adquirida en los precursores hematopoyéticos mieloides y su afectación ocurre en las últimas etapas de diferenciación celular25.
En los tejidos afectados por el LH, las células de Reed-Sternberg y las otras poblaciones celulares (linfocitos T, B y macrófagos) establecen una compleja interacción por diver-sas citocinas. Entre ellas, la interleucina 5 parece desempeñar un papel esencial en la eosinofilia en sangre periférica dado su efecto estimulador de eosinopoyesis y su capacidad para inhibir la muerte programada de los eosinófilos26-28. los eosinófilos liberan TGF-beta 1, un estimulador de la síntesis de fibroblastos responsables de la esclerosis tisular. Además, los eosinófilos proporcionan ligandos celulares para la superfamilia de los receptores TNF (CD 30 y CD 40) expresados por las células de Reed-Sternberg, que están implicados en la transmisión de señales que regulan la proliferación o la muerte celular19,29. La eosinofilia se considera como factor de buen pronóstico en la enfermedad de Hodgkin, aunque su significado es controvertido. Inicialmente, la eosinofilia en sangre periférica se consideró capaz de predecir una evolución favorable, sin embargo, un estudio reciente parece indicar una menor supervivencia en los pacientes con mayor eosinofilia30. Los objetivos del tratamiento incluyen la supresión de las interleucinas que estimulan a los eosinófilos y el control de la expansión para evitar la transformación maligna. En teoría, los glucocorticoides podrían cumplir ambos propósitos, ya que inhiben la producción de citoquinas Th2 e interfieren con la expansión clonal de células T, dependiente de il-2 31,32.
En neoplasias tales como las de colon, estómago, pulmón o cérvix, la eosinofilia se ha considerado un factor de buen pronóstico, mientras que en el LH su significancia pronóstica es controvertida considerándose la eosinofilia periférica predictora de una evolución favorable; algunos han con- siderado la eosinofilia tisular indicador de menor supervivencia y otros no han podido demostrar que influya en el pronóstico33.
No existe en la literatura información que nos explique cómo el síndrome hipereosinofílico pueda ser la causa de insuficiencia renal, lo que se esperaría encontrar en la biopsia renal es predominio de eosinófilos, sin embargo en esta paciente no se realizó. En este caso al no tener una biopsia renal confirmatoria, la causa más probable fue la compresión mecánica ejercida por el gran conglomerado ganglionar retroperitoneal.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
* Autor para correspondencia:
Av. Félix Cuevas N° 540, Colonia Del Valle,
C.P. 03000. México D.F., México.
Teléfono: 5200 5003. Celular: (044) 5559629652.
Correo electrónico: angelus_91@hotmail.com (Yadira Janet González-Paredes).