Introducción: El cáncer de mama (CM) es la primera causa de muerte oncológica en mujeres. El CM, pulmón y carcinoma de primario desconocido son los tumores primarios que con mayor frecuencia inducen metástasis oculares (MO). El tracto uveal es la estructura ocular afectada con mayor frecuencia, por la diseminación metastásica.
Métodos: Reportamos el caso de una mujer joven con CM temprano, HER2 positivo, quien desarrolló metástasis coroidea al ojo izquierdo, como primera manifestación de actividad recurrente.
Resultados: La radioterapia externa y quimioterapia produjeron regresión completa de la lesión. La paciente cursó con metástasis al cerebelo 12 meses después de la actividad ocular tumoral, y más tarde, carcinomatosis leptomeníngea.
Conclusiones: Todas las mujeres con CM metastásico y síntomas oculares deben ser valoradas por un oftalmólogo. La radioterapia es eficaz para tratar este tipo de metástasis. Nuevas formas de tratamiento se encuentran en proceso de evaluación.
Introduction: Breast cancer (BC) is the first cause of oncologic death among woman. Breast, lung and unknown primary cancer are the primaries that induce ocular metastases with high frequency. Uveal tract is the ocular structure affected frequently by metastatic activity.
Methods: We reported a case of a young woman with early BC, HER2 positive, who developed choroidal metastases on the left eye as the first feature of recurrent disease.
Results: External radiation and chemotherapy induced complete remission of the lesion. Twelve months after ocular metastases, the patient developed metastases to cerebellum and leptomeningeal carcinomatosis more latter.
Conclusions: All metastatic BC patients with ocular symptoms should be evaluated by an ophthalmologist. External radiation is an effective modality to treat these kind metastases. New approaches are ongoing to evaluation.
Pagina nueva 1
¿ INTRODUCCIÓN
El cáncer de mama (CM) es la neoplasia que con mayor frecuencia afecta a las mujeres, representa la primera causa de muerte oncológica en la población femenina. Mundialmente, en el año 2008 se registró 1 380 000 nuevos casos, y 458 400 muertes por esta enfermedad.1 Durante el mismo año, en México se informaron 13 939 nuevos casos (21.2%) y 5 217 muertes (13.2%) por CM.2 La tasa de mortalidad relacionada al CM ha disminuido a partir del año 2000; la reducción es consecuencia del efecto de los programas de escrutinio, así como por los beneficios aportados por la terapia adyuvante sistémica.3 Sin embargo, se ha precisado que la disminución de la mortalidad es más evidente entre las mujeres menores de 70 años, y para aquellas que expresan positividad a los receptores estrogénicos.4,5
A pesar del mejoramiento en la expectativa de supervivencia, hasta el 40% de las mujeres afectadas por CM temprano desarrollarán recurrencia de su enfermedad. El riesgo de recurrencia depende de diversos factores clínico-patológicos y biológicos, entre ellos, el estadio clínico, edad al diagnóstico, estado ganglionar axilar, tamaño tumoral, grado de diferenciación, expresión de los receptores hormonales y de la proteína del receptor tipo 2 de factor de crecimiento epidérmico humano (HER2, por sus siglas en inglés).6,7
La recurrencia del CM puede presentarse a nivel locorregional en el 20% de los casos, mientras que la diseminación a distancia representa el problema mayor, ya que hasta el 70% de los casos desarrollarán afectación a uno o más órganos; los sitios anatómicos afectados con mayor frecuencia son huesos (20%-60%), pulmón y/o pleura (15%-20%), hígado (5%-15%) y cerebro (5%-10%).7
El globo ocular es un órgano donde se pueden implantar metástasis a partir de diversos tumores primarios. Estudios post-mortem en pacientes oncológicos han señalado que el ojo puede ser afectado por actividad micro o macrometastásica, en 4.7% a 12.6% de los casos.8,9
Diversos estudios han reportado al CM (22%-87.5%), pulmón (7%-50%) y carcinoma de primario desconocido (7%-16%), como los tumores primarios que con mayor frecuencia inducen metástasis oculares (MO).10-14
El tracto uveal comprende a la coroides, el cuerpo ciliar y el iris, dicho tracto es la estructura ocular afectada con mayor frecuencia por la diseminación metastásica. El mecanismo patogénico implicado es la diseminación hematógena de los microémbolos tumorales, a través de la arteria carótida interna a la arteria oftálmica y hasta las arterias ciliares, lo que puede explicar la frecuencia de metástasis coroideas.
En este reporte describimos el caso de una mujer joven con CM temprano, HER2 positivo, quien desarrolló metástasis a la coroides, como el primer sitio de actividad tumoral recurrente.
¿ PResentAcIón del cAso
Mujer hispana, de 40 años de edad, evaluada por disminución súbita de la agudeza visual y dolor ocular izquierdo. De su historial médico destacó, tabaquismo de cuatro cigarrillos por día durante 15 años. La menarca fue a los 13 años, ella tuvo tres embarazos, todos a término y culminados por vía vaginal, el primero a los 20 y el último a los 28 años de edad, amamantó durante seis meses a cada producto. La paciente negó utilizar fármacos anticonceptivos. Además, la madre de la paciente tuvo CM a los 44 años de edad, el cual evolucionó a la fase metastásica y afectó la retina.
En octubre de 1996, mediante autoexploración, la paciente detectó una lesión nodular en el cuadrante superoexterno de la mama derecha. La mastografía reveló una lesión sugestiva de malignidad, por lo que se realizó biopsia por aspiración con aguja delgada, la cual confirmó la presencia de células neoplásicas. En otra institución, se realizó biopsia escisional y estudio transoperatorio seguida de mastectomía radical modificada derecha y disección axilar. El estudio histopatológico informó carcinoma ductal invasor de 2 x 2 cm, poco diferenciado, Scarff-Bloom-Richardson 4, sin infiltración vasculolinfática. Además, se identificaron dos focos de carcinoma ductal in situ (0.5 y 1.0 cm, respectivamente), así como metástasis en dos de los 19 ganglios axilares resecados; los márgenes quirúrgicos fueron negativos a neoplasia. El análisis inmunohistoquímico documentó receptores estrogénicos positivos (54.3%), receptores de progesterona negativos (0.14%), HER2 positivo 3+, p53 positivo (30%), angiogénesis 13 vasos por campo 40 X y Ki67 positivo (10%). El CM fue clasificado en etapa IIB, por lo que se indicó quimioterapia adyuvante con 5-fluorouracilo, doxorrubicina y ciclofosfamida por seis ciclos. La terapia hormonal adyuvante no fue indicada por su médico oncólogo original. A la paciente se le mantuvo en protocolo de vigilancia, sin evidencia de actividad neoplásica.
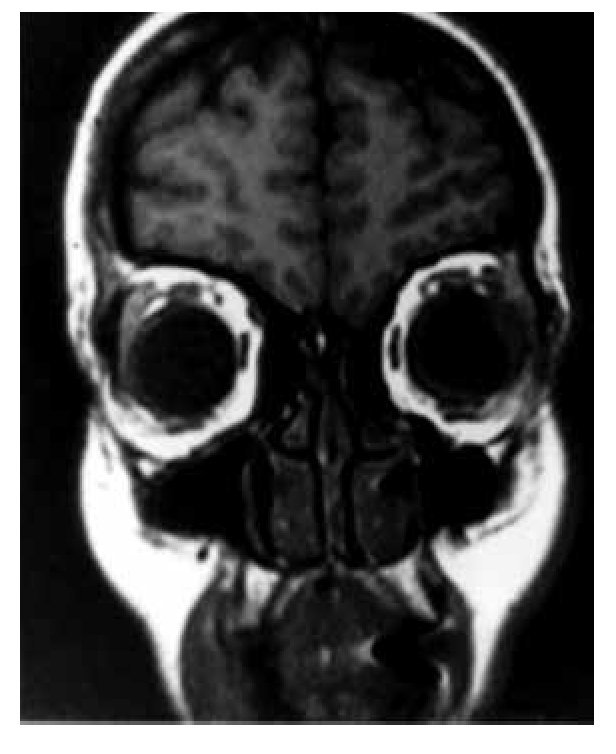
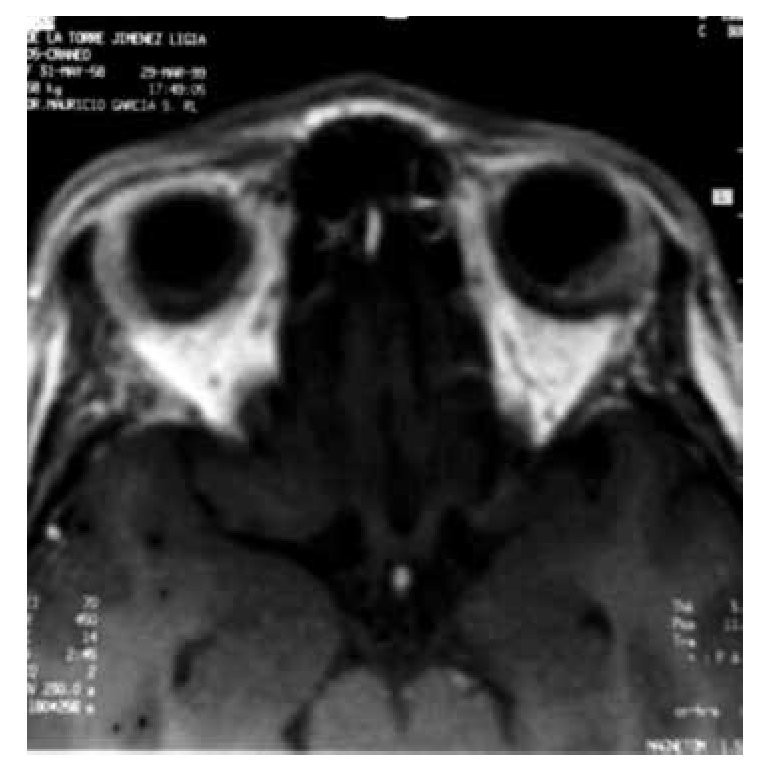
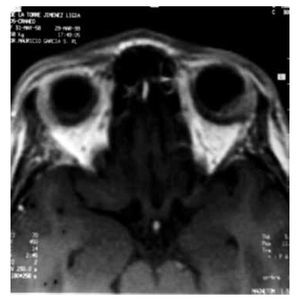
Tres años después de la mastectomía, la paciente desarrolló disminución súbita de la agudeza visual con predominio en el campo nasal izquierdo asociado a dolor opresivo y fotofobia persistente. La intensidad del dolor aumentó rápidamente, mientras que la agudeza visual disminuyó en los siguientes tres días. Un oftalmólogo diagnosticó desprendimiento de retina en el segmento posterior. El ultrasonido del globo ocular izquierdo evidenció una zona de ecogenicidad aumentada en el segmento posterior, sin reforzamiento. La resonancia magnética nuclear del encéfalo y macizo facial confirmó la presencia de una zona de engrosamiento coroidea, con bordes irregulares y poco definidos, localizada en la región posterior izquierda, 1.4 x 4 mm, isointensa en la secuencia T1 e hipointensa en la fase T2 con moderado reforzamiento homogéneo (Figuras 1 y 2), sin aparente afectación del conducto lagrimal, nervio óptico, ni de los músculos extraoculares.
Figura 1. Zona de engrosamiento coroidea, con bordes irregulares y poco definidos, localizada en la región posterior izquierda, 1.4 x 4 mm. Ausencia de afectación del conducto lagrimal, nervio óptico, ni de los músculos extraoculares. Se aprecia ausencia de lesiones supratentoriales.
Figura 2. Área de afectación coroidea en el ojo izquierdo.
Las estructuras supra e infratentoriales no mostraron alteraciones sugestivas de actividad tumoral. Tampoco se observó actividad neoplásica en otros sitios anatómicos a través del ultrasonido hepático, centellografía ósea y radiografía de tórax. La lesión coroidea fue tratada con radioterapia externa al ojo, 4 500cGy en 15 fracciones, mediante un equipo de acelerador lineal, seguida de quimioterapia con paclitaxel cada 21 días durante ocho ciclos y, más tarde, terapia endocrina con tamoxifen 20 mg/día. El dolor ocular desapareció y la agudeza visual se recuperó ad integrum, dos semanas después de haber iniciado la radioterapia.
La paciente se mantuvo en seguimiento estrecho, sin datos clínicos, radiológicos ni serológicos de recurrencia; sin embargo, en septiembre del 2000 aquejó cefalea generalizada persistente y en enero del 2001, se identificó una lesión metastásica en el hemisferio cerebeloso derecho, 3.4 x 3.3 cm, la cual fue tratada con radioterapia a holocráneo 30Gy en 15 fracciones, el tamoxifen fue suspendido y, después de confirmar el estado posmenopáusico, se inició letrozol 2.5 mg/día. En diciembre del 2003, se identificó recrecimiento de la lesión cerebelosa (47 mm), por lo que se indicó su resección quirúrgica, el estudio histopatológico reveló adenocarcinoma poco diferenciado, HER2 positivo 2+, receptores estrogénicos positivos (100%). Ante la recuperación posquirúrgica, se inició examestano 25 mg/día, pero en septiembre del 2004 se observó recurrencia local de la lesión cerebelosa y comenzó quimioterapia a base de temozolomida. Sin embargo, desarrolló carcinomatosis leptomeníngea, la cual no fue sensible a otros métodos de tratamiento, por lo que falleció en marzo del 2005.
¿ DISCUSIÓN
Para la revisión sistemática realizamos una búsqueda en PubMed (www.ncbi.nlm.nih.gov/pubmed), utilizando las palabras "ocular" o "eye" o, "choroidal" u "orbital metastases" y se ligaron con "breast cancer"; la búsqueda se limitó a aquellas publicaciones entre enero de 1980 al 31 de mayo del 2012, en idioma inglés, series en humanos con 10 o más casos incluidos y resumen disponible. Se obtuvo un total 126 referencias, de ellas se eliminaron 117, 14 por estar relacionadas a neoplasias distintas al cáncer mamario, 61 por ser casos aislados o series menores a 10 casos, nueve correspondientes a ciencia básica, cuatro evaluaciones de métodos de diagnóstico, cinco relacionadas a metástasis al párpado, cuatro a la órbita ocular, dos al nervio óptico, cuatro trabajos de revisión, cuatro informes de casos tratados localmente con fotodinamia o termoterapia y nueve series generales que incluyeron diversas neoplasias.
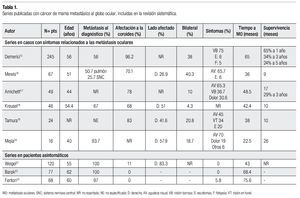
De las 126 referencias, 10 (7.9%) analizaron el comportamiento de las metástasis intraoculares asociadas al CM; las 10 referencias fueron obtenidas en texto completo, una de ellas fue descartada ya que no contenía los datos requeridos para la revisión sistemática; las restantes nueve referencias15-23 formaron el cuerpo de nuestra revisión sistemática. Seis de las nueve series analizadas evaluaron casos con síntomas relacionados a la actividad metastásica ocular, y tres series fueron realizadas en pacientes asintomáticas. A partir de cada reporte se extrajeron los datos clínicos de los casos analizados, la neoplasia mamaria, intervalo entre el diagnóstico del CM y la presencia de MO, la sintomatología y las características relacionadas a las MO, su tratamiento y la supervivencia informada.
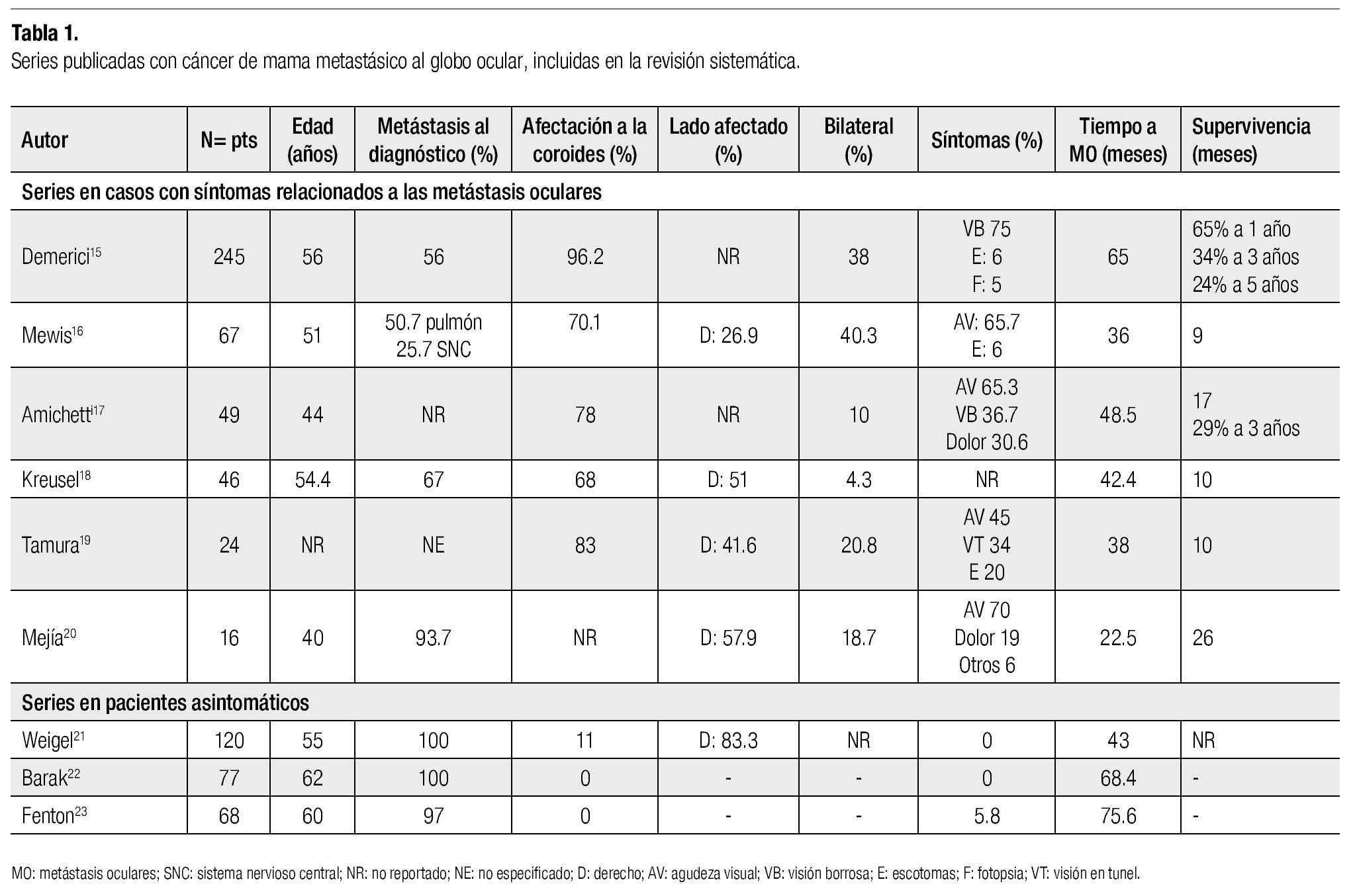
De las seis series en pacientes sintomáticos15-20 (Tabla 1), el número de casos incluidos osciló entre 17 y 245 casos, y el promedio de edad varió entre 40 y 56 años; la coroides fue la estructura afectada con mayor frecuencia (38%-96.2%). La prevalencia de la fase metastásica del CM, previa al diagnóstico de la afectación ocular, varió de 56% a 93.7%;15,16,18,20 cuatro series reportaron las metástasis pulmonares y óseas como las más frecuentes que precedieron a las MO. Mewis y colaboradores16 detectaron que el 50.7% de los casos tenían metástasis pulmonares, antes o durante el diagnóstico de las MO. En las series analizadas, el sistema nervioso central representa el tercer sitio metastásico más frecuente (6%-42%). Entre los pacientes que desarrollaron MO, se han observado al menos dos sitios anatómicos metástasis preexistentes.18,20 Los síntomas relacionados a la actividad metastásica intraocular reportados con mayor frecuencia son disminución de la agudeza visual (45%-65.7%), visión borrosa (36%-75%), dolor (19%-30.6%), visión en túnel (34%), amaurosis (10.2%) y fotopsia (5%).15-17,19,20
Tres de las seis series reportaron que el ojo derecho fue el afectado con mayor frecuencia (26.9%-57.9%),16,18,20 mientras que la enfermedad fue bilateral en 4.3%-40.3%; las dos series más grandes identificaron la bilateralidad en 38% y 40.3%.15,16 La coroides es la estructura ocular afectada con mayor frecuencia por el CM, 68%-96.2%, mientras que el iris (4%)15 y el cuerpo ciliar (1.1%-3.0%)15,18 son afectados con menor frecuencia. La lesión metastásica única fue detectada en 43%-48% de los casos; sin embargo, el promedio de lesiones detectadas es de dos.15,18 Mewis y colaboradores16 informaron que 19 de 67 casos (28.3%) tenían múltiples depósitos metastásicos en uno o ambos ojos, rango 3-16 lesiones.
Se ha descrito que el color de las lesiones es amarillo en 99% de los casos, con forma de plato en 77%, el exudado y la hemorragia de la retina no se observan en el 97% y 98%, mientras que el líquido subrretiniano se aprecia en 64%. Generalmente, estas lesiones se localizan a nivel de la mácula en el 42%, o superior en 20%, en tanto que en la localización antero-posterior se ubican en la mácula en 42%, o en la región de la mácula y ecuador en el 47% de los casos.15 El involucro del polo posterior se observa en 91% de los casos.18
El intervalo entre el diagnóstico del CM y las MO osciló entre 22.5 y 65 meses; la serie mayor informó que el tiempo medio de presentación es de tres a cuatro años.15
La supervivencia observada a partir de la identificación de la afectación ocular varía de nueve a 26 meses, tres de los seis reportes informaron supervivencia media de nueve a 10 meses.16,18,19 Demerici y colaboradores15 entre 245 pacientes, reportaron tasa de supervivencia a uno, tres y cinco años de 65%, 34% y 24%, respectivamente.
La radioterapia externa fue el tratamiento utilizado con mayor frecuencia en las series analizadas, 59% a 100% de los casos. El esquema y fraccionamiento utilizado difirió entre las series, sólo en dos de ellas se empleó un esquema estandarizado, 40Gy en 20 fracciones.18 La eficacia de la radiación externa aportó mejoría de los síntomas entre 49% y 100%, y en menor proporción indujo la regresión completa de las lesiones (26.6%-64%).15,20
Los efectos secundarios relacionados a la radioterapia fueron queratoconjuntivitis, hemorragia subconjuntival, cataratas, retinopatía, papilopatía y glaucoma, así como desprendimiento de retina.15,17,18 La quimioterapia se empleó en 29%, hormonoterapia 9% y observación en 18% de los casos de la serie más grande.15
De las tres series en pacientes asintomáticas y con enfermedad en fase metastásica,21-23 estas incluyeron entre 68 y 120 casos, con edades entre 55 a 62 años. En todos los casos se realizó evaluación de agudeza visual, examen con lámpara de hendidura y oftalmoscopia binocular indirecta y/o tonometría, así como ultrasonido en modo B. La evaluación oftalmológica se llevó a cabo entre 3.6 y 6.3 años, después del diagnóstico del CM. Dos series no reportaron ningún caso con metástasis a la coroides,22,23 mientras que en el estudio con mayor número de casos analizados, se detectó metástasis a la coroides en seis de 120 casos (5%); los seis casos fueron detectados entre 52 sujetos (11%) con más de dos sitios metastásicos; los autores estimaron que el riesgo relativo de desarrollar MO es 6.6 (IC 95%=1.3-34; p=0.03) ante metástasis pulmonares y 5.7 (IC 95%=1.2-26; p=0.04) frente a metástasis cerebrales preexistentes.21
El caso que motivó este reporte comparte características del comportamiento de las MO, a partir del CM señaladas en la revisión sistemática. No obstante, este caso posee algunas características particulares que aumentan su interés, entre ellas ser una mujer joven con carcinoma temprano HER2 positivo, la metástasis coroidea como primera manifestación de actividad recurrente, desarrollo de metástasis al sistema nervioso central, luego del control local ocular y larga supervivencia, 66 meses. La madre de nuestra paciente también tuvo CM y MO, pero nosotros no pudimos determinar el estado de los genes BRCA1 y BRCA2. Un estudio pequeño valoró la historia familiar y el estado de BRCA1 y BRCA2, en 15 casos con CM y MO, los autores concluyeron que las características del CM metastásico al globo ocular incluyen edad temprana al diagnóstico, carencia de agregación familiar y de mutaciones constitucionales de BRCA1 y BRCA2.24
Por otra parte, la sobreexpresión o amplificación de HER2 ocurre en el 20%-25% de los CM, y se asocia con alta tasa de recurrencia y cortos intervalos libres de enfermedad.25 Además, el subtipo luminal-HER2 (sobreexpresión de HER2 y receptores hormonales positivos o negativos), así como el HER2 enriquecido, luminal B y basal se asocian con mayor riesgo de recurrencia local y regional.26 Bajo los lineamientos actuales de tratamiento, esta paciente podría haber recibido trastuzumab, un anticuerpo monoclonal dirigido contra HER2, como terapia adyuvante o durante la recurrencia, ya que su incorporación reduce la tasa de mortalidad, recurrencia y metástasis,25 o induce mayor tiempo libre de progresión, tasa de respuesta, duración de la respuesta, supervivencia global y menor tasa de mortalidad.27
Sin embargo, este agente biológico estuvo disponible y aprobado en México hasta el año 2005. Actualmente, tres casos con CM, HER2 positivo y MO tratados con trastuzumab han sido informados;28-30 dos recibieron el anticuerpo monoclonal combinado con paclitaxel y el otro con vinorelbina. Los tres casos describen resolución de los síntomas visuales, con efecto sostenido por seis a nueve meses.
Las presencia de MO como manifestación inicial de enfermedad mamaria recurrente ha sido informada en forma aislada;31 sin embargo, dos series han indicado que este comportamiento fue observado en 43 de los 264 sujetos evaluados por Demerici y colaboradores,15 y en 30.4% de los 46 casos analizados por Kreusel y colaboradores.18 Por otro lado, dos estudios han señalado la presencia de metástasis al sistema nervioso central después de las MO. Demerici y colaboradores15 observaron este patrón en el 28% de sus casos evaluados, y Tamura y colaboradores19 reportaron la actividad tumoral cerebral en siete de 49 pacientes (14.2%), cinco meses después de la actividad ocular metastásica. Las mujeres jóvenes, principalmente afroamericanas, con receptores estrogénicos negativos, HER2 positivo, tumores de alto grado y fenotipo BRCA1 tienen alto riesgo para desarrollar metástasis cerebrales,32 algunos de estos factores fueron observados en el caso que nosotros reportamos.
Actualmente, diversas estrategias terapéuticas se encuentran disponibles para tratar las MO. Recientemente, estas opciones han sido revisadas. La radioterapia externa, 30-50Gy en al menos 10 fracciones, induce regresión en 85%-93%. La braquiterapia en placa permite dirigir la radiación directamente a la lesión coroidea, la regresión completa se alcanza en 94%, con complicaciones en 8% de los casos, entre ellas retinopatía, papilopatía y cataratas. La radiocirugía con Gamma Knife, la cirugía con Gamma Cyber-Knife y la radioterapia con haz de protones han sido utilizadas en casos aislados. Otras opciones de terapia local implican a la termoterapia transpupilar, fotocoagulación láser, terapia fotodinámica e incluso, la enucleación en casos extremos. De los tratamientos farmacológicos como la quimioterapia citotóxica, trastuzumab e inhibidores de la aromatasa representan opciones atractivas, así como la aplicación intravítrea de bevacizumab, han sido exploradas en casos aislados, pero se requiere mayor conocimiento acerca de sus beneficios y efectos tóxicos relacionados.33
¿ CONCLUSIONES
Las metástasis al globo ocular por CM son un evento infrecuente. Sin embargo, aquellas mujeres con carcinoma mamario metastásico a pulmones y/o sistema nervioso central tienen mayor riesgo de desarrollar MO. La coroides es el principal sitio anatómico de metástasis por CM. La presencia de síntomas oftalmológicos debe obligar la evaluación especializada. Hasta el momento, la radioterapia externa permite control de los síntomas y regresión de las lesiones metastásicas. La expectativa de supervivencia es limitada ante MO.
CONFLICTO DE INTERESES
Los autores declaran no tener ningún conflicto de intereses.
FINANCIAMIENTO
Los autores no recibieron patrocinio para llevar a cabo este estudio.
Correspondencia:
Dr. Juan Alberto Serrano Olvera.
Departamento de Oncología Médica, Centro de Cáncer,
Centro Médico ABC. Sur 128 N° 143 - 203,
Colonia Álvaro Obregón, C.P. 01120, México D.F., México.
Fax: 5272 8430.
Correo electrónico: serranoolvera@gmail.com