En el manejo de la enfermedad oncológica, la presentación de metástasis a pulmón se encuentra en el 20-60% a lo largo de su historia natural. Esta oscilación tan amplia obedece a la histología del tumor, comportamiento biológico, etapa clínica al momento de diagnóstico, tipo de control ofrecido a la enfermedad primaria y la respuesta a tratamiento. Todo lo anterior exige la constitución de un grupo oncológico torácico que se encuentre altamente familiarizado con el tratamiento y comportamiento de la neoplasia primaria para ofrecer un control de las metástasis secundarias pulmonares. Hay suficiente evidencia que corrobora que el manejo multidisciplinario de las metástasis pulmonares es hoy la mejor forma de impactar en la supervivencia libre de enfermedad y en el aumento en la supervivencia global con adecuada función pulmonar y calidad de vida.
Lung metastases occur in 20-60% of cases during the natural course of managing cancers. This wide range depends on tumour histology, biological behaviour, clinical stage at diagnosis, type of control of the primary disease, and response to treatment. All this requires the establishment of a thoracic oncology group that is highly familiar with the treatment and behaviour of the primary tumour in order to provide control of secondary lung metastases. There is sufficient evidence to demonstrate that multidisciplinary management of lung metastases is now the best way to improve disease-free survival and increase overall survival with adequate lung function and quality of life.
El parénquima pulmonar, el hígado y el hueso suelen ser los sitios más frecuentes para el depósito de células neoplásicas que han entrado al torrente sanguíneo y en menor medida por diseminación linfática. El 40% de las metástasis pulmonares coexisten con metástasis a múltiples órganos, el 30% se acompaña con metástasis a otro órgano solamente y en el 20% el pulmón es la única forma de enfermedad a distancia. Con la teoría del suelo y la semilla por Stephen Paget 1889, se estableció el microambiente alvéolo-alveolocapilar pulmonar como la primera red arteriovenosa en el drenaje venoso de los tumores. La biología intrínseca del tumor primario es por sí la principal forma de predecir el comportamiento de las metástasis pulmonares1,2. La diseminación hematógena venosa, principal vía de siembra tumoral pulmonar en cáncer renal, osteosarcoma, coriocarcinoma, melanoma, tumores germinales y cáncer de tiroides por su amplio drenaje venoso, presentan lesiones pulmonares periféricas y por lo general asintomáticas. La localización central parahiliar obedece a una diseminación hematógena a través de las arterias bronquiales que discurren acompañantes a los bronquios principales. Otra forma de metástasis a pulmón son los émbolos tumorales en los conductos linfáticos, frecuente en carcinoma de mama, estómago, próstata y pulmón, logrando depósitos tanto en el intersticio como en el parénquima pulmonar, manifestándose como linfangitis carcinomatosa, disnea y quilotórax. La extensión directa constituye la vía menos frecuente de diseminación a pulmón, tumores mediastinales anteriores, germinales y carcinoma tímico entre otros; de esta forma, la presencia de síntomas ocurre tan solo en el 15% de las metástasis pulmonares, y por ende el papel secundario de la cirugía resectiva para el control de síntomas3,4. El momento de presentación de las metástasis pulmonares es otro punto importante. Aquellas identificadas al momento del diagnóstico del tumor primario constituye una etapa clínica avanzada iv con pronóstico desalentador generalmente, tributarios de manejo oncológico paliativo o medidas de mejor soporte médico. La recurrencia en forma de metástasis pulmonar parece un escenario más favorable que reclama la atención de manejo multimodal, alcanzando hasta el momento un aumento en la supervivencia libre de enfermedad, con un impacto en creciente en la supervivencia global5.
Evaluación del paciente con enfermedad metastásica pulmonarEn la mayoría de los casos las metástasis pulmonares metacrónicas, encontradas a más de 6 meses del diagnóstico y manejo del tumor primario, son identificadas dentro de los protocolos de vigilancia del cáncer primario, en una radiografía simple de tórax, como en la vigilancia de cáncer de mama, en tomografías de tórax, en el caso de sarcomas óseos y de tejidos blandos entre otros. El primer pensamiento frente a la identificación de una o varias lesiones en un paciente con antecedente de enfermedad maligna en vigilancia es que se trate de una recurrencia metastásica a pulmón. Aunque la ubicación periférica de la lesión, la presencia de múltiples lesiones o incluso la evidencia de recurrencia local aproximen a esta idea, debemos preguntarnos si se trata de un segundo cáncer primario (pulmón) o de granulomas, infecciones entre otros, sobre todo en paciente en los que existen factores de riesgo como el hábito tabáquico la exposición al humo de leña, solventes, infección por hongos, antecedentes de radiación etc.6. El estudio de las características de imagen de lesiones metastásicas a pulmón escapan a esta revisión. El posicionamiento actual de la PET-TC ha permitido agrupar a los pacientes en aquellos con solo enfermedad metastásica a pulmón y pacientes con enfermedad metastásica a múltiples órganos que en el 30% de los casos no habían sido reconocidas por otros métodos de imagen y modifican el manejo. La sensibilidad global de la PET-TC para metástasis pulmonares se estima en el 83-87%. Pero este valor desciende al 50% en lesiones menores de 10mm. El término de enfermedad metastásica oligopulmonar definido por Hellman como una o hasta 5 lesiones pulmonares resecables, sigue siendo tema de debate7. Más recientemente se ha dicho que no hay límite en cuanto al número de lesiones a resecar, pero debe tenerse en cuenta que hasta un 20% de los casos presentan más lesiones que las identificadas en la tomografía de tórax, que escapan a la resección de todos los depósitos pulmonares8,9. La biopsia por imagen, la broncoscopia y la biopsia por ultrasonido endoscópico pueden ayudar a descartar o confirmar nuestra sospecha, aunque el rendimiento de estas técnica depende del operador y varía en las diferentes series. La inmunohistoquímica es de gran utilidad especialmente en aquellos pacientes con factores de riesgo para cáncer de pulmón y antecedentes de enfermedad maligna tipo epidermoide o adenocarcinoma, como mencionamos anteriormente, donde el estudio transoperatorio confirma la malignidad e incluso la estirpe pero no el órgano de origen10,11. La mayoría de los autores coinciden en que la tomografía de tórax sin contraste con cortes de 3-5mm con una antigüedad no mayor a 4 semanas es suficiente para el planeamiento quirúrgico.
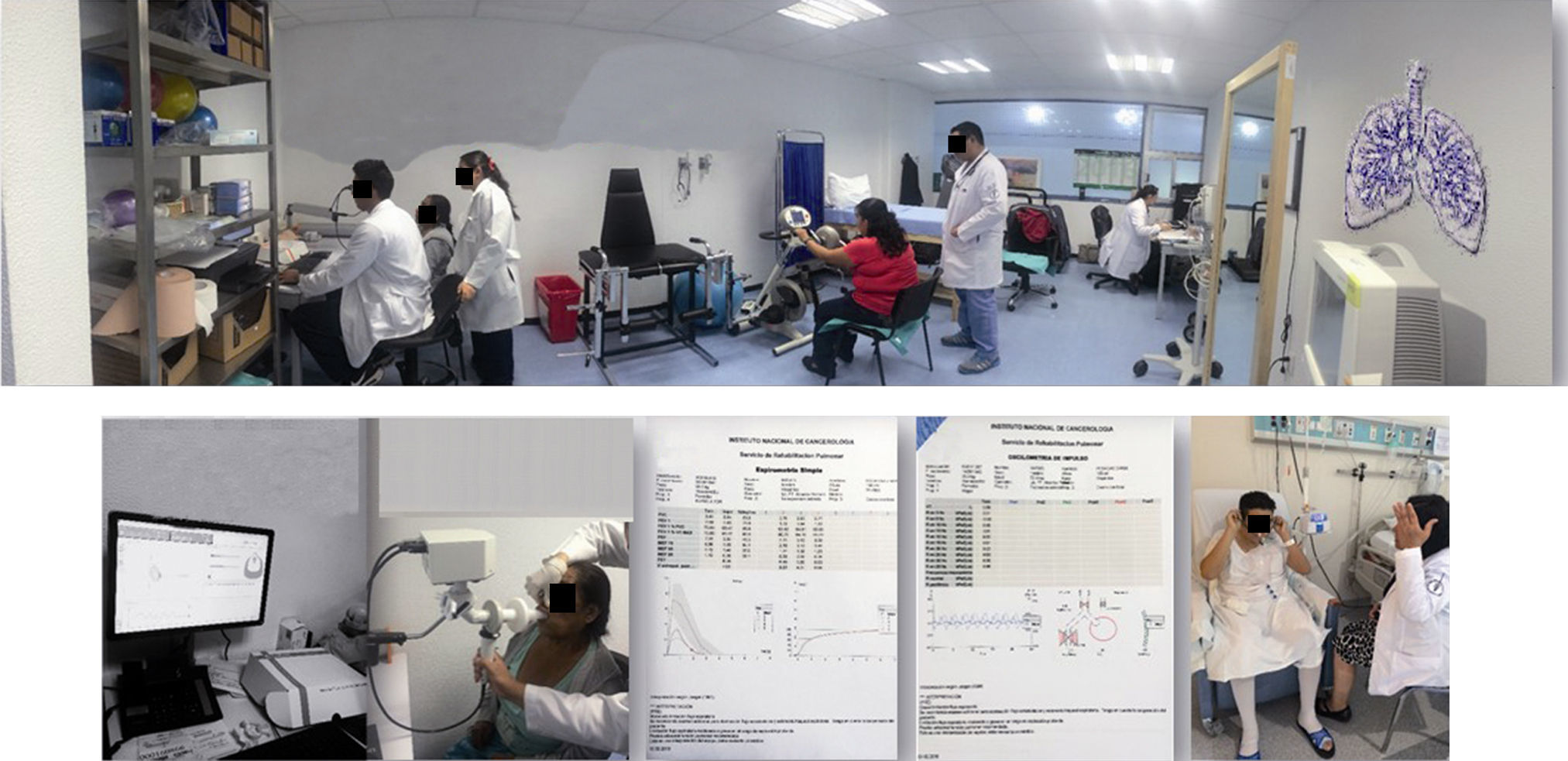
Manejo quirúrgico de las metástasis pulmonaresEl cirujano de metástasis pulmonares debe ser un cirujano oncólogo o cirujano torácico con entrenamiento en la topografía imagenológica del tórax, vías de abordaje del tórax, sistemas de grapeo, control vascular, comorbilidades pulmonares, enfermedad bullosa, pulmón enfisematoso, hipertensión pulmonar, y resecciones pulmonares mayores que sean solo advertidas intraoperatoriamente; además capacitado en el manejo de complicaciones de la cirugía torácica. Clásicamente los criterios de Alexander y Haight12 han sido lineamientos para la resección completa de las metástasis pulmonares: 1) nódulos pulmonares compatibles con metástasis; 2) no contraindicación médica ni ventilatoria; 3) tumor primario controlado o controlable; 4) evidencia radiológica de que todas las lesiones pueden ser resecadas; y 5) ausencia de enfermedad extratorácica (excepto ca colorrectal y tumores germinales). Y los criterios para la resección parcial de las metástasis pulmonares: 1) establecer diagnóstico; 2) descartar enfermedad residual posterior a quimioterapia; 3) obtener tejido para estudio molecular e inmunohistoquímica; 4) control de síntomas. El trabajo de Pastorino y sus colaboradores en 18 centros con 5,920 pacientes estableciendo 4 grupo pronósticos y el impacto en la supervivencia libre de enfermedad, han sido referente para selección de pacientes candidato a resección de metástasis pulmonares13,14. De otro lado, las características del paciente como la edad, Karnofsky, ECOG, comorbilidades asociadas principalmente cardiopulmonares y la función pulmonar actual como la predicha a la resección son directrices sobre las que se establecen las opciones de tratamiento. Pese a que el 70% de la cirugía de metástasis pulmones se limita a resección sublobares, segmentectomía y resecciones en cuña, que no repercuten dramáticamente en la función pulmonar, la evaluación integral por el grupo de rehabilitación pulmonar es un factor decisivo en el éxito de la resección y la calidad de vida del paciente (fig. 1). La espirometría con volumen espiratorio forzado en un segundo (VEF1) mayor a 1.5l continúa siendo la forma rápida para reconocer de entrada al paciente candidato a resecciones pulmonares menores, incluso a lobectomía. La fórmula clásica para el cálculo del VEF1 postoperatorio predicho=VEF1 preoperatorio multiplicado por (número de segmentos residuales/número de segmentos totales) debe realizarse cuando la cirugía de metástasis requiera de resección pulmonar mayor, lobectomía, bilobectomía o neumonectomía con valores de VEF1 postoperatorio predicho mayor al 40%15.
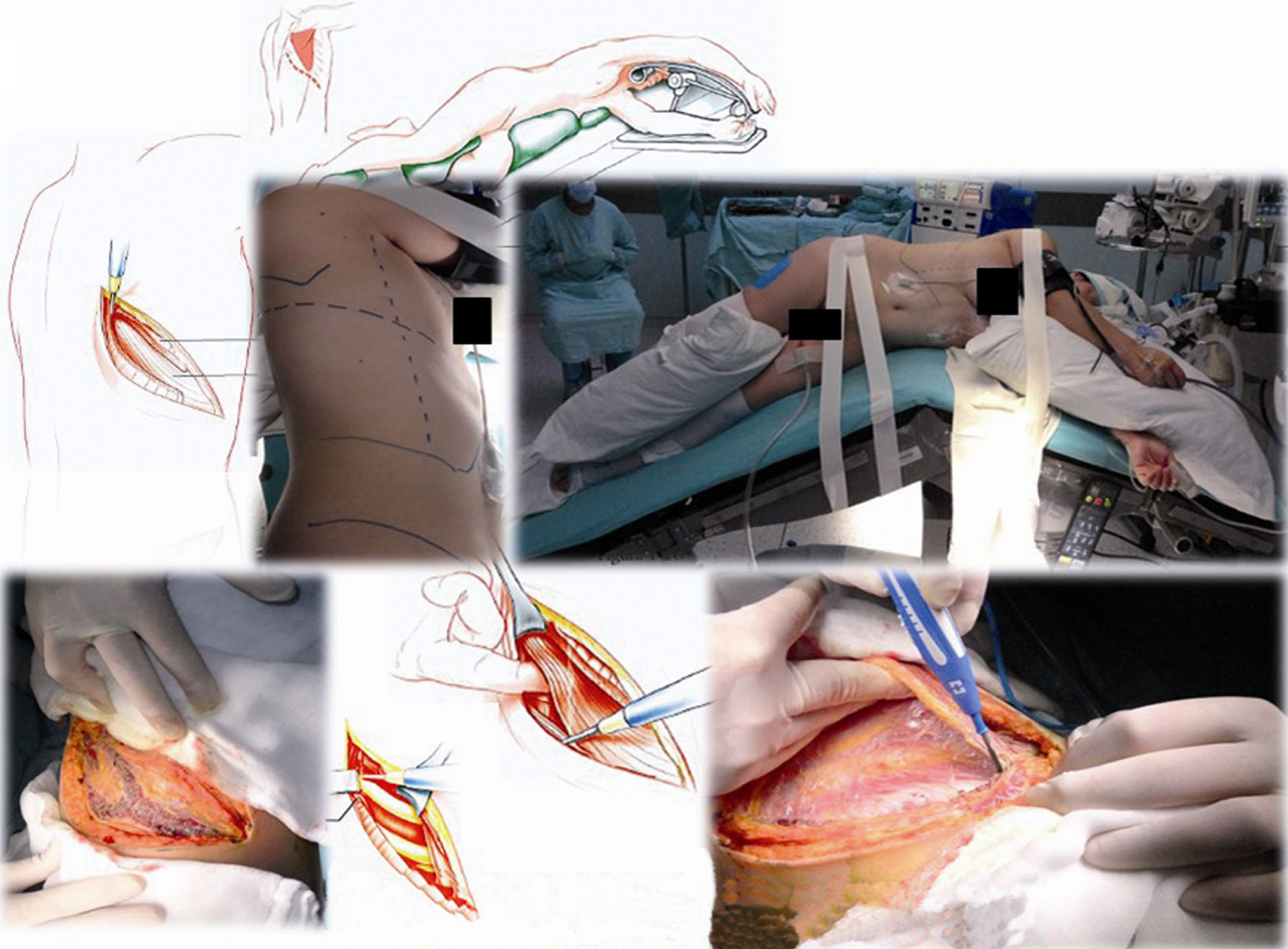
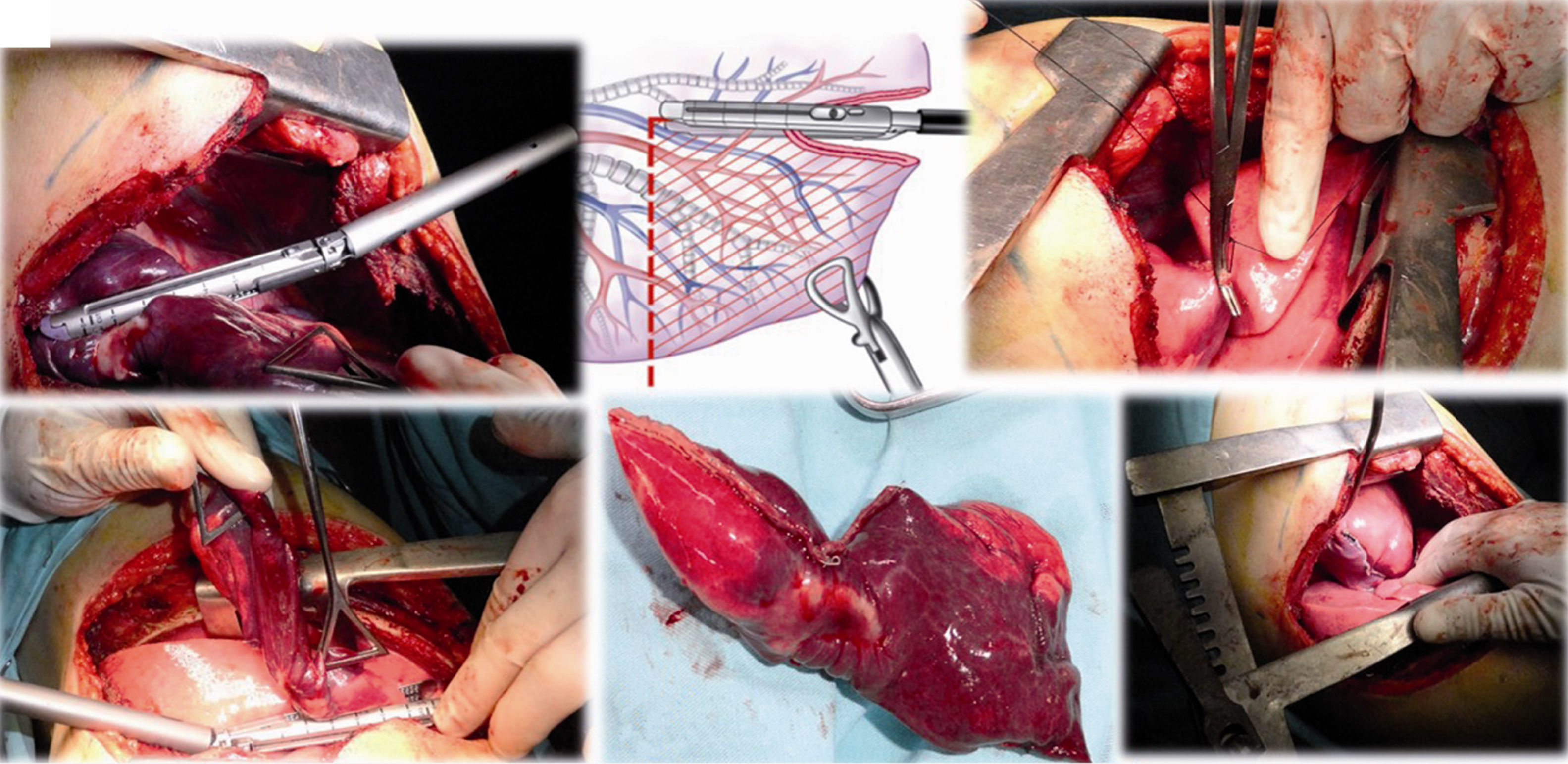
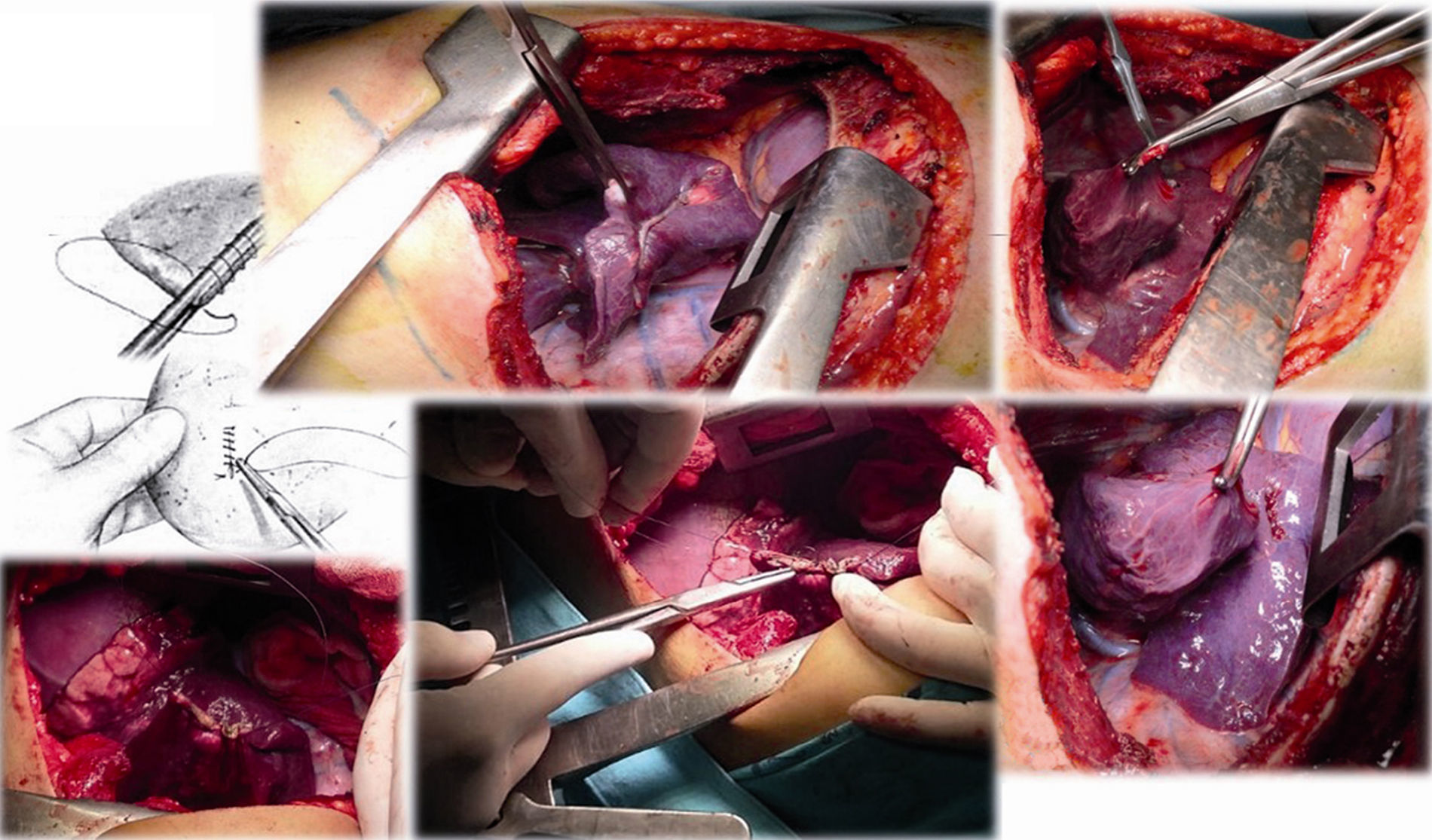
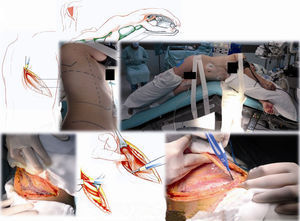
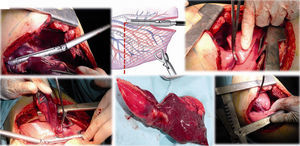
Caso clínico 1. Mujer de 27 años con tumor de células gigantes de rodilla derecha manejada con resección local amplia y posterior recurrencia metastásica pulmonar bilateral (fig. 2). Posterior a 29 ciclos de denosumab tiene enfermedad estable. Llevada a toracotomía secuencial, inicialmente de lado izquierdo de menor número de lesiones, controladas con resecciones en cuña. Y posteriormente resección de las lesiones pulmonares derechas. Se realizó una toracotomía posterolateral derecha, de Shaw Paulson con preservación muscular, con sección hemostática del músculo dorsal ancho; desinserción del músculo serrato anterior y la sección de los músculos intercostales externo, interno e íntimo, por el borde superior de la costilla inferior del 5.o espacio intercostal (fig. 3). Se practicó segmentectomía anatómica de lóbulo superior con sutura mecánica (engrapadora) (fig. 4). Y resecciones en cuña de lóbulo medio e inferior; el control del parénquima pulmonar se logra con pinza de ángulo o pinza torácica y sutura manual tipo surjete continuo o puntos de Swift para hemostasia y aerostasia (fig. 5). Nótese que luego de la segmentectomía el pulmón es reclutado y se comprueba la insuflación y conducción hacia los segmentos residuales del lóbulo superior derecho, disminuyendo la posibilidad de espacio muerto (tejido bien perfundido y mal ventilado) o tejido isquémico pulmonar. Algunos bordes del tejido, luego de sección con grapas, pueden requerir refuerzo con ligadura de sutura libre.
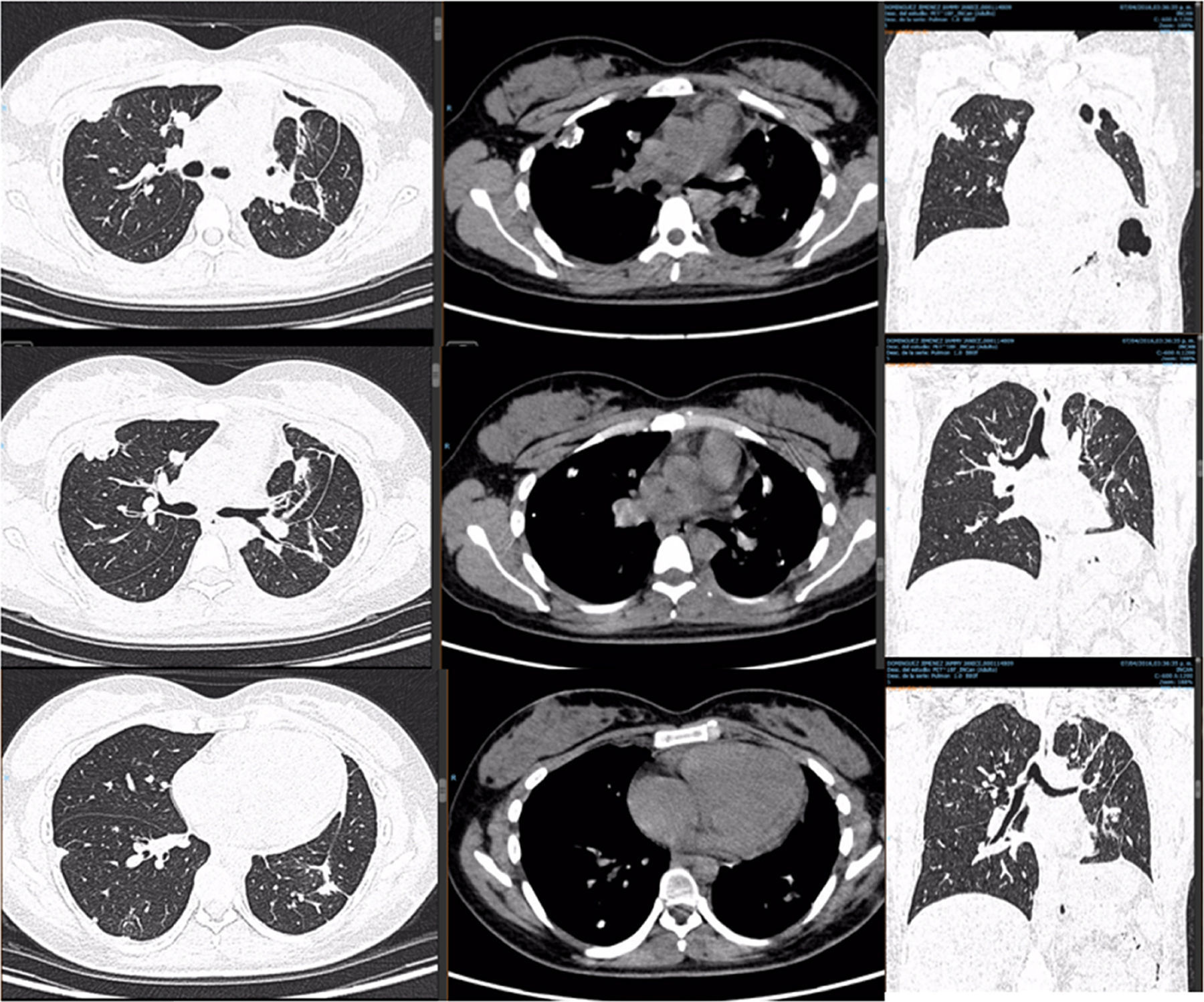
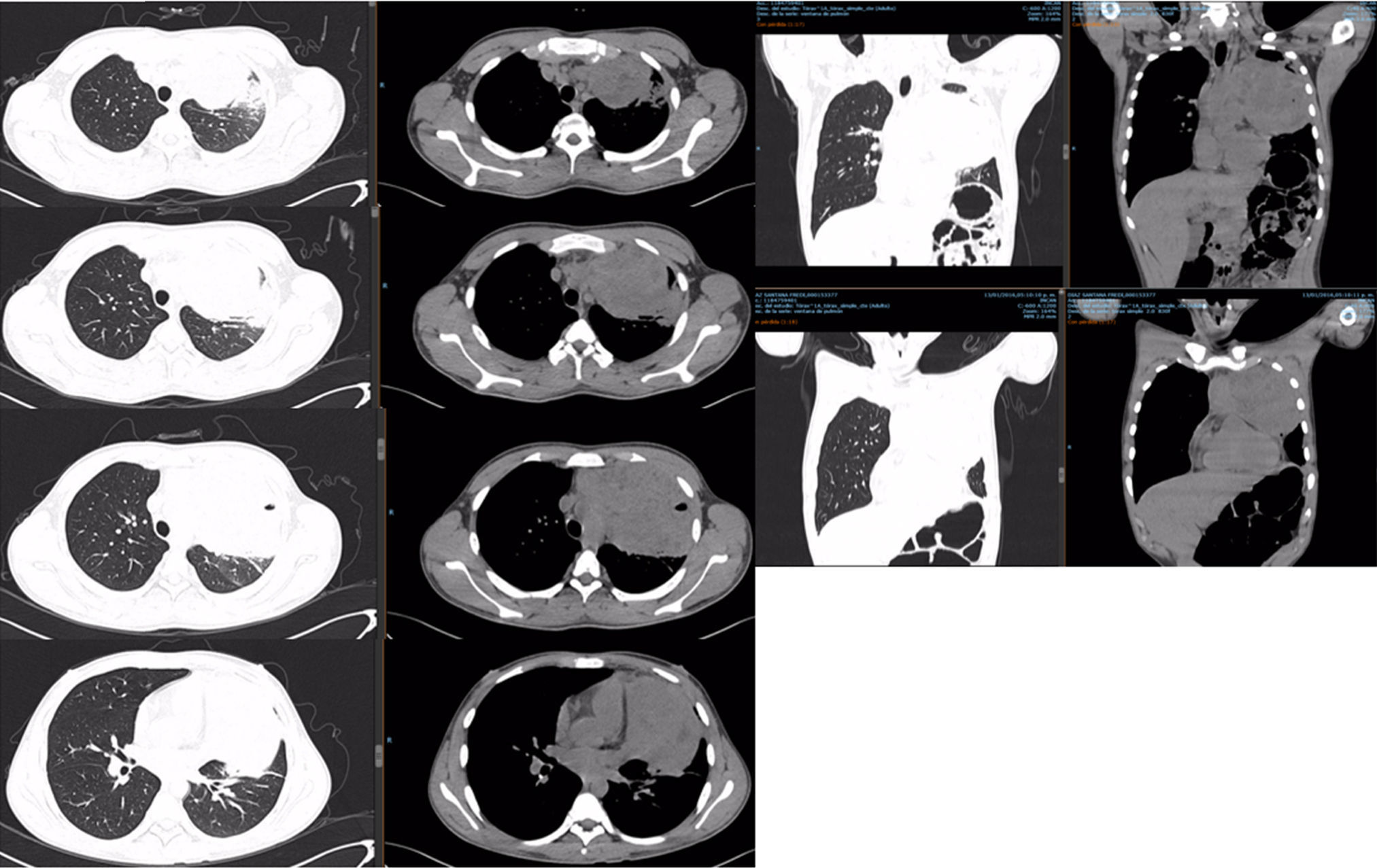
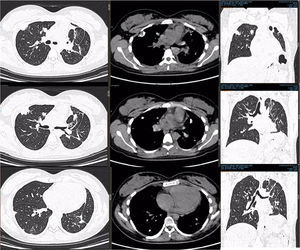
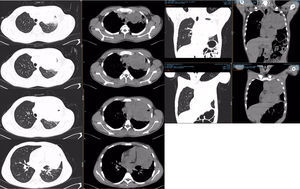
PET-TC con FDG. Corte tomográfico del tórax.
Pulmón izquierdo con disminución de tamaño con bandas de atelectasia y engrosamiento septal bilateral, lesiones nodulares calcificadas. Cambios posquirúrgicos.
Pulmón derecho con 2 lesiones, ambas en segmento anterior de lóbulo superior derecho. Con suvmax 3.4. Tres lesiones en lóbulo inferior derecho entre 5-7mm sin actividad metabólica.
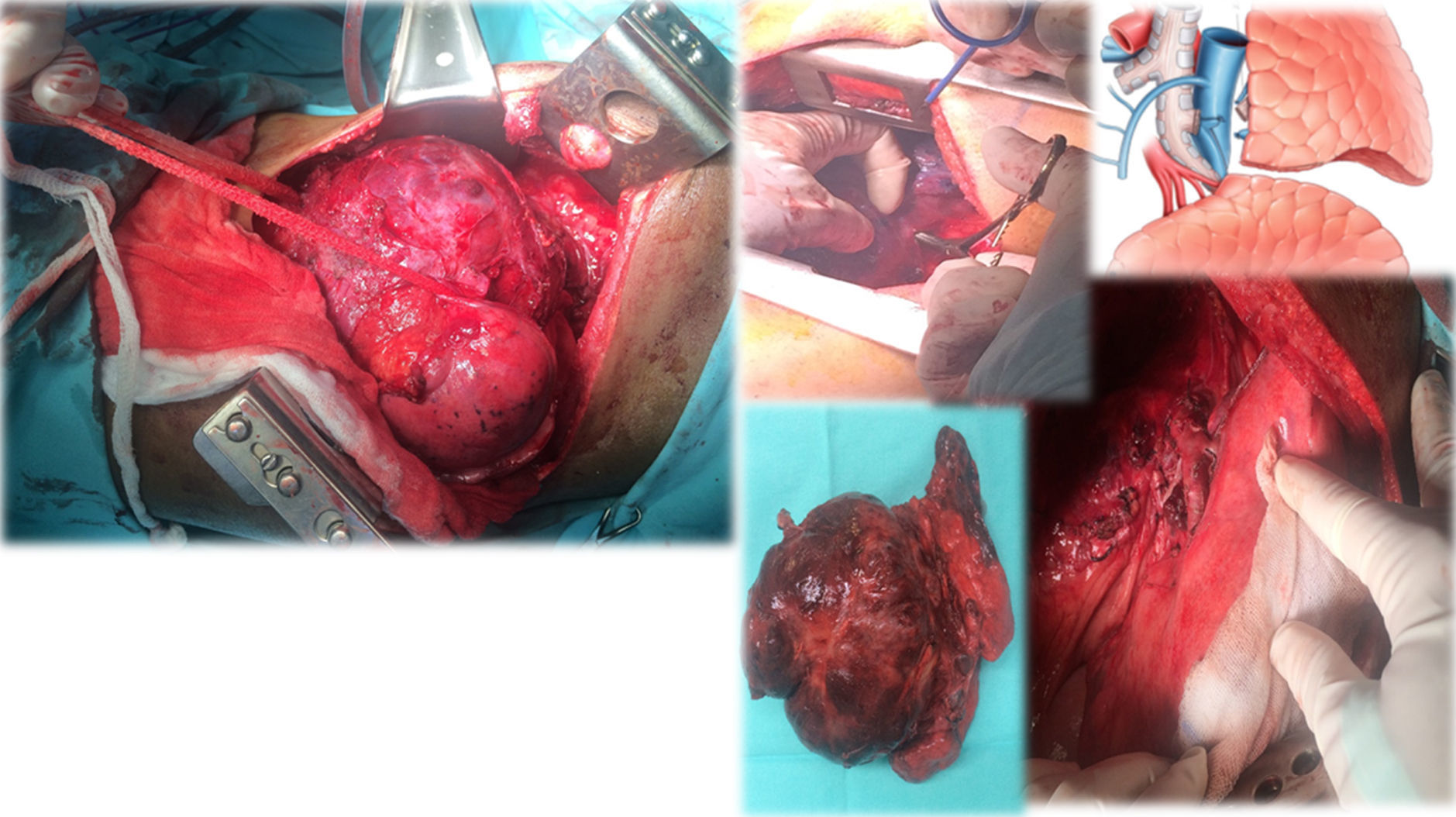
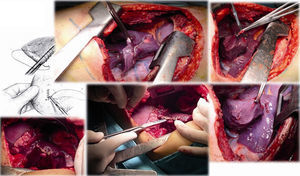
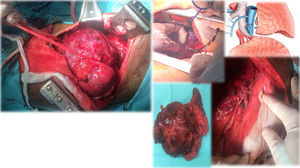
Caso clínico 2. Corresponden a un hombre de 27 años con un tumor germinal no seminoma primario de mediastino (fig. 6). Posterior a quimioterapia, negativización de marcadores tumorales sin disminución de tamaño e invasión a lóbulo superior izquierdo de pulmón, tumor que requirió de múltiples maniobras de movilización y ultradisección vascular para la preservación de parénquima pulmonar (fig. 7). «Maniobra de la grúa»: El tumor es suspendido a través de un hiladillo, solo sostenido de su pedículo y separado de estructuras vasculares mayores. Luego de la exéresis de la pieza quirúrgica se ventila el pulmón izquierdo y se observa la adecuada aireación de lóbulo inferior izquierdo y las estructuras hiliares. Finalmente el nervio frénico ipsilateral a la lobectomía se pinza con el objetivo de inducir neuropraxia y elevación del hemidiafragma, disminuyendo el volumen de la cavidad torácica residual.
TAC de tórax. Lesión metastásica en mediastino anterior.
Lesión heterogénea con múltiples áreas hipodensas y que presenta reforzamiento periférico que mide 10×15cm; en la ventana pulmonar no presenta plano de separación con el parénquima del lóbulo superior izquierdo. Enfermedad estable con respecto a estudio previo.
Tumor germinal no seminomatoso de mediastino.
En el manejo de la enfermedad metastásica a pulmón debe contextualizarse la biología individual del tumor, factores pronósticos, manejo multidisciplinario y la aplicación del concepto de cirugía ahorradora de pulmón y mínima invasión16. El principio de la cirugía de metástasis pulmonares es eliminar los depósitos secundarios con objetivo de aumentar la supervivencia. Para lograr esto el European Society of Thoracic Surgeons Lung Metastasectomy Project recomienda: No hay límite en cuanto al número de lesiones a resecar. Siempre y cuando todas puedan ser resecadas, con una morbilidad aceptable o se disponga de otra opción de control o incluso la vigilancia activa para lesiones pulmonares contralaterales17,18.
En el caso del cáncer colorrectal el 20-30% de los pacientes desarrollan metástasis a pulmón y la supervivencia en pacientes no llevados a metastasectomía es del 5% y del 40% a 5 años en los que se logró R019. Para sarcomas de tejidos blandos el 23% desarrollarán metástasis pulmonares exclusivas y en sarcomas óseos hasta el 83%, que pese a ser llevados a resección no se ha encontrado ningún beneficio en la supervivencia libre de enfermedad y la supervivencia global continúa menor al 20% a 5 años20,21. En cuanto a tumores germinales, los no seminoma son los más beneficiados de metastasectomía. Luego de negativizar marcadores tumorales, el componente de tumor viable es un 36%, teratoma un 26% y necrosis un 30%. La vigilancia activa parece ser una opción arriesgada teniendo en cuenta que el 32% de las lesiones tipo teratoma puede sufrir desdiferenciación y escapar al control quirúrgico. Es frecuente que los pacientes presenten metástasis bilaterales; lo más recomendado es la resección secuencial, iniciando en estos casos por el hemitórax de las lesiones de mayor tamaño22. La presentación de metástasis pulmonares en cáncer de mama a lo largo de su historia natural oscila entre el 7-24%, más comúnmente en HER2 sobreexpresado y basal like. En el 30% de los casos se trata de una lesión única periférica, el 10% carcinomatosis pleural, pero el gran reto son la confirmación histológica e inmunohistoquímica preoperatoria a la resección de metástasis, ya que en el 40% de los casos frente a una lesión central parahiliar puede tratarse de un adenocarcinoma primario de pulmón. Este último presente generalmente en mujeres no fumadoras, en cuyo caso la resección sublobar sería un subtratamiento. En cuanto al papel de la linfadenectomía regional en la metastasectomía pulmonar por cáncer de mama, parecer arrojar buenos resultados pues se encuentra afección ganglionar regional hasta en el 25% de los casos. El manejo trimodal ha permitido una supervivencia global a 5 años del 70% en este grupo de pacientes23,24. Se estima que en cáncer renal el 40-50% desarrollará metástasis a pulmón en algún momento de su vigilancia, con afección ganglionar regional del 20%. En el grupo de pacientes llevados a metastasectomía pulmonar por cáncer renal, histología de células claras, ausencia de componente sarcomatoide y terapia con TKI, la supervivencia global asciende a 70% a 5 años25.
DiscusiónNo hay evidencia de mayores recurrencias locales con la «cirugía ahorradora de pulmón», resecciones sublobares como la resección en cuña y la segmentectomía anatómica frente a la lobectomía. Asimismo aunque la toracotomía sigue siendo el estándar de oro para la metastasectomía pulmonar, a través de la palpación bimanual logrando una mayor cosecha de lesiones, la cirugía asistida por videotoracoscopia en manos experimentadas, usando los pulpejos o pinzas de anillos, parece tener resultados equiparables sobre todo en lesiones mayores a 5mm de diámetro por imagen, periféricas y no más de 5 lesiones, con supervivencia libre de recurrencias metastásicas del 62% para la toracotomía y del 69% para la cirugía asistida por videotoracoscopia, pese a que en el 20% hay lesiones que pasan inadvertidas por este último método26–28. Nunca hay que perder de vista la asociación de la cirugía y técnicas no quirúrgicas como la ablación por radiofrecuencia indicada en pacientes con menos de 3 lesiones, en los 2 tercios externos del parénquima pulmonar, distantes a grandes vasos y mediastino, lesiones menores de 3cm y contraindicaciones para control quirúrgico29. Otras modalidades como la citólisis por desnaturalización de proteínas con la técnica de crioablación percutánea con sistema de argón y la radioterapia estereotáxica, esta última en lesiones cerca del mediastino con toxicidad aceptable, deben ser un recurso disponible del grupo de manejo de metástasis pulmonares.
En una revisión de 18 años en el Instituto Nacional de Cancerología de México con 398 pacientes llevados a resección de metástasis pulmonares, la supervivencia global en estos pacientes fue de 81.9 meses. Y los factores independientes asociados a mejor pronóstico fue el periodo libre de enfermedad>6 meses y la resección completa de la lesión metastásica30. Consideramos en adelante que el desarrollo de la evidencia de la enfermedad metastásica de pulmón debe ser individualizado a la histología y la biología del tumor primario para el establecimiento de criterios y factores pronósticos aplicables que traduzcan el beneficio del manejo multimodal de las metástasis pulmonares.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.