La neutropenia inducida por quimioterapia es una complicación frecuente y grave del tratamiento oncológico. Una de sus consecuencias es la interrupción del tratamiento citotóxico, situación que afecta la respuesta de los pacientes oncológicos y su calidad de vida. Asimismo, produce un incremento en los costos de la atención médica. El manejo de la neutropenia inducida por quimioterapia debe incluir estrategias preventivas y terapéuticas de las cuales debe estar alerta el oncólogo clínico tanto para tomar en cuenta el potencial mielosupresor de la quimioterapia como para implementar los abordajes de tratamiento adecuados. Los factores estimulantes de colonias de los granulocitos son la piedra angular para el manejo de esta complicación y han resultado herramientas efectivas.
Chemotherapy-induced neutropenia is a frequent and serious complication of the oncological treatment. One of its consequences is the interruption of the cytotoxic treatment, which affects the patient response and quality of life, as well as increasing the cost of medical care. Management of chemotherapy-induced neutropenia must include preventive and therapeutic strategies, which the oncologist must take into account when considering the potential myelosuppressive agent and to implement the appropriate treatment approaches. Granulocyte colony stimulating factors are the cornerstone for the management of this complication and have become quite effective treatment tools.
La quimioterapia citotóxica usada comúnmente en el tratamiento de tumores malignos causa mielosupresión, además de neutropenia y neutropenia febril (NF), alteraciones frecuentes, tempranas y potencialmente serias1.
Los neutrófilos son de suma importancia en la contención de infecciones y el primer elemento celular en la cascada inflamatoria. Cuando hay neutropenia disminuye la respuesta inflamatoria a las infecciones y diseminación de las bacterias. A menudo, los pacientes con infección y neutropenia presentan fiebre como única manifestación clínica de sepsis.
La severidad de la neutropenia ha sido clasificada de acuerdo con los Criterios Comunes de Toxicidad del Instituto Nacional del Cáncer de EE. UU. en 4 grados2:
Grado 1: neutrófilos de 1,500 a 2,000 células/mm3
Grado 2: neutrófilos de 1,000 a 1,500 células/mm3
Grado 3: neutrófilos de 500 a 1,000 células/mm3 y
Grado 4: neutrófilos cuando hay<500 células/mm3
Se considera neutropenia profunda cuando la cuenta es<100células/mm3. Cuando la cuenta de neutrófilos es<500células/mm3 el riesgo de infección seria aumenta1.
La NF se define como una temperatura oral>38.5grados Celsius o 2 mediciones consecutivas>38GC por 2h y una cuenta de neutrófilos<0.5×109/l o una disminución esperada por debajo de 0.5×109/l. Se considera que la presencia de fiebre y neutropenia es una urgencia médica que requiere de atención inmediata, ya que es una complicación potencialmente letal2.
En una cohorte en EE. UU., la NF ocurrió en el 6% de los pacientes durante el primer ciclo de tratamiento3. En un estudio retrospectivo, la incidencia de NF en pacientes con enfermedad metastásica de tumores sólidos durante la administración de quimioterapia mielosupresiva osciló entre el 13% y el 21%4.
Las consecuencias de la neutropenia incluyen retrasos en el tratamiento citotóxico, lo cual puede asociarse con disminución de su eficacia; en caso de NF, con hospitalización, hemocultivos y uso de antibióticos intravenosos, así como de factores estimulantes de colonias de los granulocitos (G-CSF). Ello afecta la calidad de vida de los pacientes e incrementa los costos de la atención médica. Por estas razones es crítico limitar o prevenir la neutropenia inducida por quimioterapia (NIQ) citotóxica.
Factores de riesgo para neutropenia inducida por quimioterapiaSe pueden dividir en 2 grandes grupos: los relacionados con el paciente y los relacionados con el esquema de quimioterapia administrado.
Riesgo de acuerdo con el esquema de quimioterapiaEl esquema de quimioterapia incluye 2 factores fundamentales:
- 1)
medicamento específico con su potencial particular de mielotoxicidad y
- 2)
dosis.
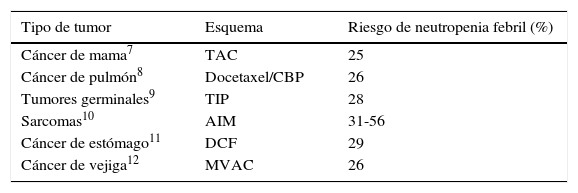
Hay extensa información de la mielotoxicidad de cada esquema de quimioterapia en numerosos ensayos clínicos. En ellos se hace mención de las complicaciones del riesgo para cada esquema5. En general, los esquemas con un riesgo mayor de 20% de presentar NF para tumores sólidos incluyen la combinación de una antraciclina con un taxano (comúnmente en cáncer de mama); ciclofosfamida, doxorrubicina, vincristina, prednisona y rituximab (y esquemas relacionados) en linfoma; docetaxel, cisplatino y fluorouracilo para cáncer de estómago; paclitaxel, ifosfamida y cisplatino para tumores germinales, entre otros6 (tabla 17–12). Algunos medicamentos son especialmente mielotóxicos por sí solos, como cabazitaxel, el cual se asocia con hasta un 82% de neutropenia grado≥3 y con un 8% de NF13.
Ejemplos de esquemas de quimioterapia con riesgo mayor de 20% para neutropenia febril
| Tipo de tumor | Esquema | Riesgo de neutropenia febril (%) |
|---|---|---|
| Cáncer de mama7 | TAC | 25 |
| Cáncer de pulmón8 | Docetaxel/CBP | 26 |
| Tumores germinales9 | TIP | 28 |
| Sarcomas10 | AIM | 31-56 |
| Cáncer de estómago11 | DCF | 29 |
| Cáncer de vejiga12 | MVAC | 26 |
AIM: doxorrubicina, ifosfamida, MESNA; CBP: carboplatino; DCF: docetaxel, cisplatino, fluorouracilo; MVAC: metotrexato, vinblastin, doxorrubicina, cisplatino; TAC: docetaxel, doxorrubicina, ciclofosfamida; TIP: paclitaxel, ifosfamida, cisplatino.
Otro factor muy importante para el desarrollo de la NIQ es la intensidad en la administración de quimioterapia. En este sentido, se puede acortar el período de descanso entre 2 administraciones de quimioterapia. Aunque la eficacia del esquema aumenta, también se incrementa el riesgo de neutropenia. Un ejemplo es el régimen doxorrubicina con ciclofosfamida en dosis densas en cáncer de mama, que mejora la respuesta tumoral y la supervivencia14. Usualmente, se considera que todos los esquemas en dosis densas son altamente mielotóxicos y se administran con G-CSF de manera profiláctica.
Así como el acortamiento entre ciclos de quimioterapia puede incrementar la eficacia del tratamiento, existe evidencia de que disminuir la dosis o incrementar el período entre ciclos disminuye la eficacia del esquema de quimioterapia en varias neoplasias como cáncer de mama, cáncer colorrectal, cáncer de pulmón y linfomas15–18.
El riesgo también es mayor en los primeros ciclos de quimioterapia. Por ejemplo, en un estudio en pacientes con cáncer de mama tratados con docetaxel y doxorrubicina y con soporte con G-CSF, la mayor parte de los eventos de NF se presentó en el primer ciclo19. Esto no implica que la NIQ no pueda presentarse en ciclos posteriores.
En un estudio reciente se demostró la importancia de continuar con la administración profiláctica de G-CSF en todos los ciclos20.
Factores de riesgo relacionados con el pacienteLas características del paciente son un factor fundamental para el riesgo de NIQ. La edad tiene gran importancia porque el factor de riesgo más frecuentemente asociado con NF es la edad mayor de 65 años21. Otros factores de riesgo para NIQ y NF son estadio avanzado del cáncer, episodios previos de NIQ o NF, no recibir factores estimulantes y no recibir antibióticos profilácticos22.
También el estado funcional, desnutrición, comorbilidades (incluida la enfermedad renal o cardiaca), leucopenia basal antes del inicio de la quimioterapia y el sexo femenino aumentan el riesgo de NIQ11,23.
Manejo de la neutropenia inducida por quimioterapiaEl manejo de la NIQ puede involucrar estrategias preventivas, terapéuticas o ambas. El clínico debe tomar en cuenta los resultados con respecto a toxicidad en los ensayos clínicos, pero también es fundamental considerar la frecuencia de neutropenia en su comunidad para tomar decisiones con respecto a la prevención de la misma. Por ejemplo, el estudio de aprobación de docetaxel/ciclofosfamida para cáncer de mama adyuvante reportó una tasa de NF del 5%24; sin embargo, otros estudios han demostrado tasas de hasta el 20%6.
Dentro de las estrategias de prevención y tratamiento se incluyen el uso de antibióticos y de G-CSF.
Factores estimulantes de colonias de los granulocitosLos factores de crecimiento mieloide son una clase de agentes biológicos que regulan la proliferación, diferenciación, supervivencia y activación de las células hematopoyéticas de la línea mieloide.
El G-CSF es producido por los macrófagos linfocitos, fibroblastos y células endoteliales. Este induce la producción y liberación de granulocitos neutrofílicos en la médula ósea y estimula su capacidad funcional periférica. Además, tiene funciones activadoras de neutrófilos como el burst oxidativo, degranulación, fagocitosis y quimiotaxia. El G-CSF también estimula los mecanismos de citotoxicidad celular dependiente de anticuerpos. Participa en la inmunidad innata y se piensa que también tiene actividad inmunorreguladora en la inmunidad adaptativa25.
Antes del advenimiento de los G-CSF en 1986, se trataba de evitar la NIQ y la NF con disminución de dosis o con alargamiento del intervalo entre ciclos. La introducción de los G-CSF tuvo un efecto significativo en el manejo de la toxicidad hematológica porque estos compuestos estimulan la producción y maduración de neutrófilos. Asimismo, diversos estudios clínicos han demostrado que los G-CSF reducen la incidencia de NF en pacientes que reciben quimioterapia26.
En México están disponibles 2 G-CSF: filgrastrim de duración corta y pegfilgrastim de larga duración. La administración de G-CSF ha demostrado reducir la incidencia, duración y severidad de la NIQ en cáncer de pulmón de células pequeñas, cáncer de mama, sarcoma, tumores sólidos, cáncer de pulmón de células no pequeñas, linfoma no Hodgkin27, así como la incidencia de NF y el riesgo de infección en pacientes que reciben quimioterapia28,29.
Los G-CSF disminuyen la necesidad de reducciones de dosis y retardos en los ciclos de tratamiento, aunque esto no se ha asociado a incremento en la supervivencia o a las tasas de respuesta. Sin embargo, esto ha permitido el uso de regímenes de dosis densas, los cuales se han relacionado con incremento en la supervivencia libre de enfermedad y en la supervivencia global en cáncer de mama, en comparación con esquemas convencionales30.
El otro compuesto en uso es la molécula pegilada del filgrastim. La pegilación limita el aclaramiento renal, de manera que el sistema del receptor del GSC en los neutrófilos se convierte en el sistema principal de excreción. Este mecanismo de autorregulación determina niveles séricos altos durante la neutropenia, lo cual permite la administración de una sola dosis por ciclo de quimioterapia31.
El filgrastim debe iniciarse al día siguiente o hasta 3-4 días después de completar la quimioterapia, en una dosis diaria de 5μg/kg diario hasta la recuperación de la cuenta de neutrófilos posterior al nadir o hasta niveles cercanos a la normalidad. En el caso de pegfilgrastim, una dosis única de 6mg es suficiente por ciclo de quimioterapia y, en la mayoría de los ensayos clínicos, ha sido administrada el día posterior a la quimioterapia. La razón de no inyectar el compuesto pegilado el mismo día de la administración de la quimioterapia es el potencial de incrementar la neutropenia, debido a la estimulación de los progenitores mieloides por el factor estimulante de colonias, lo que implica exposición de estos progenitores al efecto citotóxico de la quimioterapia.
Hay al menos 2 estudios en cáncer de mama y en linfoma no Hodgkin32,33 en los cuales se observó mayor incidencia de NF en los pacientes tratados con PEG G-CSF en el mismo día; no obstante, a pesar de que la neutropenia grado 4 fue mayor no hubo incremento en la incidencia total de neutropenia. Las guías actuales recomiendan la administración de pegfilgrastim al día siguiente de la administración de quimioterapia6,27.
En Europa ha sido aprobado desde 2013 lipegfilgrastim (G-CSF recombinante humano, r-met-HuG-CSF), una novedosa molécula glucopegilada, obtenida mediante un proceso de glucosilación enzimática específica de sitio34,35. Lipegfilgrastim ha demostrado no inferioridad frente a pegfilgrastim en un estudio clínico de fase 3 en pacientes con cáncer de mama metastásico que recibieron quimioterapia mielosupresora36. No se llevaron a cabo estudios clínicos de fase 3 en pacientes hematológicos; sin embargo, está registrado el estudio NCT02044276 en www.clinicaltrials.gov, denominado AVOID, que se encuentra en etapa de reclutamiento para pacientes con linfoma no Hodgkin agresivo de células B37. El estudio alemán NADIR también ha estado incluyendo a pacientes con linfoma Hodgkin y leucemia, según lo reportado el análisis interino38.
Efectos adversosEl uso de G-CSF no es inocuo. Del 10-30% de los pacientes presentan dolor óseo de leve a moderado, lo cual puede controlarse efectivamente con analgésicos no opioides. Además, hay un incremento en el riesgo de dolor musculoesquelético asociado con estos medicamentos39. Otros efectos adversos reportados son reacciones alérgicas, síndrome de dificultad respiratoria aguda, hemorragia alveolar y hemoptisis40,41. En pacientes con trasplante de células madre, se ha reportado rotura esplénica, en algunos casos fatal42.
Profilaxis primariaAntes de la existencia de los factores estimulantes de colonias, las estrategias para disminuir el riesgo de mielotoxicidad eran reducir la dosis de los medicamentos o retrasar su administración.
La profilaxis primaria se refiere a la administración de factores estimulantes de colonias desde el primer ciclo de quimioterapia. Antes del inicio del tratamiento sistémico, se debe realizar una valoración de riesgo de NF. Esto puede incluir diferentes variables, entre ellas, el tipo de enfermedad, esquema de quimioterapia (dosis altas, dosis densas o dosis estándar), factores de riesgo de cada paciente y la intención del tratamiento (adyuvante vs. prolongar la supervivencia vs. manejo de enfermedad sintomática).
Desafortunadamente, no existen en este momento nomogramas que evalúen el riesgo, por lo que el clínico deberá tomar la decisión sobre dar la profilaxis primaria de acuerdo con estos factores y conforme a su experiencia clínica. Las guías actuales recomiendan este tipo de profilaxis para pacientes tratados con esquemas con riesgo de NF mayor de 20% o esquemas de dosis densas27,43. Otros factores que deben tomarse en cuenta son la edad (mayor o igual a 65 años), enfermedad avanzada, tratamiento previo con quimioterapia o radioterapia, presencia de infección, heridas abiertas o cirugías recientes, estado funcional y/o nutricional pobres, función renal baja, disfunción hepática (especialmente elevación de las bilirrubinas), enfermedad cardiovascular, múltiples comorbilidades e infección por VIH44–46.
Los ensayos clínicos sobre el beneficio de la profilaxis primaria son contradictorios. Existe una revisión sistemática que incluyó estudios de pacientes con tumores sólidos y linfoma no Hodgkin tratados con G-CSF como profilaxis primaria, en el cual se demostró reducción del riesgo de NF y mejoría en la intensidad de dosis relativa de quimioterapia. Además, se reportaron resultados más alentadores en el riesgo de mortalidad relacionada con infección y de muerte temprana durante el tratamiento47. Sin embargo, no hay evidencia de que esta medida afecte la supervivencia libre de enfermedad o la supervivencia global.
Profilaxis secundariaLuego de un evento de NF, existe un riesgo del 50-60% de presentar un episodio similar en ciclos posteriores48. Hasta hace unos años, la estrategia para disminuir este riesgo en ciclos subsecuentes era ajustar la dosis inicial de quimioterapia o retrasar la administración del siguiente ciclo. La profilaxis secundaria se refiere a la administración de factores estimulantes de colonias en los ciclos posteriores a un evento de NF.
Hasta el momento, no existen estudios prospectivos que evalúen la eficacia de esta estrategia, pero las guías internacionales recomiendan utilizarla en los casos en los que los cambios en la intensidad de dosis comprometan la eficacia del tratamiento (por ejemplo, en el contexto adyuvante)27,43.
Uso de factores estimulantes de colonias de los granulocitos en otros contextosLas guías actuales no recomiendan la administración de factores estimulantes de colonias en pacientes con neutropenia asintomáticos o afebriles, ya que estos solo han demostrado acortamiento de la neutropenia por un día, sin reducción significativa de NF o infección27,43.
Por otro lado, el uso de factores de crecimiento mieloides en el contexto de NF ha reportado menor tiempo de hospitalización y menos tiempo de recuperación de neutrófilos, pero no ha logrado prolongar la supervivencia49. Esto ha propiciado que los expertos recomienden su uso únicamente en pacientes con factores de alto riesgo para complicaciones asociadas a infecciones o con factores de mal pronóstico (tabla 243). El manejo de la NF no se abordará en esta revisión, por lo que se recomienda consultar otros textos.
Factores de mal pronóstico en pacientes con neutropenia febril
| Síndrome de sepsis Edad≥65 años Neutropenia profunda (cuenta absoluta de neutrófilos≤0.1×109/l) Tiempo esperado de neutropenia≥10días Neumonía Infección fúngica invasiva Otras infecciones clínicamente documentadas Hospitalización en el momento de la fiebre Episodio previo de neutropenia febril |
Fuente: Smith et al.43.
Se han recomendado en pacientes con una duración esperada de neutropenia (cuenta absoluta de neutrófilos<1,000) por más de 7 días. Se sugiere utilizar levofloxacino porque tiene el mismo espectro de cobertura que ciprofloxacino y ofloxacino contra patógenos gramnegativos, además de cierta actividad contra microorganismos grampositivos, incluido el estreptococo.
El uso de levofloxacino en pacientes con riesgo de neutropenia mayor a 7 días se ha asociado con reducción en infecciones bacterianas clínicamente significativas. En pacientes con riesgo bajo de complicaciones infecciosas (lo cual incluye la mayor parte de los pacientes con tumores sólidos), el beneficio de los antibióticos profilácticos es la reducción de la fiebre, más que de los procesos infecciosos. En pacientes en quienes la duración de la neutropenia esperada es menor de 7 días, no se recomienda la administración de estos medicamentos20.
ConclusiónLa NIQ es el efecto adverso mielotóxico más frecuentemente asociado con quimioterapia citotóxica en pacientes con tumores sólidos; de modo que la identificación de factores de riesgo asociados es de vital importancia para el adecuado manejo de la misma. La disponibilidad de los G-CSF es una herramienta para el manejo de estos eventos. Su uso ha optimizado tanto la dosis como la frecuencia de los ciclos de quimioterapia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.