A lo largo de las dos últimas décadas se han logrado notables avances en el tratamiento del paciente hematooncológico. Sin duda, uno de los más notables ha sido la reducción de la morbimortalidad por complicaciones infecciosas, así como la reducción del período de neutropenia, gracias al empleo de factores de crecimiento hematopoyéticos. A pesar de ello, la neutropenia febril (NF) es una consecuencia severa del uso de quimioterapia mielosupresora, que usualmente deriva en hospitalizaciones y en la necesidad de administrar antibióticos intravenosos, utilizando recursos importantes para el sistema de salud. La NF también está asociada a reducciones de dosis y retrasos o suspensión en la aplicación de quimioterapia, lo que puede afectar el resultado final del tratamiento. Entonces, es de suma importancia identificar a los pacientes que tienen riesgo elevado de desarrollar NF, para que puedan recibir una quimioterapia óptima y su riesgo de NF sea tratado de manera apropiada, así como que los pacientes que se presenten con NF reciban un diagnóstico y tratamiento oportunos.
Notable advances have been made in the last 20 years as regards treatment of the haematology-oncology patient. Without a doubt, one of the most remarkable advances has been the reduction in infectious complications, as well as the decrease in the neutropenic period due to the use of haematopoietic growing factors. Nevertheless, febrile neutropenia (FN) is a severe consequence of using myelosuppressive chemotherapy, which usually leads to hospital admission, and the use of intravenous antibiotics, using important health system resources. FN is related to dose reductions and delay or suspension of chemotherapy, affecting the final outcome of treatment. It is essential to be able to identify patients with a high risk of developing FN so that they can receive optimal chemotherapy, FN risk management, as well as receiving a timely diagnosis and treatment.
Las complicaciones infecciosas son todavía causa importante de morbimortalidad en los pacientes con enfermedades hematooncológicas tratados con quimioterapia, especialmente cuando se utilizan esquemas de dosis intensivas. Estos eventos adversos propician una reducción importante de la calidad de vida del paciente, así como un aumento significativo de los costos del tratamiento1–3.
En este escenario la fiebre relacionada con la neutropenia es una de las complicaciones más frecuentes y peligrosas4. Las guías actuales establecen que los regímenes de quimioterapia con riesgo >20% de presentar neutropenia febril (NF) son considerados de alto riesgo, lo cual se basa en estudios prospectivos con pacientes altamente seleccionados, en los que las toxicidades hematológicas son comúnmente subreportadas2. De modo que es recomendable que no solo el esquema de quimioterapia sea considerado al evaluar al paciente que recibirá quimioterapia5.
Si bien se tiene un mayor conocimiento y arsenal terapéutico para el tratamiento de la NF, las complicaciones infecciosas continúan siendo causa de muerte en pacientes con enfermedades hematooncológicas1. Estos pacientes están sometidos a un mayor riesgo de reactivación de ciertas infecciones, así como a un riesgo aumentado de padecer infecciones relacionadas con las manipulaciones a las que son sometidos, tales como la colocación de catéteres venosos, urinarios o intervenciones quirúrgicas.
Esta revisión se enfoca en la valoración del paciente hematológico, con énfasis en la identificación de factores de riesgo para complicaciones en pacientes con NF, en su tratamiento y en el uso de factores de crecimiento hematopoyético mieloides, tanto en la profilaxis como en la NF establecida. La presente revisión no pretende abarcar el amplio espectro de información relacionada con el tema, sino establecer directrices sencillas para el abordaje inicial del paciente con NF.
Estratificación del riesgoDe acuerdo con las guías la Red Nacional Comprehensiva de Cáncer de los Estados Unidos o NCCN, la neutropenia se define como una cuenta absoluta de neutrófilos (CAN) menor de 500 neutrófilos/mcl o una CAN menor de 1,000 neutrófilos/mcl y una predicción de que disminuirán a ≤500 neutrófilos/mcl en las siguientes 48h.
La neutropenia puede progresar a NF, es decir, cuando la fiebre asciende a una temperatura ≥38.3°C tomada de manera oral, o a una temperatura ≥38.0°C que dure por un período de 1h5.
La NF es una complicación frecuente en los pacientes que se encuentran bajo tratamiento con quimioterapia, tanto para tumores sólidos como hematológicos; sin embargo, los últimos presentan una frecuencia de NF de hasta el 80%4 y una tasa de mortalidad de hasta el 11%6. Ante estos datos es necesario definir qué factores ponen al paciente con NF en riesgo de padecer una complicación severa.
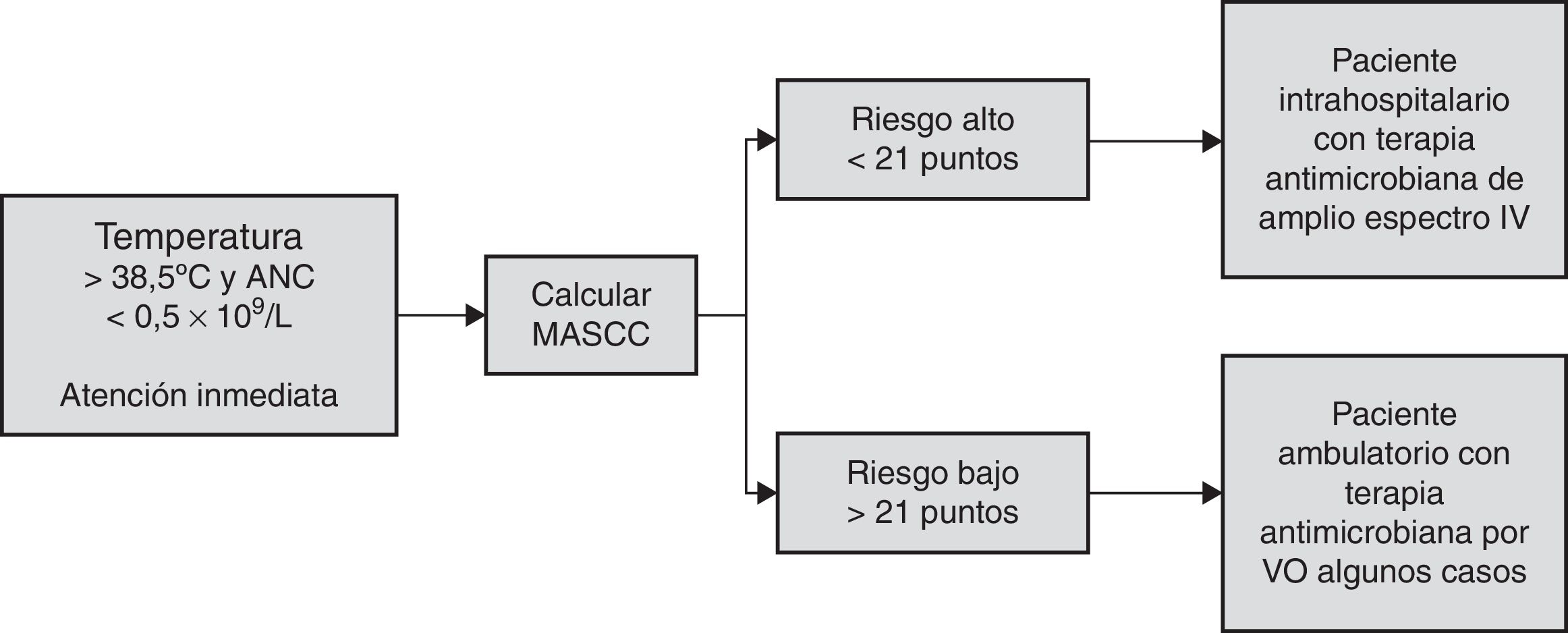
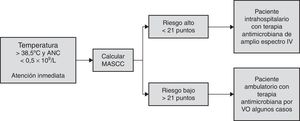
El instrumento más ampliamente utilizado con esta finalidad es el sistema de puntuación MASCC, que permite al clínico valorar el riesgo del paciente de una manera rápida y objetiva, aun sin conocer la enfermedad oncológica de base. Se utiliza una serie de criterios a los cuales se les da una puntuación y al final se suman (tabla 1). Los pacientes con una puntuación ≥21 son considerados de bajo riesgo7, ya que la tasa de complicaciones serias es de aproximadamente el 6% y la mortalidad del 1%. Estos pacientes pueden ser tratados de una manera menos intensiva con antibióticos orales, egreso temprano o inclusive con tratamiento ambulatorio. Existe también una serie de factores predictores independientes de complicaciones que se deben tomar en cuenta en este grupo de pacientes, porque no todos los pacientes de bajo riesgo se comportaran como tales. Dichos factores son: 1) ECOG≥2; 2) bronquitis crónica; 3) insuficiencia cardiaca crónica; 4) hiperglucemia; 5) monocitosis <200mm3; y 6) estomatitis grado 2 o mayor8.
Riesgo de complicaciones de pacientes con neutropenia febril, puntuación MASCC
| Característica | Puntuación |
|---|---|
| Carga de la enfermedad: sin o mínimos síntomas | 5 |
| Carga de la enfermedad: síntomas moderados | 3 |
| Carga de la enfermedad: síntomas severos | 0 |
| No hipotensión (sistólica>90mmHg) | 5 |
| No enfermedad pulmonar obstructiva crónica | 4 |
| Tumor sólido/ enfermedad hematológica sin infección fúngica previa | 4 |
| No deshidratación | 3 |
| Paciente ambulatorio al inicio de la fiebre | 3 |
| Edad<60 años | 2 |
Una puntuación mayor o igual a 21 indica bajo riesgo de complicación-
Los puntos atribuidos a la variable «Carga de la enfermedad» no son cumulativos.
La puntuación máxima sería de 26.
En el otro espectro se encuentran los pacientes considerados de alto riesgo de desarrollar una complicación y que de acuerdo con MASCC son todos aquellos con una puntuación <21 y que de manera general requieren de tratamiento intrahospitalario y administración de antibióticos intravenosos de amplio espectro.
Otros puntos a considerar para clasificar a un paciente como de alto riesgo son4:
- •
Neutropenia profunda (CAN<100células/mm3) prevista por más de 7 días.
- •
Evidencia de insuficiencia hepática (con alteraciones de aminotransferasa>5 valores normales).
- •
Insuficiencia renal (definida como una depuración de creatinina <30ml/min).
- •
Existencia de alguna comorbilidad que incluye, pero no se limita a:
- ∘
Inestabilidad hemodinámica.
- ∘
Mucositis oral o gastrointestinal que interfiere con la deglución.
- ∘
Causa síntomas gastrointestinales, como diarrea severa, incluidos dolor, náuseas y vómitos.
- ∘
Alteraciones neurológicas o cambios en el estado mental.
- ∘
Infección de catéter intravascular, especialmente del túnel.
- ∘
Aparición de nuevo infiltrado pulmonar o hipoxemia o enfermedad pulmonar crónica subyacente.
- ∘
El riesgo de NF está relacionado, en gran medida, con el régimen de quimioterapia y la intensidad de la dosis. Se considera riesgo alto de presentar NF a una proporción mayor del 20% en pacientes vírgenes a quimioterapia. Por otro lado, los esquemas que tienen un riesgo de entre el 10% y el 20% son considerados de riesgo intermedio. Vale la pena enfatizar que el esquema de quimioterapia es solo un componente en la valoración del riesgo para NF (tabla 2)4,5.
Esquemas de quimioterapia y riesgo de neutropenia febril
| Quimioterapia | Riesgo |
|---|---|
| Metotrexato, vinblastina, doxorrubicina, cisplatino (MVAC) | >20% |
| Docetaxel y trastuzumab Doxorrubicina, ciclofosfamida, paclitaxel (ACT) Doxorrubicina y docetaxel Doxorrubicina y paclitaxel Docetaxel, doxorrubicina, ciclofosfamida (TAC) | >20% |
| Docetaxel, doxorrubicina y fluoracilo | >20% |
| Bleomicina, etopósido, doxorrubicina, ciclofosfamida, vincristina, procarbazina, prednisona (BEACOPP) | >20% |
| Doxorrubicina y gemcitabine | >20% |
| Ciclofosfamida, fludarabina, alemtuzumab y rituximab (CFAR) Ifosfamida, carboplatino y etopósido (ICE) Rituximab, ifosfamida, carboplatino y etoposido (RICE) Ciclofosfamida, doxorrubicina, vincristina y prednisona (CHOP-14) con o sin rituximab Mesna, ifosfamida, novantrone y etopósido (MINE) Dexametasona, cisplatino y citarabina (DHAP) Etopósido, metilprednisolona, cisplatino y citarabina (ESHAP) Ciclofosfamida, vincristina, doxorrubicina y dexametasona (HyperCVAD)+rituximab | >20% |
| Combinación basada en dacarbazina (dacarbazina, cisplatino y vinblastina) Combinación basada en dacarbazina (dacarbazina, cisplatino y vinblastina)+interleucina-2 e interferón alfa | >20% |
| Globulina antitimocito, ciclosporina Decitabine | >20% |
| Topotecán, paclitaxel, docetaxel | >20% |
| Mesna, doxorrubicina, ifosfamida y dacarbazina (MAID) o doxorrubicina | >20% |
| Topotecán | >20% |
| Vinblastina, ifosfamida y cisplatino (VeIP) Etopósido, ifosfamida y cisplatino (VIP) Bleomicina, etopósido y cisplatino (BEP) Paclitaxel, ifosfamida y cisplatino (TIP) | >20% |
| Gemcitabina y docetaxel | 10-20% |
| Docetaxel cada 21 días Epirrubicina Epirrubicina+ciclofosfamida, metotrexato y fluorouracilo CMF clásico (ciclofosfamida, metotrexato y fluorouracilo) AC (doxorrubicina y ciclofosfamida)+docetaxel secuencial AC (doxorrubicina y ciclofosfamida)+docetaxel secuencial y trastuzumab FEC (fluorouracilo, epirrubicina y ciclofosfamida)+docetaxel secuencial Paclitaxel cada 21 días Vinblastina | 10-20% |
| Cisplatino y topotecán Topotecán Irinotecán | 10-20% |
| Fluorouracilo, leucovorin y oxaliplatino (FOLFOX) | 10-20% |
| Irinotecán y cisplatino Epirrubicina, cisplatino y fluorouracilo Epirrubicina, cisplatino y capecitabina | 10-20% |
| Doxorrubicina, bleomicina, vinblastina y dacarbazina (ABVD) Mecloretamina, doxorrubicina, vinblastina, vincristina, bleomicina, etopósido y prednisona (Stanford V) | 10-20% |
| Etopósido, prednisona, vincristina, ciclofosfamida y doxorrubicina (EPOCH) EPOCH+quimioterapia intratecal ACOD (CHOP modificado: doxorrubicina, ciclofosfamida, vincristina y prednisona) Gemcitabina, dexametasona y cisplatino (GDP) GDP+rituximab Fludarabina y mitoxantrona (FM) CHOP+rituximab, incluidos regímenes con doxorrubicina liposomal o mitoxantrona que sustituyen doxorrubicina | 10-20% |
| Cisplatino y paclitaxel Cisplatino y vinorelbina Cisplatino y docetaxel Cisplatino e irinotecán Cisplatino y etopósido Carboplatino y paclitaxel Docetaxel | 10-20% |
| Carboplatino y docetaxel | 10-20% |
| Cabazitaxel | 10-20% |
| Etopósido y carboplatino | 10-20% |
| Etopósido y cisplatino | 10-20% |
| Docetaxel | 10-20% |
Es importante reconocer que el paciente hematooncológico tiene un riesgo mayor que el de la población en general de presentar infecciones, debido a múltiples condiciones como la enfermedad de base, el estado nutricional, los procedimientos invasivos, las hospitalizaciones frecuentes y prolongadas, la posibilidad de sobreinfecciones con gérmenes hospitalarios multirresistentes, etc.
En la tabla 3 se proponen una serie de datos clínicos que clasifican al paciente acorde con el riesgo de presentar una infección, con la finalidad de obtener una sospecha diagnóstica e iniciar un tratamiento de manera oportuna, en especial en el paciente hematológico, en quien se espera la incidencia de neutropenias más prolongadas y profundas9.
Riesgo de infección de acuerdo con enfermedad y tipo de tratamiento
| Riesgo | Enfermedad y/o terapia |
|---|---|
| Bajo | Neutropenia esperada<7 días Regímenes de quimioterapia estándar para tumores sólidos |
| Intermedio | Neutropenia esperada entre 7 y 10 días Trasplante autólogo Linfomas Mieloma múltiple Leucemia linfocítica crónica Uso de análogos de las purinas: fludarabina, clofarabina, nelarabina, 2CdA |
| Alto | Neutropenia esperada ≥10 días Trasplante alogénico Quimioterapia de inducción y/o consolidación para leucemia aguda Terapia con alemtuzumab |
Fuente: Vázquez-López y García-Sánchez9.
Como se había mencionado, el abordaje inicial del paciente con NF se basa, de manera general, en su clasificación del MASCC, como lo muestra la figura 1. Los principales abordajes se realizan con antibióticos, antifúngicos, antivirales, factores de crecimiento mieloide y biosimilares.
AntibióticosAproximadamente el 85% de las infecciones bacterianas en este grupo de pacientes son causadas por Escherichia coli, Klebsiella sp. y Pseudomonas aeruginosa (gramnegativos), Staphylococcus aureus, Staphylococcus epidermidis y Streptococcus viridians (grampositivos)10.
El esquema antimicrobiano inicial recomendado debe ser de amplio espectro y tener actividad contra Pseudomonas: cefalosporina de tercera o cuarta generación (ceftazidima, cefepima), piperacilina-tazobactam o carbapenémicos (meropenem, imipenem-cilastatina)11.
En ocasiones, es necesario adicionar otro fármaco, en especial en pacientes graves con insuficiencia orgánica múltiple o que tengan una infección que requiera la administración de algún antibiótico específico. Los aminoglucósidos son una excelente opción para el tratamiento combinado, por su sinergia contra gérmenes gramnegativos y algunos grampositivos, con menor riesgo de resistencia6.
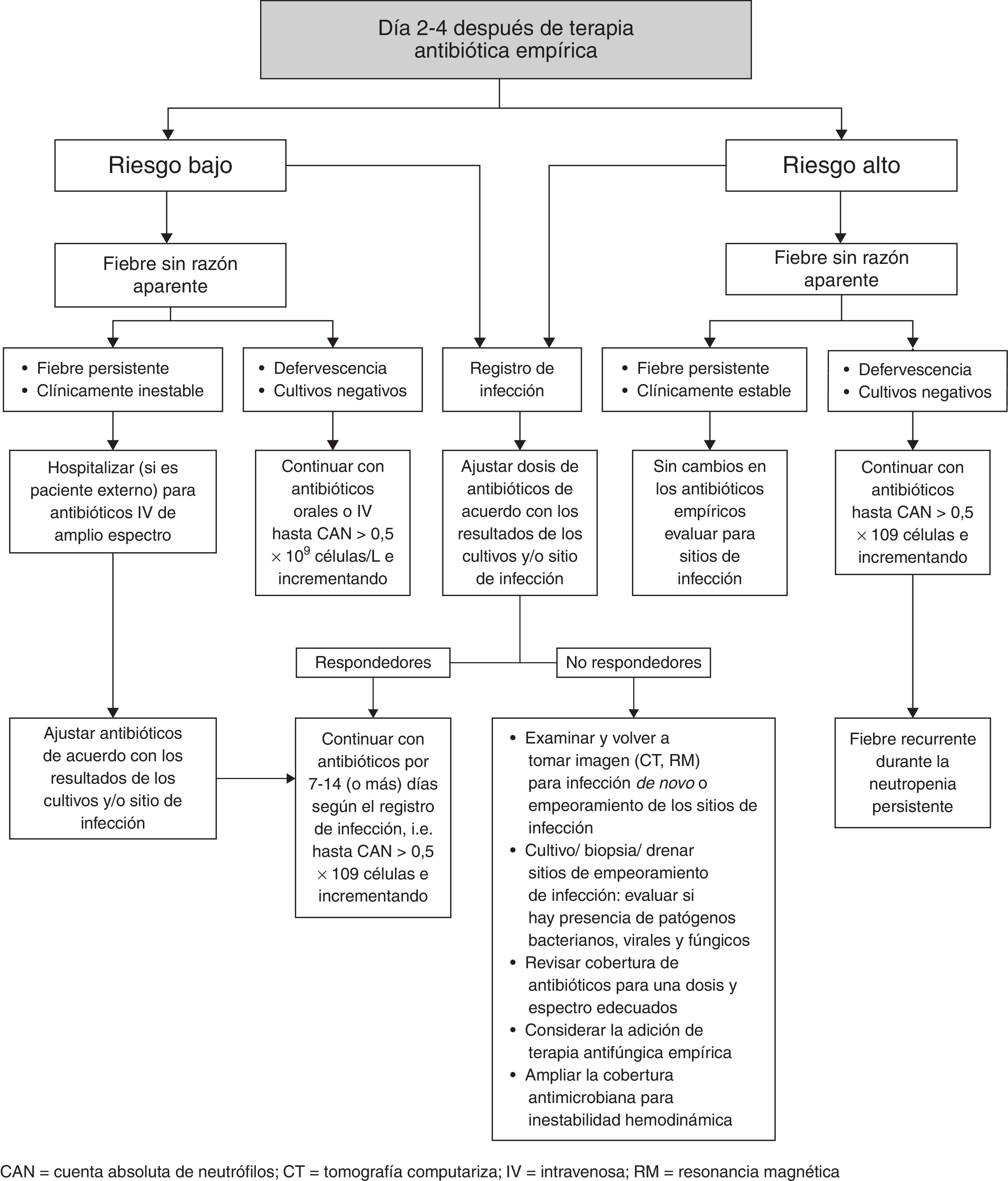
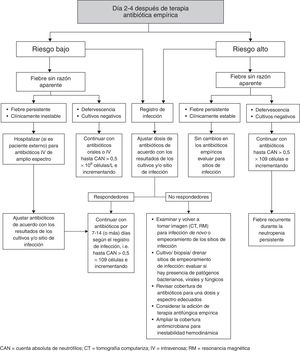
La reevaluación del tratamiento establecido debe realizarse entre los 2 y los 4 días de haber iniciado el tratamiento empírico12. Igualmente, la decisión de modificar el tratamiento antibiótico inicial debe ser guiada por datos clínicos y microbiológicos. El esquema inicial debe modificarse de acuerdo con los resultados de los cultivos o el sitio de infección. Si la fiebre persiste en un paciente cuya condición es estable, no se requiere hacer ajustes.
En el caso de pacientes hemodinámicamente inestables con fiebre, el esquema antimicrobiano debe ampliarse contra bacterias anaeróbicas y hongos. Se debe considerar el uso de antimicóticos empíricos en pacientes de alto riesgo con fiebre persistente después de 4-7 días de antibiótico de amplio espectro y sin existir un foco infeccioso evidente. La figura 2 resume la reevaluación del tratamiento inicial12.
En pacientes con infección documentada la duración del tratamiento se basa en el organismo aislado y el sitio de infección, el mismo que debe continuar hasta la recuperación de la neutropenia (CAU≥500células/mm3). En pacientes con NF de etiología no identificada se considera adecuado continuar la antibioticoterapia hasta que el paciente se encuentre afebril por 2 días y la cuenta de neutrófilos esté por encima de las 500células/mm3.
AntifúngicosLas infecciones fúngicas son una posibilidad en el paciente neutropénico. Si bien el uso de antimicóticos no está descrito en el tratamiento inicial de pacientes con NF, se debe considerar su uso en ellos y que en el cuarto día de tratamiento antibiótico persisten febriles, aunque generalmente el uso de antimicóticos se inicia entre los 7 y 10 días tras haber iniciado el tratamiento antibiótico inicial11.
Asimismo, existen otros criterios para considerar al paciente como de alto riesgo para presentar una infección fúngica, que deben tomarse en cuenta al valorar al paciente con NF como: neutropenia que dure>10 días, pacientes tratados con trasplante de médula ósea alogénico y paciente con uso de esteroides a dosis altas.
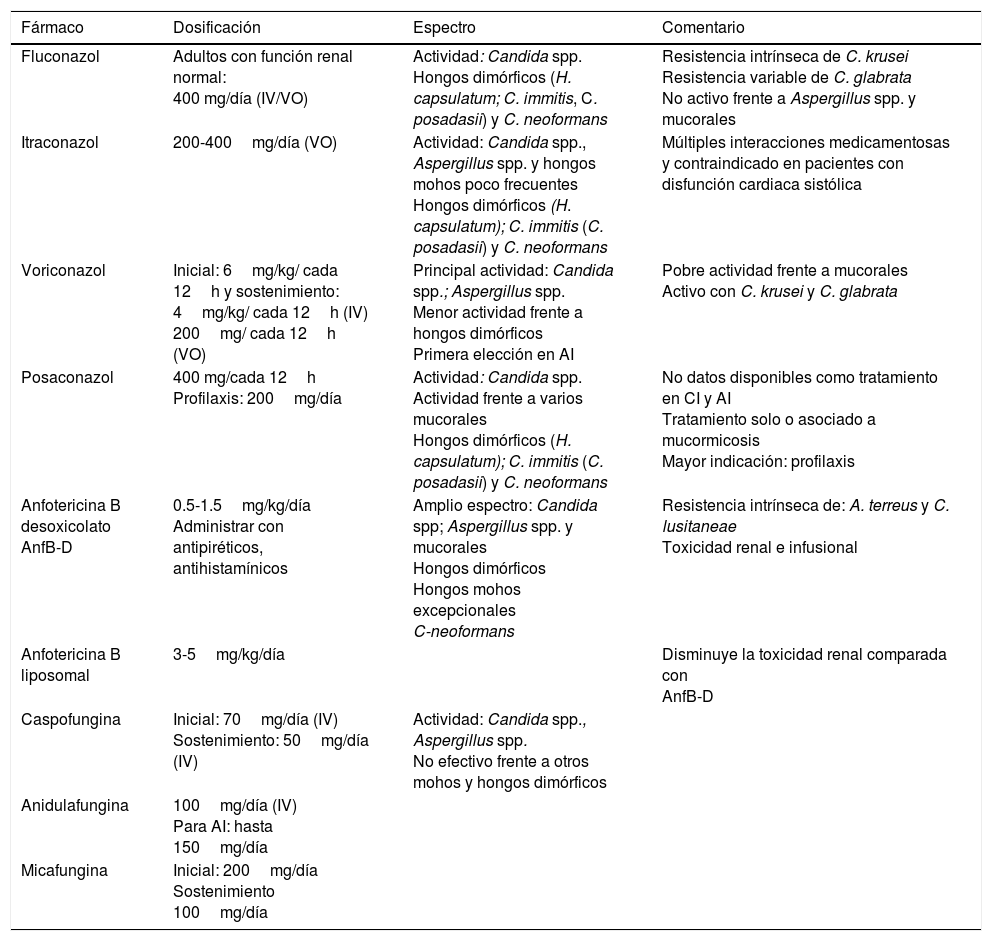
El antifúngico a prescribir como tratamiento empírico debe tener actividad demostrada contra los hongos con mayor posibilidad de infectar al paciente neutropénico, como Candida sp. y Aspergillus sp. Las diferentes opciones de antifúngicos se presentan en la tabla 4. El tratamiento debe mantenerse hasta la recuperación de las cifras de neutrófilos, así como acorde con la respuesta del paciente. En algunos casos puede prolongarse hasta por 14 días.
Antifúngicos recomendados en pacientes con neutropenia y fiebre
| Fármaco | Dosificación | Espectro | Comentario |
|---|---|---|---|
| Fluconazol | Adultos con función renal normal: 400 mg/día (IV/VO) | Actividad: Candida spp. Hongos dimórficos (H. capsulatum; C. immitis, C. posadasii) y C. neoformans | Resistencia intrínseca de C. krusei Resistencia variable de C. glabrata No activo frente a Aspergillus spp. y mucorales |
| Itraconazol | 200-400mg/día (VO) | Actividad: Candida spp., Aspergillus spp. y hongos mohos poco frecuentes Hongos dimórficos (H. capsulatum); C. immitis (C. posadasii) y C. neoformans | Múltiples interacciones medicamentosas y contraindicado en pacientes con disfunción cardiaca sistólica |
| Voriconazol | Inicial: 6mg/kg/ cada 12h y sostenimiento: 4mg/kg/ cada 12h (IV) 200mg/ cada 12h (VO) | Principal actividad: Candida spp.; Aspergillus spp. Menor actividad frente a hongos dimórficos Primera elección en AI | Pobre actividad frente a mucorales Activo con C. krusei y C. glabrata |
| Posaconazol | 400 mg/cada 12h Profilaxis: 200mg/día | Actividad: Candida spp. Actividad frente a varios mucorales Hongos dimórficos (H. capsulatum); C. immitis (C. posadasii) y C. neoformans | No datos disponibles como tratamiento en CI y AI Tratamiento solo o asociado a mucormicosis Mayor indicación: profilaxis |
| Anfotericina B desoxicolato AnfB-D | 0.5-1.5mg/kg/día Administrar con antipiréticos, antihistamínicos | Amplio espectro: Candida spp; Aspergillus spp. y mucorales Hongos dimórficos Hongos mohos excepcionales C-neoformans | Resistencia intrínseca de: A. terreus y C. lusitaneae Toxicidad renal e infusional |
| Anfotericina B liposomal | 3-5mg/kg/día | Disminuye la toxicidad renal comparada con AnfB-D | |
| Caspofungina | Inicial: 70mg/día (IV) Sostenimiento: 50mg/día (IV) | Actividad: Candida spp., Aspergillus spp. No efectivo frente a otros mohos y hongos dimórficos | |
| Anidulafungina | 100mg/día (IV) Para AI: hasta 150mg/día | ||
| Micafungina | Inicial: 200mg/día Sostenimiento 100mg/día |
Tanto en la práctica clínica como en la mayor parte de las guías el acercamiento inicial al paciente con NF se centra en microorganismos bacterianos y fúngicos; sin embargo, se considera que los virus podrían ser entre la segunda y la tercera causa de infección en el paciente con neutropenia, en especial en enfermedades hematológicas como leucemia aguda mieloide, leucemia linfoblástica aguda en recaída, síndrome mielodisplásico y los pacientes que reciben un trasplante de médula ósea13.
El tratamiento empírico con antivirales usualmente no está indicado en el manejo de pacientes con NF, pero existen pautas específicas para su uso en la profilaxis. El uso de aciclovir profiláctico debe implementarse en pacientes seropositivos para virus del herpes simple, y que estén recibiendo un trasplante de médula ósea, ya sea alogénico o autólogo y en pacientes con leucemia aguda bajo terapia de inducción o reinducción14,15.
Todos los pacientes con enfermedad hematooncológica y sus contactos familiares deben ser vacunados contra la influenza con la vacuna de virus inactivados de manera anual. Se recomienda que en los pacientes con síntomas respiratorios —incluidos tos y congestión nasal o en los que se encuentra un infiltrado en la radiografía de tórax— se realice exudado nasofaríngeo y que la muestra se procese por PCR, cultivo o ensayo directo de antígenos para virus respiratorios (influenza, parainflueza, adenovirus, VSR y metapneumovirus)16.
Los pacientes neutropénicos infectados con estos virus respiratorios pueden estar afebriles. Por esto, pueden faltar los síntomas «clásicos». Si la sospecha es influenza por epidemiología se puede iniciar tratamiento empírico con agentes anti-influenza como oseltamivir y zanamivir16.
Administración de factores de crecimiento mieloideEs bien conocido que la intensidad y la duración de la neutropenia son los factores más importantes para una infección severa, por lo que evitar la neutropenia o reducir estos factores son parte fundamental del tratamiento integral del paciente hematooncológico17.
Es de reconocerse que el uso de los factores estimulantes de colonias no está recomendado de manera general en el caso de NF establecida, excepto en circunstancias con morbimortalidad incrementada, incluyendo sepsis, infección de tejidos blandos y neutropenia prolongada debido a que los beneficios en este contexto no son convincentes18–21.
En la actualidad la indicación de los factores estimulantes de colonias se realiza de manera profiláctica19.
Los factores de crecimiento mieloides son agentes biológicos que regulan la proliferación, diferenciación, supervivencia y activación de las células de linaje mieloide22. Los estudios han demostrado que el uso profiláctico de estos puede reducir el riesgo, severidad y duración de la NF5. Los más usados son los factores de colonias de granulocitos (FEC-G): filgrastim y su forma pegilada, pegfilgrastim21. En Europa ha sido aprobado desde 2013 lipegfilgrastim, factor estimulante de colonias de granulocitos recombinante humano (r-met-HuG-CSF), una molécula glucoPEGilada, obtenida mediante un proceso de glucosilación enzimática específica de sitio23,24. Lipegfilgrastim ha demostrado no inferioridad frente a pegfilgrastim en un estudio clínico de fase 3 en pacientes con cáncer de mama mestastásico que recibieron quimioterapia mielosupresora25. No se llevaron al cabo estudios clínicos de fase en pacientes hematológicos, sin embargo, se encuentra registrado el estudio NCT02044276 en www.clinicaltrials.gov, denominado AVOID, que está en etapa de inclusión de pacientes con linfoma no Hodgkin agresivo de células B26. El estudio alemán NADIR también ha estado incluyendo pacientes con linfoma Hodgkin y y leucemia, según lo reportado en el análisis interino27.
Profilaxis primariaEl uso de FEC-G está indicado cuando el riesgo de desarrollar NF por el régimen de quimioterapia es igual o superior al 20%. Sin embargo, el esquema de quimioterapia no debe ser el único factor a considerar, en especial en los esquemas considerados de riesgo intermedio de desarrollar NF (10-20%). En estos pacientes vale la pena tomar en cuenta la edad del paciente (mayor de 65 años), enfermedad avanzada, episodios previos de NF, heridas abiertas o infecciones activas, estado funcional deteriorado, estado nutricional pobre, comorbilidades importantes, citopenias derivadas del involucro de la médula ósea y anemia5,28–30.
Por último, los pacientes bajo esquemas con riesgo menor del 10% son considerados de bajo riesgo, y en ellos no está indicado el uso de FEC-G, a menos que el paciente esté en riesgo significativo de consecuencias graves por la enfermedad y/o que el paciente sea tratado con intento curativo4,5,29,30.
Es importante hacer notar que el uso de FEC-G no ha demostrado, hasta el día de hoy, un efecto significativo en la supervivencia global ni en la mortalidad asociada con la infección4,29.
Profilaxis secundariaSe recomienda el uso de FEC-G en pacientes que han experimentado una complicación neutropénica asociada a un ciclo anterior de quimioterapia, y en quienes la reducción de la dosis en los ciclos subsecuentes puede dañar los resultados globales del tratamiento4,5,28–30.
Las dosis recomendadas de filgrastim y pegfilgrastim son las siguientes5:
- •
Filgrastim. Dosis diaria de 5mcg/kg hasta lograr una recuperación de la CAN a lo normal posnadir. Puede iniciarse el día posterior a la quimioterapia o hasta 3-4 días de haber terminado la quimioterapia5.
- •
Pegfilgrastim. Una sola dosis de 6mg por ciclo de tratamiento. Se recomienda su uso al día siguiente de haber completado la quimioterapia. La evidencia más robusta está basada en esquemas de quimioterapia trisemanales; sin embargo, existen estudios fase ii que demuestran su efectividad en esquemas bisemanales. Hasta el día de hoy no hay datos suficientes para su uso en esquemas de tratamiento semanales5.
- •
La vía subcutánea es la preferida de ambos agentes5.
En pacientes con leucemia mieloblástica aguda los factores de colonias se recomiendan después de completar la quimioterapia de consolidación, debido a la gran posibilidad de disminuir la incidencia de infección y de hospitalización. Igualmente, deben usarse de manera cuidadosa o inclusive no usarse en pacientes con leucemia mieloblástica aguda resistente o en recaída, porque el beneficio esperado es solo en el acortamiento de la neutropenia29,30.
En cuanto a la leucemia linfoblástica aguda están indicados durante el período de inducción a la remisión, en especial en leucemia linfoblástica aguda T y adultos jóvenes29,30.
En los síndromes mielodisplásicos el papel de los factores de colonias es menos claro. Los datos que apoyan su uso han fallado a largo plazo, pero su administración intermitente puede considerarse en los pacientes con neutropenia severa e infección recurrente29.
El papel de los factores estimulantes de colonias está bien establecido en el trasplante de células progenitoras hematopoyéticas, para movilizarlas y para acortar el período de neutropenia después de la citorreducción. En este contexto, en los pacientes con trasplante autólogo los factores deben iniciarse 24-120h después del tratamiento de altas dosis y mantenerse hasta que se logre una cuenta de neutrófilos de por lo menos 2 a 3×109/l5,30.
En cuanto a la movilización de células progenitoras hematopoyéticas se deben iniciar 4 días antes del primer día de leucoféresis y continuarse hasta la última sesión5,30.
La administración de factores estimulantes en trasplante alogénico ha demostrado un incremento en la incidencia de enfermedad de injerto contra huésped y disminución de la supervivencia29,30.
BiosimilaresEn la actualidad hay varios medicamentos biosimilares disponibles en el mercado mexicano, pero su eficacia debe ser comprobada con estudios adecuados. En el mercado internacional sí existe un biosimilar aprobado por la FDA, el filgrastimn-sndz31, primer biosimilar aprobado en marzo de 201525. Un caso particular en Estados Unidos fue el de Tbo-Filgrastim (TEVA Pharmaceuticals Ltd.), que obtuvo en 2012 licenciamiento como molécula nueva por parte de la FDA, ya que fue sometido mediante una licencia de producto biológico32. Filgrastrim-sndz y Tbo-Filgrastim cuentan con el mismo nivel de evidencia categoría 1 en las guías de uso de factores de crecimiento hematopoyético de la NCCN5.
ConclusionesVeamos el punto de vista del hematólogo sobre el manejo del paciente con NF:
- 1.
La NF es una complicación frecuente entre pacientes oncohematológicos tratados con QT hasta en un 80%, con una tasa de mortalidad del 11%.
- 2.
Es necesario conocer el riesgo de NF en los pacientes oncohematológicos en función del esquema de QT, la edad del paciente, su ECOG, las comorbilidades (diabetes, hepatopatía, nefropatía, etc.) y el uso de medicamentos previos (antibióticos, esteroides, etc.).
- 3.
Son considerados esquemas de QT de alto riesgo aquellos que producen una NF en una proporción mayor al 20%.
- 4.
En los pacientes oncohematológicos en tratamiento con QT y con riesgo mayor al 20% de presentar NF es recomendable administrar tratamiento profiláctico con antibióticos, antifúngicos y, en algunos casos, antivirales.
- 5.
El tratamiento empírico para NF debe evaluarse cada 2 a 4 días de iniciado y ajustarlo a la respuesta y el estado clínico del paciente.
- 6.
El uso de factores de crecimiento mieloide se recomienda rutinariamente en pacientes de riesgo elevado de NF (>20%), y en caso de riesgo intermedio (de 10% a 20%), será de acuerdo a las condiciones clínicas del paciente y la presencia otros factores de riesgo.
- 7.
El antecedente de NF severa es un dato muy importante a considerar en aplicación de QT posterior.
- 8.
El filgrastim es el medicamento de elección en la mayoría de las guías nacionales e internacionales, tanto en profilaxis primaria como secundaria.
- 9.
El filgrastim pegilado (pegfilgrastim) es la mejor alternativa al uso de filgrastim, ya que reduce la gravedad de la neutropenia y el periodo de recuperación medular. Hay alternativas que han demostrado seguridad y eficacia como profilaxis del manejo de tumores sólidos; sin embargo, es necesaria mayor evidencia sobre su uso en pacientes hematooncológicos.
El autor declara no tener ningún conflicto de intereses.