El cáncer gástrico es una enfermedad que produce una alta mortalidad a nivel mundial, y en algunos países en vías de desarrollo, como Colombia, es de las primeras causas de muerte por tumores. En el estudio de la enfermedad resalta el de los supresores tumorales, que por sus funciones biológicas inhiben los denominados eventos distintivos del cáncer, siendo un campo en el que se ha dado un importante avance gracias a la descripción de múltiples moléculas con su respectivo mecanismo de acción.
En los últimos años se ha ampliado la investigación de los miARN, que inhiben la expresión de genes determinados, impidiendo la traducción de los mismos. Diversos estudios han permitido establecer que estos miARN pueden actuar tanto como oncogenes o supresores en el cáncer gástrico, y se ha encontrado que pueden inhibir el desarrollo de los eventos distintivos de la carcinogénesis al regular negativamente genes que promueven la tumorogénesis. Además, resultan muy interesantes puesto que un solo miARN puede controlar múltiples vías de señalización relacionadas con la aparición y progresión de neoplasias malignas gástricas, convirtiéndolos en una herramienta promisoria para el diagnóstico, pronóstico, seguimiento y tratamiento de la enfermedad.
Gastric cancer is a disease that causes high mortality worldwide, and in some developing countries like Colombia it is the first in terms of cause of cancer deaths. Among the most crucial topics in the disease is the study of tumour suppressors, which due to their biological functions inhibit the so-called hallmarks of cancer. There has been a major breakthrough in this field with multiple molecules and their respective mechanisms of action being described. The study of miRNAs, which inhibit the expression of specific genes and preventing its translation, has expanded greatly in recent years. Several studies have established that these miRNAs may act as tumour suppressors gastric cancers by downregulating genes that promote tumorigenesis, and by controlling the development of the hallmarks of cancer. MiRNAs are also interesting since a single one can control multiple signalling pathways related to the onset and progression of gastric malignancies, thus making them a promising tool for diagnosis, prognosis, monitoring, and treatment of the disease.
El cáncer gástrico es una de las enfermedades tumorales con mayor mortalidad global, y que genera mayor carga de morbilidad en países en desarrollo, donde es el tercer tipo de cáncer más diagnosticado, siendo la primera causa de muerte asociada a neoplasias malignas1. Una situación similar sucede en Colombia, pues es la primera causa de muerte por tumores en hombres y la tercera en mujeres, con tasas de incidencia y mortalidad que sobresalen al nivel de Latinoamérica y del mundo2. Es por ello que la investigación biomédica es fundamental para la calidad de vida, pues podría incrementar la posibilidad de supervivencia de los pacientes mediante la implementación de nuevas estrategias de diagnóstico y tratamiento, muchas de las cuales se basan en la monitorización y modulación de supresores tumorales, los cuales por sus funciones biológicas inhiben o controlan procesos altamente relacionados con la oncopatogénesis.
Para el cáncer en general se han propuesto 8 eventos distintivos que caracterizan su aparición y progresión: la proliferación sostenida, la evasión de supresores de crecimiento, la activación de invasión y metástasis, la inmortalidad replicativa, la inducción de angiogénesis, la resistencia a la apoptosis, la desregulación de la glucólisis y la evasión del sistema inmune, así como 2 propiedades potenciadoras: la inestabilidad genómica y promoción de la inflamación3, siendo estas las características que los supresores tumorales controlan para mantener el correcto funcionamiento de las células y prevenir la aparición de neoplasias malignas.
Por lo anterior, en este artículo se busca dar un abordaje crítico de la importancia de estos supresores tumorales, especialmente de las implicaciones que conlleva la pérdida de actividad de estos en el cáncer gástrico y la relación actual de los microARN (miRNA) desregulados en dicha neoplasia con los eventos distintivos de la tumorogénesis. Adicionalmente se expone cómo 2 miARN (miR-218 y miR-375) se han estudiado en la enfermedad.
MetodologíaSe realizó una búsqueda mundial en las bases de datos Pubmed, Scopus y ScienceDirect de artículos publicados entre 2010 a marzo de 2016, con el fin de obtener una información actualizada del tema.
Para poner en contexto la importancia de los supresores tumorales en la enfermedad se usaron las palabras clave: gastric cancer AND tumor suppressor. Se seleccionaron artículos que permitieran mostrar la importancia los supresores tumorales y brindaran ejemplos de moléculas con esta función y su respectivo mecanismo de acción.
Por su parte para la relación entre la pérdida de actividad de los miARN y el desarrollo de la neoplasia gástrica se usó las palabras clave: miRNA AND gastric cancer, seleccionándose los artículos en los que se reportara una relación entre la desregulación de miARN y la enfermedad, qué genes inhibían y se estableciera su rol en la enfermedad.
Finalmente, con el fin de comprender la función que ejercen los miARN supresores de tumores 218 y 375 se usaron las palabras clave: miR-218 gastric cancer, miR-35 gastric cancer y búsquedas específicas de la función de sus genes diana. Se seleccionaron artículos que permitieran establecer los objetivos de estos miARN y la relación de estas con los eventos distintivos del cáncer.
Supresores tumorales y cáncer gástricoEl estudio de los supresores tumorales ha contribuido a dilucidar los mecanismos que controlan la homeostasis celular y la prevención de la tumorogénesis, encontrándose que la desregulación y pérdida de expresión de estos, por la acumulación de alteraciones genéticas y epigenéticas, es un paso crucial en la aparición y progresión neoplásica4, lo que ha promovido su estudio y uso como herramientas de detección, pronóstico, seguimiento o como dianas terapéuticas5.
La importancia de estos supresores ha llevado a la postulación de múltiples candidatos, como la proteína fosfatidilinositol-3,4,5-trisfosfato 3-fosfatasa (PTEN), que por su función en la regulación del ciclo y muerte celular inhibe las características de proliferación sostenida y resistencia a la apoptosis6; la proteína transmembrana CD81 que al ser inactivada aumenta el crecimiento y supervivencia de tumores gástricos7 y la galectina-7, cuya disminución durante la enfermedad se asocia a una tasa de supervivencia pobre en los pacientes, mientras que su sobrexpresión parece suprimir la proliferación, migración e invasión del tumor8.
También encontramos otras moléculas que actúan a nivel epigenético, como la proteína Tet metilcitosina dioxigenasa 1, la cual se ve reducida en células cancerígenas, y cuyo efecto supresor parece relacionarse con su función en la demetilación y activación de otros supresores como p53 y la supresión de la histona-lisina metiltransferasa9, mostrando que los supresores tumorales tienen diferentes mecanismos de acción, al intervenir en complejas redes de señalización de procesos celulares vitales.
MicroARN en el cáncer gástricoLo descrito anteriormente deja en evidencia la importancia de estos supresores en la tumorogénesis gástrica, ya sea por su acción directa en la célula, su efecto sobre otras moléculas o su rol en la regulación genética y epigenética, siendo este último punto el que aquí se enfatiza.
Los miARN son ARN pequeños no codificantes, que regulan la expresión génica mediante la formación de un complejo de silenciamiento, que impide la traducción de determinados genes diana al interferir con la lectura y traducción de su ARN mensajero. Estos miARN se han visto desregulados en múltiples enfermedades, incluyendo el cáncer gástrico, y se ha establecido que pueden actuar ya sea como oncogenes o supresores tumorales, puesto que algunos de ellos controlan eventos de interés, como la proliferación, la apoptosis y la migración celular10.
Estos miARN llaman la atención, puesto que pueden regular múltiples vías que se relacionan estrechamente con los eventos del cáncer, como se puede evidenciar con miR-133b, que se han encontrado con niveles significativamente reducidos en neoplasias gástricas e inhiben las características de proliferación sostenida, migración e invasión del tumor; en parte por la inhibición que ejerce sobre el receptor del factor de crecimiento insulínico tipo 111. De manera similar se ha descrito que miR-203 disminuye la proliferación, al inhibir la expresión de la proteína progesterone immunomodulatory binding factor 112, mientras que miR-1284 controla la tumorogénesis, ya que tiene como diana objetivo al oncogén Eukaryotic translation initiation factor 4A113. Igualmente se ha encontrado un importante control de otras características como la regulación metabólica, la inmortalidad celular y la angiogénesis, en las que se ha encontrado que miR-448 (actuando en este caso como un oncogén) promueve el incremento de la actividad metabólica celular mediante la inhibición de la demetilasa 2b específica de lisina (KDM2B), brindándole la energía necesaria a la célula tumoral para que siga creciendo y proliferando14; así mismo miR-1182 bloquea la expresión de la telomerasa transcriptasa inversa (hTERT), evitando así el mantenimiento de la longitud de los telómeros15, y miR-125a inhibe el factor de crecimiento endotelial vascular A (VEGF-A), que promueve la formación de vasos sanguíneos nuevos16.
Los miARN mencionados anteriormente se han reportado normalmente desregulados en el cáncer gástrico, y si se analiza la implicación conjunta de esto, se puede inferir que le facilitan a las células cancerígenas obtener los elementos necesarios para su funcionamiento vía sanguínea y procesar estos de forma eficiente mediante un metabolismo acelerado, manteniendo así su población de células inmortalizadas y resistentes a la apoptosis, en un estado de constante división, las cuales además son más susceptibles a la movilidad y colonización de otras áreas del cuerpo, por la pérdida del control sobre la adhesión y migración11–16.
Lo anterior nos permite apreciar las consecuencias que conlleva la pérdida de actividad de miARN supresores, lo que lleva a la necesidad de discutir también qué factores se asocian a esta desregulación, sobre lo cual se ha encontrado que puede atribuirse tanto a factores internos como a fenómenos de metilación anormal que llevan a la hipermetilación en las islas CpG de los genes codificantes para estos miARN17, al igual que factores externos como la infección por Helicobacter pylori y producción de factores de virulencia por esta bacteria18.
Ya se consideró cómo la desregulación de un clúster de miARN puede afectar en gran medida la aparición de los eventos del cáncer, pero a fin de contextualizar la importancia de los miARN supresores de tumores de una manera más individual, se mostrarán los ejemplos puntuales de genes, vías de señalización y características cancerígenas que pueden controlar los miRNA-218 y miRNA-375, de los cuales se cuenta con una mayor investigación.
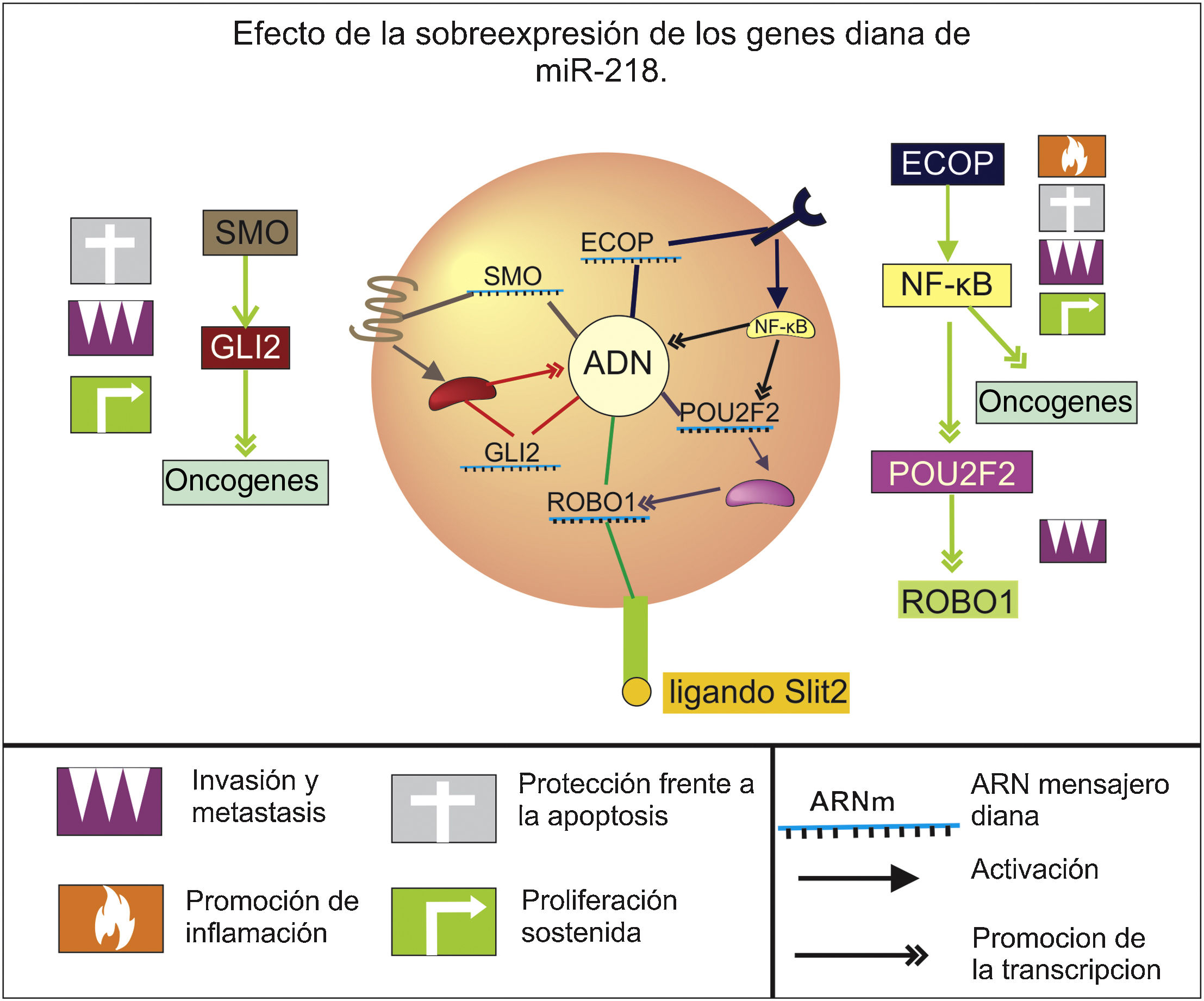
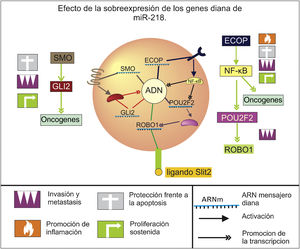
MiR-218Es un supresor tumoral que se ve desregulado negativamente en el cáncer gástrico y cuya importancia radica en el control de la diferenciación, volumen y la probabilidad de metástasis del tumor19 mediante la regulación de múltiples oncogenes y vías de crecimiento celular (fig. 1), especialmente la vía NF-κB/ POU2F2/ Slit-Robo, pues inhibe 3 de sus componentes fundamentales; por un lado tiene como objetivo al gen del Roundabout homólogo 1, el cual codifica para un receptor de la proteína Slit, que estimula la migración celular neoplásica20, y a al gen POU2F2, que codifica para un factor de transcripción que incrementa la expresión de Roundabout homólogo 121. Además suprime la expresión del receptor del factor de crecimiento epidérmico coamplificado y sobreexpresado, el cual se relaciona positivamente con una mayor actividad del factor de transcripción nuclear kappa B, promoviendo la expresión de varios genes relacionados con la proliferación, apoptosis, inflamación y migración22, entre los que se encuentra POU2F221, mostrando que la inhibición de este miRNA sobre esta vía es bastante robusta.
Esquema del efecto de la sobreexpresión de los genes diana de miR-218 referente a los sellos distintivos del cáncer propuestos por Hanahan y Weinberg (2011), en el contexto del cáncer gástrico. Al verse inactivado o disminuido los niveles de este miARN los genes señalados y las respectivas vías en los que se ven involucrados presentan un aumento en sus niveles y actividad que contribuye a la aparición y progresión de esta enfermedad.
Otro objetivo importante de este miRNA es GLI2, que codifica para un importante factor de transcripción mediador en la vía de señalización Hedgehog, y cuya sobreexpresión se relaciona con el desarrollo de neoplasias malignas, ya que promueve la expresión de oncogenes que facilitan la proliferación de las células, las protegen de la apoptosis y promueven su invasión23. También se ha establecido que miR-218 puede inhibir la expresión de la proteína Smoothened, la cual es la encargada de activar a GLI224, evidenciando que regula este factor de transcripción tanto a nivel de su expresión como de su activación.
Por último cabe resaltar que en tratamientos quirúrgicos y quimioterapias de cáncer gástrico se ha identificado un aumento en los niveles de miR-218 asociados a un mejor pronóstico, e incluso en ensayos in vitro de sobreexpresión artificial se ha encontrado una disminución significativa de la oncogénesis y un aumento a la quimiosensibilidad, despertando el interés en su uso como herramienta terapéutica20,22–25.
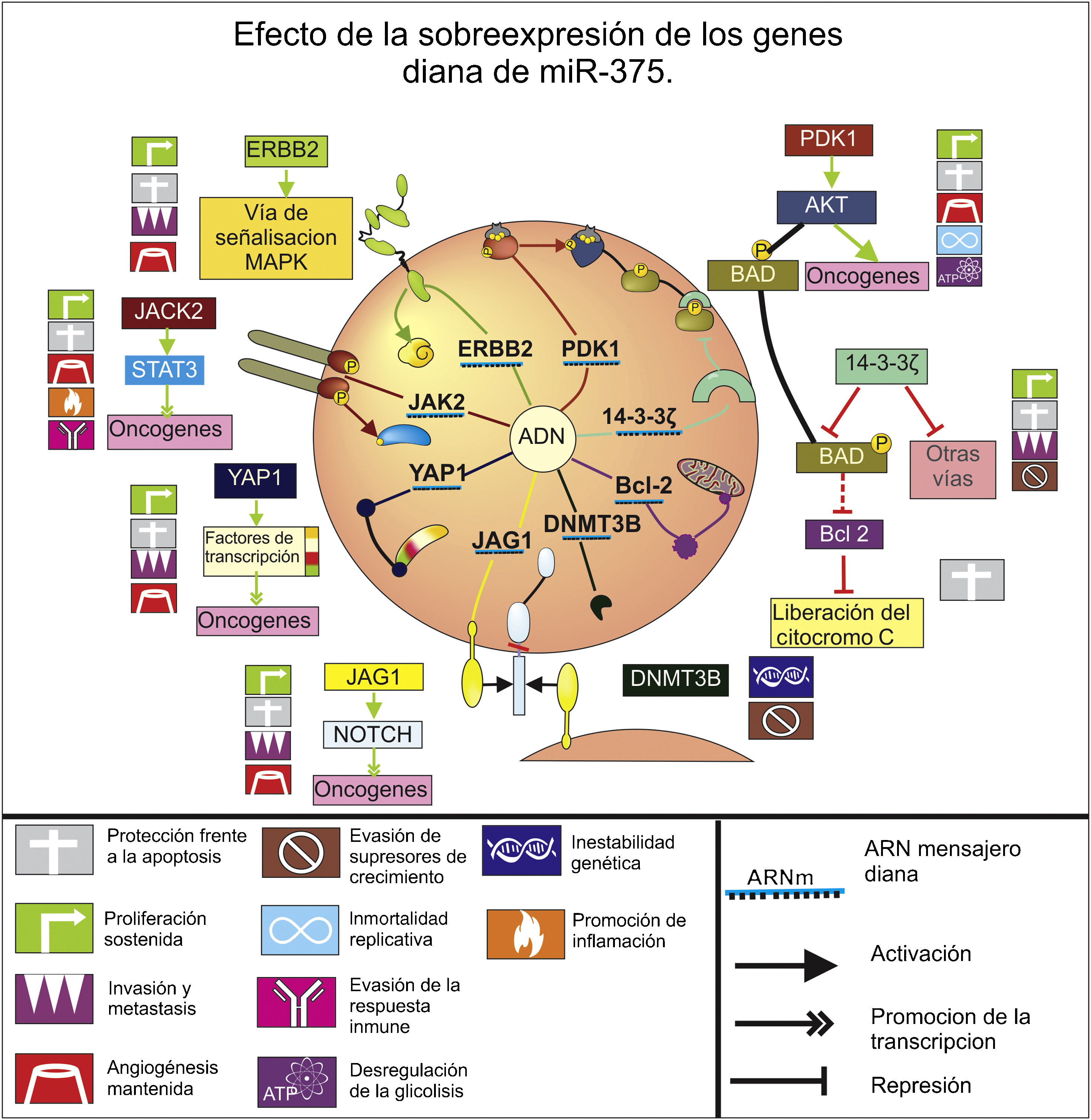
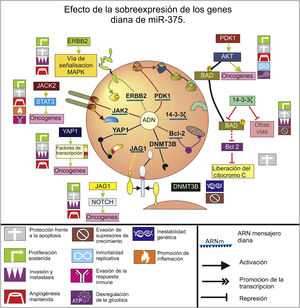
MiR-375Es un supresor tumoral de gran relevancia, e incluso en una revisión sistemática de 2014 fue el miARN más constantemente reportado como desregulado negativamente en el cáncer gástrico26. Además, su asociación con H. pylori es uno de los hallazgos más interesantes y verifica el riesgo de la bacteria carcinogénica 1B, pues se ha encontrado una disminución de los niveles de este miARN frente a la presencia de la misma27, y en experimentos de activación con el lipopolisacárido de esta bacteria18.
Este miARN inhibe múltiples genes (fig. 2), incluyendo el de la quinasa de Janus 2, regulando así la vía de señalización del gen de la quinasa Janus 2-STAT3, que promueve la proliferación, resistencia a la apoptosis, migración, invasión y metástasis, junto a la angiogénesis, inflamación y evasión de la respuesta inmunitaria28–30. Regula además la expresión de la proteína quinasa 1 dependiente de 3-fosfoinositide, que es la encargada de fosforilar y activar a la proteína quinasa que disminuye la muerte celular por apoptosis31, induce la proliferación, la angiogénesis, desregula la glucólisis por activación de mTOR32 y promueve la inmortalidad celular al activar a hTERT33. Conjuntamente este miARN reduce la expresión del gen de la proteína 14-3-3ζ31, cuyo aumento se asocia a un peor pronóstico, por la ampliación en la división celular, la migración, la invasión y una reducción de la apoptosis34.
Esquema del efecto de la sobreexpresión de los genes diana que son regulados por el miARN 218 en el cáncer gástrico. Se muestra la expresión proteica de estos genes diana, su interacción con las respectivas vías de señalización en las que se ven involucrados y la implicación que tienen en los sellos distintivos del cáncer propuestos por Hanahan y Weinberg (2011). No se tienen en cuenta los genes diana que presentaran controversias.
Igualmente este miARN inhibe el receptor 2 del factor de crecimiento epidérmico humano35, el cual es parte de la activación de la vía de señalización de MAPK, y por esta se promueve la expresión de genes de carcinogénesis y angiogénesis que favorecen la nutrición tumoral en la lámina propia de la mucosa gástrica36. Adicionalmente esta inhibición del receptor 2 del factor de crecimiento epidérmico humano puede incrementar la sensibilidad al medicamento cisplatino usado en quimioterapia, dando una interesante opción en el tratamiento de pacientes con quimiorresistencia37.
Con el uso de la bioinformática se han propuesto otros genes como posibles objetivos de miR-375 durante la carcinogénesis gástrica: B-cell lymphoma/leukemia 10, YAPI. IGF-BP3, Jagged1, Bcl-2, ADN metiltransferasa 3 beta (DNMT3B)38. De los cuales Bcl-2 y la DNMT3B son los que aportan mayor evidencia científica, pues aparte de la predicción computacional se les ha realizado un análisis a sus niveles de expresión in vitro, el cual evidenció la relación inversa de su expresión con los niveles de miR-37538, siendo significativo en la enfermedad, pues Bcl-2 es un oncogén protector de la apoptosis que evita la liberación del citocromo C de la mitocondria, mientras que se ha visto una sobreexpresión de metiltrasferasas, incluyendo DNMT3B durante el cáncer gástrico, que puede contribuir a la desregulación epigenética por metilación anormal y al silenciamiento de otros supresores tumorales39.
Por su parte Yes Associated Protein interactúa con múltiples factores de transcripción de implicación tumoral40, y Jagged1 es una proteína de superficie celular oncogénica, sobreexpresada en el adenocarcinoma gástrico, que actúa como ligando para la activación de la vía de señalización Notch41, ambas promoviendo los eventos de proliferación, protección frente a la apoptosis, angiogénesis, invasión y metástasis40,41.
La acción de B-cell lymphoma/leukemia 10 y la proteína 3 de unión al factor de crecimiento parecido a la insulina es más difícil de elucidar, puesto que para BCL10 no se encuentra información actualizada y clara sobre su función biológica en esta enfermedad. Mientras que la proteína 3 de unión al factor de crecimiento parecido a la insulina parece reducir la tasa de proliferación celular y aumentar la apoptosis al inhibir a NF-kB42, sin embargo es una proteína con gran controversia en el ámbito del cáncer.
Por todo lo anteriormente expuesto hay notable evidencia que soporta el rol de supresión tumoral de miR-375, por la inhibición que ejerce sobre varios oncogenes y su constante disminución durante la tumorogénesis gástrica. Sin embargo, hay un estudio donde amplificaron este miARN en la línea celular de epitelio con adenocarcinoma gástrico, llevando a un aumento en la proliferación e incremento de la radiorresistencia en estas; además se reportó como objetivo de miR-375 al guardián del genoma y supresor tumoral p5343. Este resultado es contradictorio con lo descrito para miR-375, sin embargo hay que analizar que p53, a diferencia de otros supresores que se ven disminuidos o inhibidos durante el desarrollo de la enfermedad, de hecho se ha encontrado sobreexpresado en cáncer gástrico, probablemente se asocie a una activación y acumulación temprana de p53, posterior bloqueo de su correcta función por otras moléculas y la aparición de formas mutantes de esta44, lo que hace difícil interpretar la implicación que tendría su inhibición. También se encuentran contradicciones con un estudio realizado en líneas celulares de cáncer cervical, en el que se observó que miR-375 estaba disminuido frente a los controles, actuaba como supresor tumoral, su sobreexpresión resultaba en un incremento significativo de p53 y reducía la radiorresistencia45. Por otro lado, el estudio ya mencionado falló en encontrar relación con la carcinogénesis al inocular estas células de adenocarcinoma gástrico (con sobreexpresión de miR-375) en ratones desnudos o al inhibir este miARN en la línea celular BGC823 (línea celular de carcinoma gástrico), por lo que los mismos autores sugieren que este miR-375 no tiene efectos tumorogénicos43, mostrándose que no hay evidencia de efectos adversos en la enfermedad por parte de este.
Mediante esta revisión se encontraron 11 genes reportados como objetivos del miARN-375 en el contexto del cáncer gástrico, los cuales fueron establecidos mediante diferentes metodologías, siendo los probados mediante ensayos de luciferasa los que presentan mayor grado de evidencia, pues esta técnica permite establecer que hay una inhibición directa por este miARN, sin embargo algunos de los objetivos predichos o descritos presentan inconsistencias, contradicciones o vacíos en el conocimiento que dificultan su comprensión en la enfermedad (tabla 1).
Genes diana de miR-375, reportados para el cáncer gástrico
| Gen | Vía en la que actúa | Técnica de detección | n | p | Implicación en el cáncer gástrico | Controversias | Referencia |
|---|---|---|---|---|---|---|---|
| JAK2 | JAK2-STAT3 | Predicción bioinformática Ensayo de luciferasa | 48 | <0.05 | Proliferación sostenida Resistencia a la apoptosis Promoción de angiogénesis Promoción de la inflamación Evasión de la respuesta inmune | Ninguna | 30 |
| ERBB2 | MAPK | Predicción bioinformática Ensayo de luciferasa | 30 | <0.05 | Proliferación sostenida Resistencia a la apoptosis Invasión y metástasis Promoción de angiogénesis | Ninguna | 35 |
| PDK1 | PI3K/Akt | Western blot | 22 | <0.05 | Proliferación sostenida Resistencia a la apoptosis Promoción de angiogénesis Desregulación de la glucólisis Inmortalidad replicativa | Ninguna | 31 |
| 14-3-3ζ | Múltiples vías | Predicción bioinformática Ensayo de luciferasa | <0.001 | Proliferación sostenida Resistencia a la apoptosis Invasión y metástasis Evasión de supresores de crecimiento | Ninguna | 31 | |
| Bcl-2 | Vía de la apoptosis | Predicción bioinformática Correlación de los niveles usando qRT-PCR | 102 | 0.0116 | Resistencia a la apoptosis | Ninguna | 38 |
| DNMT3B | Vía de la metilación de ADN | Predicción bioinformática Correlación de los niveles usando qRT-PCR | 102 | 0.00001 | Inestabilidad genómica | Ninguna | 38 |
| YAP1 | Múltiples vías | Predicción bioinformática | No aplica | No aplica | Proliferación sostenida Resistencia a la apoptosis Invasión y metástasis Promoción de angiogénesis | Ninguna | 38 |
| JAG1 | Notch | Predicción bioinformática | No aplica | No aplica | Proliferación sostenida Resistencia a la apoptosis Promoción de angiogénesis | Ninguna | 38 |
| BCL10 | NF-kB | Predicción bioinformática | No aplica | No aplica | Indeterminada | Falta de información sobre el rol de este gen en la enfermedad | 38 |
| IGFBP3 | IGF-1 IGF-2 | Predicción bioinformática | No aplica | No aplica | Posible supresión de la tumorogénesis. | Contradicciones en su función entre tipos de cáncer. | 38 |
| TP53 | Múltiples vías | Ensayo de luciferasa | 5 | <0.01 | Supresión de la tumorogénesis | Contradicciones con estudios en otros tipos de cáncer Propiedades biológicas de p53 | 43 |
Genes diana de miR-375 que se encontraron reportados para el cáncer gástrico en esta revisión de la literatura; las vías en las que se ven involucrados, la técnica usada para establecerlos como objetivo de miR-375, la implicación de estos genes en la patogénesis de neoplasias malignas, las contradicciones o problemas encontrados que refutan o impiden la comprensión de su inhibición por este miARN.
Los supresores tumorales son de gran importancia por la regulación que ejercen sobre los eventos del cáncer, mediante múltiples mecanismos en el ámbito de la genética, epigenética y proteómica. Debido a su pérdida o a una disminución en su actividad se favorece la aparición de células transformadas que son la base de la carcinogénesis gástrica, por lo que son esenciales para entender el cambio hacia el tumor y su conocimiento es la base de futuros tratamientos biomoleculares.
Los miARN de acción supresora se encuentran reducidos en los casos de cáncer gástrico como respuesta del proceso de evasión de los genes que controlan la proliferación y el crecimiento tumoral, contribuyendo además a la progresión, invasión vascular y metastásica de neoplasias malignas como el adenocarcinoma gástrico. Los miARN se desregulan por factores internos celulares como el establecimiento de patrones de metilación anormal, o por la exposición al Helicobacter pylori.
En esta revisión se encontró que miR-218 regula especialmente la invasividad a tejidos circundantes, diseminación vascular y el establecimiento de crecimiento secundario metastásico mediante el control de las vías de señalización hedgehog y NF-κB/ POU2F2/Slit-Robo. Además, por ensayos de cultivos celulares se ha propuesto su utilidad como biomarcador y diana terapéutica, ya que su acción puede incrementar la eficacia del tratamiento de quimiorreducción del volumen tumoral.
Por su parte, miR-375 es reportado en la literatura significativa y frecuentemente desregulado, controlando múltiples vías relacionadas con la aparición y progresión de neoplasias gástricas, estableciéndose en este estudio como un factor clave de la enfermedad, pues inhibe los 8 eventos distintivos del cáncer y las 2 características potenciadoras (fig. 2), lo que indica que este miARN es un biomarcador promisorio, pues su disminución y el grado de la misma puede reflejar el estado de carcinogénesis gástrica. Además, dado que puede ejercer una represión tan importante sobre las características malignas del cáncer, su modulación puede ser una estrategia eficaz en el tratamiento de la enfermedad, ya sea de forma individual o en conjunto con otros tratamientos oncológicos.
No obstante, estos 2 biomarcadores requieren ser medidos en población sin tumor, y un mapa geográfico de la distribución de sus valores amerita una línea de base en Latinoamérica.
FinanciaciónApoyo por parte de la DIN-1647 (Dirección de Investigaciones de la UPTC).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Se agradece especialmente a la doctora Ruth Maribel Forero Castro sus importantes aportes en la compresión de la genética del cáncer, y a la Dirección de Investigación de la Universidad por su apoyo en la movilidad.