El manejo de los cuadros dolorosos en general se hace con los analgésicos antiinflamatorios no esteroideos, cuya farmacopea es muy amplia en nuestro país y en el mundo.
La utilización indiscriminada de este grupo ha contribuido a incrementar y/o precipitar la incidencia de personas con falla renal. La importancia de conocer esta complicación y tratar adecuadamente a los pacientes para prevenir y evitar esta enfermedad nos lleva a conocer y utilizar otro grupo de analgésicos con menos impacto en la función renal y con mayor efecto analgésico. Es por eso que veremos la utilización de los analgésicos opioides y la versatilidad en los diferentes cuadros de dolor: dolor agudo, dolor crónico y dolor irruptivo.
The indiscriminate use of this group has contributed to increase or precipitate the incidence of patients with kidney failure. Therefore the importance of knowing this complications, in order to be able to treat, prevent and avoid this complication. This makes us considerate other group of pain killers, such as opioids, which have better analgesic effect and less impact in kidneys, this makes them versatile in various cases: like acute pain, chronic pain and breakthrough pain.
La enfermedad renal crónica (ERC) es común, y con regularidad se acompaña de varias comorbilidades. En los últimos años el número de pacientes con esta enfermedad se ha incrementado notablemente, debido tanto a la diabetes mellitus como a la nefrotoxicidad de algunos fármacos.
Las personas con insuficiencia renal tienen una mayor mortalidad (20-25%) anual. Los síntomas físicos y psicológicos de la insuficiencia real suponen una carga para el paciente y para los familiares semejante a la que se observa en cuidados paliativos de pacientes oncológicos.
La tasa de abandono de la diálisis peritoneal es elevada, y esta constituye la segunda causa de mortalidad en la insuficiencia renal terminal. Además, la participación de los servicios de cuidados paliativos es aún más limitada que en otras patologías terminales.
Los datos farmacocinéticos y farmacodinámicos en pacientes con insuficiencia renal terminal son escasos, por lo que es difícil la recomendación de esquemas analgésicos. Sin embargo, el uso de la escalera analgésica recomendada por la Organización Mundial de la Salud es útil y puede adaptase; es importante que el medico se familiarice con el uso de los opioides y las combinaciones posibles, dependiendo de las condiciones de sus pacientes.
Los pacientes con función renal límite o claramente alterada pueden empeorar su sintomatología al recibir tratamientos con antiinflamatorios no esteroideos (AINE), como consecuencia de la inhibición de la síntesis de prostaglandinas. Las alteraciones más frecuentes son la insuficiencia renal aguda (IRA), la retención de sodio y la hipercalcemia. En pacientes susceptibles, altas dosis de AINE durante al menos una semana de tratamiento pueden producir IRA, ya que estos pacientes precisan el efecto vasodilatador de las prostaglandinas para mantener la homeostasis renal (insuficiencia renal, cardíaca, hepática, ascitis, hiperreninemia, hiperaldosteronismo, shock, sepsis, lupus eritematoso sistémico o ancianos). Otra posible afectación es la nefritis intersticial aguda, que puede producirse en cualquier momento de la toma de AINE y con cualquiera de ellos. Se trata de un cuadro inflamatorio transitorio por reducción del filtrado glomerular, IRA y retención hidrosalina, siendo más frecuente en el sexo femenino y en la edad avanzada.
Años atrás, y por recursos limitados, este grupo especial de enfermos no recibía tratamientos como la diálisis o eran muy raros; actualmente observamos cada vez un número mayor de pacientes renales que son beneficiados de tratamientos de diálisis, independientemente de la edad y la complejidad. Sin embargo, debemos tomar en cuenta datos como, por ejemplo, que la prevalencia de enfermedad arterial crónica en pacientes que reciben diálisis se ha incrementado alarmantemente desde el 0,1% en 2004 al 21% en 2007 y al 36% en 2012, incremento notable, al igual que el del cáncer y el de la enfermedad pulmonar obstructiva crónica.
Dos tercios de los pacientes que se encuentran en programas de diálisis presentan moderado a severo deterioro cognitivo.
El manejo de síntomas y la planificación de cuidados avanzados de soporte son cruciales en estos pacientes.
El dolor es extremadamente común en el paciente con enfermedad renal terminal. Este puede ser de etiología renal, como también de enfermedades no relacionadas con el riñón. Por otro lado, a menudo estos pacientes se someten a procedimientos quirúrgicos y requieren analgésicos. Los pacientes con ERC generalmente presentan dolor crónico que a menudo es multifactorial, como el dolor isquémico debido a la enfermedad vascular periférica, el dolor neuropático, la polineuropatía (diabetes), el dolor óseo por osteoporosis o asociado a la diálisis, la amiloidosis y el dolor musculoesquelético.
La acción prolongada a nivel del sistema nervioso central (SNC) y la depresión respiratoria debida a la morfina y otros opioides han sido conocidos durante más de un siglo en pacientes con falla renal. Por ello es importante formular estrategias para prevenir estas complicaciones, proveyendo alivio eficaz del dolor. Durante el desarrollo del tema veremos algunas características importantes de estos cuadros dolorosos.
El dolor agudo postoperatorio a menudo es nociceptivo, mientras que el dolor crónico puede ser nociceptivo, neuropático o mixto. Se ha estimado que un 50-63% de los pacientes en diálisis padecen dolor crónico; el 42-55% de estos pacientes califican su dolor como severo. Un estudio de cohorte prospectivo que incluyó a 205 pacientes en hemodiálisis mostró que el 50% de los pacientes referían dolor, siendo el dolor de tipo musculoesquelético el más frecuente (63%), seguido del dolor asociado a la diálisis (13,6), la neuropatía periférica (12,6%) y la enfermedad vascular periférica (9,7%).
Otras causas de dolor secundario a enfermedad renal son la enfermedad renal poliquística, que causa dolor abdominal crónico, habitualmente de tipo visceral. El hiperparatiroidismo secundario frecuentemente determina dolor óseo. La calcifilaxia es una entidad relativamente rara que provoca dolor severo generalizado, presente casi exclusivamente en pacientes en programa de diálisis; el anormal metabolismo del calcio y el fósforo conduce a la calcificación vascular y a la isquemia epidérmica, la cual usualmente se presenta con un rash doloroso que rápidamente progresa a una manifiesta necrosis dérmica. Esta calcifilaxia es de difícil tratamiento y puede justificar incluso la suspensión de la diálisis en favor de los cuidados paliativos.
Por miedo a la toxicidad y la falta de experiencia, vemos que el uso de analgésicos opioides no está muy extendido, lo que conduce a un inadecuado tratamiento del dolor en la ERC. En una revisión reciente sobre el uso de opioides y benzodiacepinas en pacientes en programa de diálisis la efectividad para el tratamiento fue variable y escasa en el 17 y el 38% de los pacientes (la presencia de dolor se correlacionó con los años en diálisis), y un 72-84% con dolor severo no recibía ningún esquema analgésico.
Evaluación del dolorLa evaluación del dolor requiere una historia detallada que dilucide la causa del dolor, su posición, la naturaleza (agudo o crónico), la intensidad y su impacto funcional, físico, social y emocional, entre algunas de sus más importantes características.
La evaluación del dolor desde su inicio, las características, su evolución y los factores asociados son determinantes para un manejo adecuado del dolor. Se debe tomar en cuenta la etiología del dolor, además de la función renal y el estado dialítico del paciente.
La cuantificación y la monitorización del dolor a través de escalas debe ser un parámetro más para optimizar el manejo del paciente con enfermedad renal. La intensidad del dolor puede ser medida por una de las escalas de calificación del dolor, sean estas análogas verbales, numéricas y visuales. Sin embargo, la escala visual análoga (EVA) es el sistema más extensamente usado en la práctica clínica, donde 0 denota la ausencia de dolor y 10 el peor dolor imaginable. Además, existen otras escalas validadas que pueden ser aplicables a pacientes con daño renal; entre ellas destacan el Pain Management Index (PMI), el McGill Pain Questionnaire (MGPQ) y el Brief Pain Inventory (BPI). La etiología más frecuente del dolor en el paciente en programa de diálisis es la de tipo isquémico, y en el paciente fuera de programa de diálisis es el dolor crónico musculoesquelético. Según la escala EVA, la prevalencia y la intensidad de dolor intradiálisis es mayor que la valoración extradiálisis. El sistema de clasificación de Edmonton reducido (rESS), diseñado para valorar el dolor oncológico, podría ser una herramienta de utilidad clínica para el estudio y el abordaje del dolor en el paciente renal. Este sistema tiene la virtud de predecir la respuesta analgésica, considerando que un dolor «difícil» no debe tomarse como un dolor incontrolable. Para hacer una evaluación sencilla pero eficaz es suficiente conocer el tipo de dolor, los episodios de dolor incidental, la asociación a sufrimiento emocional y/o alteraciones cognitivas e historia de adicción.
Se ha descrito que la fístula arteriovenosa de un paciente en hemodiálisis es puncionada en promedio 300 veces por año, y ello se califica de mediana intensidad dolorosa (según la EVA). El tratamiento del dolor posoperatorio en los pacientes con ERC supone un problema por el miedo de acumulación de metabolitos que depriman el centro respiratorio. Esto preocupa también a colectivos de anestesia, y aún se investigan fármacos con eficacia y seguridad en pacientes postoperados con ERC.
En un estudio de cohorte anticipado de 205 pacientes que reciben hemodiálisis, el 50% refirió dolor; el dolor musculoesquelético fue el más común (63%), seguido del dolor asociado a la diálisis (14%), la neuropatía periférica (13%) y la enfermedad vascular periférica (10%). En el estudio de Gamondi et al. los pacientes identificaron la sesión de diálisis como un gatillo para la aparición de dolor de cabeza y calambres. Estos síndromes dolorosos son típicos en la ERC, debido al desequilibrio de electrólitos que ocurre durante la sesión de diálisis.
Manejo del dolor en el paciente con enfermedad renal crónicaEl manejo eficaz del dolor requiere entender o catalogar el tipo del dolor (nociceptivo, neuropático o mixto), la causa subyacente, la intensidad y la duración del dolor como un enfoque multifactorial. Además, la evaluación de enfermedades concomitantes y de la medicación recibida nos permitirá seleccionar los agentes analgésicos más adecuados.
Algunos analgésicos deben ser evitados de manera estricta en el enfermo renal crónico, mientras que otros deben ser ajustados en su dosis y en el intervalo de su prescripción.
De manera general se acepta en el dolor leve a moderado el uso de acetaminofén o paracetamol, con importantes niveles de seguridad en el enfermo renal. Este fármaco no requiere un ajuste de dosis. Los AINE, sin embargo, deben evitarse en el paciente con enfermedad renal, debido a que la uremia causa disfunción plaquetaria e incrementa el riesgo de sangrado gastrointestinal. Por tanto, los AINE están contraindicados en el paciente en programa de diálisis.
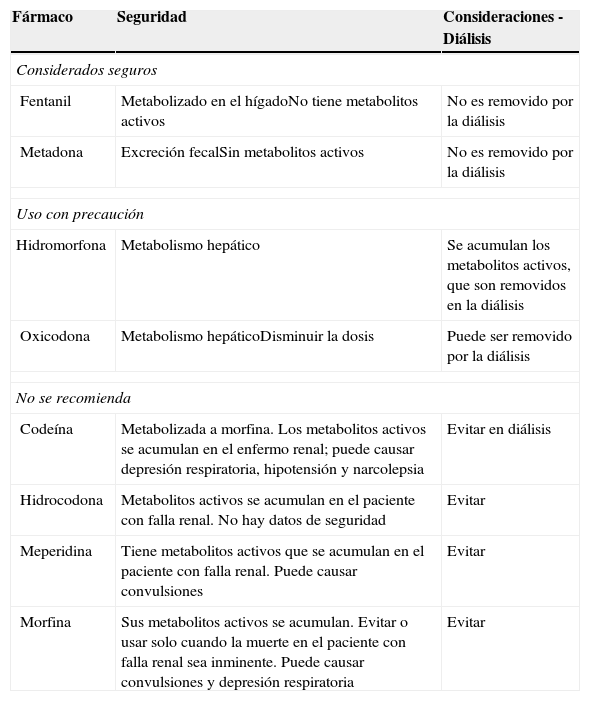
En el dolor moderado a severo el tramadol puede ser usado cautelosamente, pero requiere ajuste de dosis e incrementar el intervalo entre dosis en el paciente con ERC. La dosis máxima de tramadol no debe exceder los 50 a 100mg 2veces al día. Muchos pacientes van a requerir analgésicos opioides para alcanzar un adecuado control del dolor. El fentanil y la metadona son considerados los analgésicos opioides más seguros en el paciente con falla renal. Otros fármacos de este grupo pueden ser usados bajo una estrecha vigilancia y ajuste de dosis (tabla 1).
Selección de opioides en el paciente con enfermedad renal
| Fármaco | Seguridad | Consideraciones - Diálisis |
|---|---|---|
| Considerados seguros | ||
| Fentanil | Metabolizado en el hígadoNo tiene metabolitos activos | No es removido por la diálisis |
| Metadona | Excreción fecalSin metabolitos activos | No es removido por la diálisis |
| Uso con precaución | ||
| Hidromorfona | Metabolismo hepático | Se acumulan los metabolitos activos, que son removidos en la diálisis |
| Oxicodona | Metabolismo hepáticoDisminuir la dosis | Puede ser removido por la diálisis |
| No se recomienda | ||
| Codeína | Metabolizada a morfina. Los metabolitos activos se acumulan en el enfermo renal; puede causar depresión respiratoria, hipotensión y narcolepsia | Evitar en diálisis |
| Hidrocodona | Metabolitos activos se acumulan en el paciente con falla renal. No hay datos de seguridad | Evitar |
| Meperidina | Tiene metabolitos activos que se acumulan en el paciente con falla renal. Puede causar convulsiones | Evitar |
| Morfina | Sus metabolitos activos se acumulan. Evitar o usar solo cuando la muerte en el paciente con falla renal sea inminente. Puede causar convulsiones y depresión respiratoria | Evitar |
Tiene propiedades analgésicas y antipiréticas potentes. Es eficaz para varios síndromes dolorosos agudos y crónicos. Es el analgésico de elección en los ancianos y en pacientes con enfermedad renal y debería ser considerado en todos los pacientes, a excepción de pacientes con insuficiencia hepática. De manera general la recomendación es administrar hasta que el dolor sea aliviado o hasta una dosis máxima de 3.000mg por día o 2.6g/día en pacientes con riesgo elevado (desnutrición o alcoholismo). Generalmente no requiere el ajuste de dosis en ERC; sin embargo, algunos autores recomiendan aumentar el intervalo de medicación a partir de cada 6 a 8h cuando la tasa de filtración glomerular (TFG) es menor a 10ml por minuto. También se recomienda considerar la prescripción con al menos la mitad de la dosis diaria total en horario, y la dosis restante podría ser dada a demanda del paciente o en combinación con otros agentes.
Agentes antiinflamatoriosAntiinflamatorios no esteroideos (AINE), inhibidores de la ciclooxigenasa y bloqueadores de la síntesis de prostaglandina: cuando son usados como co-analgésicos reducen la necesidad de opioides hasta en un 30-50%. Sin embargo, debido a sus efectos secundarios a nivel gastrointestinal, cardiaco y renal, deberían ser evitados para el uso prolongado en ERC, ya que los agentes antiinflamatorios pueden disminuir el flujo sanguíneo renal y pueden precipitar el fracaso renal agudo con riesgo de hiperkalemia. Sin embargo, de ser usados, deberían ser indicados para el manejo del dolor agudo a corto plazo (3 a 7días) con un control estricto de la función renal y de los niveles séricos de potasio. Aunque, cualquier AINE puede provocar insuficiencia renal. Al parecer los menos nefrotóxicos son la aspirina, el ibuprofeno y el naproxeno.
OpioidesLa farmacocinética de los analgésicos opioides en pacientes con enfermedad renal es compleja, así como la falta de familiaridad con el uso médico de estos fármacos. Esta es una barrera importante para el alivio eficaz del dolor. El desarrollo de fallo renal como consecuencia del uso de opioides no se ha descrito con exactitud, ya que la mayor parte de los opioides o sus metabolitos son eliminados por los riñones. A menudo se requiere un ajuste de la dosis cuando la TFG estimada cae por debajo de 50ml/min o durante las etapas 3b, 4 y 5 de la ERC, y para pacientes en diálisis. Además de la depresión respiratoria y alteraciones a nivel del SNC, el estreñimiento es un efecto secundario común que es importante sea identificado, sobre todo en pacientes que reciben diálisis peritoneal. Los laxantes apropiados deben ser indicados junto con el tratamiento.
MorfinaLa morfina es el opioide más estudiado en la enfermedad renal. Es principalmente un agonista de los receptores μ, genera alivio del dolor a través de los receptores μ-1, causa depresión respiratoria y estreñimiento a través de su acción agonista sobre los receptores μ-2. La morfina es metabolizada en el hígado en varios metabolitos; de estos: la diamorfina y la morfina-3-glucurónido (M3G) no ligan a receptores opiáceos, mientras que la normorfina y la morfina-6-glucurónido (M6G) lo hacen de una forma aproximadamente 10 veces más potente que la morfina. Todos los metabolitos son eliminados por la orina, junto con aproximadamente el 10% del compuesto original. M6G se acumula en caso de fracaso renal ocasionando alteraciones a nivel del SNC y depresión respiratoria. El M6G cruza lentamente la barrera hematoencefálica, ocasionando efectos prolongados sobre el SNC que pueden persistir después de la administración de morfina, inclusive después de la hemodiálisis. Una reducción de la dosis del 25 al 50% es recomendada en pacientes con IRC leve a moderada. En severo fracaso renal la reducción de la dosis deberá ser del 75%. Sin embargo, el 20-25% de los pacientes puede tolerar la dosis completa de morfina sin efectos secundarios, debido a polimorfismo de A118G.
MeperidinaLa normeperidina es el metabolito activo de la meperidina. Es neurotóxico y se acumula en caso de fracaso renal, ocasionando una variedad de efectos neuroexcitatorios. Aunque la normeperidina sea retirada por la hemodiálisis, su administración regular es contraindicada en pacientes con cualquier nivel de falla renal. De no existir otra opción, el uso de la meperidina o petidina en pacientes con insuficiencia renal debe ser muy cauteloso, ya que su metabolito se elimina casi totalmente por esta vía, por lo que existe el riesgo de acumulación, con la consiguiente aparición de fenómenos tóxicos neurológicos.
HidromorfonaEs un análogo de la morfina con duración de acción más corta y con eficacia excelente en el dolor moderado a severo. Es de 5 a 7 veces más potente que la morfina. Es eliminada tanto por vía hepática (60%) como por vía renal (40%). No se acumula en el fracaso renal debido a su conversión rápida a su metabolito menos potente, hidromorfona 3-glucurónido (H3G), pero es eliminada por la hemodiálisis. Un estudio prospectivo realizado en 12 pacientes en hemodiálisis concluye que la hidromorfona podría ser un opioide seguro y efectivo en determinados pacientes que reciben hemodiálisis. Iguales conclusiones obtiene un estudio que compara el uso de hidromorfona en pacientes con creatinina y urea normal frente a pacientes en insuficiencia renal.
Codeína/dihidrocodeínaLa codeína es metabolizada por el hígado a una variedad de metabolitos activos (codeína-6-glucurónido, norcodeína, morfina, M3G, M6G y normorfina) que son renalmente excretados. El período de vida media de la codeína es prolongado tras la hemodiálisis; sus metabolitos se acumulan en el fracaso renal y pueden causar hipotensión, alteraciones a nivel del SNC y depresión respiratoria. La dihidrocodeína puede causar narcosis prolongada después de dosis terapéuticas en pacientes con falla renal aguda o crónica. Por lo tanto, debería ser usada con precaución en pacientes con fracaso renal. Se recomienda una disminución en el 50% de la dosis de codeína, evitando su uso crónico.
OxicodonaEs un opioide fuerte con biodisponibilidad oral muy alta. Es metabolizada por el hígado a metabolitos activos (noroxicodona y oximorfona). Aproximadamente el 19% del fármaco es eliminado sin ser alterado por la orina. La falla renal ocasiona aumento de la concentración del fármaco en el plasma en un 50%, con prolongación de su vida media. No hay consenso para su uso en la ERC debido a historiales médicos variados de toxicidad y otros con buena tolerancia. Si su uso fuera inevitable, deberá administrarse con cautela y comenzando con dosis mínimas.
BuprenorfinaEs un agonista parcial semisintético de acción prolongada con la ventaja de producir menos depresión respiratoria e hipotensión. No hay diferencia significativa en la administración del fármaco en pacientes con o sin disfunción renal. Tiene un metabolismo de primer paso extenso, por lo que requiere la administración sublingual, transdermal o parenteral. Es metabolizada por el hígado y su excreción renal es de menos del 30%. Su metabolito norbuprenorfina puede acumularse en caso de fracaso renal con actividad analgésica menor. Su unión a proteínas es del 96%, por lo que no es dializable.
Fentanil, alfentanil y sufentanilSon potentes agonistas de los receptores opioides, con un inicio rápido de acción y duración corta. El fentanil es rápidamente metabolizado en el hígado a metabolitos inactivos. Menos del 10% del fármaco original es eliminado por la orina, sin acumulación significativa en ERC; sin embargo, presenta una variabilidad individual considerable en cuanto a su farmacocinética cuando es administrado en perfusión continua o vía transdérmica, por lo que puede acumularse. Sin embargo, no requiere modificación de la dosis en pacientes con fracaso renal cuando se administra en bolo. Pese a ello, la sedación prolongada es habitual en pacientes gravemente enfermos cuando el fentanil es administrado en perfusión continua, ya que su período de vida media aumenta a 25h debido a la saturación de sus sitios de distribución, independientes de la función renal. Se observa sedación prolongada y depresión respiratoria en pacientes en fase final de la enfermedad renal después de la perfusión de fentanil. Este fármaco se une a las proteínas en un 80-86%, tiene un alto volumen de distribución y su retiro por hemodiálisis es insignificante.
TramadolEs un analgésico opioide que también inhibe los receptores de serotonina y la recaptación de noradrenalina. Es extensamente metabolizado por el hígado; el 30% del fármaco original y el 60% de sus metabolitos activos son eliminados por la orina. Es eficaz tanto para el dolor nociceptivo como para el dolor neuropático, y tiene la ventaja de producir menos sedación y menos depresión respiratoria en comparación con otros opioides, debido a su singular mecanismo de acción, inhibiendo la recaptación de monoaminas mucho más que su mínima acción sobre receptores opiáceos. Un efecto secundario común son las náuseas.
En la ERC avanzada, el período de vida media de eliminación del tramadol puede llegar al doble y la dosis debería ser disminuida a 100mg cada 12h en pacientes con TFG estimada de 30ml/min y a 50mg cada 12h cuando la TFG estimada sea menor a 10ml/min. El tramadol se elimina en un 80% de forma inalterada por el riñón, con el riesgo de acumulación en caso de patología renal. Es eliminado considerablemente por la diálisis, y debería ser administrado después de la hemodiálisis.
MetadonaEs un opioide sintético con 5 a 10 veces la potencia de la morfina, su unión a proteínas es de un 70-87% y tiene un período de vida media de 30h. Aproximadamente el 20% después de una dosis única se elimina sin modificaciones, y aproximadamente el 30% como metabolitos inactivos por la orina. Su eliminación por hemodiálisis es insignificante. Existe un riesgo bien descrito de acumulación y toxicidad con metadona, incluso en pacientes con función renal normal; por ello la supervisión debe ser estricta. Una reducción de la dosis del 50 al 75% es recomendable en pacientes con fracaso renal, pero es difícil de manejar en pacientes con ERC debido a su período de vida media larga y amplia variación interindividual en su aclaramiento.
Analgésicos adyuvantesLa medicación coadyuvante es frecuentemente asociada a los opioides en busca de un mejor control analgésico y menos efectos secundarios que la monoterapia del dolor crónico. Este tipo de medicación es necesaria cuando se diagnostican, por ejemplo, características neuropáticas o dolor neuropático en el enfermo renal, situación que además es muy frecuente.
Los adyuvantes analgésicos son medicamentos de otros grupos farmacológicos pero que, además, poseen actividad analgésica o modifican la respuesta al dolor. Estos a menudo son efectivos para el manejo, sobre todo, del dolor neuropático. Entre ellos tenemos la carbamazepina, la gabapentina y la pregabalina. Estos agentes habitualmente no son requeridos en el manejo del dolor agudo; sin embargo, en los pacientes con ERC es frecuente encontrar dolor neuropático subyacente. La dosis de estos agentes también puede necesitar ser reducida debido a disfunción renal.
Con respecto a la gabapentina, hay evidencia para su uso en el dolor neuropático en este tipo de pacientes, es frecuentemente prescrita y su dosis debe ser ajustada a la función renal. La gabapentina es excretada sin cambios por la orina, y puede acumularse y alcanzar niveles tóxicos en el paciente con falla renal. En pacientes en hemodiálisis la dosis de carga recomendada es de 300mg, seguidos de 200 a 300mg después de cada sesión de diálisis.
En los pacientes que no reciben diálisis pero tienen un aclaramiento de creatinina por debajo de 30ml/min por 1,73m2 puede administrarse la dosis de 200 a 700mg, pero una sola vez al día.
Los antidepresivos tricíclicos se evitan en el paciente con ERC por su potencial arritmogénico.
Infusión intratecal de fármacosRequiere el implante de un sistema tipo reservorio o, de lo contrario, una bomba de perfusión de fármacos implantada totalmente. Es un procedimiento quirúrgico que se desarrolla con frecuencia en unidades especializadas de dolor. Tiene la importante ventaja de utilizar microdosis de fármacos, poseer un inmejorable efecto analgésico y, debido a la entrega de los fármacos en el mismo sistema nervioso (médula espinal y raíces nerviosas involucradas), no presenta niveles tóxicos en la sangre que afecten la función renal. Actualmente es considerado un sistema analgésico óptimo en pacientes con dolor de difícil manejo y función renal deteriorada, pues de esta manera no se afecta la función renal residual.
La intensidad del dolor en el enfermo renal —más aún en aquel que recibe diálisis— es importante, pero subestimada o tratada inadecuadamente. El dolor interfiere con la calidad de sueño y la actividad de la vida diaria. La evaluación del dolor, su manejo y el uso analgésico adecuado para tratar síndromes de dolor específicos asociados a la diálisis deberían ser considerados de forma rutinaria.
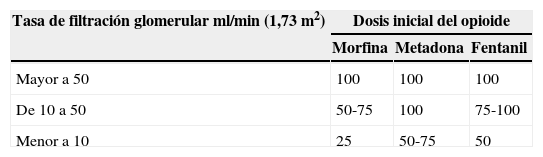
Para el dolor leve, el acetaminofén puede ser usado sin peligro y sin ajuste de la dosis. Los AINE deberían ser generalmente evitados en pacientes con enfermedad renal, porque la uremia causa disfunción de plaquetas y aumenta el riesgo de sangrado gastrointestinal. El perfil farmacocinético y farmacodinámico de la hidromorfona, la metadona y el fentanil aparentemente son seguros en el paciente con fallo renal, por lo cual son los más recomendados. La dosis debe ajustarse ante un FG<10ml/min. Fentanil y metadona se consideran los opioides más seguros para el uso en pacientes con enfermedad renal (tabla 2). También se ha aconsejado la reducción de dosis y/o el aumento del intervalo de administración en los pacientes con insuficiencia renal y diálisis. La monitorización frecuente debe ser la regla en estos casos.
Se recomienda no utilizar morfina ni codeína por la dificultad de manejar los efectos adversos y complicaciones en estos pacientes. Los metabolitos de la morfina podrían acumularse entre las sesiones de diálisis. Los metabolitos de la metadona son inactivos y no dializables, no se requiere ajuste de dosis en el paciente en diálisis. Estos estudios son limitados por poblaciones con pobre significado estadístico; por ello debemos usar los fármacos recomendados con vigilancia oportuna y haciendo una valoración clínico-analítica completa de cada paciente.
ConclusionesEl número de pacientes en terapia sustitutiva de vida (diálisis peritoneal, hemodiálisis) cada vez es mayor, y esto se ve incrementado por las complicaciones derivadas de la diabetes mellitus y la hipertensión arterial, además de otros factores.
El manejo de los cuadros dolorosos debe ser agresivo y eficaz, con el propósito de controlar el síntoma y conservar su calidad de vida; por ello, el Sistema de Protección Social en Salud incorpora fármacos seguros, y el acetaminofén oral e inyectable está disponible en el cuadro básico, así como los opioides, de tal forma que el médico tratante pueda elegir la combinación analgésica más segura y eficiente para tratar el síndrome doloroso, y también contribuir a conservar la función renal de los pacientes, siendo cautelosos en el uso de las terapias analgésicas con AINE en aquellos que tengan riesgos de padecer falla renal.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.