Introduction: The functional or anatomic amputation of a limb, doesn't seem to improve the overall survival of patients with non-resectable sof tissue sarcomas (STS). Neoadyuvant isolated limb perfusion (ILP) is an effective surgical strategy that prevents an amputation in these clinical scenarios.
Objective: To describe the surgical technique and to inform the first experience with ILP in the Hospital Regional de Alta Especialidad del Bajío (HRAEB), in patients with non-resectable STS of the limbs. To show its effectiveness in preventing amputation, and the safety of the procedure.
Materials and methods: Analysis of a prospective follow up, of the first 8 perfused cases at one institution form June 2010 to March 2012. All the 8 cases were candidates for amputation. The 8 cases were perfused with Tumor Necrosis factor alpha (TNFa) and melphalan (m) at standard dosis, with mild hyperthermia (38-39°C).
Results: All patients had high grade sarcomas, and a mean tumoral size of 11.2 cm (6 cm mínimum; 19 cm máximum), 2 patients had recurrent tumors, 5 patients had been treated with different modalities, and 7 patients had multifocal tumours. Seven out of 8 cases successfully preserved their limbs; 2 patients had a local recurrence with only one of them needing an amputation to achieve local control. None of the patients developed severe systemic toxicity, none of them lost their limb or died becasue of the ILP.
Conclusion: ILP with TNFa and melphalan is an effective and safe procedure to prevent an amputation in patients with non-resectable STS of the limbs.
Introducción: La amputación funcional o anatómica de una extremidad, no mejora la supervivencia de los pacientes con sarcomas de partas blandas (SPB) irresecables. La perfusión aislada de la extremidad (PAE) neoadyuvante, es una estrategia quirúrgica efectiva que previene una amputación en estos escenarios clínicos.
Objetivo: Describir la técnica quirúrgica y reportar la primera experiencia del Hospital Regional de Alta Especialidad del Bajío (HRAEB) con PAE, en pacientes con SPB irresecables de las extremidades. Mostrar la seguridad del procedimiento e informar la eficacia para preservar la extremidad.
Materiales y métodos: Análisis de un seguimiento prospectivo de los 8 primeros casos sometidos a PAE en una institución, desde junio del 2010 hasta marzo del 2012. Todos los pacientes eran candidatos a amputación de la extremidad. Los 8 pacientes se perfundieron con factor de necrosis tumoral alfa (TNFa) y melfalán a dosis estándar con hipertermia leve (38-39°C).
Resultados: Todos los pacientes tenían sarcomas de alto grado, con un tamaño promedio de 11.2 cm de diámetro (mínimo 6 cm, máximo 19 cm). Dos pacientes presentaban tumores recurrentes, 5 habían recibido diversos tipos de tratamiento y 7 casos tenían tumores multicompartamentales. Siete de 8 casos preservaron su extremidad, 2 casos presentaron recurrencia local, de los cuales sólo uno perdió la extremidad. No se presentaron toxicidades sistémicas severas, ninguna muerte y sin pérdida de la extremidad secundario al procedimiento.
Conclusión: La PAEt/m es un procedimiento efectivo y seguro para preservar la extremidad de pacientes con SPB irresecables de las extremidades.
Pagina nueva 1
Introducción
Los sarcomas avanzados de partes blandas de las extremidades son habitualmente tumores muy voluminosos, que se asocian con escenarios quirúrgicos muy complejos, en donde en muchas de las ocasiones, la única forma segura de obtener un adecuado control local es mediante una amputación o una cirugía radical que mutile funcionalmente la extremidad1. Con el tiempo, hemos aprendido que una amputación anatómica o funcional, no se traduce en una mejor supervivencia2-15. Lo anterior ha impulsado la creación de diferentes estrategias para tratar de preservar la extremidad, como la perfusión aislada de la extremidad (PAE) con factor de necrosis tumoral alfa (TNFa) y melfalán16.
Con el advenimiento de TNFa a nuestro país, hemos realizado PAE con TNFa y melfalán (PAEtm), a pacientes con sarcomas de partes blandas (SPB) de las extremidades irresecables, en diferentes centros de referencia dentro del territorio nacional desde el 2010. En este trabajo, se presenta la primera experiencia con PAEtm en pacientes con sarcomas irresecables de las extremidades, en un Centro de Alta Especialidad de León, Gto., México.
El objetivo del presente trabajo es describir la técnica quirúrgica de la PAEtm y reportar la factibilidad para la realización del procedimiento, la seguridad del mismo, la morbilidad y mortalidad asociadas, así como las tazas de respuesta en los primeros 8 pacientes perfundidos, en el Hospital Regional de Alta Especialidad del Bajío (HRAEB).
Material y métodos
Trabajo observacional, prospectivo y descriptivo de 8 pacientes con SPB de las extremidades, que cumplían con la definición de irresecabilidad: 1) Tumor multicompartamental, y/o multifocal, 2) tumor con invasión vascular y nerviosa, 3) invasión articular, 4) recurrencia en una zona radiada previamente o, 5) invasión ósea, en quienes se realizó PAE-tm, en el Servicio de Melanoma, Piel y Partes Blandas de Oncología del HRAEB, desde junio del 2010 hasta marzo del 2012. Así como reportar la efectividad para preservar la extremidad, la toxicidad del procedimiento y la factibilidad para realizarla.
La decisión de perfundir se tomó en sesiones multidisciplinarias, conformadas por cirujanos oncólogos, oncólogos médicos, radioterapeutas y un ortopedista oncólogo. Todos los pacientes fueron perfundidos con melfalán y TNFa a dosis convencionales16, no se administró ningún otro tratamiento en el lapso de tiempo entre la PAE y la resección del tumor residual.
Técnica quirúrgica de PAEtm
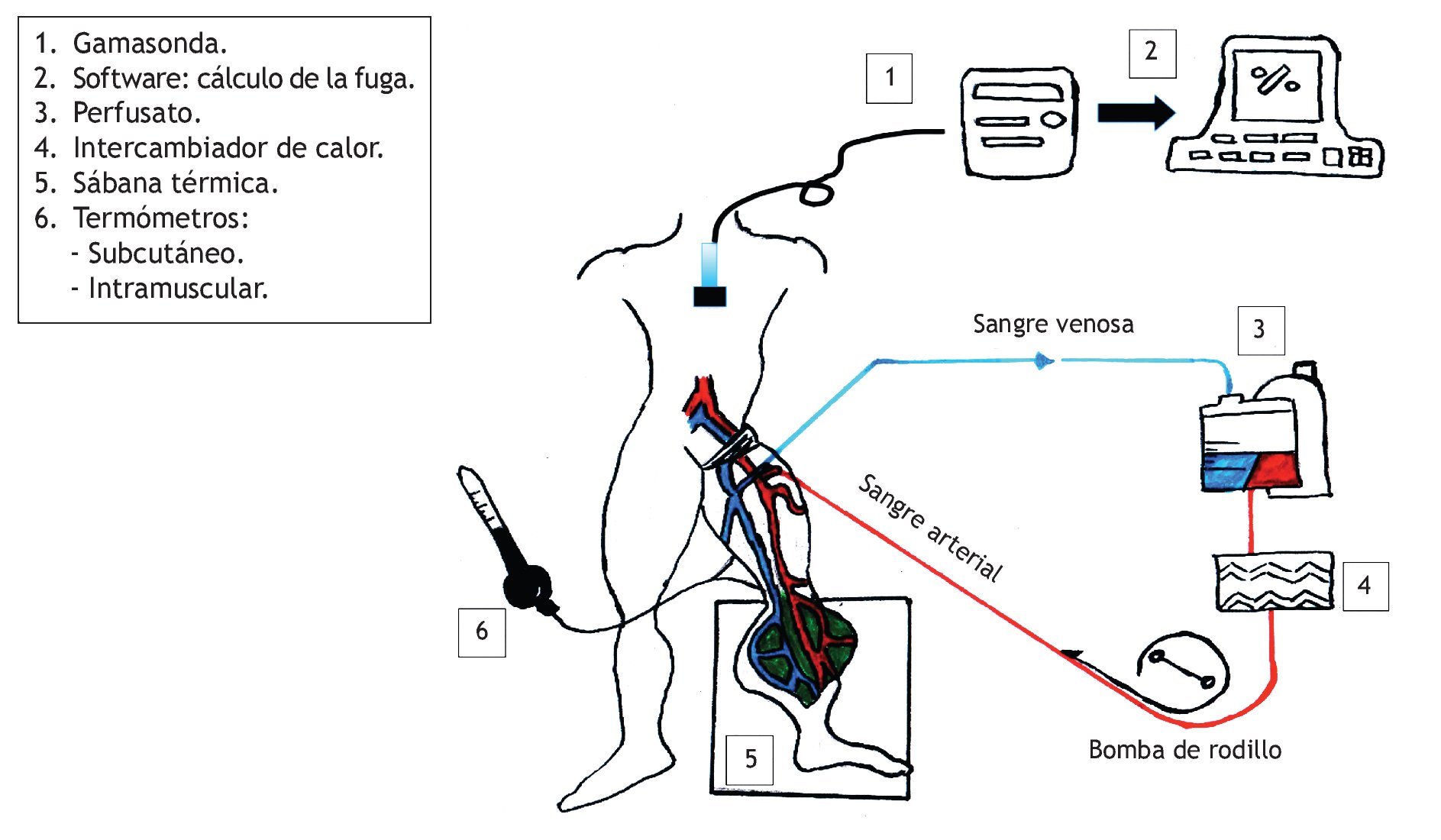
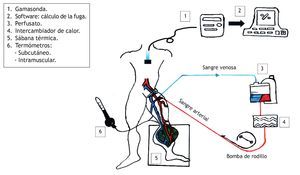
El aislamiento de la extremidad se logra mediante la disección y canulación de la arteria y vena principales de la extremidad, y ligando u ocluyendo con un clamp vascular los vasos colaterales. Para lograr un completo aislamiento de la extremidad, se coloca un torniquete con una venda de Es-march en un sitio proximal de la extremidad; con esta técnica se previene la circulación colateral en los músculos, tejido subcutáneo y piel. Posterior a la heparinización del paciente y de la canulación de los vasos principales, la extremidad en cuestión es perfundida artificialmente mediante una bomba de circulación extracorpórea.
Medición de la fuga
La fuga hacia la circulación sistémica se monitoriza mediante la utilización de radiofármacos y una gamasonda, colocada a nivel precordial. Este método está basado en la medición de un gradiente de detección de radioactividad, entre el sistema de perfusión y la circulación sistémica. Esta variable es la más importante, ya que de su correcta y precisa medición dependerán los resultados, la viabilidad y la seguridad del procedimiento. Inicialmente se verifica que el volumen del perfusato se encuentre estable, que las condiciones del microambiente sean las adecuadas y que la extremidad haya alcanzado la temperatura óptima. Posteriormente, una dosis de pirofosfatos y Tc99 (con intervalo de tiempo de 20 minutos para su interacción) es inyectada a la circulación general, y una vez estabilizada la cuenta, es inyectada una dosis mayor de pirofosfatos y Tc99 al circuito de la extremidad artificialmente perfundida. La fuga sistémica es expresada cuantitativamente como un porcentaje, ya que el 100% de la fuga representa una distribución homogénea del isótopo en el cuerpo. En este modelo se asume que los volúmenes del circuito extracorpóreo y los de la circulación sistémica están en una relación de 1:5.
El flujo promedio es de 38-48 mL/min/L de tejido perfundido y por lo general, se mantienen flujos que van desde 150 cc/min hasta 750 cc/min, dependiendo el porcentaje de fuga durante la perfusión. Se logran temperaturas entre 38°C y 40°C con el uso de sábanas térmicas, y calentando la solución perfundida con un intercambiador de calor. Las temperaturas tisulares se miden con la utilización de 2 termómetros, que se colocan en tejido celular subcutáneo y el músculo (fig. 1).
Figura 1 Esquema gráfico de la perfusión aislada de la extremidad.
Fármacos y secuencia
El volumen de la extremidad a perfundir se debe calcular antes de iniciar el procedimiento. Esto puede realizarse utilizando el método de desplazamiento de agua, o mediante la fórmula geométrica para conocer el volumen de un cilindro.
Una vez estabilizada la cuenta registrada por la gamasonda, y con un porcentaje de fuga menor de 10%, se infunde el TNFa a una dosis estándar de 1 mg para la extremidad superior y de 2 mg para la extremidad inferior. Posterior a 30 minutos, se administra el melfalán al circuito a una dosis de 10 mg/mL (para extremidades inferiores) y de 13 mg/mL (para extremidades superiores) de volumen tisular perfundido, por 60 minutos. Al final de la perfusión, el líquido es drenado de la extremidad, el circuito es lavado con 2-3 litros de solución Hartman, se retiran el torniquete y las cánulas, y los vasos son reparados. Posterior a la restauración de la circulación normal de la extremidad, se revierte el efecto de la heparina con protamina a dosis convencionales.
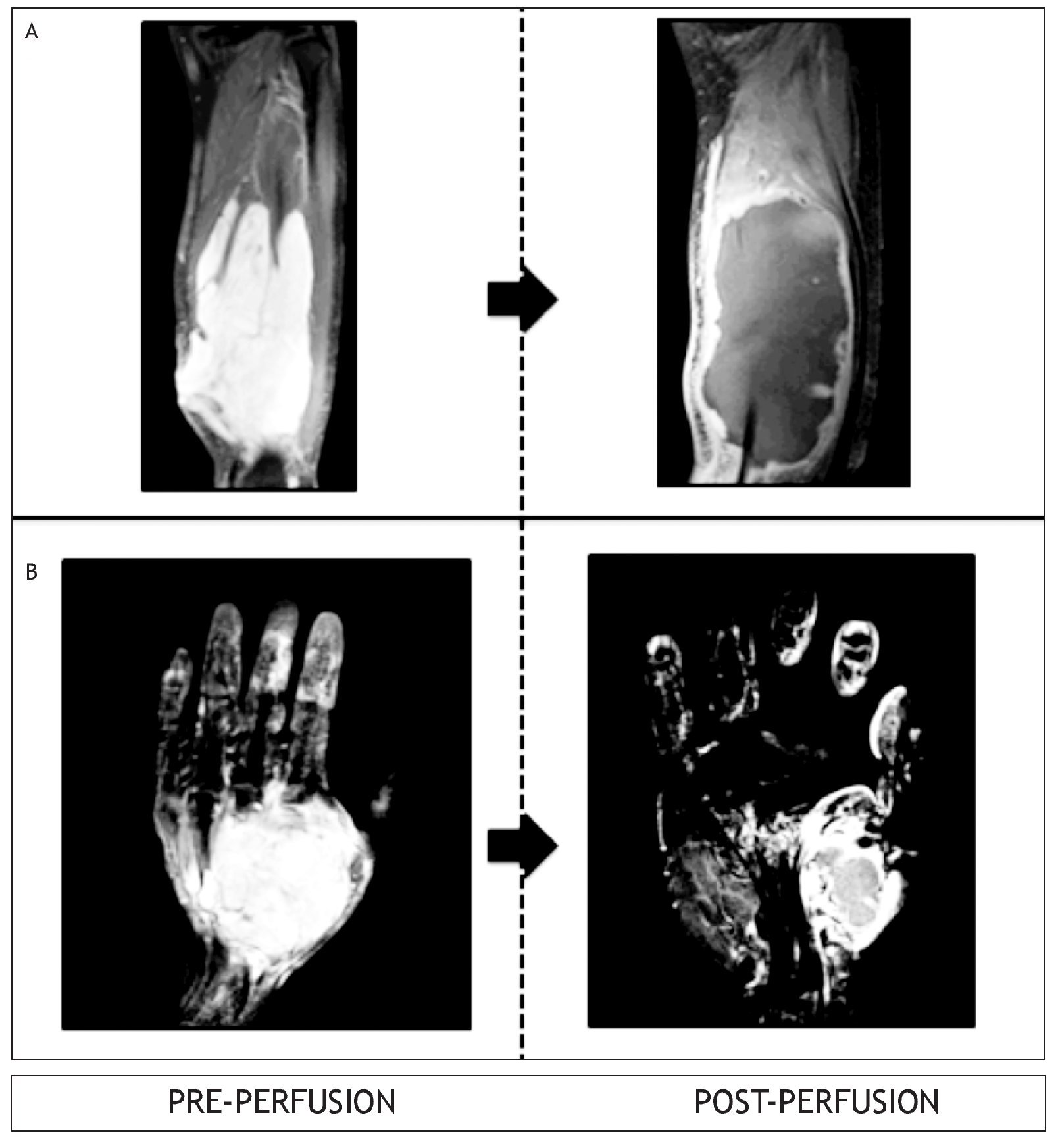
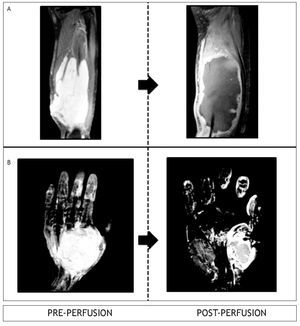
Evaluación clínica de la respuesta y de la toxicidad Posterior a la PAEtm, los pacientes fueron evaluados cada 2 semanas de forma clínica, en la semana 8 se realizó una resonancia magnética (RM) para documentar los cambios producidos por la PAEtm: cambios en el tamaño del tumor (disminución o aumento), cambio de las características por imagen del tumor (disminución o aumento de la intensidad de señal de la lesión) y/o aparición de nuevas lesiones (fig. 2).
Figura 2 Evaluación de la respuesta por resonancia magnética. A) Liposarcoma mixoide. Caso N° 2. B) Sarcoma sinovial monofásico. Caso N° 6.
La toxicidad regional se evaluó de acuerdo a la clasificación de Wieberdink y colaboradores17,18.
La toxicidad sistémica (síndrome de sepsis, náusea, vómito, pancitopenia, síndrome de insuficiencia respiratoria del adulto, elevación de enzimas hepáticas y toxicidad renal), fue evaluada y registrada de forma prospectiva desde el postoperatorio inmediato hasta la semana 8 posterior al procedimiento.
Resección local
Siempre que la respuesta a la PAEtm permitió una resección, el paciente fue llevado a cirugía entre las semanas 8-12 posterior a la perfusión, definiendo resección con márgenes positivos (R1, o marginal) cuando se observaron células neoplásicas en el margen entintado, y resección con márgenes negativos (R0) a la ausencia de células neoplásicas en el mismo.
Evaluación histológica de la respuesta
Para la evaluación histológica, el espécimen quirúrgico fue seccionado a lo largo de planos longitudinales y transversales para calcular el promedio de necrosis y documentar la presencia de células neoplásicas viables dentro del tumor. El tejido sin identificación de núcleo fue considerado como necrótico o no viable. Una respuesta completa (RC) se definió como la ausencia absoluta de células neoplásicas viables; como muy buena respuesta, se definió a la presencia de necrosis en más del 90% del tumor; como respuesta parcial, si existía necrosis entre el 50% a 90%; y sin respuesta, si existía menos del 50% de necrosis.
Resultados
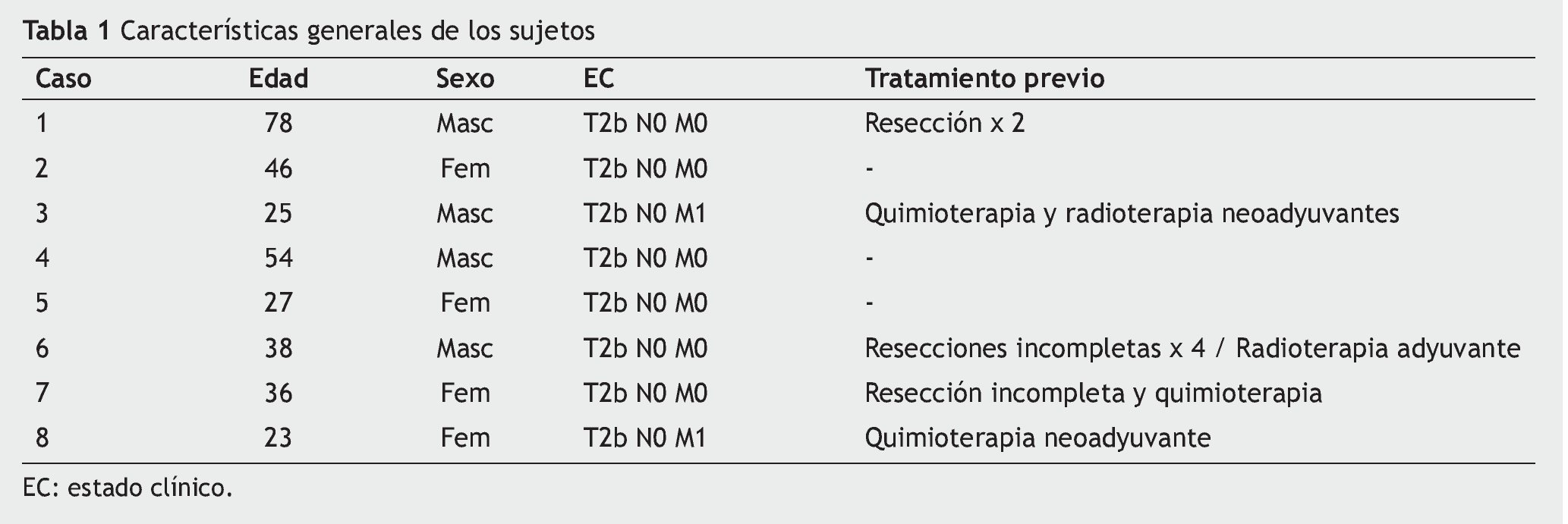
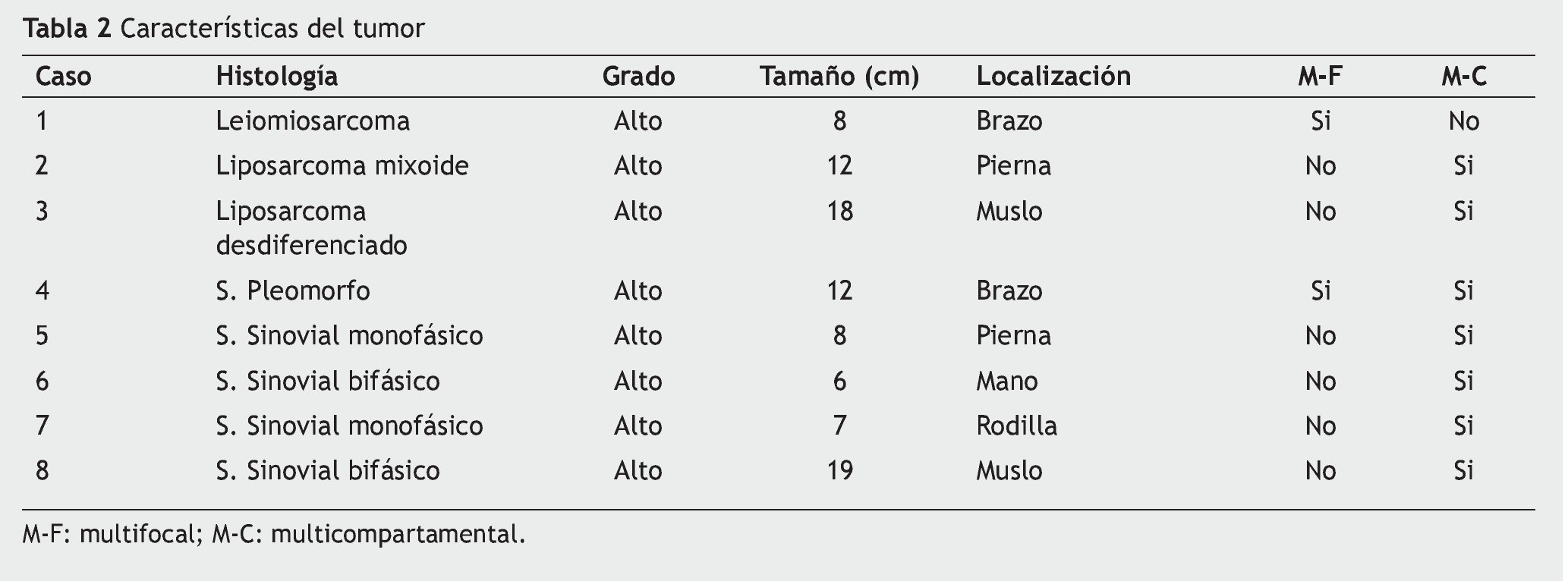
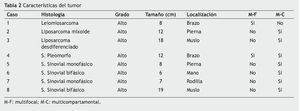
Los subtipos histológicos de los 8 casos fueron: sarcoma sinovial (casos 5, 6, 7 y 8), liposarcoma (casos 2 y 3), sarcoma pleomorfo (caso 4) y leiomiosarcoma (caso 1). Todos los tumores fueron clasificados como de alto grado, presentando un tamaño promedio de 10 cm (mínima de 6 cm, máxima de 19 cm). Siete de los 8 casos presentaban extensión multicompartamental (casos 2, 3, 4, 5, 6, 7 y 8); un caso presentó enfermedad multifocal exclusivamente y uno de ellos, enfermedad multifocal y multicompartamental (caso 4) (tablas 1 y 2).
De los 8 pacientes de esta serie, 5 habían sido tratados antes de ingresar a nuestra institución con diferentes estrategias: resecciones incompletas (casos 1, 6 y 7), un paciente con quimio y radioterapia neoadyuvante (caso 3), un paciente con múltiples resecciones previas además de radioterapia adyuvante (caso 6), y un paciente con quimioterapia neoadyuvante (caso 8). Dos pacientes se presentaron con enfermedad metastásica pulmonar al momento de su primera cita en el hospital: el caso 3 rechazó tratamiento quirúrgico posterior a la perfusión, y falleció a los 8 meses posterior a la PAEtm, preservando su extremidad; el caso 8 preservó su extremidad y se encuentra vivo, en tratamiento sistémico paliativo (tablas 1 y 2).
Fuga del circuito a la circulación sistémica
Todos los pacientes fueron monitorizados con Tc99 y pirofosfatos, reportándose fugas promedio entre 1.1% (mínima) y 8% (máxima). En ninguno de los casos fue necesaria la interrupción del procedimiento por inestabilidad hemodinámica, o por presencia de fuga superiores al 10%.
Toxicidad regional
La toxicidad regional en todos los casos fue grado II, con un solo caso de toxicidad grado 4 (caso 2), quien requirió de desbridación en quirófano en 2 ocasiones, salvando su extremidad con curaciones y cuidado avanzado de heridas (tabla 3).
Toxicidad sistémica
Ninguno de nuestros pacientes presentó algún tipo de leucopenia, anemia o pancitopenia. Se detectó una muy leve elevación de bilirrubinas en el caso 8 (bilirrubina total de 3), que remitió a valores normales en las primeras 72 horas. No se reportaron elevación de transaminasas en ninguno de los casos. Todos nuestros pacientes cursaron el primer día posquirúrgico dentro de una Unidad de Cuidados Intensivos, manejados con resucitación hídrica y ocasionalmente con el uso de un vasopresor que se descontinuó dentro de las primeras 12 horas del postoperatorio. Se detectó náusea y vómito leve en el caso 8, que remitieron espontáneamente a las 48 horas del procedimiento. Ninguno de nuestros pacientes presentó fiebre en el postoperatorio inmediato. No se reportó ninguna muerte por el procedimiento (tabla 3).
Respuesta y preservación de extremidad
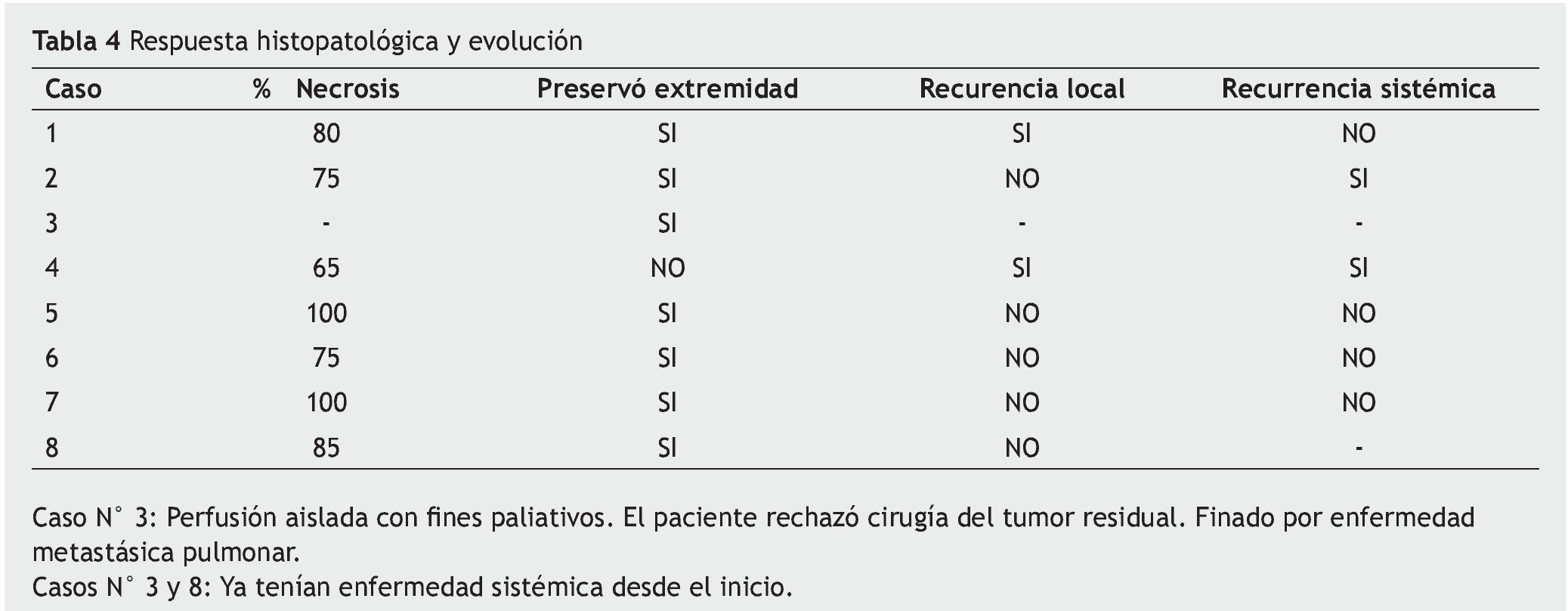
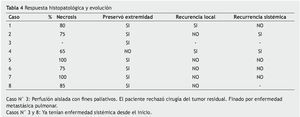
Todos los pacientes excepto el caso 4, preservaron su extremidad. Todos presentaron alguna respuesta objetiva tanto por imagen como por patología (repuesta promedio de 82.5%); encontrando respuestas patológicas completas en 2 casos (casos 5 y 8) (tabla 4).
Recurrencia local y sistémica
A 21 meses de seguimiento se han documentado hasta este momento a 2 pacientes con recurrencia local posterior a la resección: casos 1 y 4. El caso 1 presentó una muy pequeña recurrencia local en la piel de la herida a los 16 meses de la perfusión, que fue controlada con una resección con márgenes negativos y actualmente, se encuentra libre de enfermedad. El caso 4 presentó una recurrencia multifocal muy voluminosa e irresecable a los 8 meses, además de progresión pulmonar bilateral, necesitando de una amputación por presencia de dolor neuropático secundario a compresión nerviosa por el tumor; actualmente, se encuentra vivo en quimioterapia paliativa. Dos pacientes han progresado de forma sistémica en el lapso de 21 meses (casos 4 y 2). El caso 2 respondió muy bien a quimioterapia sistémica, y pudo rescatarse con cirugía de la enfermedad residual en el mediastino; actualmente, se encuentra en vigilancia (tabla 4).
Discusión
Los sarcomas avanzados de partes blandas de las extremidades son en una gran proporción, tumores muy voluminosos donde no es posible realizar una resección con márgenes negativos sin afectar seriamente la función (mutilación funcional), o son tumores que por su extensión (multifocal o multicompartamental), resulta prácticamente imposible preservar la extremidad1. En estos escenarios, la realización de una amputación anatómica o funcional, no ha mostrado mejorar la supervivencia (mortalidad del 60%)2-15.
Este reporte presenta los primeros resultados con el uso de una novedosa estrategia para preservar la extremidad en un grupo muy selecto de pacientes que presentan tumores muy avanzados, con escenarios quirúrgicos muy complejos, en donde la única opción para control local es la amputación.
Este reporte confirma la efectividad de la PAEt/m para preservar las extremidades de pacientes con sarcomas irresecables (solo un caso perdió su extremidad), logrando un muy aceptable control local a 21 meses (tabla 3); resultados muy similares a los reportados por los centros de mayor experiencia: en Holanda (Eggermont), Suiza (Lejeune) y el Instituto Tumori en Milán (grupo italiano), en donde se reporta la preservación de la extremidad en el 81%, 86% y 83%, respectivamente16,19,20.
La ausencia de toxicidad sistémica severa es gracias al estricto control y monitorización de la fuga, con el uso de radiofármacos y la gamasonda durante el procedimiento. Los leves cambios en la presión arterial y la presencia de náusea y vómito controlables, están en concordancia con lo reportado por otros de estudios, que avalan la seguridad del procedimiento21-23. En esta serie, el caso 8 fue el único que presentó evidencia clínica de toxicidad sistémica, aunque esta fue muy leve. Durante la perfusión se reportaron fugas menores al 2%, lo que nos hace suponer que probablemente esta toxicidad fue secundaria a un lavado insuficiente del circuito al final de procedimiento, justo antes de restablecer la circulación normal de la extremidad.
La progresión sistémica se reportó en 2 casos, y es en cierta medida esperado por los diversos factores de mal pronóstico para enfermedad a distancia presente en esta población de estudio (tumores con un tamaño promedio de 11.2 cm, profundos y de alto grado)24,25. Hasta el momento del análisis, estos resultados se encuentran en concordancia con lo reportado por otros trabajos, donde la mayoría de las progresiones sistémicas se presentan en los primeros 12 meses posteriores al tratamiento16,19.
El uso de radioterapia adyuvante posterior a la resección del tumor residual secundario a perfusión aislada es un tema controversial, y se ha optado por diferentes conductas en diferentes centros de la Unión Europea. Nosotros basamos nuestra decisión de no ofrecer radioterapia tomando como base los hallazgos de Eggermont, quien demostró (con y sin radioterapia) una misma eficacia en el control local, si la respuesta patológica es superior a 50% y los márgenes de resección son negativos16,26. En nuestra serie, todos los pacientes presentaron respuestas superiores al 50% y en todos fue posible proporcionar una resección con márgenes negativos, razón por la cual se decidió omitir el uso de radioterapia adyuvante.
Existen otras alternativas de neoadyuvancia además de la PAEt/m, como la quimioterapia neoadyuvante con hipertermia regional. En el estudio europeo fase III, mostró de forma contundente, mejorar las respuestas globales y el control local, al compararla con la quimioterapia sola27. Sin embargo se desconoce el total de pacientes con tumores irresecables desde el inicio; se reportan respuestas completas del 3% (evaluadas por imagen), no hay ninguna respuesta patológica completa y falta seguimiento a largo plazo. Otra potencial estrategia es el uso de quimio-radioterapia neoadyuvante, en donde se han reportado respuestas objetivas que van hasta el 70% a 80% con respuestas patológicas completas del 15% a 30%28,29. Sin embargo, cerca del 80% a 90% de la población estudiada con esta modalidad de tratamiento tenía tumores primarios y sin antecedentes de tratamientos previos, no se reporta la presencia de tumores multifocales y no se tiene registro del porcentaje de pacientes con tumores irresecables desde el inicio, además de que podría ser un tratamiento en exceso tóxico, con muy poco apego a el tratamiento. Kraybill reporta una toxicidad letal del 5%, y sólo el 56% del grupo completó el tratamiento29.
En nuestra serie, sólo un caso presentó una toxicidad que potencialmente ponía en riesgo su extremidad (caso 2). El resto de los pacientes presentó una toxicidad leve, que también está en relación con lo reportado en otros estudios: toxicidad grado I-II, en el > 90% de los casos15,16,18,19.
En estos primeros 8 casos, se puede observar una mejor evolución en aquellos pacientes que presentaron una respuesta patológica completa. Sin embargo, el pequeño número de pacientes y el corto seguimiento no permiten arrojar ninguna conclusión.
Conclusiones
La PAEt/m es un procedimiento efectivo, seguro y viable, que permite salvar las extremidades de un grupo muy selecto de pacientes con sarcomas irresecables de partes blandas de las extremidades, que son candidatos a una amputación. Siempre que sea necesaria la realización de una amputación para controlar localmente a un SPB de las extremidades, se deberá de considerar a la perfusión aislada con TNFa y melfalán.
Financiamiento
No se recibió ningún patrocinio para llevar a cabo este artículo.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
* Autor para correspondencia:
Loma del Sauz N° 105, Colonia Lomas del Campestre,
C.P. 37150, León, Gto., México.
Teléfono: (477) 717 0625. Celular: 477 128 1901.
Correo electrónico: atavaresmd@yahoo.com (L. A. Tavares-de la Paz).