Determinar la frecuencia y el valor predictivo y/o pronóstico de la positividad a los receptores androgénicos (RA) en mujeres con cáncer de mama tratadas quirúrgicamente en el Hospital Universitario «José Eleuterio González» durante el periodo de enero de 2006 a diciembre de 2009.
Material y métodosSe realizó un estudio retrospectivo, descriptivo, observacional, abierto y longitudinal. Se incluyeron mujeres con cáncer de mama tratadas quirúrgicamente en el Hospital José Eleuterio González durante el periodo de 2006 a 2009, de quienes se contara con expediente completo y una muestra viable en patología para realizar la determinación de RA. Para la estadística descriptiva se utilizó el programa informático SPSS versión 13.0, la prueba de la χ2 y la prueba exacta de Fisher.
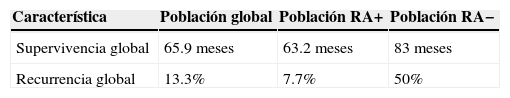
ResultadosSe analizaron 256 pacientes, de las cuales solo 15 satisficieron los criterios de inclusión. Se encontró positividad a RA en el 86.7% de los casos (n=13) y negatividad en el 13.3% (n=2). En el grupo con positividad a los RA con neoadyuvancia (n=8), se obtuvo una respuesta patológica completa en el 12.5% de los casos (n=1). La supervivencia global en la totalidad de la muestra fue de 65.87 meses, en el grupo con RA positivos fue de 63.23 meses y en el grupo con RA negativos, de 83 meses. La recurrencia global fue del 13.3%, con RA positivos+, fue del 7.7% y en el grupo con RA negativos del 50%.
ConclusionesEl presente estudio muestra la alta prevalencia de positividad a los RA en una población del noreste de México.
To determine the prevalence and prognostic value of positive androgen receptors (AR) in women with breast cancer who were surgically treated at the University Hospital «José Eleuterio González» during the period from January 2006 to December 2009.
Material and methodsA retrospective, descriptive, observational, open label, longitudinal study was conducted. Women with breast cancer, surgically treated at the José Eleuterio González Hospital during the period from 2006 to 2009 were included. The patients included had to have complete clinical records available and a viable specimen in pathology for AR determination. For descriptive statistics, the SPSS software version 13.0 was used, as well as the chi-squared and Fisher exact tests.
ResultsOf the 256 patients analysed, only 15 met the inclusion criteria. Positive AR were found in 86.7% of the cases (n=13), and were negative in 13.3% (n=2). In the AR-positive group with neo-adjuvant therapy (n=8), a complete pathological response was obtained in 12.5% of the cases (n=1). Overall survival for the entire sample was 65.87 months; 63.23 months in the AR-positive group and 83 months the AR-negative group. Overall recurrence rate was 13.3%; in the AR-positive group it was 7.7% and in the AR-negative group, 50%.
ConclusionsThis study shows the high prevalence of positive AR in a population of North-eastern Mexico.
A pesar de los avances en la detección temprana y las mejoras en el tratamiento, el cáncer de mama continúa siendo la primera causa de muerte en mujeres en México. Entre el arsenal terapéutico con que se cuenta, la hormonoterapia es fundamental, pero no es efectiva en pacientes que no expresan receptores hormonales, constituyendo este grupo entre un 25 y un 30% del total de los casos de cáncer de mama1.
La vía de señalización androgénica desempeña un papel vital en la homeostasis de la mama, inhibiendo los efectos proliferativos de la vía estrogénica y actuando como promotor de crecimiento tumoral independiente del estrógeno y de manera sinérgica2. Los receptores androgénicos (RA) ejercen un efecto antiestrogénico, con influencia inhibitoria del crecimiento en el tejido mamario normal y en el tejido tumoral con positividad a los receptores de estrógenos (RE)3. En el grupo de pacientes con tumores RE-negativos (RE−) facilita el crecimiento tumoral dependiente de andrógenos y actúa como oncogén4.
Se estima que los RA se encuentran expresados en el 60-70% de todos los tumores mamarios malignos, específicamente en el 65-95% de los tumores RE-positivos (RE+), en el 10-60% de los RE−, y en el 9-35% del grupo de triple negativos2,5–7. No existe ningún parámetro internacional para reportar la expresión de los RA, pero normalmente se establece la positividad si el porcentaje de tinción por inmunohistoquímica de las células es superior al 10%, aunque se puede dividir por el porcentaje de positividad, como propusieron Secreto et al. en 2012: negativos con 0%, pobremente positivos con 1-30%, moderadamente positivos con 31-60% y altamente positivos con más del 61%8.
Desde finales de la década de los ochenta se ha investigado el bloqueo androgénico como terapéutica para el cáncer de mama. Tomando en consideración que los andrógenos producen el crecimiento de células tumorales en la mama, sería razonable utilizar terapia antiandrogénica para bloquear la producción de los mismos. En general, el grueso de los estudios ha demostrado una estabilización o regresión de la enfermedad en un 20-25%. Para tal efecto, se han utilizado medicamentos como flutamida, bicalutamida, enobosarm y enzalutamida, entre otros7. El Hospital Memorial Sloan-Kettering Cancer Center, en un estudio fase ii con 436 pacientes, utilizando bicalutamida en cáncer de mama metastásico con RA+, encontró positividad a RA en el 12% y un beneficio clínico del 19%, principalmente enfermedad estable9. En un estudio fase ii, enobosarm demostró un beneficio clínico del 20% en forma de enfermedad estable10.
Además del potencial impacto en el tratamiento del cáncer de mama, los RA tienen un valor pronóstico y/o predictivo favorable para las pacientes RA+, como se evidencia en los siguientes estudios. Agoff et al., en 2003, encontraron una asociación del estado RA+/RE− con pacientes de edad más avanzada, estado posmenopáusico, mayor grado y tamaño tumoral y sobreexpresión de HER2/neu y mejores índices de supervivencia en el grupo de pacientes RA+11. En la cohorte del Nurse's Health Study de 1,467 pacientes se concluyó que el estado RA+ se asoció a un mejor pronóstico en mujeres RE+12. Un metaanálisis belga con 6,525 pacientes demostró que la positividad a RA confiere un valor pronóstico positivo, con menor riesgo de recurrencia y un índice superior de supervivencia global (SG), con un riesgo relativo de 0.65 y 0.60, respectivamente, en el grupo de mujeres con RE+13. Un estudio coreano de 931 pacientes encontró una supervivencia libre de enfermedad a 5 años del 88% y una SG a 5 años del 93% en el grupo con RA+, a diferencia del 83% de supervivencia libre de enfermedad y 90% de SG en el grupo con RA−, con una diferencia estadísticamente significativa en el grupo de mujeres con RE+, mas no así en el grupo con RE−14,15. Un estudio canadiense, mediante una revisión sistemática y metaanálisis que incluyó a 7,693 pacientes, encontró expresión de RA+ en el 60%, la cual estuvo asociada a mejores índices de SG y supervivencia libre de enfermedad sin importar el estado de RE16.
También se ha analizado la expresión de los RA y su relación con la respuesta a la quimioterapia neoadyuvante. Un estudio en mujeres de la India demostró que las mujeres RA+ presentaron mejores respuestas a la quimioterapia neoadyuvante en comparación con mujeres RA−17. Estudios del MD Anderson Cancer Center demostraron que las pacientes con cáncer de mama del subtipo RA luminal presentaban las tasas más bajas de respuestas patológicas completas18. En Europa, el estudio GeparTrio encontró que el estado RA− confiere una tasa más elevada de respuesta patológica completa, pero que el grupo con RA+ experimentaba mejores índices de supervivencia si no se obtenía dicha respuesta patológica completa19.
La expresión de los RA tiene implicaciones importantes en el pronóstico y el tratamiento del cáncer de mama y se pretende validar la adición de su determinación al panel estándar junto con los RE, receptores de progesterona y el HER2/neu. En nuestro país no contamos con estadísticas que permitan conocer la prevalencia de RA en las mujeres mexicanas y tampoco conocemos las implicaciones predictivas o pronósticas que de dichos receptores se derivan. Como dice la literatura, la expresión de los RA en las pacientes con cáncer de mama mejora la SG. Es por esto que el objetivo del presente estudio consistió en determinar la frecuencia y el valor predictivo y/o pronóstico de la positividad a los RA en mujeres con cáncer de mama tratadas quirúrgicamente en el Hospital Universitario José Eleuterio González durante el periodo de enero de 2006 a diciembre de 2009.
Material y métodosSe realizó un estudio retrospectivo, descriptivo, observacional, abierto y longitudinal, con el objetivo de determinar la prevalencia y el valor predictivo y/o pronóstico de la positividad a los RA en mujeres con cáncer de mama tratadas en el Hospital Universitario «José Eleuterio González».
Se incluyeron mujeres mayores de 18 años con diagnóstico de cáncer de mama que habían sido sometidas a tratamiento quirúrgico en el Hospital Universitario José Eleuterio González durante el periodo del 2006 al 2009, de las cuales se contará con un expediente completo y una muestra viable en patología para la determinación de los RA. Para efectos del presente estudio, el resultado de la determinación de RA se expresó en porcentajes y se definió como positivo un valor superior o igual al 10% de células teñidas (núcleos celulares inmunorreactivos).
Para la estadística descriptiva de las variables sociodemográficas se utilizó el programa informático SPSS, versión 13.0. Asimismo, se realizó la prueba de la χ2 o la prueba exacta de Fisher para correlacionar la positividad a los RA con la respuesta al tratamiento y con la SG.
ResultadosLa muestra incluyó a 256 pacientes, de las cuales únicamente 15 satisficieron los criterios de inclusión; el resto se excluyó por no contar con acceso al expediente clínico o a una muestra viable en patología para realizar la determinación de los RA.
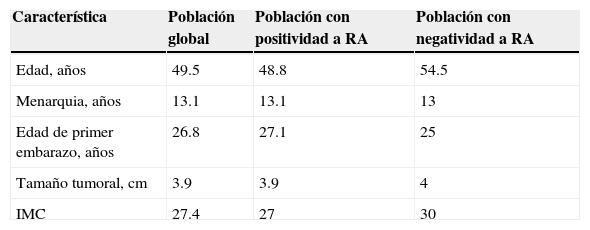
Se realizó el análisis de las 15 pacientes que cumplieron con todos los requisitos establecidos. El total de las pacientes fue del género femenino y la mayoría eran originarias del estado de Nuevo León (73%). En cuanto a características clínicas, la mayoría correspondió al tipo histológico de adenocarcinoma en un 80% y con positividad al receptor de HER2/neu en el 26% (n=4). La muestra contó con una mayoría de pacientes en etapas tempranas, un 66.7%, y con un 33.3% en etapas avanzadas.
En lo concerniente a factores de riesgo para cáncer de mama, solo un 26% de las pacientes tenía antecedentes heredofamiliares en primer o segundo grado. Además, el 67% de la muestra se encontraba en la menopausia y el 47% eran nulíparas.
Se aplicó la escala de Gail para determinar el riesgo de desarrollo de cáncer en estas mujeres, obteniendo como resultado un 20% de la población con bajo riesgo y un 80% con alto riesgo. En cuanto al manejo terapéutico de las pacientes, se les proporcionó quimioterapia neoadyuvante en el 53.3% de los casos (n=8). El resto de las características de las pacientes, tanto de forma global como relacionada con la positividad o negatividad a RA, se presentan en las tablas 1-3.
Características de la muestra
| Característica | Población global | Población con positividad a RA | Población con negatividad a RA |
|---|---|---|---|
| Edad, años | 49.5 | 48.8 | 54.5 |
| Menarquia, años | 13.1 | 13.1 | 13 |
| Edad de primer embarazo, años | 26.8 | 27.1 | 25 |
| Tamaño tumoral, cm | 3.9 | 3.9 | 4 |
| IMC | 27.4 | 27 | 30 |
IMC: índice de masa corporal; RA: receptores androgénicos.
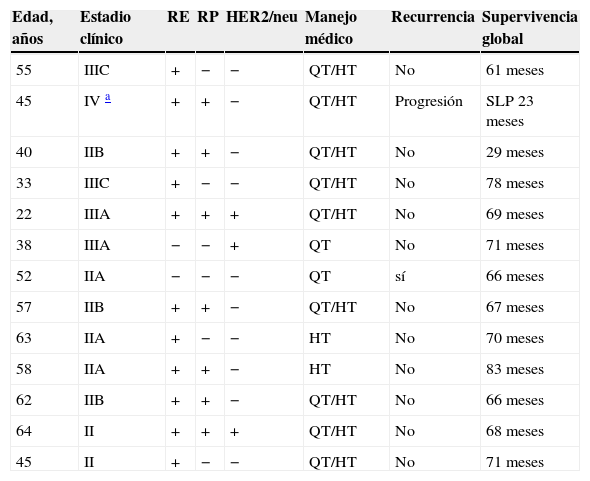
Características de las 13 pacientes RA+
| Edad, años | Estadio clínico | RE | RP | HER2/neu | Manejo médico | Recurrencia | Supervivencia global |
|---|---|---|---|---|---|---|---|
| 55 | IIIC | + | − | − | QT/HT | No | 61 meses |
| 45 | IV a | + | + | − | QT/HT | Progresión | SLP 23 meses |
| 40 | IIB | + | + | − | QT/HT | No | 29 meses |
| 33 | IIIC | + | − | − | QT/HT | No | 78 meses |
| 22 | IIIA | + | + | + | QT/HT | No | 69 meses |
| 38 | IIIA | − | − | + | QT | No | 71 meses |
| 52 | IIA | − | − | − | QT | sí | 66 meses |
| 57 | IIB | + | + | − | QT/HT | No | 67 meses |
| 63 | IIA | + | − | − | HT | No | 70 meses |
| 58 | IIA | + | + | − | HT | No | 83 meses |
| 62 | IIB | + | + | − | QT/HT | No | 66 meses |
| 64 | II | + | + | + | QT/HT | No | 68 meses |
| 45 | II | + | − | − | QT/HT | No | 71 meses |
HT: hormonoterapia; QT: quimioterapia; RA: receptores androgénicos; RE: receptores de estrógenos; RP: receptores de progesterona; SLP: supervivencia libre de progresión; (+) positividad; (−) negatividad.
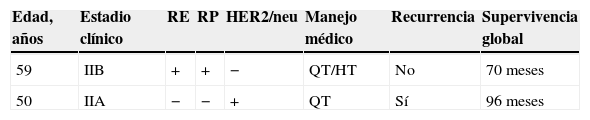
Características de las pacientes RA−
| Edad, años | Estadio clínico | RE | RP | HER2/neu | Manejo médico | Recurrencia | Supervivencia global |
|---|---|---|---|---|---|---|---|
| 59 | IIB | + | + | − | QT/HT | No | 70 meses |
| 50 | IIA | − | − | + | QT | Sí | 96 meses |
HT: hormonoterapia; QT: quimioterapia; RA: receptores androgénicos; RE: receptores de estrógenos; RP: receptores de progesterona; (+) positividad; (−) negatividad.
En cuanto a los resultados, en esta muestra se encontró positividad a los RA en el 86.7% de los casos (n=13) y negatividad en el 13.3% (n 2). Por otro lado, en lo que se refiere a la respuesta al tratamiento, en el grupo con RA+ tratado con neoadyuvancia (n=8), se obtuvo una respuesta patológica completa en el 12.5% de los casos (n=1).
Asimismo, el índice de recurrencia y la SG de la muestra en su totalidad y la obtenida en los grupos RA+ y RA− se presentan en la tabla 2. El resto de las características de las pacientes con positividad a los RA se muestran en la tabla 4.
El resto de las características de las pacientes RA+ se presentan en la tabla 5, en tanto que en la tabla 6 se observa la relación por etapa clínica y estado de RA. No se evidenció ninguna asociación con significación estadística entre el grupo con positividad a los receptores de andrógenos y el estado de los RE (p=0.371), el estado de los receptores de HER2/neu (p=0.476) o el estadio de la enfermedad (p=0.524). Se encontró una correlación negativa significativa entre la edad al momento del diagnóstico y el tamaño tumoral (r: −0.539, p=0.039).
La prevalencia de positividad a los RA en esta muestra fue del 86.7%, lo cual es superior a la cifra reportada hasta el momento en la literatura, la cual oscila entre un 60% y un 80%. Específicamente, en el grupo triple negativo fue del 7.7%, lo cual es inferior a la cifra reportada del 9-35%, pero similar en el grupo con receptores hormonales positivos con un 84.6%, correspondiendo a las cifras reportadas de entre un 65 y un 95%. No se evidenció ninguna asociación estadísticamente significativa entre la positividad a RA y la SG o la respuesta al tratamiento. Se obtuvo una tasa de respuesta patológica completa del 12.5%, similar a las tasas reportadas del 10-30%.
El grupo RA+ en esta muestra presentó un índice de recurrencia más bajo que el grupo RA− (7.7% vs. 50%), pero una tasa inferior de SG (63.2 meses vs. 83 meses).
Si se comparan los datos obtenidos en esta muestra con los datos reportados en un estudio retrospectivo de este mismo centro oncológico (observación no publicada), se observa una SG más prolongada en todos los pacientes de 65.9 meses vs. 51.3 meses (estudio actual vs. estudio previo) y una tasa de recurrencia inferior del 13.3% vs. 15% (estudio actual vs. previo).
Estos mismos datos de SG por grupos RA+ vs. RA− son similares a los reportes en la literatura. Park et al., en 2011, reportaron una SG a 5 años del 93% en RA+ vs. 90% en RA−, en tanto que en el presente estudio fue del 84.6% vs. 100%, respectivamente.
No se encontró ninguna asociación entre la expresión de los RA y la edad, el grado nuclear, el estado hormonal, el estado del HER2/neu y/o la etapa clínica.
ConclusionesEn conclusión, el presente estudio muestra la alta prevalencia de positividad a los RA en una población del noreste de México. Es importante continuar los esfuerzos para caracterizar a esta población, ampliando el tamaño de la muestra para determinar su valor pronóstico y predictivo. Asimismo, esto ayudaría a beneficiar con tratamientos hormonales a este grupo de pacientes.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Los autores expresan su agradecimiento al Departamento de Patología del Hospital Universitario José Eleuterio González por su apoyo en esta labor.