Introducción: El cáncer de mama (CM) es el más común en las mujeres mexicanas. El Ki-67 es un antígeno nuclear relacionado a la proliferación celular.
Objetivo: Determinar la asociación entre Ki-67, recurrencia y supervivencia en CM temprano.
Material y métodos: Mujeres > 18 años con CM invasor, etapa clínica (EC) I-IIB, ductal o lobulillar, inicialmente operadas, con determinación de Ki-67 (MIB-1) fueron incluidas. Se analizaron 4 grupos en relación al Ki-67: 1) < 5%, 2) 6%-20%, 3) 21%-50% y 4) > 51%. Realizamos análisis inferencial para evaluar las diferencias entre los grupos y análisis univariado y multivariado para estimar la asociación a recurrencia y supervivencia global (SG).
Resultados: Ciento treinta y dos casos fueron analizados. Los grupos 1-4 se integraron por 23 (17.4%), 49 (37.1%), 39 (29.5%) y 21 (15.9%) pacientes; mediana de edad 48, 48, 51 y 48 años (p>0.05), respectivamente. Ki-67 correlacionó con tamaño > 2 cm (p=0.003), receptores estrogénicos positivos (+) (p=0.000) y p53 + (p=0.048). Detectamos 18 recurrencias (13.6%); 0, 5, 7 y 6 casos en los grupos 1-4, respectivamente; además, 0, 2 (4%), 4 (10.2%) y 3 (14.2%) muertes, en cada grupo. La EC (razón de momios [RM]=6.69; p=0.03) y el nivel de Ki-67 (RM=2.96; p=0.017) fueron asociados a la recurrencia. Ki-67 fue el factor asociado a la SG (RM=3.3; p=0.04).
Conclusiones: El Ki-67 elevado (>5%) se observa en el 82% con CM temprano. El Ki-67 y la EC son los factores pronóstico más importantes para recurrencia del CM temprano.
Background: Breast cancer (BC) is the most common malignant tumor in Mexican women. Ki-67 is a nuclear antigen related to cellular proliferation.
Objective: To determine the correlation between Ki-67, recurrence and survival in early BC.
Material and methods: Women > 18 years old with invasive BC, clinical stages (CS) I - IIB, ductal OR lobular, underwent surgery and Ki-67 determination were included. We analyzed 4 groups regarding to Ki-67 (MIB1) expression: 1) < 5%, 2) 6%-20%, 3) 21%-50% and 4) > 51%. We performed an inferential statistical analysis to assess differences between groups and univariate and multivariate analysis for detecting association to recurrence and overall survival (OS).
Results: One hundred thirty two patients analyzed. Groups 1-4 were of 23 (17.4%), 49 (37.1%), 39 (29.5%) and 21 (15.9%) patients; median age 48, 48, 51 and 48 years (p>0.05), respectively. Ki-67 correlated with tumor size > 2 cm (p=0.003), estrogen receptor + (p=0.000), p53 + (p=0.048). We detected 18 recurrences (13.6%): 0, 5, 7 and 6 cases in groups 1-4, respectively. There were 0, 2 (4%), 4 (10.2%) and 3 (14.2%) deaths, in each group. CS (odds ratio [OR]=6.69; p=0.03) and Ki-67 level (OR=2.96; p=0.017) were associated to relapse disease. Ki-67 was a factor related to OS [OR=3.3; p=0.04].
Conclusions: Elevated Ki-67 (>5%) is observed in 82% of early BC. Ki-67 expression and CS are the most important prognostic factors for recurrence in early BC.
Introducción
Mundialmente, el cáncer de mama (CM) es la neoplasia más común entre las mujeres. Durante el año 2008 se registró más de un millón de casos nuevos y 458,000 muertes por esta enfermedad1. En los Estados unidos de Norteamérica durante el 2007, se identificaron 209,995 casos nuevos, de los cuales fallecieron casi 43,000 mujeres2. En México, el CM representa la segunda causa de muerte entre las mujeres de 30 a 54 años y se estima que habrá 16,500 nuevos casos en el año 20203.
La detección temprana del CM y los avances en la quimioterapia adyuvante han reducido su tasa de recurrencia y mortalidad4,5. La enfermedad micrometastásica es responsable de la recurrencia6; el riesgo de recurrencia y muerte se estima a través del análisis de diversas características de la paciente y del tumor; entre ellas la edad al diagnóstico, tamaño tumoral, estado ganglionar axilar, grado de diferenciación e invasión vascular y/o linfática4,7-9. Estos factores ayudan a determinar el grupo de pacientes que requieren tratamiento adyuvante, evitando la exposición a efectos tóxicos para quienes no la necesitan. Sin embargo, ante tumores pequeños y ganglios axilares negativos, la información clínica e histopatológica es insuficiente para identificar con máxima precisión a quienes pueden beneficiarse de la terapia sistémica adyuvante. Diversos marcadores biológicos han sido estudiados para tratar de refinar la selección de candidatos a adyuvancia9-11, entre ellos se encuentran los receptores de estrógenos (RE) y progesterona (RP), la oncoproteína HER2 (Human Epidermal Growth Factor Receptor 2), así como algunos marcadores de la actividad angiogénica y/o apoptótica6,12. Recientemente, la determinación de perfiles de expresión genética ha mostrado ser capaz de identificar la heterogeneidad molecular del CM y el riesgo de recurrencia8,13,14.
Ki-67 es una proteína nuclear del tipo no histona, identificada en 1991 y relacionada con el control de la proliferación celular. Esta proteína tiene 2 isoformas, una larga de 359 kDa y otra corta de 320 kDa; el gen regulador de su actividad se localiza en el cromosoma 10q25. Su vida media es de 60 a 90 minutos y es fosforilada por el sistema serina/treonina. Su localización celular e intensidad de expresión se relaciona a las fases del ciclo celular, pero la mayor intensidad de su expresión se observa durante la mitosis, a nivel citoplasmático. La expresión de la proteína puede ser detectada a través del estudio inmunohistoquímico del tejido fijado y embebido en parafina mediante los anticuerpos MIB-1 y MIB-3; su expresión se reporta como el porcentaje de células tumorales teñidas nuclearmente15-18.
La expresión de la proteína Ki-67 correlaciona con el resultado de otros marcadores de proliferación celular, como la fracción de fase S, índice mitótico, índice de tirosina-cinasa y la captación in vivo de la bromodesoxiuridina. Ki-67 ha mostrado ser útil como factor pronóstico de la supervivencia libre de enfermedad (SLE) y supervivencia global (SG) en pacientes con ganglios axilares negativos9,17,18. Por otra parte, se ha informado que este marcador puede ser un elemento predictor de la respuesta a la terapia hormonal y la quimioterapia en CM localmente avanzado9,10,17-21. El objetivo primario de este estudio fue determinar la correlación entre la intensidad de expresión del antígeno Ki-67, recurrencia y supervivencia global en CM temprano.
Material y métodos
Estudio retrospectivo que incluyó todos los casos atendidos y tratados entre el 1° de enero del 2000 y el 31 de diciembre del 2008. Los casos incluidos se seleccionaron bajo los siguientes criterios: mujeres mayores de 18 años, CM invasor confirmado histológicamente, etapa clínica I-IIB, tipo histológico ductal o lobulillar, tratadas con mastectomía radical modificada o cirugía conservadora seguida o no por terapia adyuvante. Se excluyeron los casos con diagnóstico de carcinoma in situ e inflamatorio; variantes histológicas infrecuentes y/o consideradas de buen pronóstico (tubular, papilar, mucinoso, etc.); carcinoma metastásico a la mama, así como aquellos casos con enfermedad localmente avanzada tratados con quimioterapia neoadyuvante.
Se registraron y analizaron las siguientes variables: edad, tamaño tumoral, estado ganglionar axilar, tipo histopatológico, etapa clínica AJCC-TNM7, tipo de cirugía, terapia adyuvante utilizada, número de sitios anatómicos con recurrencia, tiempo libre de recurrencia (TLR) y SG. El TLR se consideró como el lapso transcurrido desde la cirugía y el momento de la detección de la recurrencia, mientras que la SG se consideró como el lapso desde el diagnóstico original y el momento de la muerte, o la última visita médica. Para precisar la relación entre la intensidad de la expresión del Ki-67 y las características clínico-patológicas del CM, arbitrariamente, designamos 4 grupos en función del nivel de expresión del marcador de proliferación celular; en el grupo 1 se incluyeron los casos con expresión baja (< 5%) en relación a la técnica empleada en nuestra institución; en los grupos 2-4 se incluyeron casos con niveles elevados, con rangos entre 6%-20%, 21% - 50% y > 51%, respectivamente.
Análisis inmunohistoquímico
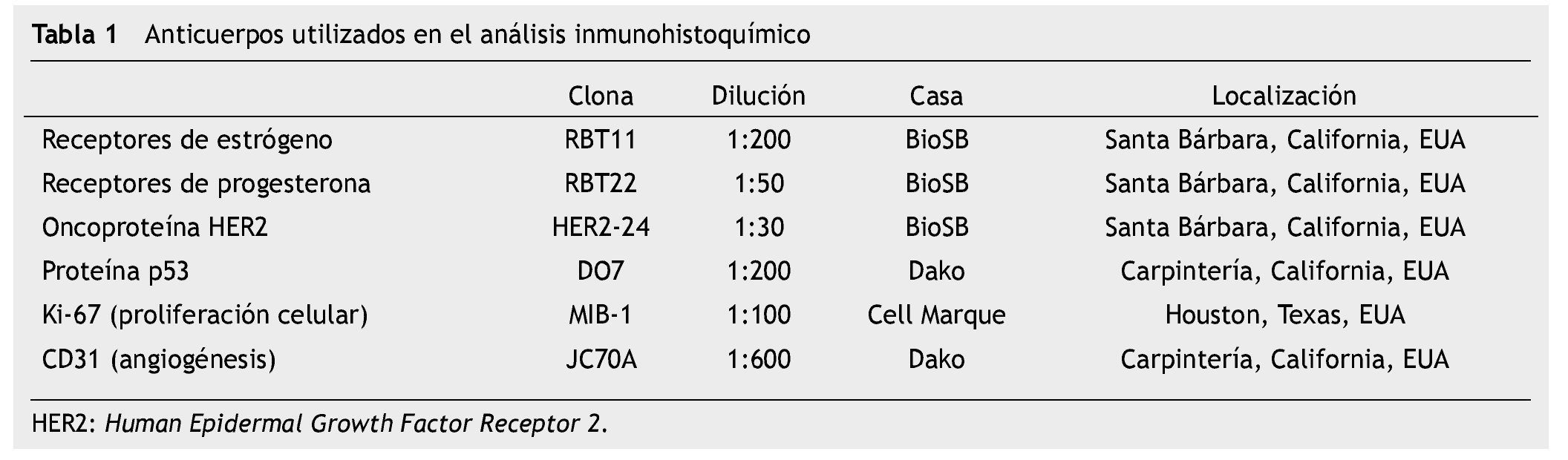
Se realizó estudio inmunohistoquímico en los cortes de tejido embebido de parafina, obtenidos del tumor primario para detectar los marcadores biológicos. En los bloques de parafina se realizaron cortes de 2 micras que se montaron en un control positivo y otro negativo con incubación a 60 grados por 30 minutos. Posteriormente, se procedió al desparafinado mediante 2 lavados de xilol, 2 más de alcohol absoluto al 96% y más tarde se rehidrataron con agua destilada. La recuperación de proteínas se llevó a cabo mediante la aplicación de solución de citrato amortiguadora, exposición a altas temperaturas, enfriamiento, lavado, reincubación y reamortiguación. Para obtener el bloque de proteínas se empleó peróxido de hidrógeno, seguido de la exposición a los anticuerpos primarios con RE, RP, HER2, p53, KI-67 y CD31 (tabla 1). Para conseguir la fijación y amplificación de la respuesta se expusieron a un anticuerpo secundario biotinado seguido de lavado para luego conseguir la formación de complejos con estreptoviridina. El revelado se realizó con diaminobenzidina y aplicación de cromógenos y la de contraste con hematoxilina de Meyer. La técnica fue auxiliada por un aparato de inmunotinción automática, DAKO-autostainer, DAKO, California, EUA.
Los criterios de positividad para cada una de las pruebas realizadas fueron: 1) RE inmunotinción nuclear > 5% de las células tumorales; 2) RP inmunotinción nuclear > 10% de las células tumorales; 3) HER2 positivo tinción membranal, 3+ en intensidad; 4) p53 tinción nuclear positiva; 4) Ki-67 tinción nuclear > 5% de las células tumorales; 5) CD31 tinción citoplásmica > 17 vasos por campo 40X.
Análisis estadístico
Para el análisis estadístico se emplearon los métodos de la estadística descriptiva; la asociación entre la intensidad de expresión de Ki-67 y otras variables clínico-patológicas se determinaron mediante las pruebas de ANOVA, ji cuadrada, prueba exacta de Fischer y/o Kruskall-Wallis. La influencia del marcador de proliferación (nivel de expresión < 5% o > 5%) y, de otras variables sobre el TLR y SG se valoró a través del análisis univariado y multivariado con el modelo de Cox.
Resultados
Ciento treinta y dos casos fueron analizados, la mediana de expresión de Ki67 fue 20%, rango 0%-95%. Noventa por ciento de los casos tuvieron histología ductal y en el 10% fue lobular. Se incluyeron 23 (17.4%) en el primero, 49 (37.1%) en el segundo, 39 (29.5%) en el tercero y 21 pacientes (15.9%) en el cuarto grupo (tabla 2). La edad fue similar en todos los grupos, mediana 48 años, pero en el grupo 3 fue 51 años (rango 30-79; p>0.05). Predominó la etapa IIA, la proporción de casos con etapa IIB aumentó conforme lo hizo la expresión de Ki-67 (13%, 16.3%, 15.3% y 23.8%; p>0.05). El estado ganglionar axilar fue negativo en la mayor parte de los grupos, y en los casos con ganglios axilares positivos no observamos diferencia en relación al número de ganglios afectados y Ki-67. La expresión de Ki-67 fue asociada a mayor tamaño tumoral, (p=0.003); RE positivos (p=0.000) y expresión positiva de p53 (p=0.048) (tabla 2). Además, se detectó una tendencia a la correlación inversa entre RP y Ki-67 (p=0.068). La expresión de HER2 fue más frecuente conforme aumentó la proliferación celular y la frecuencia de tumores con inmunofenotipo triple negativo (RE, RP y HER2 negativo) fue mayor en el grupo 4, pero no se observó diferencia estadística significativa.
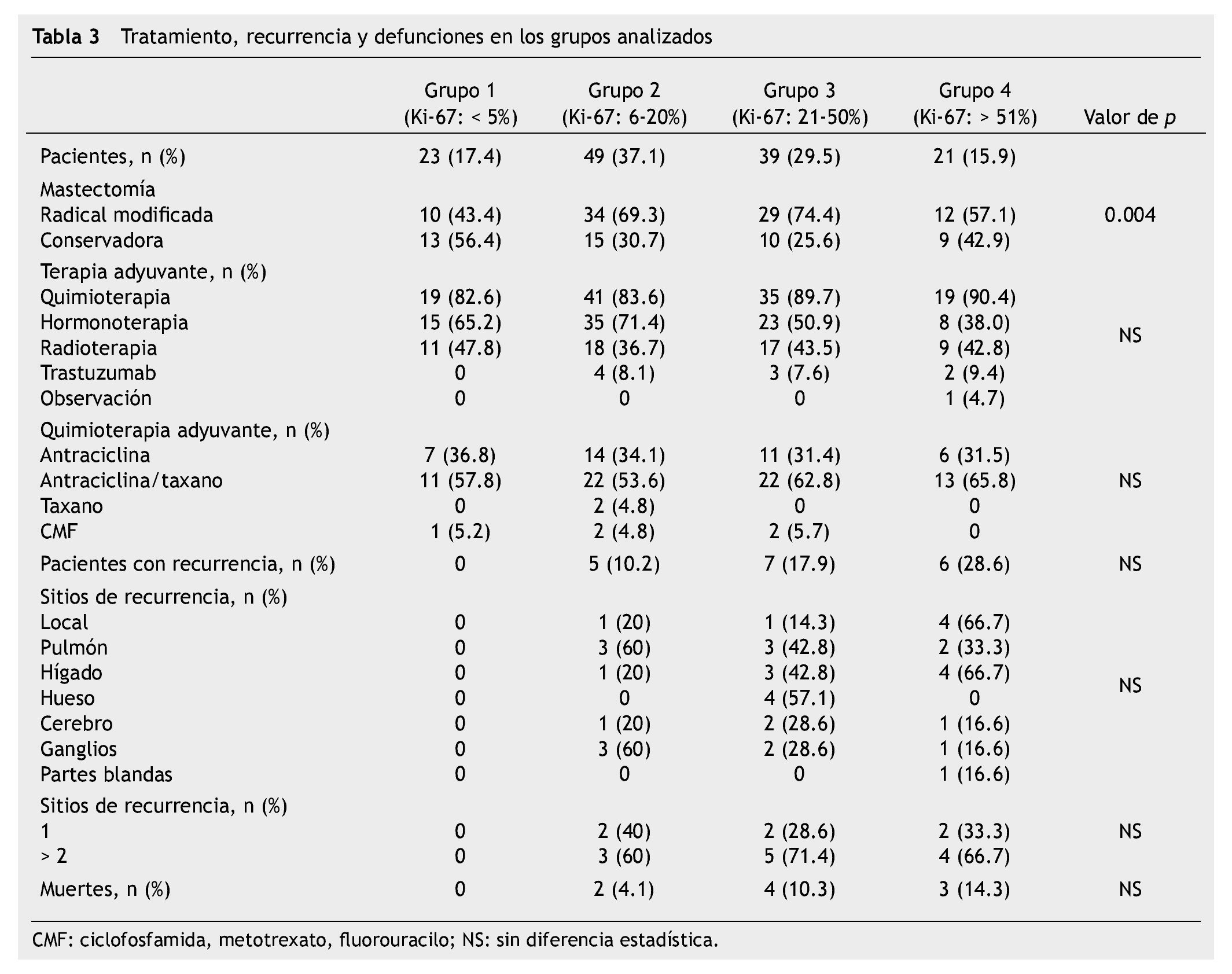
La tabla 3 muestra las modalidades terapéuticas empleadas en cada grupo. En el primero predominó la cirugía conservadora frente a la mastectomía radical modificada (43.4% vs. 56.4%), mientras que en los grupos 2 y 3 predominó la cirugía radical modificada (p=0.004). La proporción de pacientes que recibió quimioterapia, radioterapia y/o trastuzumab adyuvante fue similar entre los grupos (p>0.05). Las integrantes del grupo 4 recibieron terapia hormonal en menor frecuencia que la observada en los otros grupos (65.2%, 71.4%, 50.9% y 38%). No hubo diferencia en la proporción de pacientes tratadas con antraciclinas y/o taxanos. El tiempo de seguimiento del primer grupo fue 49 meses (rango 7-106); 37 (3-114) en el segundo, 41 (6-118) en el tercero y 48 meses (rango 6-90) en el cuarto grupo (p>0.05).
Durante el seguimiento registramos 18 (13.6%) casos con recurrencia, en ellos la mediana de Ki-67 fue 40%, rango 8-80. Todos los casos con recurrencia se ubicaron en los grupos con Ki-67 > 5%; 5 casos (10.2%) en el grupo 2 (mediana Ki-67: 15, rango 8-15%); 7 (17.9%) en el tercero (Ki-67: 40, rango 35-45) y 6 (28.6%) en el cuarto grupo, (Ki-67: 70, rango 60%-80%), p=0.000. En relación a los sitios anatómicos de la recurrencia, en el segundo grupo predominó a nivel pulmonar y ganglios no regionales (60%), en el tercero pulmón e hígado (42.8%) y en el cuarto grupo se notó mayor frecuencia de metástasis hepáticas (66.7%) y recurrencia local (66.7%). El TLR fue menor en aquellas con elevado Ki-67, mediana 27, 39 y 12.5 meses en los grupos 2-4, respectivamente. Se registraron 9 defunciones, todas con Ki-67 > 5% (mediana Ki-67: 45, rango 10-80); 2 (4.2%) en el segundo grupo, 4 (10.3%) en el tercero y 3 (14.3%) en el cuarto grupo. Los fallecimientos del grupo 2 se registraron a 17 y 42 meses, en el tercero a 7, 31, 46 y 94 meses y, en el cuarto grupo a 45, 60 y 62 meses.
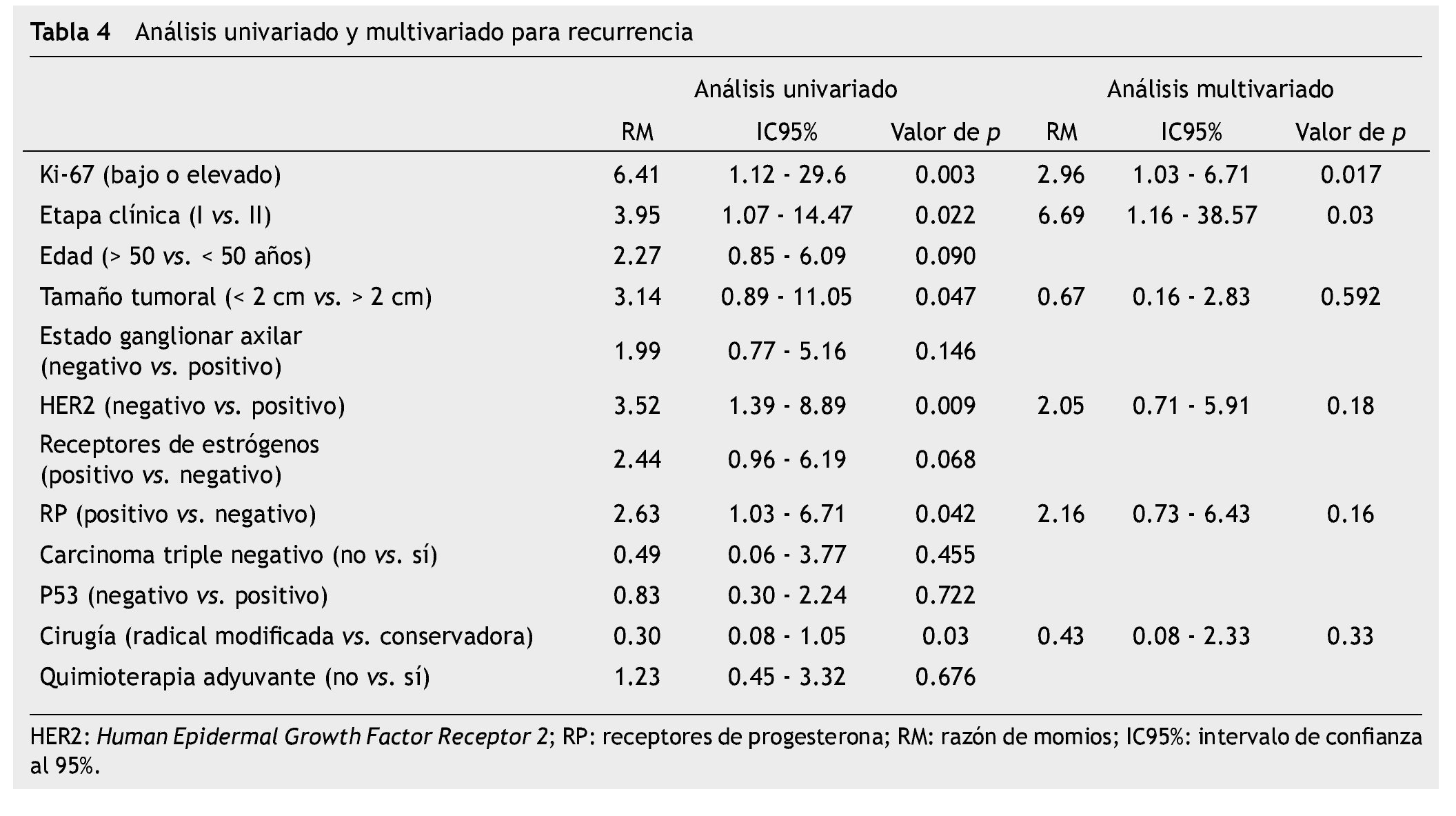
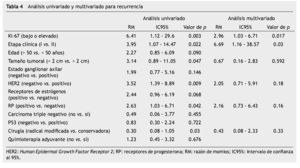
Distintos factores se asociaron a la recurrencia en el análisis univariado, entre ellos la etapa clínica (RM=3.95; p=0.03), tamaño tumoral (razón de momios [RM]=3.14; p=0.02), HER2 positivo (RM=3.52; p=0.009) y RP negativo (RM=2.63; p=0.04) y la expresión del Ki-67 > 5% (RM=6.41; p=0.003); sin embargo, en el análisis multivariado sólo la expresión de Ki-67 (RM=2.96; p=0.017) y el estadio clínico (RM=6.69; p=0.03) mantuvieron valor pronóstico independiente (tabla 4). Finalmente, Ki-67 fue el único factor que mostró correlación con la SG en el análisis univariado (RM=3.3; IC95%=0.81-14.2; p=0.04).
Discusión
Los hallazgos del presente trabajo muestran que el nivel de expresión de Ki-67 se asocia a mayor tamaño tumoral, expresión positiva de RE y p53. La proliferación celular y la etapa clínica fueron factores con valor pronóstico independiente para la recurrencia del CM temprano; además, Ki-67 fue el único factor asociado a la SG en el análisis univariado.
Tres estudios robustos respaldan el valor pronóstico de Ki-67 en CM 22-24. Colozza et al.22 realizó una revisión sistemática de 15 estudios retrospectivos en pacientes con ganglios axilares positivos y negativos, todos ellos informaron correlación estadística entre Ki-67 y SLE o SG. Azambuja et al.23 condujo un meta-análisis de 38 estudios (10,954 pacientes); los resultados mostraron mayor riesgo de recurrencia (HR=1.93; IC95%=1.74-2.14; p=0.001) y mortalidad (HR=1.95; IC95%=1.70-2.23; p=0.001] ante expresión positiva; la influencia del Ki-67 sobre el pronóstico prevaleció en casos con y sin afectación ganglionar axilar. Stuart-Harris et al.24, analizó 43 reportes que incluyeron 15,790 pacientes, los autores identificaron HR combinado 1.73 (IC95%=1.37-2.17; p=0.001) para SG y 1.84 (IC95%=1.62-2.10; p=0.93) para SLE frente a la sobreexpresión de Ki-67.
En relación a Ki-67 como factor pronóstico en CM temprano, aunque la evidencia es robusta, los lineamientos internacionales no han recomendado su determinación rutinaria ya que la mayor parte de información proviene de estudios retrospectivos, con poblaciones heterogéneas y limitado número de pacientes en los cuales se han empleado distintos anticuerpos para detectar el nivel de proliferación celular, así como por la falta de un punto de corte preciso para señalar el nivel elevado de proliferación celular7,17-19,25.
La expresión de Ki-67 proporciona información adicional que modifica el pronóstico de SLE en CM temprano. Jung et al.26 evaluó la tasa de SLE a 5 años en 1,080 pacientes; 196 considerados con bajo riesgo, 786 riesgo intermedio y 84 alto riesgo de recurrencia de acuerdo con la clasificación de St. Gallen 2007. Al dividir los grupos en relación a la expresión del Ki-67 (< 10% y > 10%) en el grupo de bajo riesgo se observó SLE a 5 años 97.7% y 93.3% (p=0.32); riesgo intermedio 91.9% y 86.3% (p=0.01); y alto riesgo 82.5% y 61.4% (p=0.01). De igual forma, las estimaciones de SLE a 5 años sufrieron modificaciones cuando el riesgo se calculó mediante Adjuvant!Online (http://www.adjuvantonline.com/) y Ki-67 (< 10% o > 10%); en el grupo con bajo riesgo se encontró SLE a 5 años 97.8% y 89.5% (p=0.02) y en el de alto riesgo 90.4% y 82.6% (p=0.005). Por lo anterior, el Consenso internacional de Expertos de St. Gallen ha reconocido la utilidad del marcador de proliferación en la toma de decisiones para indicar la quimioterapia y/o terapia endocrina adyuvante27.
El pronóstico del CM temprano es heterogéneo desde el punto de vista molecular. En los albores del siglo XXi, se describieron 5 subtipos del CM en función de su expresión genética (luminal A y B, predominio de HER2, basal y normal), los cuales fueron caracterizados a través de técnicas de inmunohistoquímica13. Cheang et al.28 analizó la expectativas de SLR y SG en 3 inmunofenotipos del CM: luminal A (receptores hormonales positivos, HER2 negativo y Ki-67 < 14%), luminal B (receptores hormonales positivos, HER2 negativo y Ki-67 > 14%) y luminal A o B con sobreexpresión de HER2. En ese estudio, la SLR a 10 años fue 78%, 67% y 64% en cada grupo para los casos que no recibieron terapia adyuvante, mientras que la SG a 10 años fue 92%, 79% y 78%, respectivamente. También, los autores reportaron menor SLR y SG para el subtipo luminal B y luminal A o B con HER2 positivo en comparación con el subtipo luminal A tratados únicamente con terapia endocrina adyuvante, SLR a 10 años 53% y 51% vs. 70% y SG a 10 años 64% y 57% vs. 79%, respectivamente. Un efecto similar se observó en la población que recibió quimioterapia y terapia endocrina adyuvante, la SLR a 10 años en los 3 subtipos fue 69%, 51% y 42%, mientras que la SG a 10 años fue 78%, 58% y 44%, respectivamente.
Por otra parte, aquí se observó que la expresión de Ki-67 se asoció con tumores de mayor tamaño (p=0.003), RE positivos (p=0.000) y expresión positiva de la proteína p53 (p=0.048). Diversos estudios han mostrado resultados similares a los encontrados en este trabajo. La actividad proliferante se relaciona con menor actividad apoptótica29 y de la proteína antiapoptótica Bcl-230, mutaciones o sobreexpresión de la oncoproteína p5320,31,32, y mantiene correlación inversa con los receptores de estrógenos19,30-34. También, la expresión del marcador de proliferación celular correlaciona con el grado histológico y tamaño tumoral19,32,33,35; mientras que su asociación con la positividad de HER2 y el factor de crecimiento epidérmico es infrecuente33,36. También, Ki-67 guarda relación con los tumores triple negativo (RE, RP y HER2 negativo), subtipo agresivo y asociado a pobre pronóstico37-40. No hay una razón clara que explique la relación entre Ki-67 y RE positivos observada en este estudio, este hallazgo puede obedecer a un sesgo de selección involuntario ya que la mayor parte de los casos con Ki-67 tuvieron RE positivos, así como al menor número de sujetos incluidos en los grupos 1 y 4.
Los resultados del presente estudio deben ser evaluados cautelosamente, ya que algunos aspectos metodológicos deben moderar su interpretación. Primero, se trata de un estudio retrospectivo con un limitado número de pacientes incluidos en cada grupo, lo cual puede influir en la fuerza y significancia del valor pronóstico detectado para Ki-67. Segundo, no se determinó el punto de corte que define la influencia pronóstica del Ki-67; aquí se observó que la mediana de proliferación celular fue 40% (rango 8-80), en los casos con recurrencia. Actualmente, la falta de un punto de corte preciso ha sido una limitante para establecer al marcador de proliferación celular como un factor pronóstico definitivo; sin embargo, niveles de expresión superiores a 11%-14% parecen ser el punto de corte adecuado18. Tercero, el valor pronóstico del Ki-67 fue detectado en una población mixta -con y sin ganglios axilares afectados-; idealmente, la capacidad pronóstica de un factor debe ser considerada en población con ganglios negativos que no recibe tratamiento adyuvante9. Cuarto, el tiempo de seguimiento fue mayor a 3 años en todos los grupos; es posible que este lapso sea insuficiente para evaluar el efecto pronóstico real sobre la recurrencia y supervivencia del CM temprano, ya que una considerable proporción de casos desarrolla recurrencia y/o fallecen tardíamente, más de 10 años después de terminar la terapia adyuvante11.
El valor pronóstico de Ki-67 en CM ha orientado a investigar su capacidad predictiva de la terapia neoadyuvante. Se ha reportado que un nivel alto, previo a la terapia neoadyuvante, se asocia a mayor tasa de respuesta completa patológica (RCp) (r=-0.31; p<0.025)41. Algunos reportes observaron aumentada RCp en mujeres con CM subtipo triple negativo y aumentada proliferación celular comparada con otros inmunofenotipos42,43. Fasching et al.42 observó mayor tasa de respuesta entre los subtipos moleculares del CM que expresaron Ki-67 > 13% comparado con < 13% (luminal A: 8 vs. 2.9%; luminal B: 43.3 vs. 14.3%; HER2: 52 vs. 28%; triple negativo: 49.2 vs. 14.3%); también, Darb-Esfahani et al.43 detectó mayor tasa de RCp en casos CM triple negativo y Ki-67 > 20% (63 vs. 0%).
Algunos estudios sugieren que el nivel de Ki-67 posquimioterapia predice la respuesta clínica y la RCp. Burcombe et al.44 notó alta tasa de RCp ante una reducción mayor al 75% del nivel basal, comparado con quienes lograron reducción < 75% (77.8 vs. 26.7%), después de 6 ciclos de quimioterapia basada en antraciclinas. Otros investigadores han confirmado el valor predictivo de Ki-67 después de la terapia neoadyuvante45. No obstante, diversos reportes indican que las modificaciones en el nivel de expresión del marcador de proliferación no guardan relación con la SLR, ni Sg43,45-47.
Por otra parte, el valor predictivo de Ki-67 a la terapia endocrina neoadyuvante ha sido explorado. Dowsett et al.48 reportó que el índice elevado de Ki-67, basal y 2 semanas después de anastrazol, se asoció inversamente a la SLR (HR=2.09; IC95%=1.41-3.08; p=0.04). En el ensayo ACOSOG Z103149 se detectaron similares niveles de reducción en el Ki-67 en grupos tratados con letrozol, anastrazol y exemestano, después de 16-18 semanas (p>0.05). Los autores indicaron que Ki-67 > 5% posterior a la neoadyuvancia, en tumores con subtipo luminal A, sugiere la presencia de células resistentes al tratamiento y debe motivar un cambio en la estrategia terapéutica. Finalmente, Viale et al.50, en el escenario adyuvante, informó menor SLE en CM temprano y Ki-67 > 11% (HR=1.8; IC95%=1.4-2.3; p=0.0001]; sin embargo, aquellas con Ki-67 alto tratadas con letrozol tuvieron SLE a 4 años similar a la observada en casos con Ki-67 < 11%, que recibieron letrozol o tamoxifeno (89.6%, 93.4% y 90.9%, respectivamente).
Conclusiones
La proliferación celular elevada (alto Ki-67), se observa en el 82% de los casos con CM temprano y representa un factor pronóstico importante para la recurrencia y supervivencia. Por lo anterior, sugerimos que este marcador debe ser solicitado y analizado por patólogos expertos, rutinariamente, en casos con CM temprano.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
* Autor para correspondencia:
Centro de Cáncer del Centro Médico ABC. Sur 128 N° 143 - 203,
Colonia Las Américas, Delegación Álvaro Obregón,
C.P. 01120, México D.F., México.
Teléfono: (55) 5272 3345, (55) 5272 2521. Celular: (044) 5554374105. Fax: +52 (55) 5272 8430.
Correo electrónico: serranoolvera@gmail.com (Juan Alberto Serrano-Olvera).