Introducción: El hepatoblastoma (HB) es el tumor hepático más frecuente en la infancia, su sobrevida en la actualidad supera el 70%. El factor pronóstico principal es la etapa clínica.
Objetivo: El objetivo del presente artículo es describir las características clínicas y la supervivencia a dos años, en una cohorte de niños con HB (2005-2011).
Material y métodos: Se realizó un estudio descriptivo, retrospectivo, retrolectivo y comparativo de pacientes con HB, tratados en el Hospital Infantil de México "Federico Gómez" (HIMFG), entre enero de 2005 y enero de 2011.
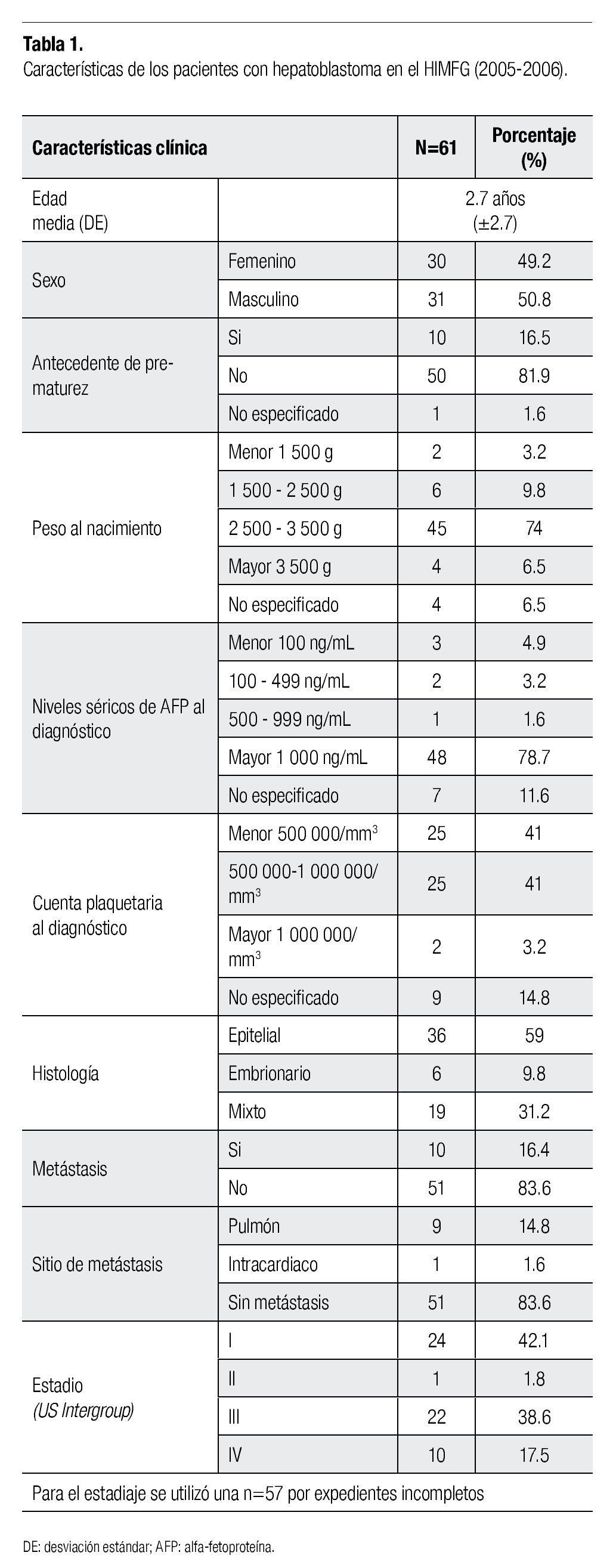
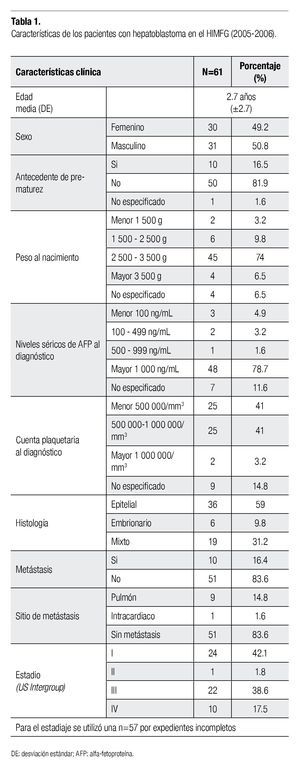
Resultados: Se incluyeron 61 casos, 10 pacientes tenían antecedente de prematurez y ocho peso bajo al nacer. No existió predominio de género. La edad media al diagnóstico fue de 2.7años (DE ± 2.7). El 51.8% tuvo trombocitosis. Los niveles de alfa-fetoproteína fueron mayores de 100 ng/mL en el 94.5% de los casos. El subtipo histológico más frecuente fue el epitelial (n=36; 59%). La distribución de las etapas: I (42.1%), III (38.6%) y IV (17.5%). Se administró quimioterapia neoadyuvante en 34 pacientes. Los esquemas adyuvantes empleados fueron PHIS (23 casos), PLADO (17 casos), ICE (dos casos). Once pacientes murieron por progresión o sus tumores fueron irresecables; 13 pacientes abandonaron tratamiento posterior a la cirugía.
Conclusiones: Los pacientes con HB tienen características epidemiológicas similares a las referidas en otras series. Sin embargo, los pacientes analizados acuden en estadios clínicos avanzados o previamente manejados en otras instituciones, lo cual empobrece su pronóstico de supervivencia a dos años.
Introduction: Hepatoblastoma (HB) is the main hepatic tumor in childhood and its survival is over 70%. The main prognosis factor is the clinical stage.
Objective: To describe clinical features and survival in a cohort of children with HB (2005-2011).
Material and methods: We realized a descriptive, retrolective, retrospective and comparative study of patients with HB treated at Hospital Infantil de México "Federico Gómez" (HIMFG) between January 2005 y January 2011.
Results: Sixty-one patients were included. We identified 10 patients with prematurity and eight with low weight at birth. No sex predominance was seen. Age average at diagnosis was 2.7 years (DE ± 2.7). The 51.8% had thrombocytosis. Alfa-fetoprotein levels were over 100 ng/mL in 94.5% of cases. More frequent hystological subtypes was epitelial one (n=36; 59%). Stage distribution: I (42.1%), III (38.6%) and IV (17.5%). Neoadyuvant chemotherapy was given in 34 pacients.
Adyuvant chemotherapy was PHIS (23 cases), PLADO (17 cases) and ICE (two cases). Eleven tumors were unresectable or died with disease progression. Thirteen patients abandoned treatment after surgery.
Conclusion: Patients with HB have clinical features similar to the one described in literature. Patients that are referred to our institution arrive with advanced stages o with previous treatments in other institutions which makes their prognosis worst.
Pagina nueva 1
¿ INTRODUCCIÓN
Los tumores hepáticos primarios constituyen cerca del 0.5% a 2% de los tumores malignos en pediatría.1 Los tumores malignos son más comunes que los benignos, en una relación de 2:1.2 De éstos, el más frecuente es el hepatoblastoma (HB), que representa alrededor del 90% en menores de cuatro años.3 En Estados Unidos, la incidencia es de aproximadamente 1 por cada 1.2 millones de niños por año; en México, ocupan el séptimo lugar en frecuencia en la edad pediátrica. Se refiere un discreto predominio en el sexo masculino, en una relación de 1.7:1. La edad promedio al diagnóstico comprende los primeros 18 meses de vida, aun cuando se han informado casos en las primeras dos semanas de vida.4-6
Se desconoce su causa, sin embargo, se ha asociado con el síndrome de Beckwith-Wiedemann y el síndrome de Simpson Golabi Behmel.7-9 Estos niños tienen un mayor riesgo de desarrollar tumores embrionarios, tales como el HB con un riesgo 2 280 veces mayor, que para otras neoplasias embrionarias.1,10
Por otra parte, existe una relación del HB con la poliposis adenomatosa familiar (PAF),11 relacionado a mutaciones en la línea germinal del gen APC (adenomatous poliposis coli); los niños de las familias que son portadoras del gen mutado, tienen un riesgo relativo 800 veces mayor de desarrollar HB comparado con la población general;1 la PAF también se ha relacionado con otros tumores hepáticos como el hepatocarcinoma, el adenoma hepatocelular y el carcinoma fibrolamelar.
Se han reportado anormalidades genéticas como las trisomías; de éstas, la más frecuente es la trisomía 20, trisomía 2 y menos común la trisomía 8.1,12 La traslocación t(1:4)(q12;q34), se ha descrito en los tumores en estadios avanzados.13 Otras son la sobreexpresión de IGF-2, deleciones en el gen de la B-catenina, sobreexpresión de la ciclina D1 y la fibronectina, y la inactivación del p16.14-16
Los recién nacidos pretérmino tienen mayor riesgo de desarrollar HB.17,18 Peggy describe un riesgo de 1.8 veces más de padecer HB en los niños con bajo peso al nacer, principalmente en los menores de 1 500 g.19 Se ha descrito igualmente más riesgo en madres muy jóvenes, el tabaquismo materno, obesidad materna durante el embarazo y tratamiento de la infertilidad previo a la concepción.20 Finalmente, un estudio de casos y controles mostró que la exposición ocupacional materna a metales, productos derivados del petróleo, pinturas y pigmentos y la exposición paterna a metales pesados, se relacionan con riesgo para desarrollo de HB.21
Desde el punto de vista histológico, el HB se divide en epitelial embrionario, fetal y mixto. El patrón fetal se presenta en 31% de los casos y es el que más semeja al hígado embrionario. El patrón embrionario existe en 19%.22, 23
El Children's Cancer Study Group (CCSG) y el Pediatric Oncology Group (POG) evaluaron el valor pronóstico del tipo histológico. De los pacientes en los que el tumor se resecó por completo en la intervención quirúrgica primaria, los que tenían histología fetal pura tuvieron mejor supervivencia comparados con otros tipos histológicos.24
El signo más frecuente es una masa abdominal asintomática palpable en el cuadrante superior derecho; se han asociado distensión abdominal, vómito, anorexia y reducción de peso, sólo en etapas avanzadas de la enfermedad.1,2,25
La ictericia y la osteopenia grave se presentan en 5% a 10% de los pacientes y es una condición de enfermedad avanzada. Entre 20% y 49% tiene metástasis pulmonares, lo cual se relaciona con menor supervivencia a largo plazo. Se estima que ésta puede disminuir de 90% a menos del 25% a cinco años. La diseminación del HB es por vía hematógena y afecta pulmón; se ha informado en tumores quimiorresistentes, el síndrome de compresión de la médula espinal consecutiva a extensión epidural.22,23
La alteración de laboratorio más frecuente es la trombocitosis, con cifras mayores de 500 000/mm3 en un 80% de los casos, la cual está relacionada al aumento de la secreción de trombopoyetina. Recientemente, se ha sugerido que la trombocitosis es secundaria a la síntesis intratumoral de interleucina 6. Se puede presentar anemia normocítica normocrómica. Las pruebas de funcionamiento hepático se alteran cuando hay afección de más del 75% del parénquima, o cuando la lesión es central y obstruye la vía biliar.1,2 La alfa-fetoproteína (AFP) es el marcador tumoral sérico más sensible. Después de la resección quirúrgica, la AFP disminuye de manera logarítmica alcanzando sus valores normales de cuatro a seis semanas. Un aumento consistente en el marcador precede con frecuencia a la recidiva tumoral, aún cuando ésta no sea identificable por estudio de imagen.
Van Tornout en un análisis de los valores iniciales de AFP y su disminución con el tratamiento en pacientes con HB no extirpado inicialmente o con metástasis, concluyeron que no existe relación entre el nivel inicial de AFP y la supervivencia final, sin embargo, la magnitud y rapidez del declive temprano inducido por el tratamiento fue el factor pronóstico mas importante. Este hallazgo permite identificar tempranamente a los pacientes que no responden satisfactoriamente a la quimioterapia (QT) inicial, y por consiguiente, candidatos a segunda línea de tratamiento.26
El estudio SIOPEL-2 demostró que pacientes con AFP al diagnóstico menor de 100 ng/mL tenían mal pronóstico, y son actualmente considerados de alto riego por dicho grupo.27 En ocasiones, el antígeno carcinoembrionario (ACE) y la fracción beta de la hormona gonadotropina coriónica humana (βGCH) pueden estar elevados.
La Sociedad Internacional de Oncología Pediátrica (SIOP) establece que el diagnóstico puede realizarse con AFP elevada, trombocitosis con conteo de plaquetas mayor a 500 000/mm3 y una masa tumoral dependiente de hígado, que confiere una probabilidad diagnóstica de más del 90% y sin llegar a la biopsia hepática, con lo que es posible iniciar tratamiento neoadyuvante.28 La SIOP ha propuesto un sistema de estadificación prequirúrgica denominado PRETEXT, basado en la información radiológica, que utiliza las venas o ductos biliares más importantes para identificar el número de sectores hepáticos infiltrados por el tumor.
Por otro lado, el POG propone una estadificación de acuerdo al grado de resecabilidad y a la presencia o ausencia de metástasis al diagnóstico. La escuela americana estratifica a los pacientes de acuerdo al resultado posquirúrgico. Ha funcionado en la evaluación de protocolos terapéuticos que requieren intervención quirúrgica inicial antes de comenzar la QT, sin embargo su valor es limitado en la identificación de pacientes que pueden beneficiarse con el uso de QT prequirúrgica.29-32
El factor pronóstico más importante para la supervivencia es la resección quirúrgica total. En segundo lugar, la presencia de enfermedad metastásica al diagnóstico, aunque este factor ha sido modificado por el tratamiento con QT neoadyuvante. El tercer factor es la histología, donde la variedad fetal tiene mejor pronóstico.
La disminución de las concentraciones séricas de AFP después de la QT neoadyuvante, se relacionan con mejor respuesta al tratamiento con QT.33,34
El manejo quirúrgico de primera intención se considerará siempre que sea posible; en caso contrario, se tomará una biopsia y se iniciará tratamiento con QT neoadyuvante.35-37 El hecho de que un tumor sea resecable es un criterio del cirujano, sin embargo se han referido los siguientes criterios como base para determinar la resecabilidad del tumor: tumor muy grande, que puede llevar a un sangrado excesivo, compromiso de ambos lóbulos hepáticos, involucro de las venas hepáticas principales o la vena cava inferior (VCI) y la enfermedad multifocal o difusa. La complicación intraoperatoria más frecuente es la hemorragia.38,39 El riesgo de hemorragia aumenta con la hepatectomía extendida, o la proximidad del tumor a la VCI o de los vasos hepáticos. Las complicaciones posquirúrgicas incluyen absceso subfrénico, fuga de bilis, sangrado u obstrucción del intestino delgado.37 Se reportan menos complicaciones después de la QT preoperatoria. Para los tumores que permanecen irresecables después de la QT o la recidiva local, el trasplante de hígado puede ser una opción.40,41 El sitio más común de metástasis del HB son los pulmones. La resección de la metástasis pulmonar puede resultar en supervivencia a largo plazo y puede considerarse útil cuando: el tumor primario fue resecado, el desarrollo de las metástasis fue después de seis meses de la resección del tumor primario, y se demostró una buena respuesta a la QT con una reducción de los niveles de AFP a menos de 25 ng/mL.42,43
Antes de la utilización de la QT preoperatoria, aproximadamente la mitad de los HB eran considerados irresecables.44-46 Un estudio del Intergrupo Pediátrico de Estudio del HB (PHIS),47 comparó dos regímenes: el régimen A, cisplatino (CDDP) 90 mg/m2 (día 1), vincristina (VCR) 1.5 mg/m2 (día 3) y 5-fluorouracilo (5FU) 600 mg/m2 (día 3); y el régimen B, CDDP 90 mg/m2 (día 1) y doxorrubicina (DOXO) 20 mg/m2/d (días 1-4). La sobrevida libre de enfermedad (SLE) y la sobrevida global (SG) fueron de 57% y 69% en el régimen A, y del 69% y 72% en el régimen B, respectivamente. El tiempo de SLE y SG no fueron significativamente diferentes en los dos brazos. La toxicidad de régimen B fue mayor, resultando en una recomendación del esquema VCR/5FU/CDDP. Otro estudio del PHIS, en un intento de reducir la toxicidad, ha propuesto alternar el esquema de CDDP/VCR/5FU con el uso de carboplatino (CBP). Para los pacientes con estadio I, con histología puramente fetal propone sólo tratamiento quirúrgico de seguimiento con estudio de imagen y determinación sérica de niveles de AFP.
El estudio de tumores hepáticos HB 89 de la Cooperativa Pediátrica Alemana propuso: ifosfamida 3.5 mg/m2 durante 72 horas (días 1-3), CDDP 20 mg/m2/d durante cinco días (días 4-9) y DOXO 60 mg/m2 durante 48 horas (días 9-10); con el cual reportó una SLE de: 100% y 50% para etapas I y II; y del 74% y 29% para las etapas III y IV, respectivamente. Para aquellos paciente que no respondieron, se utilizó CBP y etopósido, obteniendo respuesta en poco menos de la mitad.48,49
Hay pocos trabajos sobre nuevos agentes en el tratamiento del HB. Fuchs ha informado de respuestas a paclitaxel en modelos de xenoinjerto, sin estudios fase II.50,51 Ocho pacientes con HB fueron tratados en un estudio de fase II con topotecan, refiriendo enfermedad estable.52
La quimioembolización arterial transcatéter o quimioembolización arterial se ha utilizado en tumores muy grandes.53-56
¿ MATERIAL Y MÉTODOS
Se realizó un estudio retrospectivo, retrolectivo y descriptivo, donde se incluyeron a todos los pacientes con diagnóstico de HB tratados en el Hospital Infantil de México "Federico Gómez" (HIMFG), durante el periodo comprendido entre enero de 2005 a enero de 2011, con revisión de expedientes clínicos. Se utilizó el sistema de etapificación del POG.
¿ RESULTADOS
Se incluyeron 61 casos, de los cuales se resumen las características clínicas en la Tabla 1. La distribución entre géneros no establece predominio por sexo. En cuanto a la edad al diagnóstico, el 90% de los casos se diagnosticó en los primeros cinco años de edad, con un promedio de 2.7 años. Considerando la distribución de la edad al diagnóstico, se observó un pico de edad entre el primer y segundo año de vida. El intervalo de edad de presentación varió de 0 a 15 años de edad. Se encontró antecedente de prematurez en 16.4%. La mayoría correspondieron a pacientes con peso adecuado a la edad gestacional (73.8%) y al grupo con peso menor de 1500 g, correspondió sólo al 3.3% de los casos.
Se establecieron tres grupos de acuerdo a la determinación sérica de AFP al momento del diagnóstico; el 78% de los pacientes tuvieron al diagnóstico niveles séricos mayores a 1000 ng/dL. La relevancia de establecer estos grupos se analizará más adelante en este trabajo, en relación a la sobrevida de esta cohorte. El 44.2% de los pacientes se presentó con trombocitosis al momento del diagnóstico.
En lo relacionado a las características del tumor, se analizaron: la estirpe histológica, la presencia de metástasis al diagnóstico y sitio más frecuente, así como el estadio clínico de acuerdo a la clasificación del US Intergroup.
El patrón histológico más frecuente fue el tipo epitelial (59%), seguido del patrón mixto (epitelial fetal/ embrionario) y finalmente el embrionario, con 31.2% y 9.8%, respectivamente.
El 16.4% de los pacientes se presentó con metástasis pulmonares al diagnóstico. Finalmente, la etapa clínica más frecuente fue el estadio I (39%), seguido por el estadio III (36%).
Se analizaron los datos con respecto al manejo neoadyuvante (prequirúrgico) y adyuvante (posquirúrgico). Cabe comentar que en un caso no se dispone de los datos, ya que el paciente abandonó tratamiento posterior a su diagnóstico.
El 44% de los pacientes no recibió ningún tipo de tratamiento neoadyuvante. De los pacientes que recibieron tratamiento prequirúrgico, el 27.9% recibió en total cuatro ciclos, siendo el esquema PHIS (VCR/5FU/ CDDP) el más utilizado (26.2%), el segundo esquema de QT neoadyuvante más utilizado fue PLADO (CDDP/ADR) en el 13.1% de los casos. El resto de los esquemas mencionados, incluyen segundas líneas de tratamiento y corresponden al restante 16.2% de los casos tratados de forma prequirúrgica.
Con respecto al manejo posquirúrgico, en el 18% de los casos se aplicaron hasta cuatro ciclos de QT, siendo los esquemas de QT más utilizados: PHIS (34.4%) y PLADO (21.3%), en cinco de los casos (8.2%) se requirió cambio de esquema durante de tratamiento y en 3.2% de los casos se requirió una segunda línea de tratamiento (ICE). Aunque, como ya se refirió, la mediana de tratamiento fueron cuatro ciclos; se encontró un caso en que el tratamiento requirió de hasta 12 ciclos de QT posquirúrgica.
Finalmente, para revisar los resultados de la supervivencia de esta cohorte de pacientes, se consideró realizar el corte del estudio a uno y dos años, ya que incluimos pacientes con diagnóstico reciente que aún no cuentan con el tiempo de seguimiento requerido para un análisis de supervivencia mayor.
Como parte de este estudio se realizó un análisis de la supervivencia en relación con algunas de las características clínicas, los hallazgos de laboratorio y las características del tumor (Figuras 1 a 3). Como se mencionó previamente, el análisis de datos se realizó con un corte de tiempo a 12 y 24 meses.
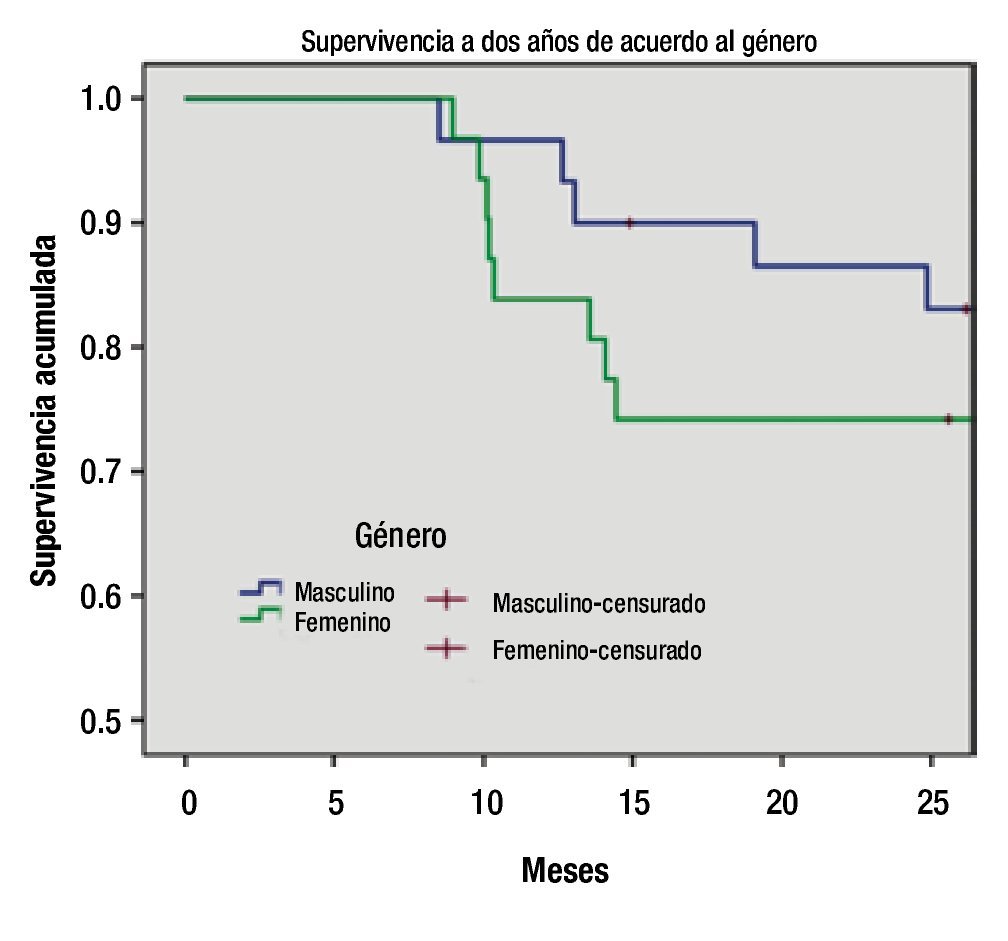
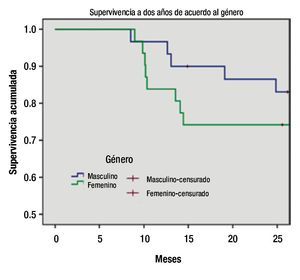
Figura 1. Supervivencia en meses por género (Kaplan-Meier).
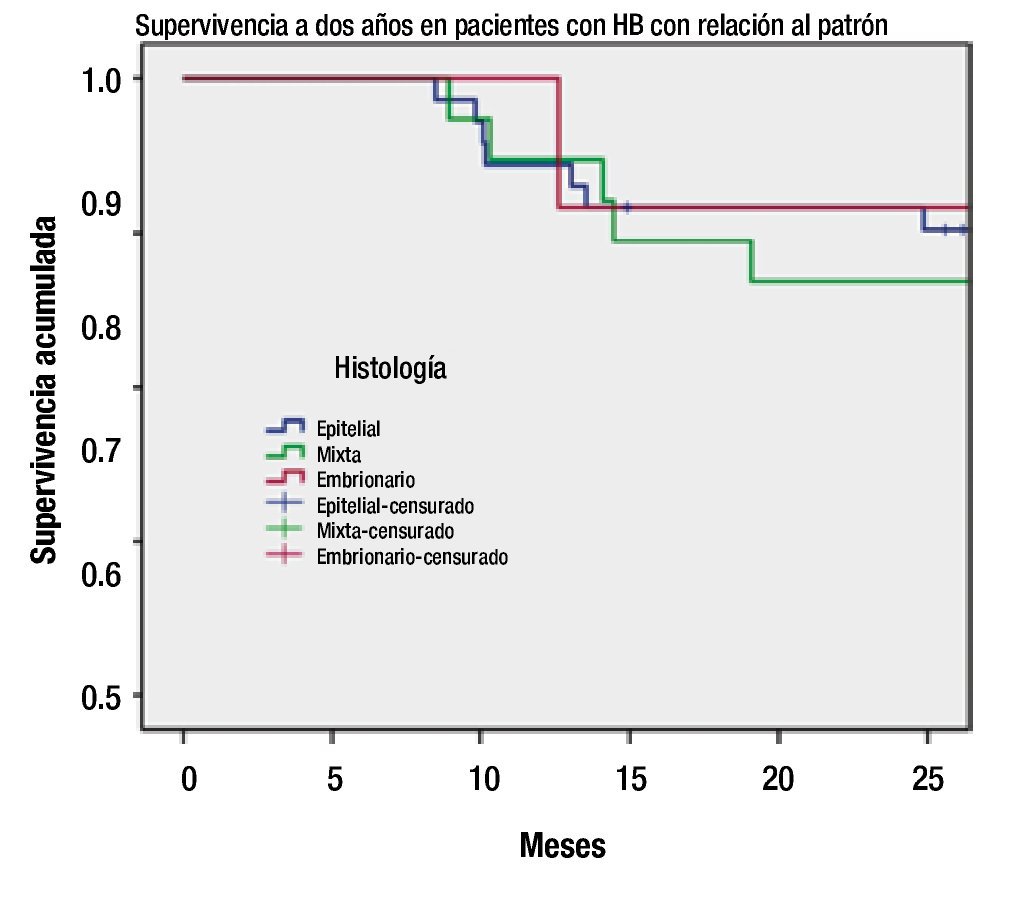
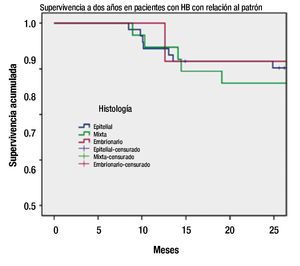
Figura 2. Supervivencia por histología (Kaplan-Meier).
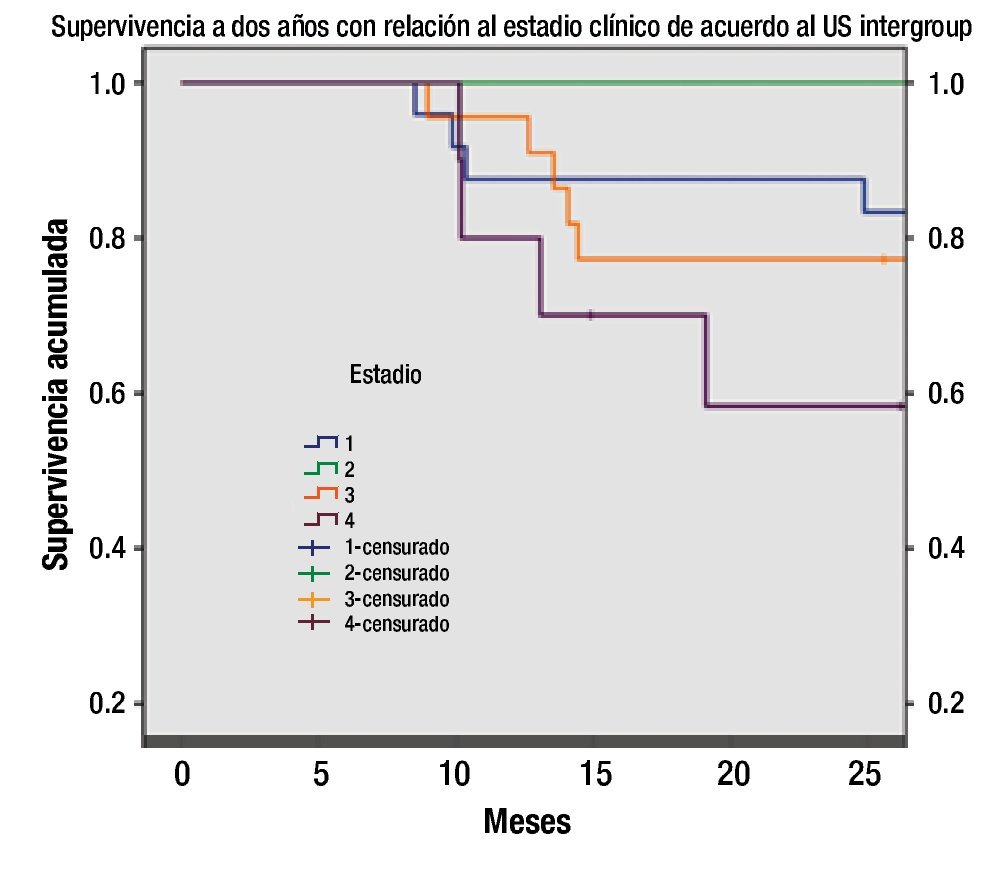
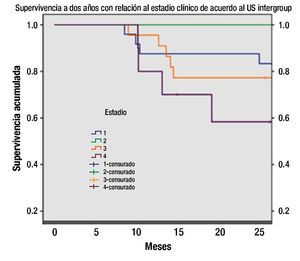
Figura 3. Supervivencia por estadio clínico de acuerdo a US Intergroup (Kaplan-Meier).
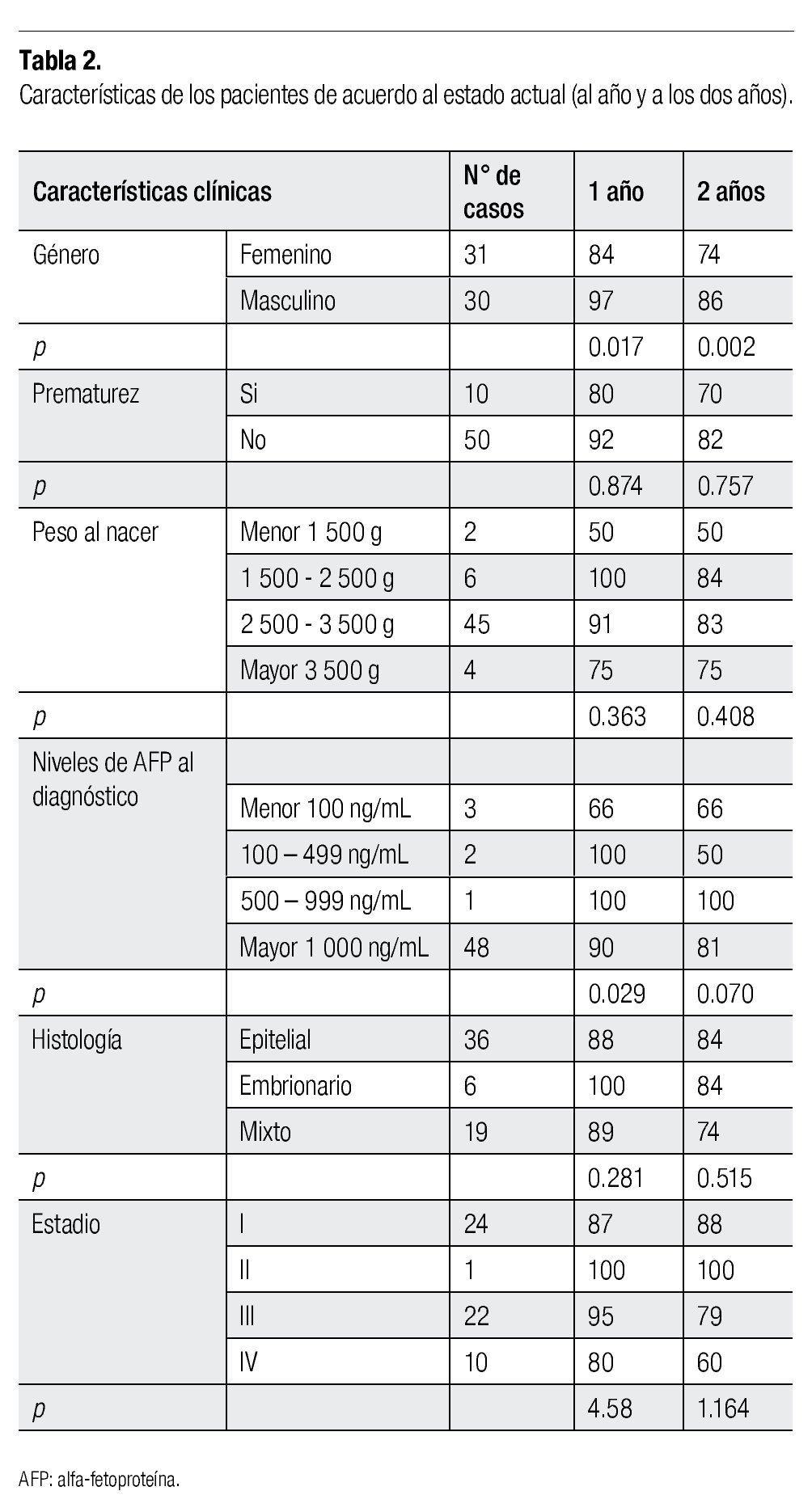
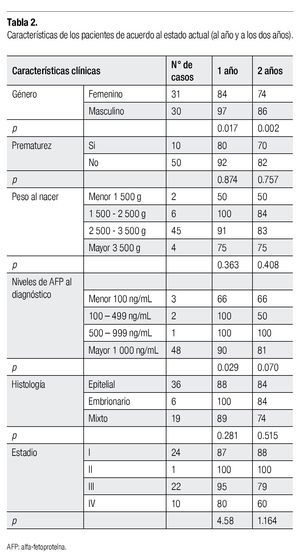
Con relación a las características de los pacientes se encontró que la sobrevida a dos años en niñas es del 74%, mientras que en los niños es del 86%, con lo que se estable una diferencia significativa entre género (p=0.002).
En relación al antecedente de prematurez, encontramos que estos pacientes alcanzan una sobrevida a dos años del 70%, mientras que aquellos nacidos a término, la sobrevida aumentó hasta el 82%, sin tener significancia clínica a este corte de seguimiento.
Por otro lado, en lo relativo a peso al nacimiento, se observó en los pacientes con bajo peso al nacer una sobrevida a dos años del 50%, mientras que en los pacientes con peso adecuado a la edad gestacional esta alcanza un 84% (p=0.40).
Con respecto a los resultados de laboratorio, encontramos que la supervivencia de los pacientes con niveles séricos de AFP menores de 100 ng/mL es del 66%, mientras que con niveles séricos mayores de 500 ng/mL mejora hasta el 100%, siendo clínicamente significativo (p=0.70), relación que se observa incluso desde los primeros 12 meses de seguimiento. Llama la atención que los paciente con niveles intermedios de AFP (100-499 ng/dL) a los dos años, marcan una menor sobrevida de la esperada.
Con respecto a algunas de las características del tumor, se encuentra que el patrón epitelial y el embrionario tuvieron una supervivencia similar a dos años de 84%, sin una diferencia significativa con respecto al patrón mixto (p=0.51). Al año de seguimiento sin embargo, si se observa una diferencia a favor del patrón embrionario con una supervivencia del 100%.
En relación al estadio clínico, como se comentó al inicio de los resultados, la etapa clínica I fue la más frecuente con una sobrevida a dos años del 88%. La principal diferencia en el seguimiento de los casos se encuentra en la etapa clínica III, en donde se reporta una sobrevida a un año del 95%, cayendo hasta el 79% en el análisis a dos años. El estadio IV tiene la menor supervivencia tanto a uno como a dos años del 80% y 60%, respectivamente, sin que en análisis comparativo muestre diferencia significativa (p=1.16). La presentación comparativa de supervivencias por características clínicas y de laboratorio con seguimiento a uno o dos años, se muestra en la Tabla 2.
Por último, encontramos durante el seguimiento de los pacientes, que de los casos evaluados el 21.3% abandonaron tratamiento o dejaron de asistir a su seguimiento. Mientras que las defunciones fueron el 18% de los casos. Actualmente, nuestra población en seguimiento (37/61 casos) representa el 60.7%. No se evaluaron las secuelas en este análisis.
¿ DISCUSIÓN
La edad al diagnóstico más frecuente es en niños menores de cinco años, como se ha reportado en otras bibliografías internacionales, aunque llama la atención la presentación de casos atípicos, una adolescente de 15 años de edad. No encontramos una asociación directa entre el antecedente de prematurez y el desarrollo de HB. Sin embargo, en relación al pronóstico, si se observó que los pacientes con antecedente de prematurez fallecen antes que los pacientes nacidos a término. En relación al peso al nacimiento, la mayor parte de nuestros pacientes se encontraron en el intervalo de peso adecuado para la edad gestacional. Aunque si se obtuvo una menor supervivencia en el grupo de pacientes con peso menor a 1 500 g. Cabe la consideración que los pacientes con bajo peso al nacimiento en esta serie, se relacionaron además al antecedente de prematurez. Es decir, que como se ha referido en la literatura médica, los pacientes con HB prematuros y peso menor de 1 500 g tienen peor pronóstico en general.
Con relación a las características del tumor, como se ha hecho alusión previamente, hay una distribución similar entre los patrones histológicos, por lo que en esta serie no se puede determinar este factor como pronóstico en la respuesta al tratamiento. En relación al estadio clínico encontramos que los estadio I y III fueron los más frecuentes. Tumores de gran tamaño pudieron estadificarse como estadio I, aunque no fue motivo de análisis en este trabajo, pero debe ser estudiado en nuestra población. El pulmón fue el sitio más frecuente de metástasis, siendo además el segundo sitio más frecuente de recaída.
Finalmente con lo que respeta al tratamiento, se tiene un protocolo bien definido en cuando a la elección de esquema de QT inicial PHIS vs. PLADO. La respuesta clínica hasta el momento no está alejada de lo reportado. Sin embargo, hay que observar que algunos casos encontrados en esta serie, que incluyen a los pacientes con recaída y aquellos previamente manejados en otra institución, requirieron más de una línea de tratamiento y un mayor número de ciclos de QT, lo que se refleja de forma adversa en nuestros resultados. Otro punto a analizar con relación a la sobrevida, son los pacientes que abandonan el tratamiento o que dejan de asistir al seguimiento una vez enviados a vigilancia, ya que estadísticamente se reportan como pacientes censados.
Leal y colaboradores en una serie de pacientes del Instituto Nacional de Pediatría, analizan 32 pacientes clasificados con el sistema de etapificación de SIOPEL, encontrando un alto porcentaje de tumores PRETEXT 4.57 Es necesario realizar una correlación entre esta clasificación y la resecabilidad en México. Una limitante importante de este trabajo es el tiempo de seguimiento.
¿ CONCLUSIONES
Los pacientes con HB que acuden a nuestra Institución llegan con características epidemiológicas similares a las referidas en otras series. Sin embargo, algunos de los factores que se consideran pronósticos en la respuesta al tratamiento no tuvieron un impacto significativo. Nos parece importante resaltar que los pacientes que son referidos, llegan en estadios clínicos avanzados. Existe un grupo de pacientes previamente manejados en otras instituciones, lo cual empobrece el pronóstico de supervivencia, ya que generalmente son casos que en otros hospitales se consideraron fuera de tratamiento quirúrgico. El abandono en este grupo supera el 20%.
CONFLICTO DE INTERESES
Los autores declaran no tener ningún conflicto de intereses.
FINANCIAMIENTO
Los autores no recibieron patrocinio para llevar a cabo este estudio.
Correspondencia:
Dra. Marta Zapata Tarrés.
Instituto Nacional de Pediatría.
Insurgentes Sur N° 3700-C, Colonia Coyoacán-Cuicuilco, Delegación Coyoacán,
C.P. 06720, México D.F., México.
Teléfono: 1084 0900, ext. 1339. Celular: (04455) 5418 4099.
Correo electrónico: magazapata@yahoo.com