Los sarcomas primarios renales son muy raros y representan entre el 1% y 3% de las neoplasias malignas de riñón, siendo las formas histológicas más frecuentes el leiomiosarcoma y el liposarcoma. El sarcoma indiferenciado pleomórfico primario renal es una variante rara de mal pronóstico, con alrededor de 60 casos descritos en la literatura. Nosotros presentamos el caso de una mujer de 52 años con tumor renal derecho, tratada quirúrgicamente y cuyo diagnóstico histológico confirmado con estudio inmunohistoquímico fue Sarcoma indiferenciado pleomórfico variedad células gigantes.
Primary sarcomas of the kidney are a rare entity and it counts for 1-3% of malignant neoplasms. The most frequent histologic types are leiomyosarcoma and liposarcoma. The primary pleomorphic undifferentiated sarcoma of kidney is a rare variant and it has a poor prognosis, with around 60 cases described in the literature up to date. We present a 52-year-old female case with high renal tumor, treated surgically whose histological diagnosis confirmed by immunohistochemistry was undifferentiated pleomorphic sarcoma, giant cell variant.
El sarcoma indiferenciado pleomórfico (SIP), antiguamente denominado fibrohistiocitoma maligno pleomórfico, es la neoplasia maligna de partes blandas más común en la adultez1-3. Fue descrito por primera vez por O’Brien y Stout en 1964, siendo los lugares más afectados las extremidades (67-75%) y el retroperitoneo (6-16%)4-6. Sin embargo, también puede presentarse en otras localizaciones como la genitourinaria, en orden de frecuencia: vejiga, próstata, cordón espermático, cápsula y parénquima renal4,6,7. El SIP primario renal es extremadamente raro, su presentación clínica y manejo quirúrgico no difiere del carcinoma renal convencional y para su diagnóstico necesita de técnicas de inmunohistoquímica que lo confirmen7–9. Nosotros presentamos el caso de una mujer de 52 años con SIP primario renal, tratada quirúrgicamente, que evolucionó desfavorablemente.
Presentación del casoPaciente mujer de 52 años, natural y procedente de Chimbote, G2P2002 con antecedente familiar directo de hepatocarcinoma. Ingresa en la institución por presentar desde hace 4 meses dolor en el hipocondrio y el flanco derecho, pérdida ponderal de 10kg, llenura precoz, náuseas y vómitos; niega hematuria macroscópica. En el examen físico preferencial la paciente se encontró adelgazada, con masa palpable, móvil, de consistencia incrementada en el hemiabdomen derecho.
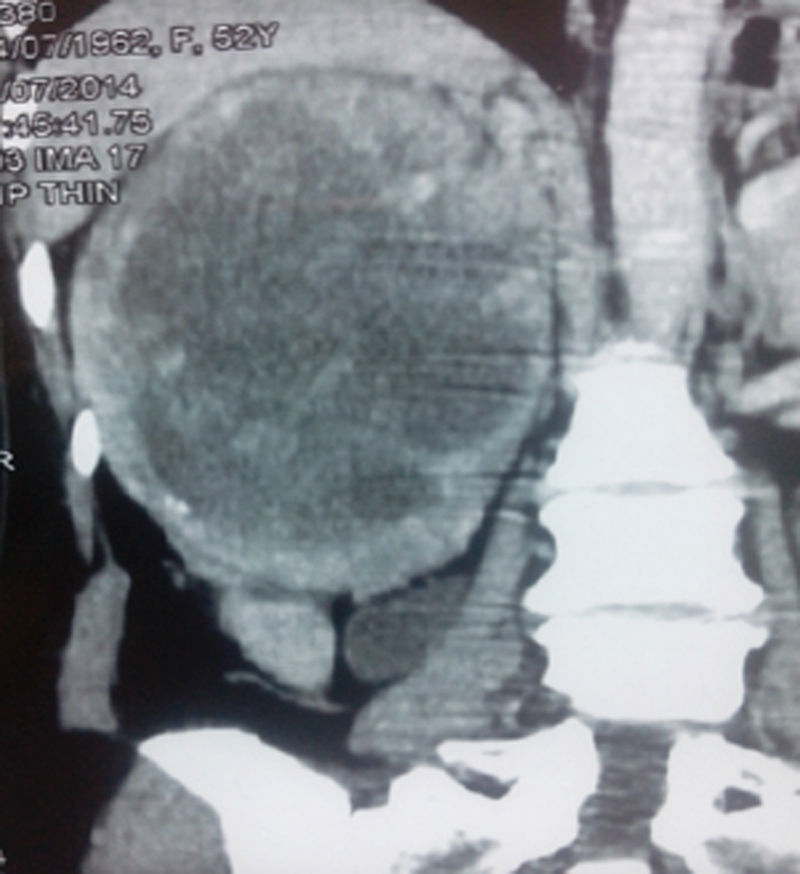
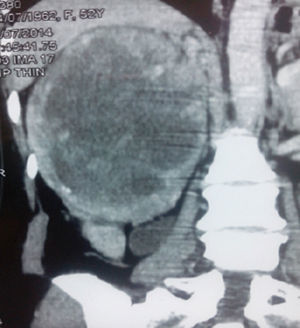
En la tomografía computarizada se observó tumor de 223×190mm dependiente del polo superior del riñón derecho, encapsulado, con tenue trabeculado captador de contraste y amplia necrosis central (20UH). La tumoración contacta con el pedículo vascular, sin signos de infiltración, manteniendo un adecuado plano de clivaje en el borde hepático. No se observó adenopatías retroperitoneales (fig. 1). La radiografía de tórax no mostró lesiones compatibles con metástasis. Los exámenes de laboratorio de rutina estuvieron en los parámetros normales.
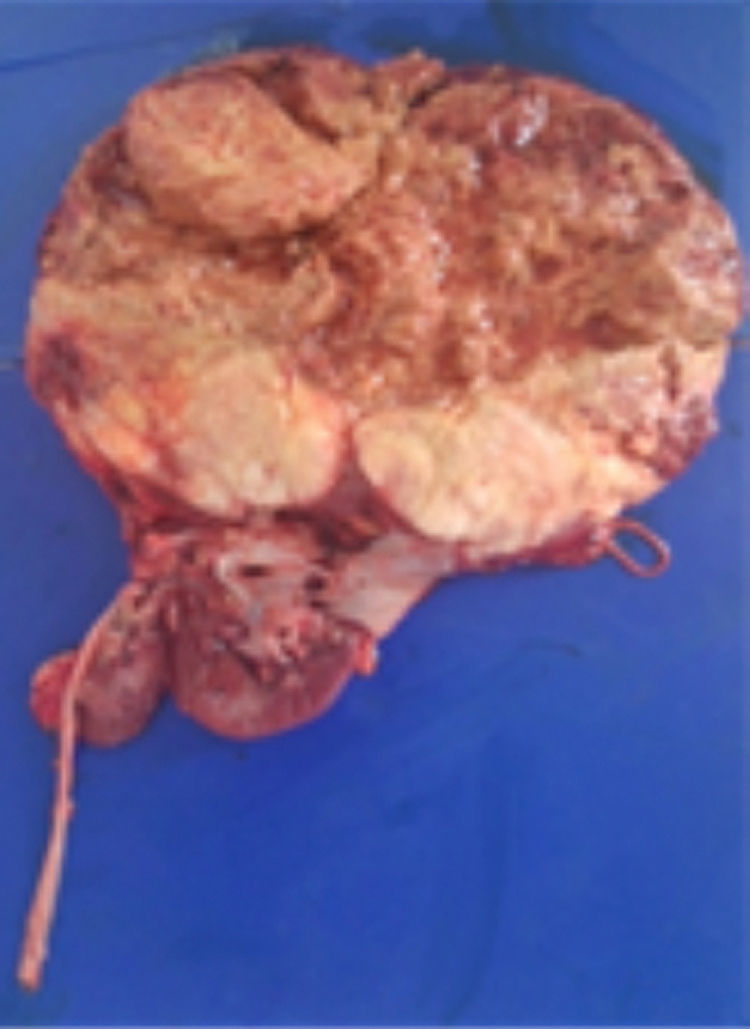
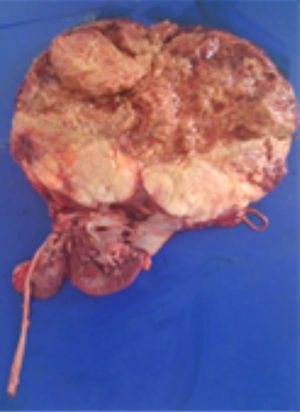
Con estos resultados la paciente fue sometida a nefrectomía radical derecha con adrenalectomía ipsilateral y disección de adenopatías retrocavas. En el laboratorio de patología se recibió espécimen quirúrgico de 1,619gr; la grasa perirrenal se encontró firmemente adherida al riñón, el mismo que tenía la superficie multinodular y de color pardo violáceo. Al corte se identificó un tumor de 20.0×18.0cm., que destruye los cálices renales e infiltra la cápsula renal, la grasa perirrenal y el seno renal. El tumor era de color pardo claro, con áreas de hemorragia y necrosis. El uréter era de 14.0x6.0cm y la glándula suprarrenal de 5.0×1.8cm, sin alteraciones macroscópicas significativas. Además se recibió un ganglio retrocavo de 3.5cm congestivo (fig. 2).
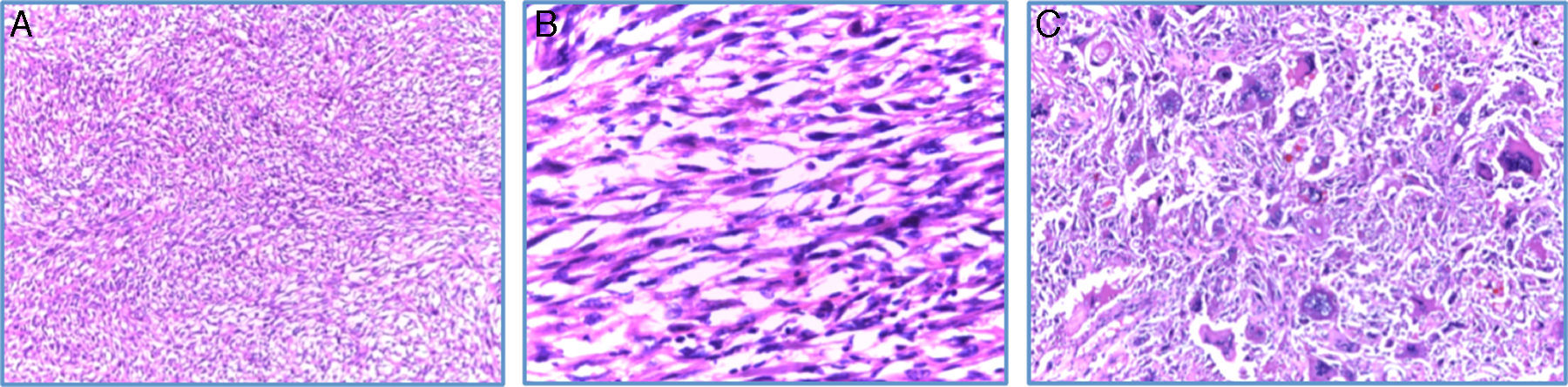
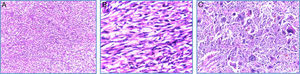
En la microscopia se observó una neoplasia maligna fusocelular de tipo sarcomatoide, pleomórfica, con células gigantes multinucleadas, alto índice mitótico (12-15 mitosis/10CAP), necrosis tumoral y embolia vascular. La neoplasia infiltra la cápsula renal, la grasa renal y el seno renal. El uréter, la glándula suprarrenal y el borde quirúrgico están libres de neoplasia. El ganglio retrocavo también está libre de neoplasia (0/1) (fig. 3A-C).
Microscopia (H-E): A. 10×. Vista panorámica del tumor renal en el que se observa proliferación neoplásica fusocelular con patrón de crecimiento estoriforme. B. 40×. Microfotografía a mayor aumento, en la que se observan células fusiformes malignas en relación con sarcoma. Nótese la hipercromasia nuclear. C. 100×. Detalle a alto poder, células pleomórficas gigantes con multinucleación.
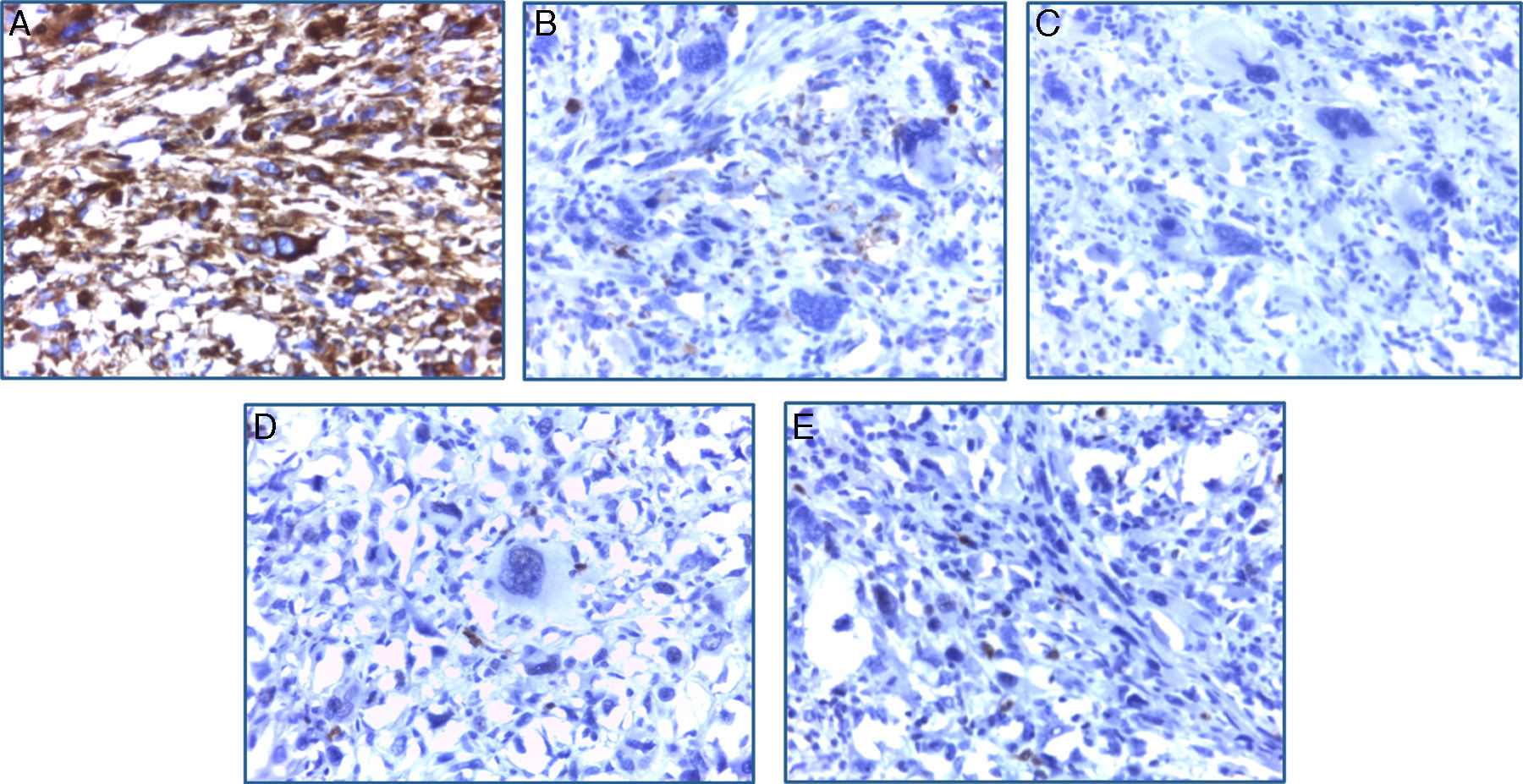
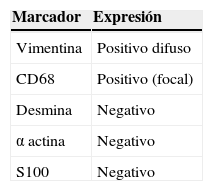
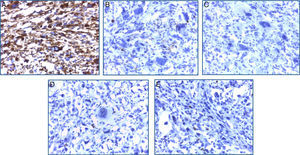
El estudio inmunohistoquímico mostró positividad difusa para vimentina y focal para CD68, confirmando la naturaleza mesenquimal de la neoplasia; el resto de marcadores específicos para otros linajes celulares fueron negativos (tabla 1). Con estos resultados se concluyó como diagnóstico: sarcoma indiferenciado pleomórfico primario renal, variedad células gigantes (fig. 4A-E).
La paciente toleró el acto quirúrgico y fue dada de alta al séptimo día postoperatorio. Tres meses después reingresó en el instituto por presentar disnea de leve y mediano esfuerzo, sin tolerancia al decúbito. En la radiografía de tórax se observó un tumor macronodular en la región parietocostal derecha, asociado a derrame y atelectasia compresiva. La paciente se deterioró progresivamente, falleciendo por compromiso multisistémico.
DiscusiónLos sarcomas primarios de riñón son neoplasias de origen mesenquimal muy infrecuentes, que representan entre el 1% y 3% de los tumores malignos en este órgano1,2,5. Según su tipo histológico se han descrito casos de leiomiosarcoma, rabdomiosarcoma, liposarcoma, angiosarcoma, sarcoma pleomórfico, sarcoma sinovial y osteosarcoma4,7,10–12. El más común de estos tumores es el leiomiosarcoma, que representa entre el 40% y 60% de los casos publicados2,3.
El SIP, antes llamado fibrohistiocitoma maligno pleomórfico5,13, es una variante inusual, con alrededor de 60 casos publicados en la literatura mundial, la mayoría del siglo pasado, no encontrando en la revisión bibliográfica reportes nacionales1,7. No existen criterios definidos para el diagnóstico de sarcoma renal primario, sin embargo se sugieren los siguientes: 1) no tener antecedentes de sarcoma en otra localización anatómica (exclusión de metástasis); 2) un estudio macroscópico que demuestre el origen renal de tumor; 3) la exclusión del diagnóstico de carcinoma renal de patrón sarcomatoide; y 4) de existir una metástasis, esta debe ser más pequeña que el tumor renal2,13,14. Su origen aún sigue siendo desconocido, la hipótesis más aceptada es la que considera las células mesenquimales pluripotenciales como sus precursoras1,6,9. Otra teoría aceptada es la que involucra las células del sistema fagocítico mononuclear15–17.
El SIP primario de riñón ocurre principalmente en adultos entre la quinta y séptima décadas de la vida y compromete a ambos sexos por igual1,16,18. La clínica es inespecífica, y por lo general depende del tamaño tumoral. El síntoma inicial es el dolor en el flanco comprometido asociado a pérdida de peso, como se describe en el caso que presentamos; también se reportan fiebre, masa palpable y más raramente hematuria15,18,19.
Los estudios de imagen permiten orientar sobre la composición, densidad, extensión y su relación con órganos y estructuras adyacentes15. La radiografía abdominal presenta aumento de densidad con efecto de masa al nivel del flanco comprometido, y la ecografía permite identificar la localización, el tamaño y la estructura renal interna15. Aunque el SIP es indistinguible tanto clínica como radiográficamente del carcinoma renal, usando imágenes de mayor resolución, como la tomografía computarizada y la resonancia magnética se puede orientar el diagnóstico14,15,20. Se han descrito características radiológicas sugestivas de SIP: 1) tumores con varias intensidades de señales en resonancia magnética; 2) tumores hipovasculares o avasculares en la angiografía; 3) tomográficamente presencia de áreas hipodensas (degeneración quística) e hiperdensas (calcificaciones); y 4) tumores mayores de 10cm que no invaden la vena renal ni la cava; estos últimos criterios presentes en nuestro caso6,15.
El diagnóstico definitivo es histológico, con confirmación inmunohistoquímica6,18. El riñón más afectado es el izquierdo1, a diferencia de nuestro caso, que fue el derecho. Los SIP renales son de gran tamaño y presentan características similares a los sarcomas de partes blandas: son multilobulados, de color amarillo grisáceo, pobremente encapsulados, con extensas áreas de hemorragia y necrosis7,13. Microscópicamente se caracterizan por presentar células fusiformes muy pleomórficas, multinucleadas, que se entremezclan con fibroblastos y macrófagos13,18. La actividad mitótica es intensa, identificándose infiltrado inflamatorio y áreas de necrosis15,16. Se describen 5 variantes histológicas, que en orden de frecuencia son: estoriforme-pleomórfico, mixoide, de células gigantes, inflamatorio y angiomatoso1,6,13. Desde el punto de vista inmunohistoquímico el diagnóstico es de exclusión, utilizando el panel de marcadores clásico para sarcomas de partes blandas3. Lo más importante es la negatividad de las reacciones para linajes celulares específicos y la positividad intensa para vimentina y variable para CD68, quimiotripsina, Leu-M3 y otros marcadores histiocíticos7,15,18. El estudio histológico del caso que reportamos presenta características morfológicas de sarcoma de alto grado, en el que predominan las células gigantes multinucleadas. La marcación positiva para vimentina y CD68 confirman la naturaleza mesenquimal del tumor, siendo negativos los otros marcadores utilizados para determinar el linaje específico.
El diagnóstico diferencial incluye lesiones benignas como la pielonefritis xantogranulomatosa y malignas como el carcinoma renal sarcomatoide y otros tipos de sarcoma6,13,14. En el caso específico de la variedad células gigantes debemos distinguirla del leiomiosarcoma de células gigantes osteoclásticas, el carcinoma indiferenciado tipo osteoclastoma y el carcinoma indiferenciado tipo células gigantes; enfermedades muy inusuales en el riñón, que tienen morfología e inmunofenotipo propios16. Se han identificado como factores asociados a pobre pronóstico: edad añosa, tamaño tumoral, profundidad de infiltración, necrosis tumoral, alto índice mitótico y metástasis a distancia14,17. El componente inflamatorio y el grado histológico también han sido incluidos1,19. En el reporte que presentamos identificamos la mayoría de los factores descritos.
El SIP es un tumor agresivo, de pobre pronóstico, que tiene la cirugía radical como primera línea de tratamiento con intención curativa14,16,17,20. La recurrencia local es alta, entre el 50% y el 82%, en un rango temporal de 3 a 24 meses después de la cirugía7,15,18. Está asociado a metástasis pulmonar en el 82% y ganglionar en el 32%1; con menos frecuencia también se afectan el hígado, el hueso y la médula ósea15. La utilidad de la quimioterapia y la radioterapia no está definida, debido al pequeño número de casos reportados14,16; sin embargo, en algunos artículos la quimioterapia ha demostrado un ligero beneficio en la supervivencia, posterior al tratamiento quirúrgico (10 a 18 meses libres de enfermedad)18,20. Por el contrario, la radioterapia adyuvante no ha demostrado resultados beneficiosos18. La mortalidad es alta, aproximadamente del 66% a los 2 años posterior a la nefrectomía radical1.
ConclusiónEl SIP primario renal variante células gigantes es una neoplasia rara, altamente agresiva, de pobre pronóstico, cuyo diagnóstico preoperatorio es muy difícil. Para confirmarlo se requiere de un estudio histológico e inmunohistoquímico. La cirugía es el único tratamiento con intención curativa. La terapia adyuvante no ha demostrado beneficios.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.