Introducción: Ixabepilona es un fármaco utilizado en pacientes con cáncer de mama metastásico, del cual entre sus efectos adversos más frecuentes reportados en la literatura mundial son neutropenia y neuropatía.
Material y métodos: Se realizó un estudio retrospectivo incluyendo pacientes con cáncer de mama metastásico que recibieron ixabepilona, como monodroga o en combinación, con el objetivo de encontrar las principales toxicidades que se presentan en los pacientes con cáncer de mama en el Centro Médico Nacional "20 de Noviembre", México.
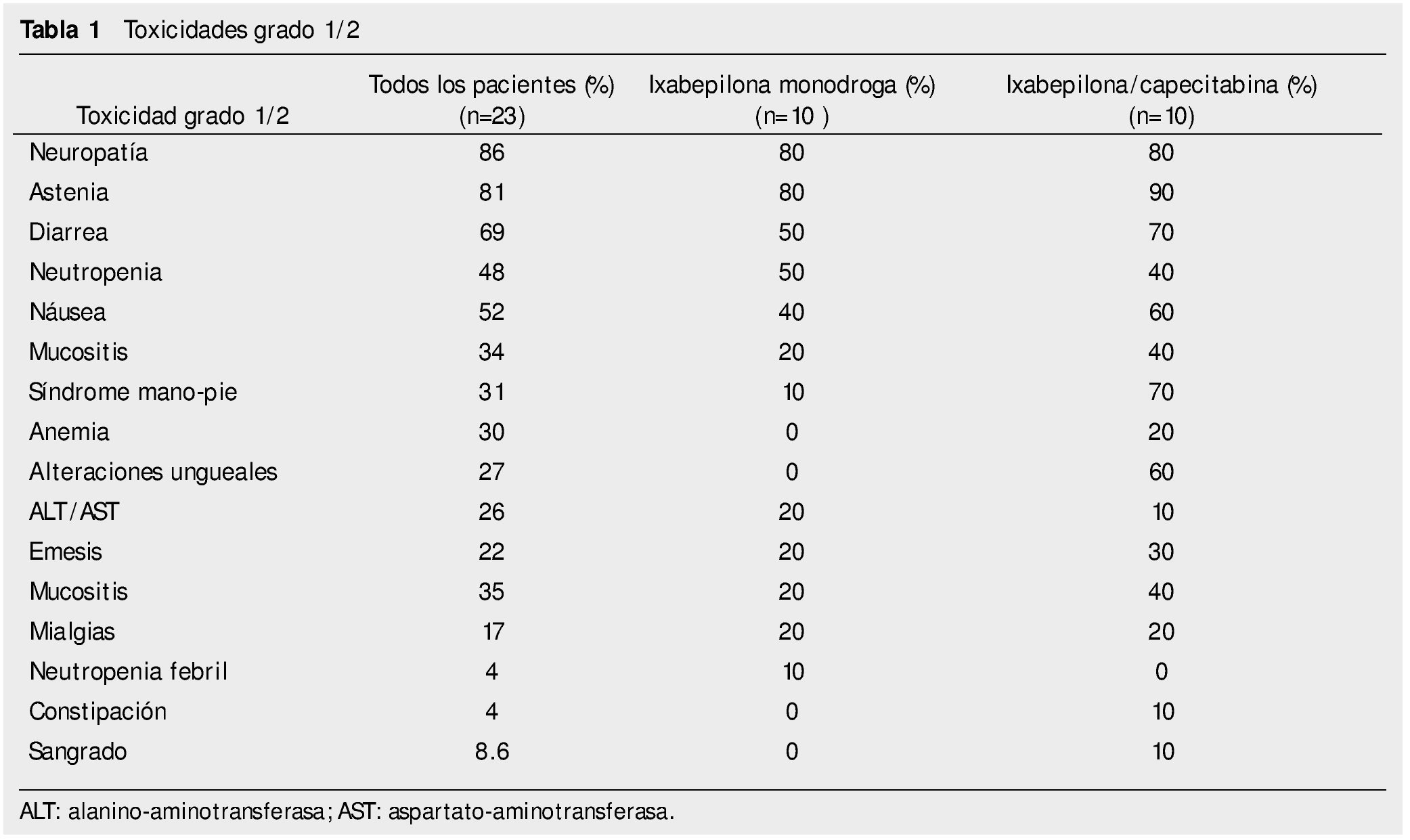
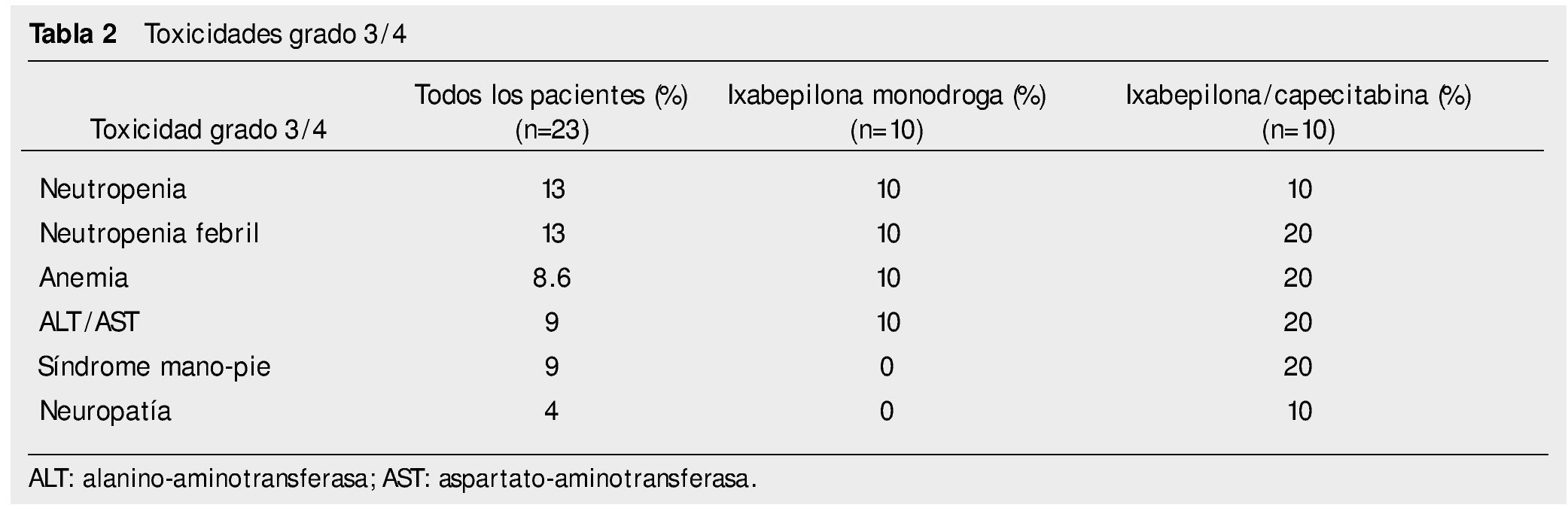
Resultados: Se encontraron: neuropatía grados 1/2 en el 86% de los pacientes y diarrea grado 1/2 en el 69% de pacientes. Las toxicidades grado 3/4 más frecuentes fueron la neutropenia y la neutropenia febril. No hubo muertes relacionadas al tratamiento.
Conclusiones: La toxicidad presentada, concuerda con lo reportado previamente en otros estudios en la mayoría de los efectos adversos.
Introduction: Ixabepilone is a drug used in the metastatic breast cancer context, amongst its most common adverse events, reported in world literature, are neuropathy and low neutrophils count.
Material and methods: This was a retrospective study including patients with metastatic breast cancer who received ixabepilone as single drug or in combination, in order to find the major toxicities occurring in patients with breast cancer at the National Medical Center "20 de Noviembre".
Results: One and 2 degree neuropathy was found in 86% of patients. One and 2 degree diarrhea was found in 69% of patients. The most common grade 3 and 4 toxicities were: neutropenia and febrile neutropenia. There were no treatment-related deaths.
Conclusions: The toxicity presented, matches the previous reports in most adverse events.
Introducción
Las epotilonas y sus análogos son fármacos que estabilizan los microtúbulos, son activos contra líneas celulares y tumores resistentes a múltiples fármacos. Si bien estabilizan los microtúbulos de forma similar a los taxanos, son estructuralmente diferentes y se unen a la microtubulina de distinta manera, lo que les confiere actividad en tumores resistentes a taxanos1.
Seguridad como monodroga
Un estudio fase 2 en pacientes con cáncer de mama metastásico previamente con antraciclinas, taxanos y capecitabina, evaluó el uso de ixabepilona 40 mg/m2 trisemanal. Se obtuvo intervalo libre de progresión (ILP) de 3.1 meses y tasa de respuesta de 11.5%. La tolerancia fue aceptable ya que los eventos adversos fueron manejables y en su mayoría grado 1/2. Las toxicidades grado 3/4 más frecuentes fueron: neutropenia 54% y fatiga 14%. El evento adverso no hematológico más frecuente fue neuropatía periférica2,3.
Seguridad en tratamientos de combinación
En estudios previos fase 3 comparando capecitabina monodroga vs. la combinación de capecitabina más ixabepilona trisemanal, reportó que la combinación obtuvo mejor ILP y fue bien tolerada con un perfil de toxicidad manejable. Los efectos adversos más comunes grado 3/4 se presentaron en el 24% de pacientes del brazo de combinación, comparado a un 0%-1% en el brazo de capecitabina monodroga. Los siguientes efectos adversos también se presentaron con mayor frecuencia en el grupo de combinación: fatiga 9%-12% vs. 3%, mialgia en 4%-8% vs. < 1%, y astenia 6%-7% vs. 1%1,2,4.
En un estudio fase 2 con ixabepilona monodroga semanal vs. trisemanal, se reportó en el grupo de tratamiento semanal toxicidades grado 3/4 en el 28%, en el grupo trisemanal fue en el 69%, e incluyeron neuropatía (11% vs. 20%), así como neutropenia (7% vs. 40%). Se alcanzó un ILP mayor en el grupo trisemanal2,5.
Otro estudio fase 2 evaluando la combinación de ixabepilona con carboplatino y trastuzumab, reportó como toxicidad hematológica más importante la neutropenia grado 3/4 en poco menos del 50%. No se presentaron eventos de neutropenia febril. Las toxicidades no hematológicas fueron en su mayoría leves. La toxicidad grado 3 más importante fue: fatiga en un 11.9% y neuropatía sensorial en un 6.8%. Sólo un paciente (1.7%) presentó toxicidad no hematológica grado 4 (trombosis/embolismo)2,6.
No existe evidencia, reportes o estudios evaluando la seguridad de ixabepilona en población mexicana. En el Centro Médico Nacional "20 de Noviembre" del ISSSTE, se cuenta con ixabepilona para pacientes con cáncer de mama avanzado desde hace varios años; el motivo de este estudio es reportar la seguridad en los pacientes del Centro Médico Nacional, lo cual se podría considerar como un reflejo de la población nacional.
Objetivo primario: conocer la toxicidad de ixabepilona trisemanal monodroga (M) o en combinación (C), en pacientes con cáncer de mama metastásico del Centro Médico Nacional "20 de Noviembre".
Material y método
Estudio retrospectivo de pacientes con cáncer de mama metastásico que recibieron ixabepilona, en el Centro Médico Nacional "20 de Noviembre" del ISSSTE.
Criterios inclusión: pacientes con cáncer de mama avanzado que recibieron ixabepilona entre mayo de 2011 a mayo de 2012 a dosis convencionales, contar con la información completa en las notas clínicas, así como reporte de estudios de laboratorio completos.
Resultados
Se incluyeron 23 pacientes, la mediana de edad fue de 55 años (rango de 37 a 69). Los sitios de metástasis al momento de iniciar el tratamiento fueron: tejidos blandos y/o óseo 35%, metástasis viscerales 65%. El estatus de receptores hormonales y Her2 fue: receptores hormonales (RH)+/HER-45%, triple negativo 22%, RH+/HER+ 17%, desconocido 4.3%. Mediana de líneas de quimioterapia previas: 3. El 95% recibió previamente antraciclinas y taxanos. Sólo un paciente fue hombre.
La mediana de seguimiento fue de 12 meses. La mediana de ciclos recibidos de ixabepilona fue de 6 (1-8). Los pacientes recibieron: ixabepilona monodroga 43%, en combinación 57% (con capecitabina 43%, con trastuzumab 9%, con bevacizumab 4%).
El 96% de los pacientes presentó algún efecto adverso grado 1/2. Las toxicidades grado 1/2 más frecuentes reportadas son: neuropatía 86%, astenia 81%, diarrea 69%; el resto se observa en la tabla 1. No se comenta la alopecia ya que se encontró un subregistro de dicho dato en los expedientes.
El 39% del total de pacientes presentó algún efecto adverso grado 3/4. Las toxicidades grado 3/4 fueron: neutropenia 13%, neutropenia febril 13%, anemia 8.6%. En la tabla 2 describen a detalle los eventos.
El 69% de los eventos de neutropenia (grados 1/3) se presentó en los primeros 2 ciclos de tratamiento (9 de 13 eventos); el resto en los ciclos 3 a 5. Se presentó neutropenia febril en 3 pacientes; 2 de ellos en el primer ciclo y uno en el tercero. Sólo se presentaron 3 eventos de neutropenia grado 3, todos en los primeros 3 ciclos. No se dieron eventos de neuropatía grado 4.
El 68% de los eventos de neuropatía periférica grado 1/3, se desarrollaron en el ciclo 3 o subsecuentes. La neuropatía periférica (grado 1/2) se registró en 8 pacientes en el primer ciclo, en 9 en el segundo, en 11 en el tercero, en 10 en el cuarto, en 9 en el quinto y en 6 pacientes en el sexto ciclo (uno de ellos grado 3). Esto tomando en cuenta que cada paciente pudo haber presentado más de un evento de neuropatía periférica. No hubo eventos de neuropatía periférica grado 4 o 5. Sólo el 5% de los pacientes que presentaron neuropatía eran portadores de diabetes mellitus.
Se requirió ajuste de dosis en el 35% de los pacientes (por neutropenia en 13%, neuropatía en 13%, y transaminasemia en 9%). Se registró un retraso en el tratamiento (de uno a 7 días) en el 27% de los pacientes, por las siguientes causas: neutropenia 18% y neuropatía 9%. Se suspendió el tratamiento en 18% de pacientes por neuropatía periférica, ya sea por ser grado 3/4 o de grado menor pero persistente.
En los pacientes que recibieron ixabepilona monodroga, la toxicidad grado 1/2 más común fue: neuropatía 80%, astenia 80%, diarrea 50%. El resto se puede ver en la tabla 1. Toxicidad grado 3 o 4: neutropenia febril 10%, neutropenia10%, anemia 10%, transaminasemia 10%.
En los pacientes que recibieron ixabepilona más capecitabina, la toxicidad más frecuente grado 1/2 fue: astenia 90%, neuropatía periférica 80%, diarrea 70%; grado 3/4 fue: síndrome mano-pie 20%, neuropatía periférica 10%, anemia 20%, neutropenia 10%, transaminasemia 20%.
Interesante fue observar que la única paciente que recibió ixabepilona con bevacizumab, presentó rectorragia y epistaxis grado 1.
No se reportaron muertes asociado al tratamiento con ixabepilona monodroga o en combinación.
Eficacia
El ILP en los pacientes que recibieron ixabepilona monodroga a 6 y 12 meses fue de 57% y17%, respectivamente. En los pacientes que recibieron ixabepilona/capecitabina, el ILP a 6 y 12 meses fue de 40% y 10%, respectivamente. Un paciente tratado con ixabepilona/trastuzumab logró un ILP de 8 meses, mientras que el paciente tratado con ixabepilona/bevacizumab fue de 4 meses.
El 48% de los pacientes recibió tratamiento posterior a la progresión a ixabepilona. El 79% de los pacientes que tuvieron progresión recibieron algún tratamiento sistémico paliativo subsecuente.
La tasa de supervivencia a un año en los pacientes tratados con ixabepilona es del 87% (20/23 pacientes) reportando 3 fallecimientos, 2 de ellos por progresión de la enfermedad a nivel visceral y el tercero por toxicidad al tratamiento posterior a la falla a ixabepilona.
Discusión
En este estudio se observaron diferencia en las tasa de toxicidad con ixabepilona sola o en combinación de forma comparativa con los estudios clásicos de la literatura internacional, una de las principales causas podría ser el hecho de que se trata de pacientes fuertemente pretratados, así como de un reporte retrospectivo, o una muestra de sólo 23 pacientes.
En el estudio actual fueron mayores los porcentajes de efectos adversos grado 1/2 con la combinación de capecitabina/ixabepilona; excepto para emesis, vómito, constipación y anemia en relación al estudio de Sparano et al. En lo relativo a toxicidad grado 3/4, resultaron comparables en cuanto a síndrome mano-pie, pero menor en este reporte en cuanto a neuropatía periférica y mayor en los eventos de anemia1. Las alteraciones ungueales (paroniquia y onicolisis), sólo se encontraron en los pacientes que recibieron capecitabina/ixabepilona.
En el estudio fase III de Thomas et al. de 2007, con la combinación capecitabina/ixabepilona, las toxicidades grado 1/2 fueron menos frecuentes que en el presente documento, a excepción de mialgias, constipación y anemia. En cuanto a los efectos adversos grado 3/4, encontramos mayor anemia y neuropatía periférica en nuestro estudio7.
La toxicidad con ixabepilona monodroga, fue mayor en los efectos adversos grado 1/2, a excepción de la náusea, en comparación a estudios previos. Asimismo, encontramos un mayor porcentaje de toxicidades hematológicas grado 3/4, especialmente anemia3,8,9.
La neuropatía periférica resultó mucho más frecuente en nuestra población respecto a estudios previos, y fue una de las razones principales de retraso o suspensión de tratamiento1,7. La neuropatía periférica es probablemente causada por la interrupción del transporte axonal, inducida por los agentes estabilizadores de microtúbulos, y en el caso de ixabepilona en estudios previos se encontraba en grado 3/4 hasta en un 25%10.
La diferencia en ILP con ixabepilona/capecitabina vs. ixabepilona podría deberse a lo pequeño y heterogéneo de la muestra del estudio, y no es posible determinar un beneficio o subgrupo de pacientes específicos para la monoterapia.
Conclusiones
La toxicidad asociada a ixabepilona en nuestra población es en términos generales aceptable. Las principales diferencias en comparación con los estudios internacionales deben ser evaluada en el contexto de pacientes fuertemente pretratados. La neutropenia y la neuropatía son los principales eventos adversos documentados, sin embargo, se debe destacar que no se presentaron muertes relacionadas al tratamiento.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
* Autor para correspondencia:
Centro Médico Nacional "20 de Noviembre".
Félix Cuevas N° 540, Colonia del Valle, Delegación Benito Juárez, C.P. 03100, México D.F., México.
Teléfono: (0155) 5200 5003.
Correo electrónico: norahildachavez@hotmail.com (Nora Chávez-Hernández).