Introducción: El cáncer de mama en México representa la primera causa de mortalidad en mujeres. Desafortunadamente, el mayor porcentaje de ellas son diagnosticadas en etapas localmente avanzadas para lo cual se requiere de complejas estrategias en el tratamiento neoadyuvante.
Material y métodos: Las pacientes incluidas al estudio fueron diagnosticadas con cáncer de mama en etapas IIB, IIIA, IIIB, IIIC y sin tratamiento previo de quimioterapia. El tratamiento consistía en 8 ciclos de docetaxel (75 mg/m2) más ciclofosfamida (500 mg/m2) con o sin trastuzumab, dependiendo de la sobreexpresión de Her2Neu, a dosis de impregnación y mantenimiento establecidas como tratamiento neoadyuvante.
Resultados: De mayo de 2009 a junio de 2010, se incluyeron 92 mujeres con cáncer de mama, de las cuales 90 reunían los criterios de inclusión, 28 mujeres Her2Neu positivo y 62 mujeres Her2Neu negativo. Las respuestas clínicas evaluadas fueron del 64% vs. 63%, respectivamente. Las respuestas patológicas completas reportadas fueron del 54% vs. 33%, a favor del grupo Her-2Neu positivo.
Discusión: En población del ISSSTE, el uso de la combinación docetaxel-ciclofosfamida como es una buena opción como tratamiento neoadyuvante. Los pacientes presentan buena tolerancia a este esquema de tratamiento.
Conclusión: La adición de trastuzumab en pacientes con sobreexpresión de Her2Neu, como es bien conocido, presenta una mejor tasa de pCR, encontrándose una respuesta similar a resultados ya publicados.
Introduction: Breast cancer in Mexico is the leading cause of death in women. Unfortunately, a significant proportion is diagnosed in advanced stages which require better strategies in the neoadjuvant treatment.
Material and methods: Patients included in the study were diagnosed with breast cancer stage IIB, IIIA, IIIB, IIIC with no previous chemotherapy treatment. The prescribed treatment consisted of 8 cycles of docetaxel at a dose of 75 mg/m2 plus cyclophosphamide at 500 mg/m2 with or without trastuzumab as per the over-expression of Her2Neu. A loading and maintenance dose were established as neoadjuvant therapy.
Results: Ninety two women with breast cancer were included from May 2009 to June 2010; ninety met the inclusion criteria: 28 with positive Her2/Neu and 62 with negative Her2/Neu. Clinical responses obtained were 64% vs. 63%, respectively. Reported pathological complete responses were 54% for the positive Her2/Neu vs. 33% of the other group.
Discussion: Combination of docetaxel/cyclophosphamide in 8 cycles as preoperative chemotherapy showed to be a good alternative to common regime based on anthracyclines to reduce the likelihood of late cardio-toxicity. The use of trastuzumab in patients with Her2neu positive is well known to achieve higher rates of a positive response.
Conclusion: The pathological response rate was similar to other studies previously reported and the regime was well tolerated.
Introducción
El cáncer de mama ocupa a partir del 2006 el primer lugar de mortalidad en mujeres mexicanas, superando al cáncer cervicouterino. La incidencia va en aumento y se estima que para el 2020 se diagnosticarán unos 16,500 casos nuevos anuales. La falta de una educación preventiva para la realización de métodos de pesquisa como lo es la mastografía anual posterior a los 40 años, dificulta la detección de cáncer de mama en etapas tempranas, presentándose un mayor porcentaje de etapas localmente avanzadas. Desde el año 2006, sólo el 22% de las mujeres mayores de 40 a 69 años se habían sometido a la realización de una mastografía en el último año1.
El cáncer de mama localmente avanzado requiere de un tratamiento multidisciplinario, en donde la primera intervención es el uso de quimioterapia. Desde la década de los 70 se conoce la sensibilidad de este tumor a la quimioterapia, sin embargo la respuesta observada no siempre es la misma en todas la pacientes. En los últimos 15 años, el conocimiento del comportamiento biológico del cáncer de mama ha contribuido a diseñar nuevos fármacos y terapias dirigidas que han aumentado la tasa de respuesta, con la posibilidad de efectuar un tratamiento quirúrgico conservador y de incrementar la supervivencia en mujeres que son diagnosticadas en esta etapa clínica.
Las antraciclinas y los taxanos son los agentes citotóxicos más activos para el tratamiento del cáncer de mama2, por lo que en estudios de neoadyuvancia es imprescindible su uso. En el meta-análisis publicado por Mauri et al. comparando quimioterapia neoadyuvante vs. quimioterapia adyuvante, reporta resultados similares en supervivencia libre de progresión y recurrencia a distancia3.
Dentro de los avances en el manejo del cáncer de mama en la última década, el descubrimiento de los receptores de crecimiento epidérmico, así como la sobreexpresión del receptor del factor de crecimiento epidérmico 2 (Her2Neu) en pacientes con cáncer de mama, fue determinante para el diseño de nuevas estrategias de tratamiento. En cáncer de mama se conoce que la sobreexpresión del Her2Neu, se encuentra en el 20% al 30% de los casos4-6. La sobreexpresión del Her2Neu en pacientes con cáncer de mama metastásico (CMM), se ha asociado con una menor supervivencia libre de progresión y supervivencia global7-11.
Trastuzumab es un anticuerpo monoclonal derivado de ADN recombinante humano, dirigido de forma selectiva al sitio de acción extracelular de la proteína del Her2Neu. Tanto en los estudios in vitro como en la experimentación animal, se ha comprobado que el trastuzumab inhibe la proliferación de las células tumorales humanas con sobreexpresión de HER2. Desde el 2001, Slamon et al. reporta en un estudio en pacientes con CMM que en la población que sobreexpresaba el Her2Neu y que recibió trastuzumab más quimioterapia, se observó un mayor beneficio en respuestas globales, supervivencia libre de progresión y supervivencia global, en comparación a la quimioterapia sola12. No obstante, en este mismo estudio se reportó que el 27% de los pacientes expuestos al trastuzumab en combinación con antraciclinas presentó toxicidad cardiaca grado 3-4, por lo que inicialmente se sugirió no utilizarlos como tratamientos combinados.
Estudios adyuvantes han comparado esquemas con doxorrubicina vs. esquemas con docetaxel, ambos con ciclofosfamida, con resultados similares planteando inicialmente la posibilidad de utilizar esquemas sin antraciclinas13. Existen también estudios adyuvantes que comparan esquemas secuenciales con antraciclinas y docetaxel combinados con trastuzumab, en pacientes con cáncer de mama Her2Neu positivo vs. esquemas con docetaxel, carboplatino y trastuzumab sin incluir antraciclinas, sin diferencias en los resultados14.
Los resultados antes mencionados soportan la utilización de trastuzumab en el ámbito neoadyuvante, en combinación con quimioterapia como una nueva modalidad de tratamiento. El estudio de Buzdar et al. fue uno de los primeros en resolver esta interrogante, al utilizar un esquema de quimioterapia neoadyuvante con 4 ciclos de paclitaxel seguido de 4 ciclos de FEC con trastuzumab semanal por 24 aplicaciones, obteniendo respuestas patológicas completas (rPC) del 41% vs. 21% a favor de trastuzumab15.
El objetivo del estudio fue evaluar la respuesta patológica en pacientes con cáncer de mama localmente avanzado, utilizando un esquema de 8 ciclos de quimioterapia neoadyuvante a base de docetaxel más ciclofosfamida, y agregando trastuzumab en pacientes con sobreexpresión del Her2Neu.
Material y métodos
Se realizó un estudio prospectivo fase II en mujeres afiliadas al Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado (ISSSTE). Este estudio fue elaborado de acuerdo a las buenas prácticas clínicas y con la aprobación del comité de ética e investigación central. Todos los pacientes proporcionaron su consentimiento informado por escrito antes de la inclusión al estudio.
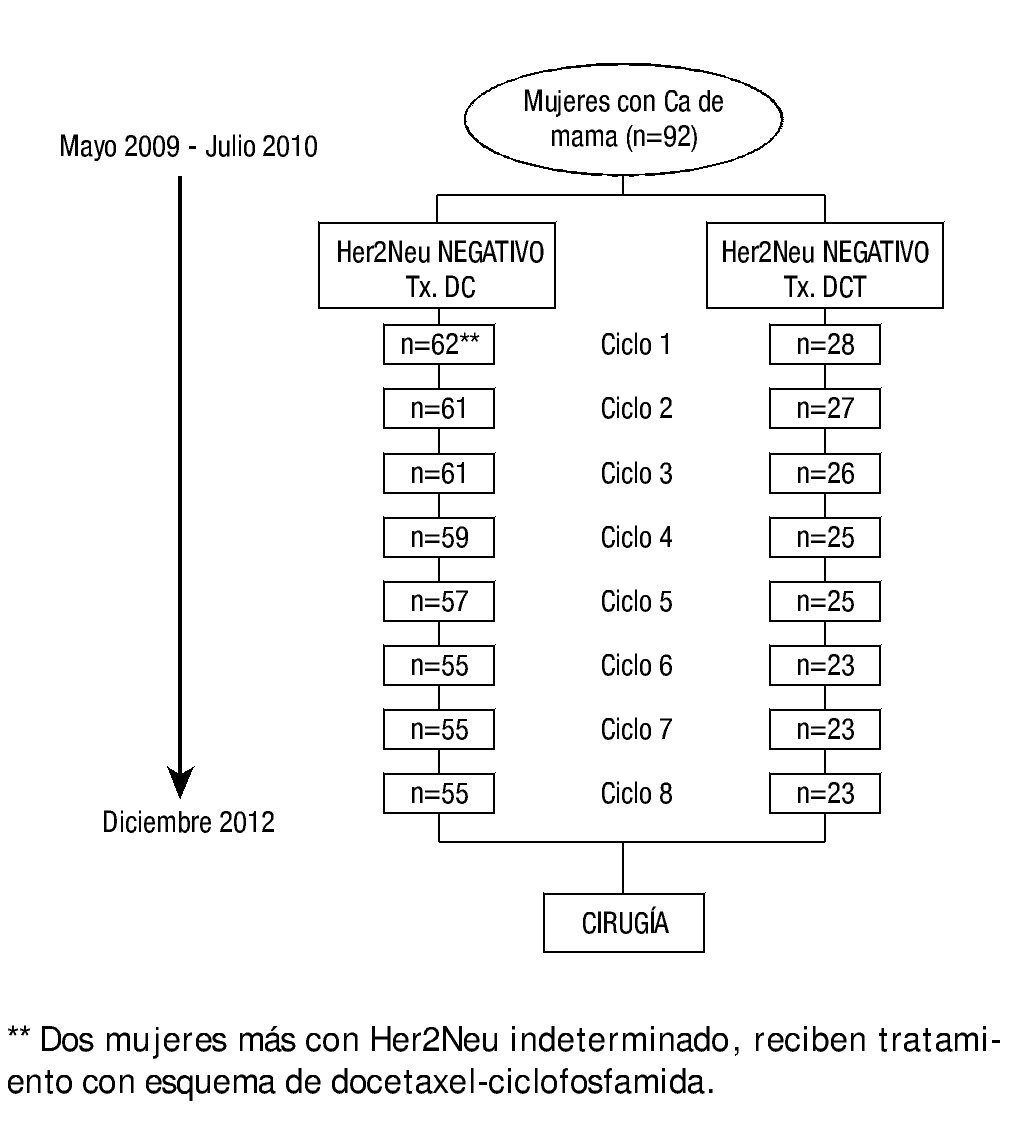
Ingresaron pacientes que reunieran los siguientes criterios de inclusión: confirmación histopatológica de carcinoma mamario con determinación de receptores hormonales y Her2Neu por inmunohistoquímica, en caso de ser Her-2Neu++, se realizó determinación de Her2Neu por el método de FISH; mujeres entre 18 y 70 años, se podían incluir mujeres mayores de 70 años a consideración del investigador; enfermedad en etapas clínicas IIB, IIIA, IIIB y IIIC sin tratamiento previo de quimioterapia; estado funcional (ECOG) 0 o 1 con una función cardiaca, hepática y renal normales. El estado del receptor Her2Neu fue negativo en 30% de las pacientes y positivo en 70%. Los receptores hormonales a estrógenos y progesterona pueden observarse para cada grupo en la figura 1. La función cardiaca fue valorada con electrocardiograma y ecocardiograma considerando una fracción de eyección del ventrículo izquierdo (FEVI) igual o mayor a 50%. Dentro los requisitos de laboratorio, la biometría hemática debería contar con neutrófilos ≥ 2.0x109/L, plaquetas ≥ 100x109/L y una hemoglobina ≥ 10 g/dL. La función renal fue evaluada por valores de creatinina sérica ≤ 1.5 mg/dL y función hepática con bilirrubina total ≤ 1ULN, AST (TGO) y ALT (TGP) ≤ 2.5 ULN y fosfatasa alcalina ≤ 5 LN; con una prueba negativa de embarazo (en orina o en sangre) obtenida dentro de los 7 días anteriores al registro, para todas las mujeres con potencial reproductivo.
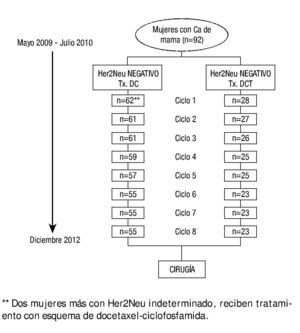
Figura 1. Descripción de la evolución de las pacientes durante el estudio.
El tratamiento consistió en 8 ciclos de docetaxel a 75 mg/m2 de superficie corporal diluida en 250 mL de solución salina al 0.9% o solución glucosada al 5%, a pasar en 45-60 minutos de forma IV el día 1, seguido de ciclofosfamida a 500 mg/m2 de superficie corporal diluida en 100 mL de solución salina al 0.9%, a pasar en 30-60 minutos de forma IV el día 1 cada 21días. En pacientes Her2Neu+++, se agregó trastuzumab a una dosis de carga de 8 mg/Kg en 500 mL de solución salina al 0.9% a pasar en 2 horas el día 1 del primer ciclo, seguido de una dosis de mantenimiento de 6 mg/Kg el día 1 a pasar en 45 a 60 minutos cada 3 semanas, los ciclos 2 al 8.
La premedicación incluía dexametasona 16 mg IV más un antiemético y antihistamínico, utilizado de acuerdo a las guías de manejo de cada centro hospitalario.
El tratamiento fue administrado durante 8 ciclos previos a la cirugía, el tratamiento se suspendió en caso de progresión de la enfermedad, aparición de toxicidad grave de acuerdo al Common Criteria Toxicity (CCT v. 12.0), y/o retiro del consentimiento informado del paciente. En la figura 1 se describe la evolución de los pacientes desde el momento del ingreso.
La respuesta clínica después de los 8 ciclos de quimioterapia se evaluó siguiendo los criterios de la OMS. El tratamiento quirúrgico para las pacientes evaluables consistía en cirugía conservadora (cuadrantectomía) o mastectomía radical modificada más disección radical de axila, una vez recuperados los valores normales de la biometría hemática y en un periodo no mayor de 6 semanas después de la administración de la última dosis de quimioterapia.
La radioterapia estaba indicada en las pacientes con cirugía conservadora, inmediatamente después de la cirugía. En las pacientes con mastectomía radical modificada, la radioterapia se administró según resultados de patología.
Se utilizó como herramienta de análisis estadístico el programa PASW® (versión 18.0). Las características demográficas de las pacientes se compararon entre los grupos mediante prueba t de student para las variables cuantitativas y ji cuadrada para las variables cualitativas. Se resumen las frecuencias de respuestas patológicas en porcentajes, de acuerdo al esquema de quimioterapia aplicado.
Resultados
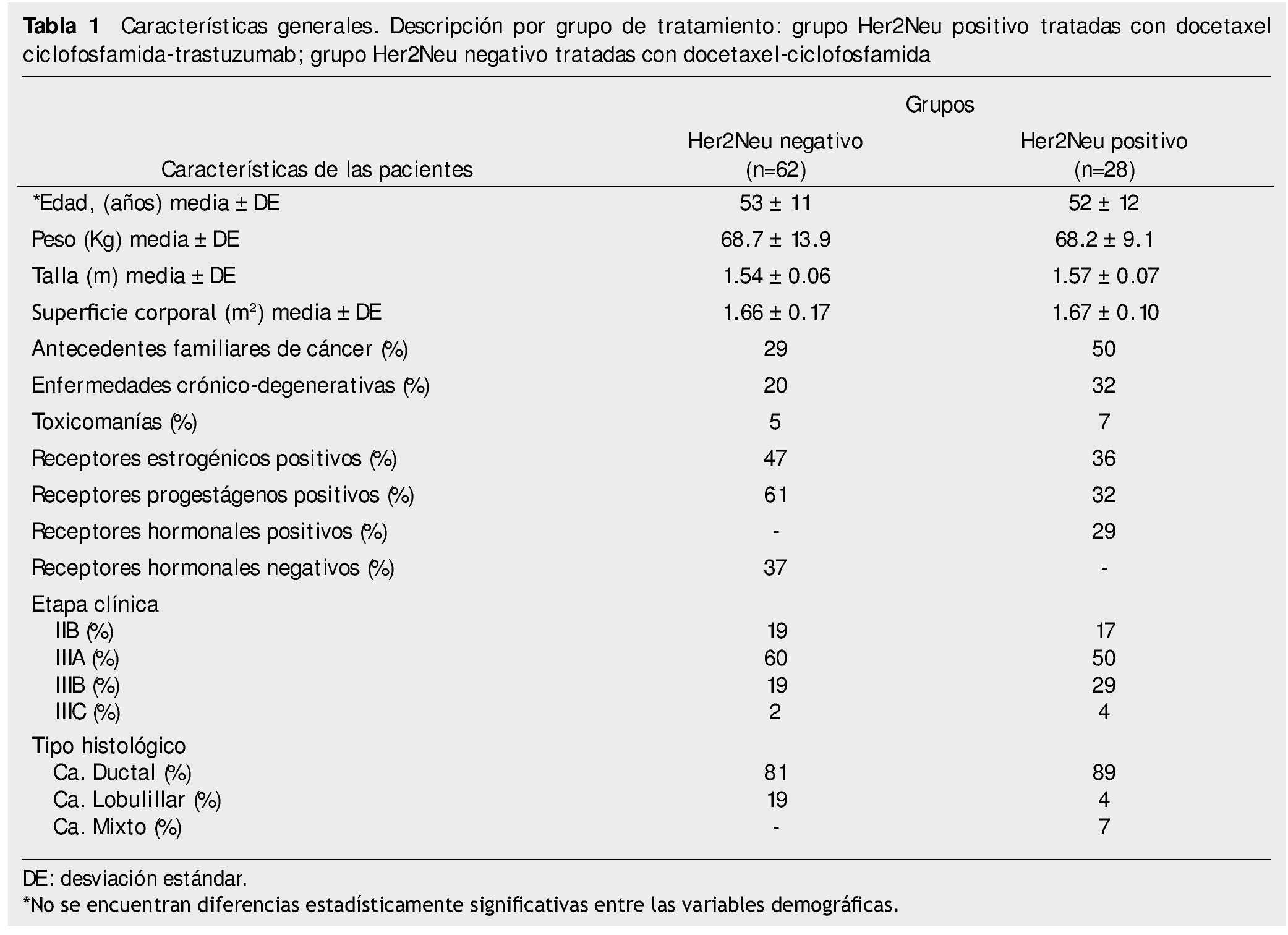
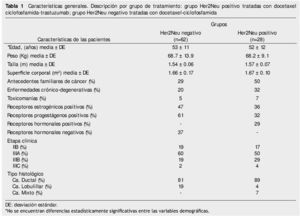
De mayo de 2009 a junio de 2010, se reclutaron 92 mujeres con cáncer de mama de las cuales 90 pacientes reunían los criterios de inclusión, y se dividieron en 2 grupos: pacientes con cáncer de mama Her2Neu positivo 28 pacientes (30%) y pacientes con cáncer de mama Her2Neu negativo 62 pacientes (70%), en este grupo se consideraron 2 pacientes con Her2Neu indeterminado. Las características de la población se describen en la tabla 1. La edad media para ambos grupos fue de más de 50 años, con una superficie corporal de 1.6 m2. La etapa clínica diagnosticada con mayor frecuencia fue la EC IIIA: 60% en el grupo Her2Neu negativo y 50% en el grupo Her2Neu positivo. El tipo histológico predominante fue el carcinoma ductal en el 81% y 89%, respectivamente.
Para la evaluación de la respuesta patológica se integró al análisis 77 pacientes que completaron el plan de tratamiento, 23 pacientes (30%) para el grupo Her2Neu positivo y 54 pacientes (70%) para el grupo Her2 negativo. El estado de receptores hormonales puede verse en la tabla 1, tanto para las pacientes Her2Neu positivo, como para las pacientes con Her2Neu negativo. Puede apreciarse que las pacientes con Her2Neu negativo, tuvieron más receptores hormonales (estrógenos y progestágenos) positivos.
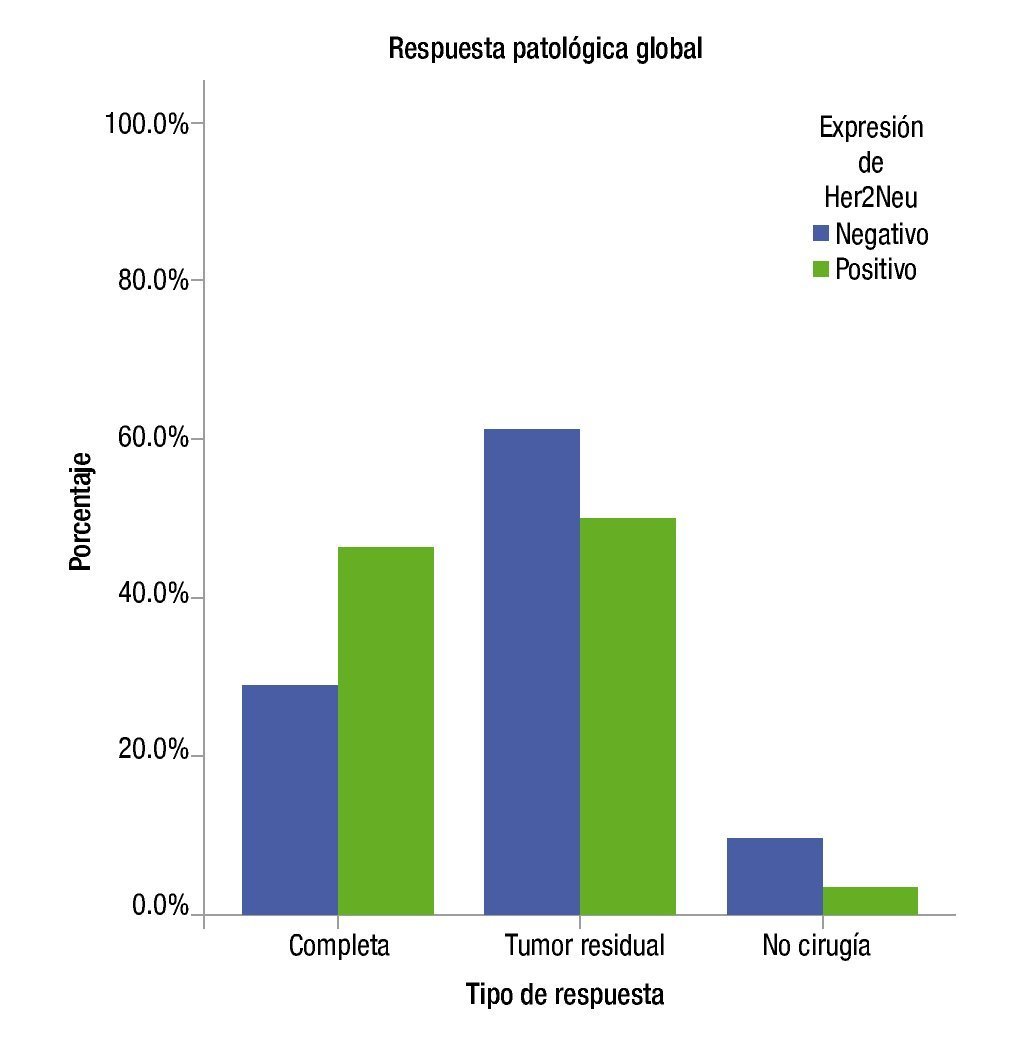
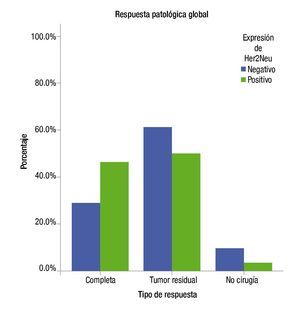
Las respuestas clínicas completas observadas fueron de 64% en el grupo Her2Neu positivo y de 63% en el grupo Her-2Neu negativo sin significancia estadística. Tampoco se observaron diferencias significativas en repuestas parciales, enfermedad estable y progresión. Las respuestas patológicas completas fueron del 54% en el grupo Her2Neu positivo vs. 33% para el grupo Her2Neu negativo (tabla 2) (fig. 2).
Figura 2. Resultados de patología.
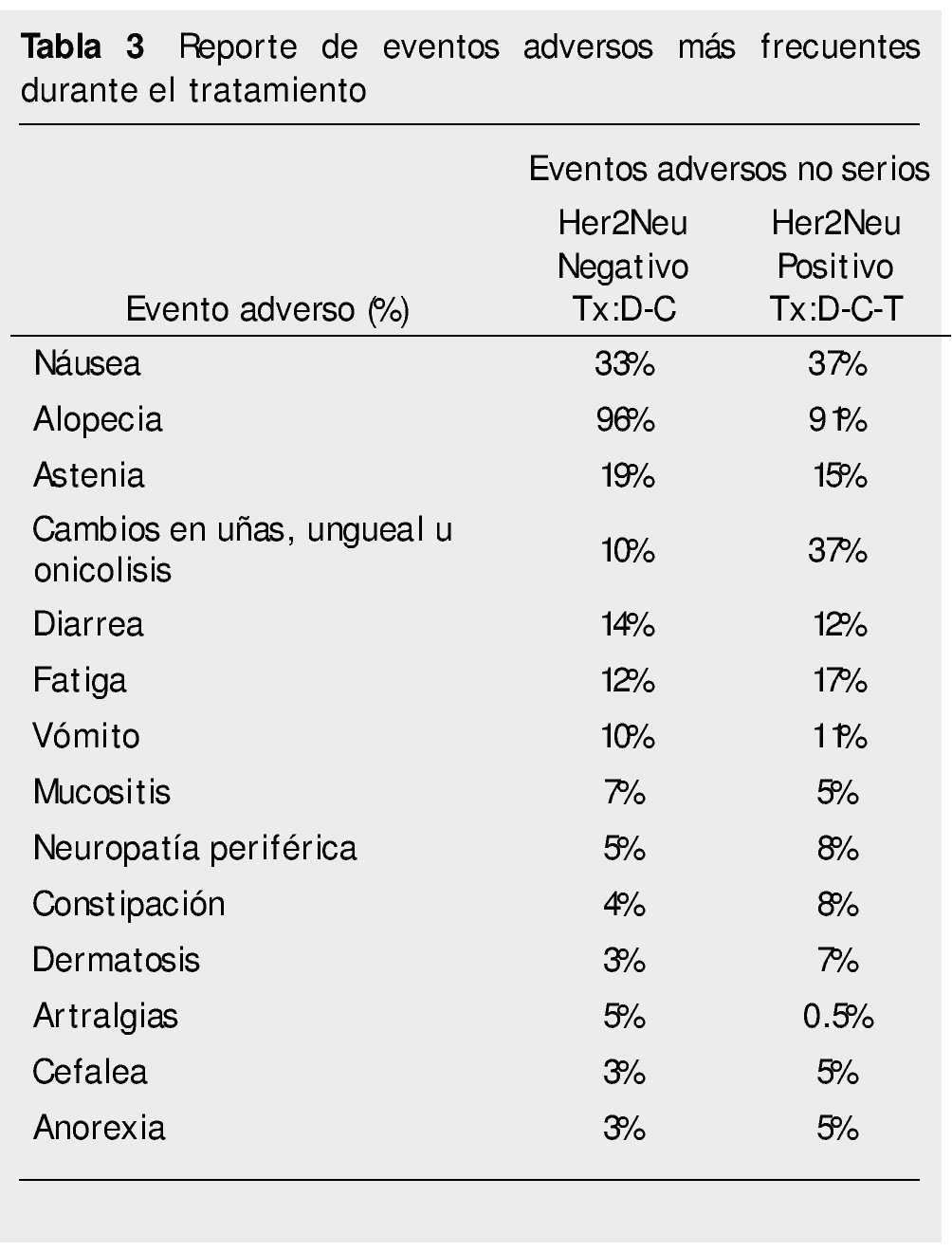
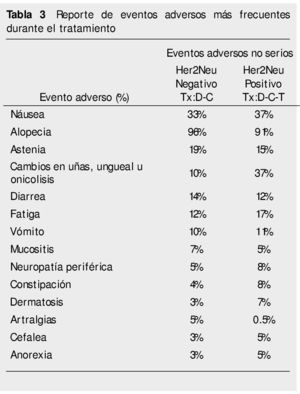
Se detectaron 3 reportes de eventos adversos serios: en el grupo Her2Neu positivo se presentó un caso de crisis hipertensiva en el ciclo 2 y 6, siendo motivo de eliminación de la paciente y un caso de neutropenia severa en el ciclo 7, que remitió con tratamiento; en el grupo Her2Neu negativo se presentó un caso de neutropenia severa en el ciclo 4 que remitió con tratamiento médico. No se presentaron casos de cardiotoxicidad durante el desarrollo de este estudio, como está reportado para los pacientes con empleo de antraciclinas. Otros eventos adversos presentados se describen en la tabla 3.
Discusión
En el cáncer de mama localmente avanzado, el tratamiento sistémico neoadyuvante se ha convertido en una estrategia valiosa dentro del tratamiento multidisciplinario. Si bien hoy en día los fármacos más activos para el tratamiento de cáncer de mama lo constituyen las antraciclinas y taxanos, las respuestas patológicas completas que se obtienen con la combinación no son mayores al 26% y con antraciclinas solamente el 13%16. Con el descubrimiento de la sobreexpresión del factor de crecimiento epidérmico 2 como factor pronóstico negativo, ha permitido el uso de terapias blanco como el trastuzumab en el ámbito neoadyuvante. Teniendo en cuenta la cardiotoxicidad conocida al combinar trastuzumab con doxorrubicina, se buscaron alternativas con el uso secuencial o combinaciones diferentes. En cáncer de mama en el escenario adyuvante, estudios recientes han demostrado la misma efectividad al dar esquemas basados en antraciclinas en combinación con ciclofosfamida vs. esquemas con docetaxel más ciclofosfamida, es por ello que en este estudio se planteó dar una combinación de docetaxel más ciclofosfamida como tratamiento neoadyuvante preoperatorio. En el estudio de ABCSG-14 se compararon 3 vs. 6 ciclos de tratamiento, combinando epirrubicina más docetaxel como terapia neoadyuvante, las rPC que se reportaron fueron del 18.6% vs. 7.7% a favor de 6 ciclos, concluyendo que 6 ciclos incrementan la probabilidad de presentar una rPC17. Con base en lo anterior, en el presente estudio se administraron 8 ciclos de quimioterapia neoadyuvante esquema basado en los hallazgos de Buzdar et al.15, donde empleó 8 ciclos de tratamiento en neoadyuvancia con mejores respuestas, seguido de cirugía sin tratamiento adyuvante y sólo se continuó el tratamiento adyuvante con trastuzumab durante un año en el grupo Her2Neu positivo. Las pacientes con Her2Neu positivo lograron una respuesta patológica completa del 46% vs. 29% con Her2Neu negativo, entendido por el uso de trastuzumab.
No existen estudios en población mexicana con este esquema de quimioterapia propuesto. La intención de dar 8 ciclos de quimioterapia neoadyuvante es propuesto por el Consenso Mexicano de Oncología, este esquema pretende lograr una reducción máxima del tumor previo a la cirugía y posteriormente la terapia adyuvante podrá continuarse a juicio del investigador y de los resultados de patología.
Las pacientes que expresan el receptor Her2Neu positivo y son tratadas con la combinación docetaxel-ciclofosfamida-trastuzumab, presentan una proporción de respuestas patológicas completas mayor (55%), mientras que las pacientes que no lo expresan y se tratan solamente con una combinación docetaxel-ciclofosfamida (33%). Estos resultados son de suma importancia para nuestra experiencia debido a que estudios previos han demostrado que alcanzar una respuesta patológica completa, puede reflejarse en una mayor sobrevida global de las pacientes y un intervalo libre de enfermedad más prolongado.
Los resultados son muy similares a lo descrito en la literatura y actualmente con base en la información de estudios retrospectivos, se conoce que las pacientes que logran una respuesta patológica completa, son el subgrupo de pacientes que pueden beneficiarse en términos de supervivencia global.
Conclusiones
En pacientes derechohabientes del ISSSTE, la combinación de tratamiento docetaxel más ciclofosfamida es bien tolerada por las pacientes y una buena opción de tratamiento neoadyuvante sin empleo de antraciclinas.
El empleo de terapias dirigidas de acuerdo a la expresión de marcadores como el Her2Neu positivo, representa una mayor probabilidad de lograr una tasa de respuesta positiva con un esquema de quimioterapia neoadyuvante durante 8 ciclos de tratamiento.
La combinación docetaxel-ciclofosfamida y/o trastuzumab de acuerdo a la expresión de Her2Neu logra buena tasa de respuesta patológica completa, similar a las observadas en otros estudios; con la ventaja de que al no utilizar antraciclinas puede beneficiar a las pacientes al reducir la probabilidad de presentar toxicidad cardiológica tardía.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
Agradecimientos
Se agradece la colaboración de los siguientes investigadores para la realización de este estudio: Cepeda-López RF, Gutiérrez-Morales MA, Jiménez-Cervantes C, López-Sánchez JC, Sauza-Aguilera FJ, Velasco-Rodríguez JC, Cervantes-Sánchez G, Jefe Servicio Oncología Médica del CMN 20 de noviembre ISSSTE, Torrecillas-Torres L, Jefe de la Sección de Quimioterapia del CMN 20 de noviembre ISSSTE.
* Autor para correspondencia:
Centro Médico Nacional "20 de Noviembre".
Félix Cuevas N° 540, Colonia del Valle, Delegación Benito Juárez, C.P. 03229, México D.F., México.
Teléfono: 5200 5003.
Correo electrónico: auraerazo@yahoo.com.mx (Aura Erazo Valle-Solis).