EGFR mutation became one of the main therapeutic targets in lung cancer treatment. This is why Mexican experts in Molecular Biology and Oncogenetics performed a study in these mutations to contribute to the epidemiological knowledge in Mexico. In the present study, genetic and epigenetic alterations are reviewed and samples of pathology specimens were studied. Samples were taken from Mexican patients with histology confirmed lung cancer. Total DNA was extracted from lung biopsies. Statistics analysis was performed with SPSSTM. Cases from 19 Mexican states were studied. Mean age was 62.8 ± 10.5 years. No statistical difference was found among mutation positives and type tumor or presence of mutations and sex. Eighty-one (77.1%) of cases were diagnosed pulmonary adenocarcinoma and 24 (22.9%) were diagnosed with other tumors. The importance of this study is that it is the first publication on EGFR mutations in Mexico and its contribution to lung cancer mutations epidemiology in our country.
EGFR mutation became one of the main therapeutic targets in lung cancer treatment. This is why Mexican experts in Molecular Biology and Oncogenetics performed a study in these mutations to contribute to the epidemiological knowledge in Mexico. In the present study, genetic and epigenetic alterations are reviewed and samples of pathology specimens were studied. Samples were taken from Mexican patients with histology confirmed lung cancer. Total DNA was extracted from lung biopsies. Statistics analysis was performed with SPSSTM. Cases from 19 Mexican states were studied. Mean age was 62.8 ± 10.5 years. No statistical difference was found among mutation positives and type tumor or presence of mutations and sex. Eighty-one (77.1%) of cases were diagnosed pulmonary adenocarcinoma and 24 (22.9%) were diagnosed with other tumors. The importance of this study is that it is the first publication on EGFR mutations in Mexico and its contribution to lung cancer mutations epidemiology in our country.
La mutación EGFR (por sus siglas en inglés, Epidermal Growth Factor Receptor) se ha convertido en una de las dianas terapéuticas en el cáncer de pulmón. Por ello, expertos mexicanos en Biología Molecular y Oncogenética, realizaron una investigación para profundizar en el campo de las mutaciones, como una colaboración al conocimiento de la mutación EGFR en la epidemiología mexicana. En el presente trabajo, primero se revisan las alteraciones genéticas y epigenéticas; posteriormente, se presenta la investigación que evaluó una muestra por conveniencia, de pacientes con cáncer pulmonar, confirmado histopatológicamente en sus sitios de atención. El DNA total fue extraído a partir de biopsias de pulmón. Se analizaron los datos utilizando el programa estadístico SPSSTM. Se estudiaron casos provenientes de 19 estados de la República Mexicana, se incluyeron un total de 105 pacientes. La edad promedio de la muestra fue de 62.8 ± 10.5 años. No se encontraron diferencias estadísticamente significativas entre los que portaban alguna mutación y el tipo de tumor (adenocarcinoma vs. otros tumores), o presencia de mutaciones por género. Se encontró que 81 (77.1%) de los casos fueron diagnosticados como adenocarcinoma pulmonar y que 24 (22.9%) fueron diagnosticados como portadores de otro tipo de tumores. La importancia de este estudio consiste en su calidad de primera publicación sobre mutaciones EGFR en pacientes mexicanos y su aportación a la epidemiología de las mutaciones del cáncer pulmonar en nuestro país.
La mutación EGFR (por sus siglas en inglés, Epidermal Growth Factor Receptor) se ha convertido en una de las dianas terapéuticas en el cáncer de pulmón. Por ello, expertos mexicanos en Biología Molecular y Oncogenética, realizaron una investigación para profundizar en el campo de las mutaciones, como una colaboración al conocimiento de la mutación EGFR en la epidemiología mexicana. En el presente trabajo, primero se revisan las alteraciones genéticas y epigenéticas; posteriormente, se presenta la investigación que evaluó una muestra por conveniencia, de pacientes con cáncer pulmonar, confirmado histopatológicamente en sus sitios de atención. El DNA total fue extraído a partir de biopsias de pulmón. Se analizaron los datos utilizando el programa estadístico SPSSTM. Se estudiaron casos provenientes de 19 estados de la República Mexicana, se incluyeron un total de 105 pacientes. La edad promedio de la muestra fue de 62.8 ± 10.5 años. No se encontraron diferencias estadísticamente significativas entre los que portaban alguna mutación y el tipo de tumor (adenocarcinoma vs. otros tumores), o presencia de mutaciones por género. Se encontró que 81 (77.1%) de los casos fueron diagnosticados como adenocarcinoma pulmonar y que 24 (22.9%) fueron diagnosticados como portadores de otro tipo de tumores. La importancia de este estudio consiste en su calidad de primera publicación sobre mutaciones EGFR en pacientes mexicanos y su aportación a la epidemiología de las mutaciones del cáncer pulmonar en nuestro país.
Introducción
El cáncer de pulmón se caracteriza por presentar múltiples alteraciones genéticas y epigenéticas, incluyendo las que conducen a la activación de oncogenes y a la inactivación de los genes supresores de tumores1-3.
El receptor del factor de crecimiento epidermal (EGFR, Epidermal Growth Factor Receptor), forma parte de la familia del receptor de tirosin cinasa (TK), referido como HER o familia ErbB. Ésta se conforma de 4 miembros que regulan procesos tanto metabólicos como fisiológicos:
• EGFR (HER1/ErbB1).
• HER2 (ErbB2).
• HER3 (ErbB3).
• ErbB4.
Con respecto a EGFR, la actividad intracelular del TK se eleva debido a la unión de varios ligandos, que incluyen a EGF. Esta actividad los conduce a la homodimerización de 2 EGFR o a la heterodimerización del EGFR con otros componentes de la familia, generalmente HER24.
La heterodimerización con HER2 es un potente activador de EGFR TK. Por su parte, la activación del receptor TK conduce a la autofosforilación del dominio intracelular de EGFR5. En células tumorales, la actividad TK de EGFR puede ser desregulada por mecanismos oncogénicos, incluyendo mutación del gene EGFR, elevada copia de genes y sobreexpresión de la proteína EGFR6. Las mutaciones de EGFR son las más prevalentes, por lo cual, se cree que representan eventos genéticos muy tempranos que conducen al desarrollo de cáncer de pulmón7,8.
Por su parte, las mutaciones del dominio cinasa en el EGFR se denominan "mutaciones activadoras", porque conducen a una activación ligando-independiente de la actividad TK. Las mutaciones activadoras del gene EGFR se encuentran en los exones 18 al 21 del dominio TK. Éstas caen en 3 clases mayores9,10.
Las mutaciones clase I son deleciones en ventana, en el exón 19; estas deleciones generalmente incluyen residuos de aminoácidos leucina-747 a ácido glutámico-749 (ΔLRE), y representan aproximadamente el 44% de todas las mutaciones del EGFR TK11.
Las mutaciones clase II son sustituciones de un solo nucleótido que alteran un aminoácido. La mutación predominante de un solo punto es en el exón 21, que sustituye una arginina por una leucina en el codón 858; éste, el L858R, suma casi el 41% de todas las mutaciones activadoras de EGFR TK11.
Otras mutaciones activadoras de clase II, resultan en una glicina-719 (G719) que cambia a serina, alanina o cisteína, y que constituye el 4% de todas las mutaciones activadoras EGFR TK11.
Las mutaciones clase III son duplicaciones en marco y/o inserciones en el exón 20. Éstas representan el restante 5% de las mutaciones activadoras del EGFR TK11.
Una inadecuada activación de EGFR TK resulta en una supervivencia aumentada de las células malignas, proliferación, invasión y metástasis. La sobreexpresión de EGFR se observa en tumores de más del 60% de los pacientes con cáncer metastásico de células no pequeñas y se correlaciona con pobre pronóstico11.
Dado que las alteraciones descritas condicionan mutaciones y las amplificaciones génicas, permitiendo la supervivencia tumoral, EGFR se ha convertido en una de las dianas terapéuticas en el cáncer de pulmón. Cabe decir, que el EGFR forma parte de una red de señalización y representa el componente central del crecimiento, la proliferación y la motilidad celulares12.
De forma global, la frecuencia de la mutación del gen del EGFR en el cáncer de pulmón de células no pequeñas (CPCNP), es del 5%-20%; es más frecuentes en mujeres y en no fumadores, con histología de adenocarcinoma y pertenecientes a la raza asiática12.
La evidencia es cada vez mayor, en el sentido de que las mutaciones en EGFR son favorables marcadores de pronóstico de supervivencia, así como en relación a que constituyen marcadores predictivos de la respuesta, en función de la reducción tumoral13. El pronóstico de los pacientes que presentan las alteraciones moleculares descritas y son tratados con terapias específicas, es más favorable comparado con el de la población general de cáncer de pulmón12.
Por lo anterior, una de las perspectivas de tratamiento actualmente más importantes, es la terapia blanco, la cual depende de la tipificación molecular de los tumores. Es necesario profundizar la epidemiología de las mutaciones en poblaciones específicas. En nuestro país se conoce la epidemiología basada en series considerables y el presente trabajo forma parte de ese esfuerzo.
Metodología
Se evaluó una muestra por conveniencia, de pacientes con cáncer pulmonar, confirmado histopatológicamente en sus sitios de atención. Los pacientes aceptaron que se enviase alguna muestra de tejido para explorar la presencia de mutaciones en el tumor. En el consentimiento informado se aclaró que las muestras no afectarían su atención y que los resultados permanecerían en forma anónima.
Extracción de DNA
El DNA total fue extraído a partir de biopsias de pulmón fijados en formol y embebidas en parafina, utilizando el kit de extracción QIAamp DNA FFPE Tissue kit (Qiagen®), de acuerdo con las instrucciones del fabricante. Las concentraciones de DNA se ajustaron a 150 ng/μL para su procesamiento.
Detección de mutaciones
El análisis de las mutaciones en EGFR se realizó con el kit EGFR RGQ PCR (Qiagen®) utilizando la plataforma de PCR en tiempo real (qPCR) Rotor-Gene Q 5plex HRM (Qiagen®). Esta metodología nos permite identificar 29 mutaciones somáticas mediante la técnica ARMS, donde las secuencias mutadas son selectivamente amplificadas y la detección de la amplificación se realizó con sondas ScorpionsTM.
Las reacciones de qPCR se realizaron en 25 μL por reacción, la cual contenía 19.5 μL de mezcla de reacción (Qiagen®), 0.5 μL de Taq DNA polimerasa (Qiagen®) y 5 μL de DNA. El programa de amplificación incluyó un paso de desnaturalización durante 15 minutos a 95°C y uno de amplificación de 40 ciclos, 30 segundos a 95°C, y 60 segundos a 60°C.
La presencia de una mutación se determinó cuando el valor ΔCT de la muestra (CT ensayo de la mutación - CT ensayo del control) era menor que el ΔCT de corte. La muestra se consideró sin mutaciones (silvestre) o que contenía cantidades menores de DNA mutado al que puede ser detectado por el kit, con un valor por arriba del corte.
Para confiabilidad de resultados, el fabricante provee en el ensayo un control positivo de mutaciones en EGFR.
Análisis estadístico
Se describieron las variables discretas con número y porcentaje, y las variables valores continuas con media y desviación estándar. Los valores no disponibles fueron sustituidos con la mediana o moda de la variable, siempre y cuando los valores perdidos no superaran al 10%. Todos los casos tenían el resultado de la presencia o ausencia de mutación.
Utilizando el programa estadístico SPSSTM, se analizaron los datos, recodificando las variables centrales. La variable "mutación" fue recodificada como presente o ausente con fines del análisis.
Se utilizó ji cuadrada para analizar variables discretas y T de Student para comparar medias.
Resultados
Se incluyeron un total de 105 pacientes, 54 (51.4%) del sexo femenino y 51 (48.6%) masculino. La edad promedio de la muestra fue de 62.8 ± 10.5, con un rango de 33 a 89 años de edad. Se analizaron casos provenientes de 19 estados de la República Mexicana; 96 (91.4%) y 9 (8.6%) no reportaron el estado de origen. Los estados que aportaron más muestras fueron: Distrito Federal con 25 (23.8%), Veracruz con 17 (16.2%) y Jalisco con 14 (13.3%).
En cuanto al consumo de tabaco, 37 (35.2) eran positivos, 51 (48.6%) negativos y 17 (16.2%) pasivos.
No se encontraron diferencias estadísticamente significativas entre los que portaban alguna mutación y el tipo de tumor (adenocarcinoma vs. otros tumores), o presencia de mutaciones por género.
Tumores reportados
El adenocarcinoma fue el tumor más frecuente (frecuencia 86, 81.9%), por lo cual se le recodificó la variable en 2 categorías, con adenocarcinoma u otros tipos de tumores. Se encontró que 81 (77.1%) de los casos fueron diagnosticados como adenocarcinoma pulmonar y que 24 (22.9%) fueron diagnosticados como portadores de otro tipo de tumores. Así, se tiene lesión pulmonar (1.0%), carcinoma epidermoide (8.6%), neoplasia de extirpe epitelial (1.9%), carcinoma de células grandes (1.9%), carcinoma anaplásico (1.0%), metástasis por cáncer bronquio-alveolar (3.8%).
Mutaciones reportadas
Se encontró que los sujetos sin mutación (79.0%), tuvieron una edad significativamente mayor que los sujetos con mutación (13.3%). El resultado asociado con la edad fue: sin mutación 65.1 ± 10.4 vs. con mutación 55.8 ±1 1.3 (T=3.5; GL 88; p=0.001).
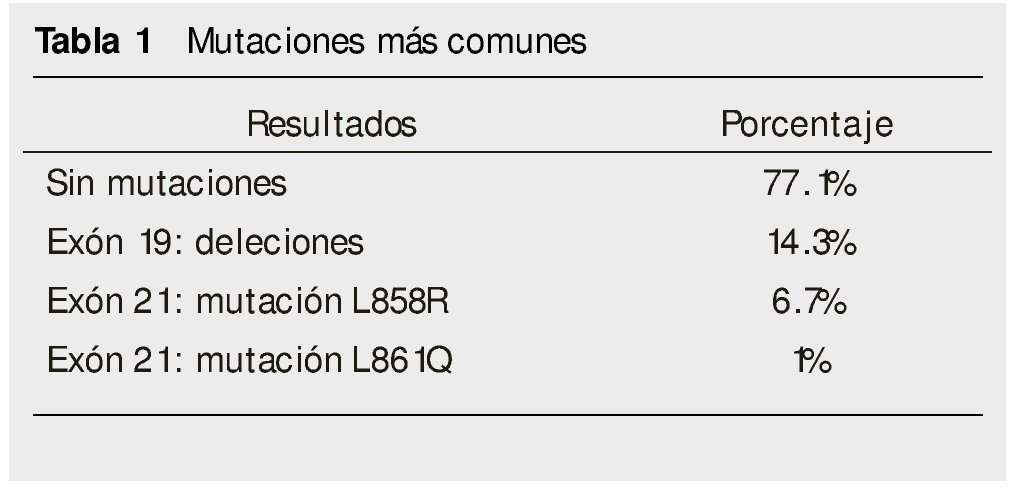
Las mutaciones más comunes identificadas fueron: las deleciones en el exón 19 con un 14.3% y la mutación L858R (6.7%), como se muestra en la tabla 1.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
* Autor para correspondencia:
Camino a Sta. Teresa N° 13, Nivel 3, Local 25.
Teléfono: 5652 0307, ext. 4128.
Correo electrónico: javier.ortiz@diagnomol.com (Javier Ortiz-Ibarra).