¿ INTRODUCCIÓN
El síndrome de lisis tumoral fue descrito por primera vez por Bedrna y Polcak en 1929 en pacientes con leucemia crónica; sin embargo, fue reconocido como entidad clínica hasta 1980 a raíz de la publicación de Cohen y colaboradores, sobre las alteraciones observadas en ocho pacientes con linfoma de Burkitt en quimioterapia.1 Al introducir el tratamiento con quimioterapia citotóxica a la práctica clínica de la oncología y la hematología se han observado varias alteraciones metabólicas importantes que se conocen como síndrome de lisis tumoral.
Este síndrome se origina por la súbita liberación de elementos intracelulares con la destrucción del tumor, y las manifestaciones clínicas aparecen al exceder la capacidad renal de excreción de varios iones y cationes, entre ellos potasio, calcio, ácido úrico, magnesio y fósforo, y su subsecuente elevación en sus concentraciones séricas.
El objetivo de este trabajo es realizar una revisión sobre el tema, enfatizando sus principales características de presentación, diagnóstico y manejo. Enfatizando que el mejor tratamiento para el síndrome de lisis tumoral es la prevención, empero, al presentarse el deterioro clínico y bioquímico requiere especial atención por especialistas en oncología para lograr su remisión y/o control con múltiples intervenciones terapéuticas.
¿ FACTORES DE RIESGO
Es importante mencionar que puede ocurrir de forma espontánea o por destrucción celular neoplásica, ocasionada por los tratamientos oncológicos, habitualmente en los primeros cinco días de iniciado, tales como: quimioterapia, radioterapia, hormonoterapia, terapia biológica (imatinib, nilotinib) e incluso esteroides, siendo este último usado como antiemético y como antineoplásico en el tratamiento de los linfomas.2-5
Los principales tumores que se han relacionado con el síndrome de lisis tumoral han sido las neoplasias hematológicas de alto grado y de importante índice de replicación, como el linfoma de Burkitt, linfomas linfoblásticos y leucemias agudas. Entre los tumores sólidos o neoplasias no hematológicas, destacan el carcinoma de pulmón de células pequeñas y no pequeñas (bronquiolo-alveolar), tumores germinales, mieloma múltiple, plasmocitomas solitarios, carcinoma de mama, ovario, hepatocarcinoma e incluso de la próstata.6-10
Los factores de riesgo identificados para desarrollar síndrome de lisis tumoral se enlistan a continuación:
1. Tipo de tumor: linfoma de Burkitt, linfoma linfoblástico, linfoma difuso de células grandes, leucemia linfocítica aguda, y tumores sólidos con alto índice de replicación
2. Volumen tumoral: enfermedad voluminosa (mayor de 10 cm), deshidrogenasa láctica más de dos veces su valor normal, leucocitos totales mayor de 25 000 en tumores sólidos, metástasis hepáticas o afección de órganos intra-abdominales
3. Función renal: insuficiencia renal previa, oliguria
4. Niveles basales de ácido úrico: mayor de 7.5 mg
5. Respuesta efectiva al tratamiento citotóxico: variable
Con base en estos factores, se estratifica a los pacientes con neoplasias, en alto, intermedio y bajo riesgo de presentar síndrome de lisis tumoral. Los de alto riesgo son casos con linfoma de Burkitt, linfoma linfoblástico y leucemia linfocítica aguda; los de riesgo intermedio son los linfomas de células grandes difusos y neoplasias de proliferaciones similares; y por último los tumores de bajo riesgo son linfomas indolentes de bajo grado y neoplasias de lenta proliferación.11,12
¿ CLASIFICACIÓN
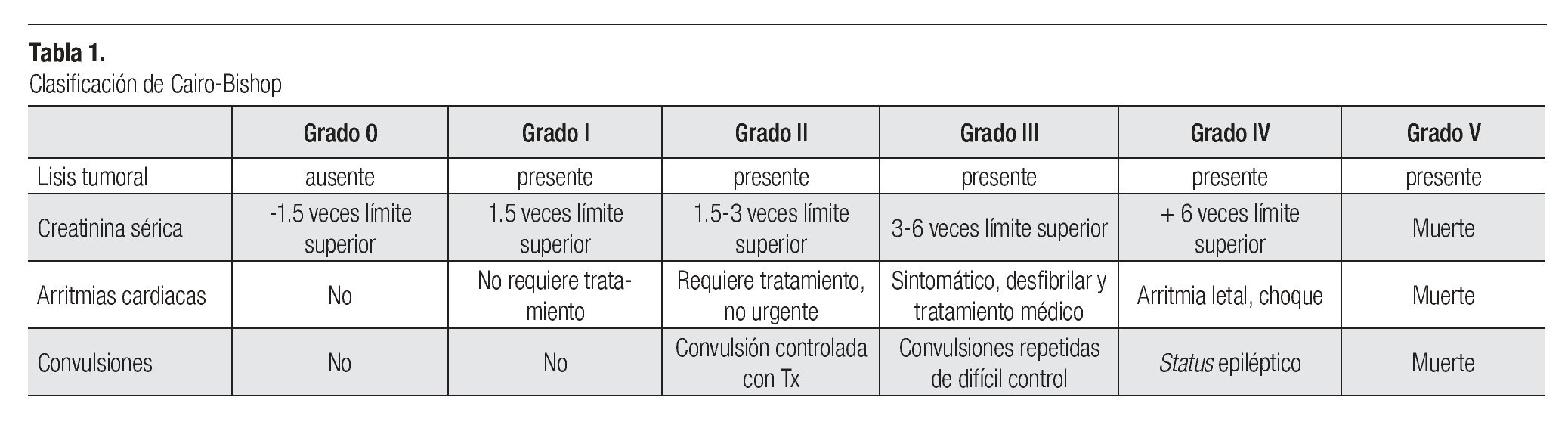
En 1993, Hande y Garrow (estudiando 102 pacientes con linfomas no Hodgkin de grado intermedio y alto) sugirieron dividir el síndrome de lisis tumoral en dos tipos, detectado clínicamente y por laboratorio únicamente. En el primer tipo los pacientes requieren tratamiento y en el segundo sólo existen alteraciones metabólicas y bioquímicas, con incremento de 25% de los valores basales de los parámetros medidos, que no necesitan intervención terapéutica; la desventaja de esta clasificación es que no toma en cuenta los pacientes con valores previamente alterados y los cambios de los primeros cuatro días de iniciada la terapia. En 2004, Cairo y Bishop propusieron una modificación a la clasificación previa; el primer grupo sin evidencia clínica ni de laboratorio del síndrome de lisis tumoral al momento de la presentación, se va a subdividir en bajo riesgo (neoplasia no hematológica, bajo volumen tumoral, baja quimiosensibilidad y cifras bajas de leucocitos y de deshidrogenasa láctica) y alto riesgo (neoplasias hematológicas, de alto grado, gran volumen tumoral, gran quimiosensibilidad, leucocitosis y cifras aumentadas de deshidrogenasa láctica). En las alteraciones de laboratorio se usan el aumento de 25% de los valores, y toma en cuenta los valores anormales que ocurren tres días antes de iniciar el tratamiento o siete días después del comienzo del mismo. En el grupo clínico se requiere la presencia de una o más de las siguientes condiciones, insuficiencia renal, arritmias/muerte súbita, y convulsiones (Tabla 1).13
¿ FISIOPATOLOGÍA
Las principales alteraciones que ocurren en el síndrome de lisis tumoral son la hiperuricemia, la hiperpotasemia, hiperfosfatemia, hipocalcemia y uremia; la hiperuricemia resulta del rápido catabolismo de ácidos nucleicos intracelulares (purinas), que son catabolizados en hipoxantina, posteriormente en xantina y finalmente en ácido úrico por la enzima xantina-oxidasa; su aclaramiento se lleva a cabo en el riñón que normalmente elimina 500 mg de ácido úrico cada 24 horas.
La hiperpotasemia se da por la incapacidad del riñón de eliminar potasio liberado por las células lisadas del tumor; esta se agrava por la uremia y la falla renal que conducen a arritmias e incluso muerte súbita.
La hiperfosfatemia se da por la rápida liberación de fósforo del interior de las células neoplásicas (las cuales tienen cuatro veces más concentración de fosfatos que las células normales). El riñón inicialmente aumenta la excreción de fósforo y disminuye su reabsorción tubular, sin embargo el mecanismo de transporte se satura y aumentan los niveles séricos de fósforo, lo cual lleva a la insuficiencia renal por la precipitación de fosfato de calcio en los túbulos renales.
La hipocalcemia puede ser asintomática o sintomática; esta resulta de la hiperfosfatemia y la precipitación de cristales de fosfato de calcio en los túbulos renales; cuando sobrepasa el nivel de 70, hay mayor riesgo de depósito de fosfato de calcio tanto en el riñón como en otros órganos, que secundariamente lleva a la hipocalcemia.
La uremia se da por varios mecanismos, el más común en el síndrome de lisis tumoral, es por la formación de cristales de ácido úrico secundario a la hiperuricemia o bien, por el depósito de fosfato de calcio, infiltración tumoral en el riñón, uropatía obstructiva asociada al tumor, nefropatía asociada a medicamentos o por sepsis.13
Hay otras entidades asociadas al síndrome de lisis tumoral, como la mielopoiesis anormal transitoria en pacientes neonatos con síndrome de Down.14
¿ MANIFESTACIONES CLÍNICAS
Generalmente los pacientes exhiben una gama de signos y síntomas asociadas a los trastornos metabólicos como náusea, vómito, diarrea, letargia, edema, retención hídrica, insuficiencia cardiaca, arritmias (taquicardia o fibrilación ventricular), convulsiones, calambres, tetania, síncope, muerte súbita, sin embargo, estas manifestaciones pueden estar presentes antes del tratamiento o bien se desarrollan entre 12 y 72 horas de iniciado el mismo.
¿ DIAGNÓSTICO
Los exámenes paraclínicos empleados en el síndrome de lisis tumoral, comprenden determinaciones séricas de electrólitos: sodio, potasio, calcio, fósforo, magnesio, así como azoados: urea, creatinina; además de la determinación de deshidrogenasa láctica, ácido úrico, biometría hemática y examen general de orina; también se indica un electrocardiograma, dado que se propician alteraciones por elevación del potasio sérico: onda T alta y picuda, arritmias o asistolia. Por último, debe determinarse el estado de los gases arteriales.
¿ TRATAMIENTO
Es importante considerar que esta entidad es considerada por varios autores como una urgencia oncológica, de tipo metabólico o relacionada al tratamiento antineoplásico. Cervantes y Chirivella, dividen las urgencias oncológicas en tres tipos: estructurales u obstructivas; alteraciones hormonales o metabólicas y secundarias al tratamiento.15
Como ya se mencionó, la mejor herramienta terapéutica para esta entidad es la prevención. Inicialmente deben considerarse a los pacientes con alto e intermedio riesgo para presentar lisis tumoral y comenzar su tratamiento 48 a 72 horas antes del tratamiento antineoplásico; además de identificar a los pacientes con lisis espontánea. Lo recomendado es tener al paciente en una unidad de terapia intensiva, con personal médico y de enfermería especializado en oncología, determinando pero corporal, signos vitales (frecuencia cardiaca, respiratoria, tensión arterial, presión venosa central y temperatura, además de uresis) cada seis horas, antes del inicio del tratamiento oncológico y con toma de muestras de electrólitos séricos ya mencionados, química sanguínea con deshidrogenasa láctica, electrocardiograma y examen general de orina, además de ultrasonido renal para valorar nefropatía obstructiva.
¿ LÍQUIDOS Y ALCALINIZACIÓN
Se aconseja hiperhidratar a los pacientes con base en soluciones parenterales, habitualmente de cloruro de sodio al 0.9%, a razón de 2000 mL/kg/día, o bien a tres litros por metro cuadrado de superficie corporal al día, a menos de que el paciente esté en falla renal establecida y con oliguria; forzar la uresis con diuréticos, de tipo osmótico o bien de asa, como manitol a razón de 0.5 mg/kg o furosemide 0.5-1.0 mg/kg, respectivamente, para mantener un gasto urinario mayor de 100 mL/m2 de superficie corporal/hora, y determinaciones de la densidad urinaria cada ocho horas, manteniendo ésta entre 1010 mOs o mayor. Las soluciones parenterales no deben llevar potasio, calcio, ni fósforo. Cabe mencionar que a pesar de este manejo agresivo, hay pacientes que presentan el síndrome de lisis tumoral. Actualmente no se recomienda utilizar la alcalinización urinaria con bicarbonato de sodio intravenoso, la cual antes se fundamentaba en que tener un pH urinario mayor de 7.0, promovía la excreción de urato (máxima solubilidad de urato con pH de 7.5).16,17 La hiperhidratación se recomienda para evitar la lesión renal aguda, (AKI, por sus siglas en inglés, acute kidney injury), que es la reducción súbita en 48 horas de la función renal por aumento en la creatinina sérica mayor de 0.3 mg/dL, o un incremento mayor de 50% o, como oliguria, a razón de menos de 0.5 mL/kg/hora por más de seis horas.18,19 Es importante mencionar que los pacientes que no responden a estas medidas convencionales, pueden ser candidatos a hemodiálisis.
La hiperuricemia (ácido úrico mayor de 8 mg/L o 476 micromoles/L), se maneja con alopurinol, primordialmente en pacientes con riesgo intermedio; es un medicamento análogo de la xantina, que inhibe competitivamente a la enzima xantina oxidasa, con lo que bloquea el metabolismo de xantina a hipoxantina, así como el paso final; la síntesis de ácido úrico. El alopurinol disminuye únicamente la formación de ácido úrico nuevo; no reduce el previamente formado antes de su administración, la cual es vía oral a razón de 100 mg/m2 de superficie corporal/dosis cada ocho horas o 10 mg/ kg/día, sin exceder 800 mg en 24 horas. Debe ajustarse esta dosis si hay insuficiencia renal y señalarse que incrementa los niveles séricos de xantina e hipoxantina. La xantina es menos soluble en la orina y se precipita en cristales, por lo que exacerba la nefropatía previa por uropatía obstructiva. Una alternativa para inhibir la formación de ácido úrico es bloqueando la xantina oxidasa con alopurinol; con ello se promueve el catabolismo del ácido úrico a la alantoína, por la acción de la enzima urato oxidasa; la alantoína es cinco veces más soluble en la orina que el ácido úrico. La urato oxidasa es una enzima que no se encuentra en los humanos, sin embargo, existen preparaciones que la tienen por la extracción no recombinante de dicha enzima proveniente del microorganismo Aspergillus flavus. Recientemente se aisló el gen que la codifica, en su forma recombinante pura: rasburicasa. Ésta se utiliza en la prevención y el tratamiento de la hiperuricemia en la lisis tumoral, principalmente en pacientes con alto riesgo; aprobada por la Food and Drug Administration (FDA) de Estados Unidos para este uso, a razón de 0.15-0.20 mg/kg/día, en infusión intravenosa para 30 minutos, dos a cuatro horas antes de la quimioterapia; debe continuarse por cinco días. Sus resultados son hasta ahora alentadores, disminuyendo el ácido úrico en 83% de los casos.20,21
El potasio sérico mayor de 6.0 mmol/L, o mEq/L, resulta de la destrucción masiva de células neoplásicas. Se maneja de dos formas: si el paciente está asintomático, se administra por vía rectal el sulfato de poliesterino sódico, (1g/kg con 50% de sorbitol); en los pacientes sintomáticos, se emplea insulina rápida 0.1 U/kg vía intravenosa, con infusión de glucosa a 25% a razón de 2 mL/kg.
La hiperfosfatemia, mayor de 6.5 mg/dL o 2.1 mmol/L, requiere tratamiento médico. Se suspende el aporte exógeno de este elemento, se proporcionan quelantes, como hidróxido de aluminio por vía oral o sonda nasogástrica a dosis de 50 - 150 mg/kg/día, cada seis horas; no se deben administrar infusiones de calcio. De no haber buena respuesta con estas alternativas, se deben considerar tanto la hemodiálisis como la hemofiltración.
La hipocalcemia menor de 7 mg/dL o 1.75 mmol/L, ocurre asociada de manera constante a la hiperfosfatemia. Para su tratamiento, en el paciente asintomático (ausencia de calambres, tetania, espasmos musculares, arritmias, confusión mental, delirio, convulsiones), se sugiere una conducta expectante. El tratamiento para los casos sintomáticos, es con base en gluconato de calcio intravenoso a razón de 50-100 mg/kg/dosis; esto propicia el inminente riesgo de aumentar su precipitación e incremento de falla renal.
Si el síndrome de lisis tumoral no responde a las medidas tanto profilácticas como terapéuticas y el paciente evoluciona con franco deterioro en las funciones renales, cardiovasculares o neurológicas principalmente, es señal de su progresión que lleva a falla orgánica múltiple y la muerte.22
¿ CONCLUSIONES
El síndrome de lisis tumoral es una urgencia en el paciente oncológico; se presenta espontáneamente o bien secundario al tratamiento antineoplásico: quimioterapia, radioterapia, tratamiento hormonal, esteroides, inmunoterapia, principalmente en los tumores hematológicos, por ende se consideran como los de alto riesgo; sin embargo, hay que sospechar su posible aparición en pacientes con factores de riesgo intermedio o aún en los de bajo riesgo si en particular se presenta deterioro clínico y bioquímico compatible con el síndrome, tales como hiperuricemia, hiperfosfatemia, hiperkalemia, e hipocalcemia, junto con falla renal o complicaciones cardiovasculares, neurológicas y metabólicas.
El mejor recurso terapéutico es la prevención. Por ello, es básico que el equipo oncológico mantenga un alto índice de sospecha y conocimiento de esta entidad, para su precoz reconocimiento y manejo.
Se necesita un abordaje multidisciplinario, encabezado por los especialistas en oncología, nefrología, medicina crítica y enfermería, para garantizar óptimos resultados, preferentemente en unidades de terapia intensiva.
Correspondencia: Dr. José Eduardo Rovelo Lima.
Bosques de Durango # 7, Santa Mónica, CP 54050. Tlalnepantla, Estado de México. México D.F. Teléfono: 5365 8719.
Correo electrónico: lalomd@gmail.com