¿ INTRODUCCIÓN
El cáncer epitelial de ovario representa la novena causa más común de cáncer en mujeres en Estados Unidos y el segundo cáncer ginecológico más común después del cáncer de endometrio. En 2009 se informó sobre 21 550 nuevos casos, lo que representó 3% de todos los tumores malignos en mujeres.
En cuanto a la mortalidad, representa la quinta causa más común de muerte por cáncer, con 14 600 muertes en 2009; esto representó 5% del total de las muertes por cáncer en mujeres.1 En México, el Reporte Histopatológico de Neoplasias Malignas de 2003 señaló 2907 nuevos casos, lo que represento 4.04% de todos los tumores malignos en la mujer; y se informó sobre 1403 muertes; cifra que representó 4.5% del total de las muertes por cáncer en mujeres.
Aunque la incidencia varía entre un estudio y otro, aproximadamente 25% de los casos se presentarán con enfermedad temprana (Etapa Clínica I-II), mientras que el 75% restante, se presentarán en etapas avanzadas (Etapa Clínica III-IV).
La tasa de supervivencia global (SG) a cinco años dependerá de la Etapa clínica (EC). La proporción es de 50% a 90% para la EC I y entre 30% a 80% para la EC II. En EC avanzadas, el pronóstico es más sombrío con una SG a cinco años de 20% a 30% para la EC III y de < 10% para la EC IV. El manejo inicial estándar consiste de una etapificación quirúrgica inicial mas cirugía citorreductora (rutina de ovario), seguido habitualmente de seis ciclos de quimioterapia (QT). Diversas series retrospectivas han demostrado que la cirugía citorreductora que deja un residual ≤ a 1 cm, se asocia con mejor pronóstico para SG. Un meta-análisis publicado por Bristow y colaboradores, que incluyó 53 estudios y 6885 pacientes en EC III-IV, mostró la importancia de realizar una citorreducción óptima, ya que por cada incremento de 10% de citorreducción se lograba un incremento de 5.5% en la SG media.2 Sin embargo, como se mencionó previamente, aproximadamente 75% de los pacientes, se presentarán con enfermedad avanzada y a pesar de que más de 80% se beneficiaran del uso de QT, la gran mayoría de ellos recaerán en un lapso de 15 meses.
¿ QUIMIOTERAPIA ADYUVANTE ETAPAS TEMPRANAS (EC I-II)
Aunque la SG a largo plazo es buena comparada con la obtenida en pacientes con enfermedad avanzada, aproximadamente 10% a 50% de las pacientes con enfermedad en etapas tempranas (EC I-II), experimentarán recaída o morirán como resultado de su enfermedad. Por esta razón se han realizado grandes esfuerzos tratando de desarrollar terapias adyuvantes que mejoren el pronóstico y la supervivencia en este grupo de pacientes. La quimioterapia adyuvante consiste en la administración sistémica de agentes quimioterapéuticos en pacientes sin evidencia clínica, radiológica ni serológica de enfermedad residual posterior a la resección quirúrgica. La decisión de administrar una terapia adyuvante dependerá del riesgo de recaída de cada paciente y esto se verá reflejado por diversos factores pronósticos descritos. Para pacientes en etapas tempranas los principales factores pronósticos son: Etapa clínica (IA-IB vs. IC vs. II), Rotura de la cápsula ovárica, Grado de diferenciación, Tipo histológico (Papilar/Endometrioide vs. Mucinoso vs. Células claras), Edad del paciente al diagnostico y Citología pélvica (positiva vs. negativa).3 Con base en esto, se han descrito dos grandes grupos de riesgo: Las pacientes con bajo riesgo de recaída: EC IA bien diferenciado (G1) en los cuales la SG a cinco años supera 95% por lo que la adyuvancia no está indicada. Por otro lado las pacientes de alto riesgo: EC IA o IB y pobre grado de diferenciación (G3) o histología desfavorable (Células claras), EC IC independientemente del grado de diferenciación y todas las EC II muestran un peor pronóstico y por tanto en estas pacientes estará indicada la terapia adyuvante. En relación a las EC IA o IB Moderadamente diferenciado (G2) el uso de QT adyuvante es aun controversial. A continuación se mencionan los estudios de QT adyuvante de mayor relevancia y que han demostrado impacto en el pronóstico de los pacientes. El estudio ICON1 evaluó el papel de la QT adyuvante en pacientes con cáncer de ovario en etapas tempranas. Incluyó a 477 pacientes que se asignaron al azar a recibir QT adyuvante basada en platino por seis ciclos (n = 241) vs. sólo observación (n = 236). Recibió carboplatino el 87%, como monodroga, a un AUC de cinco; 11% recibió el esquema CAP y 1% recibió cisplatino como monodroga, a 70 mg/m2. Con un seguimiento de 51 meses, se demostró su beneficio en SLR (SLR a cinco años: 73% vs. 62%, p = 0.01) y SG (SG a cinco años 79% vs. 70%, p = 0.03) a favor de la QT adyuvante.4 Sin embargo, en la reunión anual de la sociedad internacional de cáncer ginecológico en el 2006 se presentaron los resultados a largo plazo de SG y con un seguimiento de nueve años, se demostró que el beneficio en SG no alcanzaba significancia estadística (71% vs. 64%, p = 0.1).5 Un segundo estudio paralelo al ICON1, el ACTION, con un diseño muy similar incluyó a 448 pacientes que se aleatorizaron a recibir QT adyuvante, basada en platino (n = 224) vs. sólo observación (n = 224). Se demostró el beneficio en SLR cinco años: 76% vs. 68%, p = 0.0153 a favor del brazo de adyuvancia; sin embargo, a diferencia del ICON1 no tuvo impacto en SG a cinco años: 85% vs. 78%, p = 0.1037. En el sub-análisis de acuerdo con el tipo de cirugía realizada (óptima vs. sub-óptima) se demostró beneficio en SG sólo en aquellos pacientes sometidos a cirugía sub-óptima (SG HR 1.75 [95% IC 1.04-2.95] p = 0.03).6 Un análisis combinado de estos dos estudios (ICON1/ACTION) con un total de 925 pacientes, demostró beneficio en SLR a cinco años: 76% vs. 65% (p = 0.001) y SG a cinco años: 82% vs. 74% (p = 0.008) a favor del uso de QT adyuvante.7 Finalmente, dos meta-análisis y dos revisiones sistemáticas,8-10 confirman el papel benéfico de la QT adyuvante al mejorar tanto la SLR como la SG aunque el beneficio parece limitarse sólo a aquellas pacientes sometidas a estadificación quirúrgica sub-óptima, quedando menos claro el beneficio en pacientes con cirugía óptima. De esta forma se establece el uso de QT adyuvante por seis ciclos como un estándar en aquellas pacientes con EC I-II y factores de mal pronóstico (ej. Grado 3, Histología de células claras, entre otros). Existe un estudio que comparó el administrar 3 vs. 6 ciclos de QT basada en platino en el marco adyuvante; el GOG-157 que incluyó a 457 pacientes en EC I y II y que se aleatorizaron a recibir 3 vs. 6 ciclos de carboplatino-paclitaxel. Este estudio demuestra que no existe ninguna diferencia en SLR (Tasa de recurrencia a cinco años: 25.4% (tres ciclos) vs. 20.1% (seis ciclos) HR 0.761, 95% IC [0.51-1.13], p = 0.18; y SG a cinco años: 81% (CPx3) vs. 83% (CPx6) HR 1.02, 95% IC [0.662-1.57], p = 0.94, entre dar 3 vs. 6 ciclos. Por otra parte hubo mayor neutropenia G4, neuropatía G3-4 y anemia ≥ G2 en el brazo de seis ciclos.11 Con base en los estudios anteriores, se concluye lo siguiente, en relación al uso de QT adyuvante:
EC IA/B, Grado 1: Solamente observación
EC IA/B, Grado 2: Controversial; observación o QT con carboplatino más taxano por tres a seis ciclos
EC IA/B, Grado 3: QT con carboplatino más taxano por tres a seis ciclos
EC IC cualquier grado: QT con carboplatino más taxano por tres a seis ciclos
EC II cualquier grado: QT con carboplatino más taxano por seis ciclos
Histología células claras: QT con carboplatino más taxano por seis ciclos
Existe un claro beneficio con el uso de QT adyuvante en cuanto a mejoría de la SLR; sin embargo, es menos claro el beneficio en SG y éste parece limitarse sólo a pacientes con estatificación quirúrgica incompleta
No existen diferencias en términos de SLR y SG entre administrar tres vs. seis ciclos de QT con carboplatino más paclitaxel (GOG-157)
¿ QT EN ENFERMEDAD AVANZADA (EC III-IV)
El cáncer de ovario fue uno de los primeros tumores sólidos malignos en ser tratados con quimioterapia y los agentes alquilantes como monoterapia (ciclofosfamida, melfalán, clorambucilo) fueron el pilar de tratamiento para esta enfermedad hasta mediados de los años setentas. A partir de entonces el cisplatino se convirtió en el principal agente para el tratamiento de pacientes con enfermedad avanzada. Cinco meta-análisis publicados en la década de los noventas que incluyeron 45 ensayos clínicos aleatorizados y cerca de 10 000 pacientes, ayudaron a establecer el importante papel del cisplatino en esta enfermedad. La terapia de combinación basada en platino ha demostrado ser más efectiva que los agentes alquilantes solos o las combinaciones sin platino. El beneficio se ve reflejado al mostrar mejoría no sólo en las tasas de respuesta (parcial y completa) sino además en la SLP y SG. De tal manera que cuando los agentes alquilantes como monoterapia o combinaciones sin platino eran utilizados en el manejo del cáncer de ovario avanzado, las tasas de respuesta observadas eran en rangos de 40% a 50% (10% a 20% de respuestas patológicas completas), con una supervivencia global media de 12 a 15 meses. En contraste, aquellas pacientes tratadas con combinaciones basadas en platino las tasas de respuesta son en rangos del 60% a 80%, siendo las respuestas completas más comúnmente vistas en pacientes con adecuada terapia quirúrgica. Inicialmente el grupo de estudio del GICOG sugirió que el uso de cisplatino como monodroga era tan efectivo como las combinaciones basadas en Platino aunque con menor toxicidad, sin embargo una revisión sistemática de ensayos clínicos aleatorizados demostró la superioridad del uso de la combinación.12 Por muchos años, la terapia de combinación basada en cisplatino más ciclofosfamida fue considerada como el estándar de cuidado en pacientes con cáncer de ovario avanzado; sin embargo, a mediados de la década de los noventas, dos estudios pivote demostraron el importante papel de paclitaxel y de esta forma, estudios posteriores demostraron que la combinación de cisplatino más paclitaxel era superior a la combinación de cisplatino mas ciclofosfamida en tasas de respuesta, SLP y SG. El primero de estos estudios fue el publicado por McGuire y colaboradores (GOG-111), que incluyo a 386 pacientes; 65% eran EC III con residual > 1 cm y el 35% restante eran EC IV. Se aleatorizaron a recibir seis ciclos de cisplatino mas ciclofosfamida (n = 202) vs. cisplatino más paclitaxel (n = 184). Las tasas de respuesta fueron de 60% vs. 73% (p = < 0.001); la SLP media de 13 vs. 18 meses (p = <0.001) y la SG media de 24 vs. 38 meses (p = <0.001), todo a favor de cisplatino mas paclitaxel.13 Sólo 78% de los pacientes en el brazo de cisplatino más ciclofosfamida completó los seis ciclos de tratamiento en comparación con 87% en el brazo de cisplatino más paclitaxel; además el brazo de ciclofosfamida ameritó mayor retraso en los ciclos de tratamiento debido a toxicidad (neutropenia, neurotoxicidad y alopecia). Un segundo estudio, llevado a cabo por el Intergrupo Europeo-Canadiense (OV-10), confirmó los resultados anteriores. Tuvo el mismo diseño que el GOG-111, pero con un mayor número de pacientes, 680 con EC IIB a IV e incluyó pacientes con cirugía óptima y sub-óptima; se asignaron aleatoriamente a recibir cisplatino más ciclofosfamida (n = 338) vs. cisplatino más paclitaxel (n = 342). Se demostró un mayor beneficio en tasas de respuesta a favor de la combinación con paclitaxel (44.7% vs. 58.6% p = 0.01). A pesar de que 48% de los pacientes del brazo de ciclofosfamida se cruzaron para recibir paclitaxel, se demostró beneficio en SLP (11.5 vs. 15.5 meses p = 0.0005) y SG (25.8 vs. 35.6 meses p = 0.0016) a favor del brazo de paclitaxel.14 Hubo mayor incidencia de neuropatía sensitiva y motora, alopecia, mialgias y reacciones de hipersensibilidad en el brazo de paclitaxel mientras que el vómito fue mayor en el brazo de ciclofosfamida. De esta forma la combinación de cisplatino más paclitaxel se establece como el manejo estándar en pacientes con cáncer de ovario avanzado.
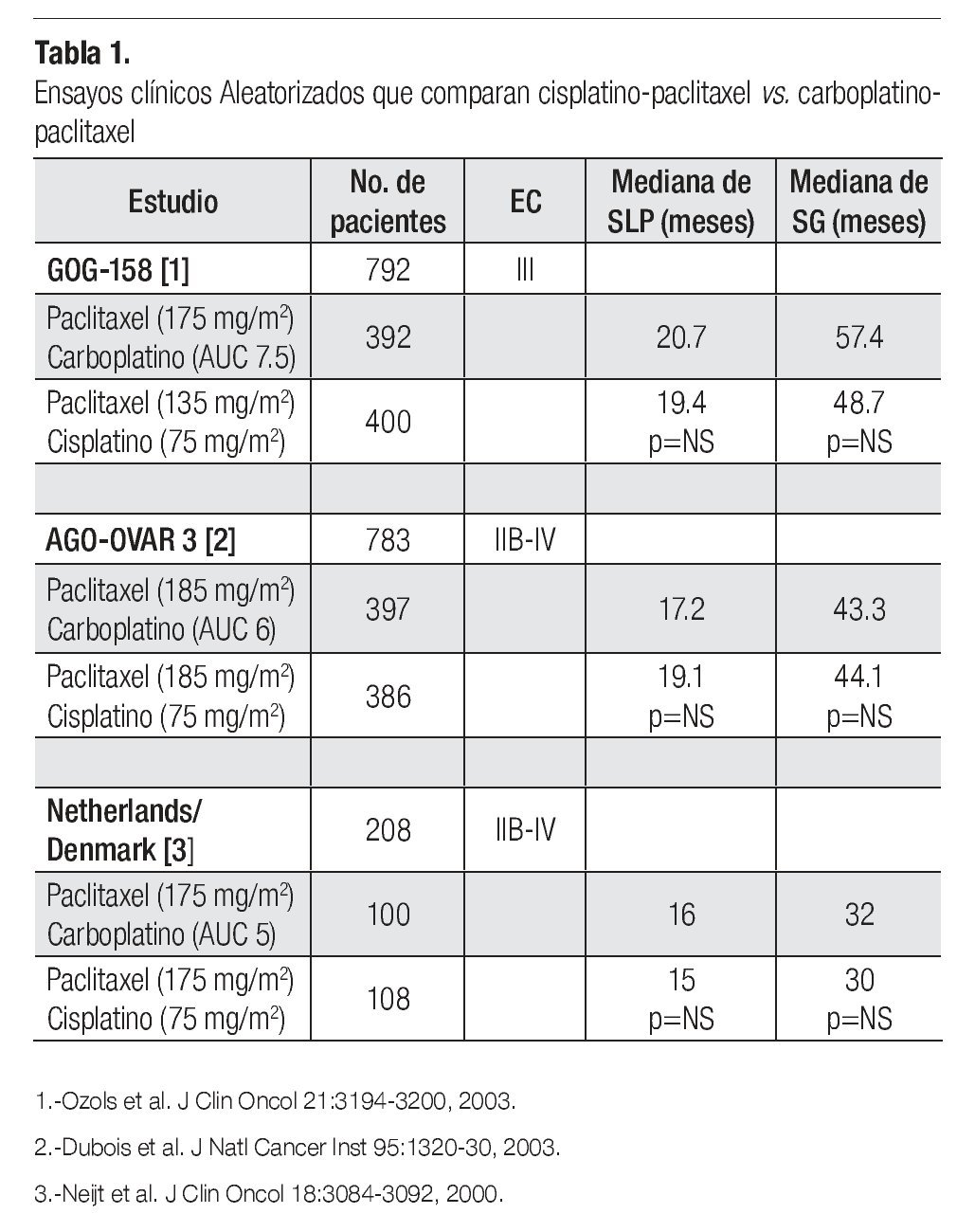
¿ CISPLATINO VS. CARBOPLATINO
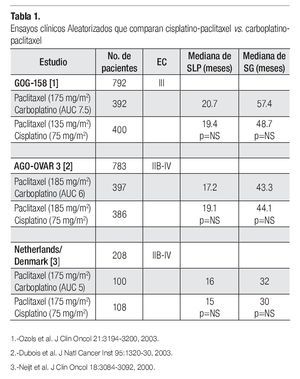
Carboplatino es un análogo de platino que en forma global muestra mejor perfil de toxicidad que cisplatino. Es menos emetogénico y aunque también requiere ajuste de dosis de acuerdo a la tasa de filtración glomerular, se considera menos nefrotóxico que cisplatino y no requiere de hidratación intravenosa pre y pos-tratamiento. El perfil de toxicidad hematológica es diferente entre ambos agentes; son más frecuentes la leucopenia y neutropenia con cisplatino, pero mayor la trombocitopenia con carboplatino. Se han realizado diversos estudios tratando de establecer la bioequivalencia de carboplatino con cisplatino en pacientes con cáncer de ovario avanzado. Son tres los estudios más importantes (Tabla 1). El primero de ellos fue publicado por el grupo Danés y de los Países Bajos, que aleatorizó a 208 pacientes con cáncer de ovario EC IIB-IV a recibir cisplatino-paclitaxel vs. carboplatino-paclitaxel; ambos esquemas, cada tres semanas por un máximo de seis ciclos. Se demostró la bioequivalencia entre ambos brazos ya que no hubo diferencia estadísticamente significativa en cuanto a tasas de respuesta (62% vs. 66%) SLP (15 vs. 16 meses) y SG (30 vs. 32 meses). Hubo menor náusea, vómito y neuropatía en el brazo de carboplatino, aunque mayor neutropenia y trombocitopenia. Un segundo estudio, publicado por el grupo AGO-OVAR-3 (un estudio de no inferioridad) aleatorizó a 783 pacientes con cáncer de ovario avanzado EC IIB-IV a recibir cisplatino-paclitaxel vs. carboplatino-paclitaxel por seis ciclos cada tres semanas. Hubo mayor tasa de respuestas clínicas completas en el brazo de cisplatino con significancia estadística (81.4% vs. 67.7%), sin embargo cuando se analizan las tasas de respuesta patológica, tanto completas como parciales (en aquellos pacientes sometidos a citorreducción de intervalo) los resultados fueron similares (76.6% vs. 78.4%). No hubo diferencias en SLP (19.1 m vs. 17.2 meses) y en SG (30 vs. 32 meses). Finalmente el estudio GOG-158 asignó aleatoriamente a 792 pacientes con cáncer de ovario EC III para recibir cisplatino-paclitaxel vs. carboplatinopaclitaxel. Nuevamente no hubo diferencias en SLP (19.4 vs. 20.7 meses) y SG (48.7 vs. 57.4 meses) entre ambos brazos de tratamiento. Los pacientes en el brazo de cisplatino mostraron mayor leucopenia y mayor toxicidad gastrointestinal, metabólica y renal. Hubo mayor trombocitopenia en el brazo de carboplatino, mientras que la neurotoxicidad fue similar en ambos brazos. Con estos resultados se demuestra la bioequivalencia y la no inferioridad en utilizar carboplatino en lugar de cisplatino en pacientes con cáncer de ovario avanzado y con mejor perfil de toxicidad. Por tanto la combinación de carboplatino-paclitaxel por seis ciclos cada tres semanas se constituye en un nuevo estándar de manejo para este grupo de pacientes.
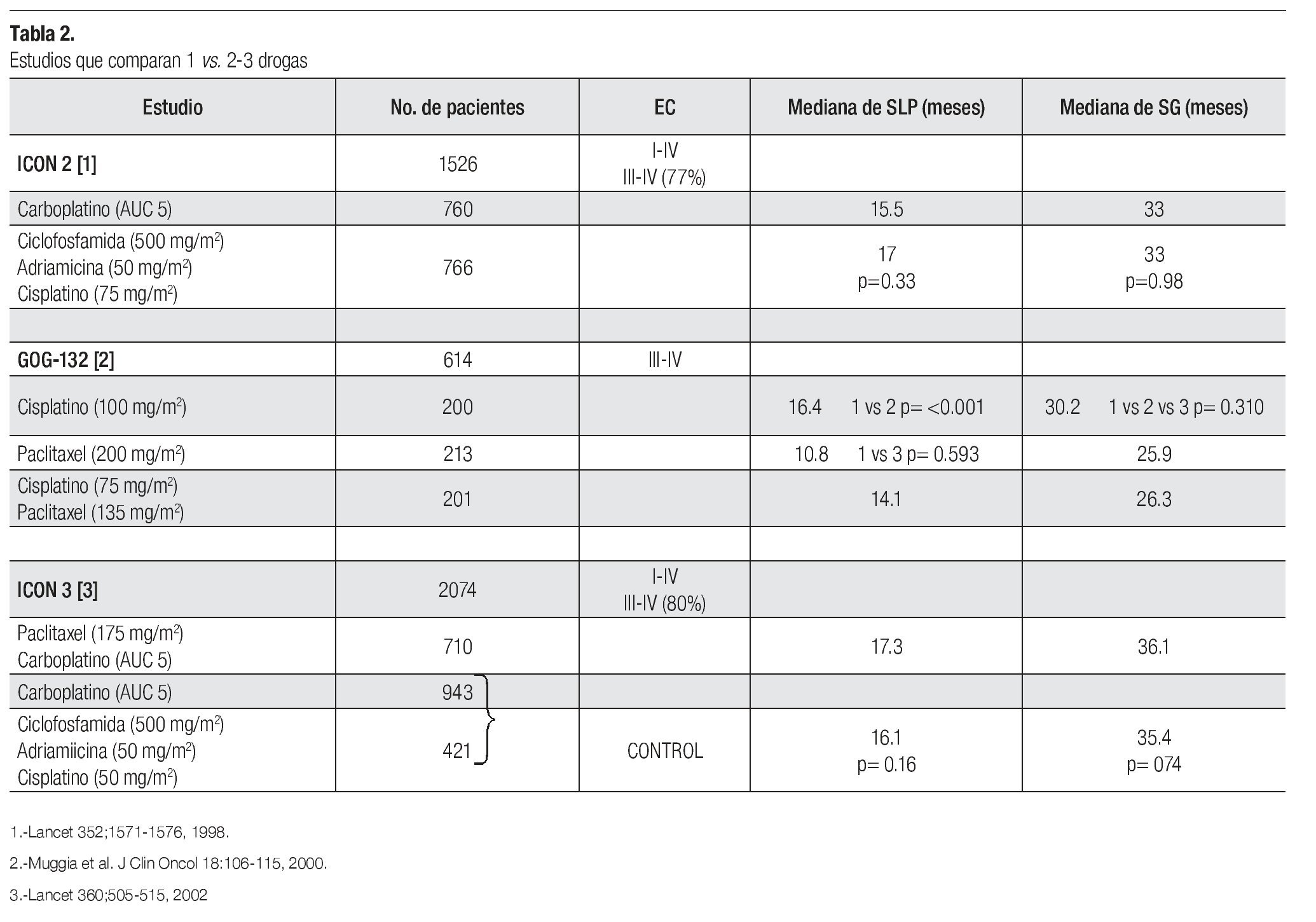
¿ UNA VS. DOS O TRES DROGAS
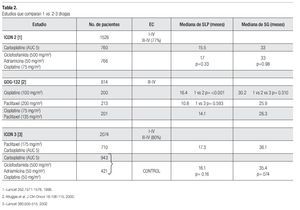
El manejo estándar para paciente con cáncer de ovario avanzado es a base de un doblete con carboplatino más paclitaxel por seis ciclos; sin embargo, existen diversos estudios que evalúan el uso de una sola droga (básicamente una sal platinada) vs. dobletes o tripletes. En relación con esto, existen tres estudios que demuestran la misma eficacia entre el esquema de monodroga vs. poliquimioterapia (Tabla 2). El primero de ellos es el ICON-2 el cual incluyó a 1526 pacientes de los cuales 77% eran EC III y IV. Fueron asignados al azar para recibir carboplatino a AUC de cinco (n = 760) vs. el esquema CAP (n = 766). No hubo diferencias en SLP (15.5 vs. 17 meses, p = 0.33) y en SG (33 vs. 33 meses p = 0.98). El esquema CAP se asoció con mayor toxicidad, con más alopecia, leucopenia, náusea y vómito, mientras que con carboplatino hubo más trombocitopenia. El segundo estudio, el GOG-132, incluyó a 614 pacientes en EC III-IV. Se aleatorizaron a recibir cisplatino como monodroga (n = 200), paclitaxel como monodroga (n = 213) vs. cisplatino-paclitaxel (n = 201). Al comparar los resultados, no hubo diferencias en las tasas de respuesta y en SLP entre cisplatino y cisplatino-paclitaxel (TR 67% vs. 66%) (SLP 16.4 vs. 14.1 meses); sin embargo, sí hubo inferioridad en el brazo de paclitaxel como monodroga y con significancia estadística (TR 42% y SLP 10.8 meses). Ambos brazos de monoterapia se descontinuaron con mayor frecuencia, cisplatino por toxicidad (17%) y paclitaxel por progresión 20% vs. 7% en el doblete.
Cisplatino como monodroga se asoció a mayor toxicidad hematológica, renal y gastrointestinal. La SG fue similar en los tres brazos de tratamiento (30.2 vs. 25.9 vs. 26.3 meses). El tercer estudio, el ICON-3, incluyó a 2074 pacientes, 80% eran EC III-IV. Se aleatorizaron a uno de tres brazos: carboplatino-paclitaxel (n = 710) vs. carboplatino monodroga (n = 943) vs. el esquema CAP (n = 421). Al analizar los resultados, los brazos de monodroga y el triplete fueron considerados en forma conjunta como brazo control. No hubo diferencias en SLP (17.3 meses para carboplatino-paclitaxel vs. 16.1 meses para los brazos control, p = 0.16) y SG (36.1 meses vs. 35.4 meses, p = 0.74).
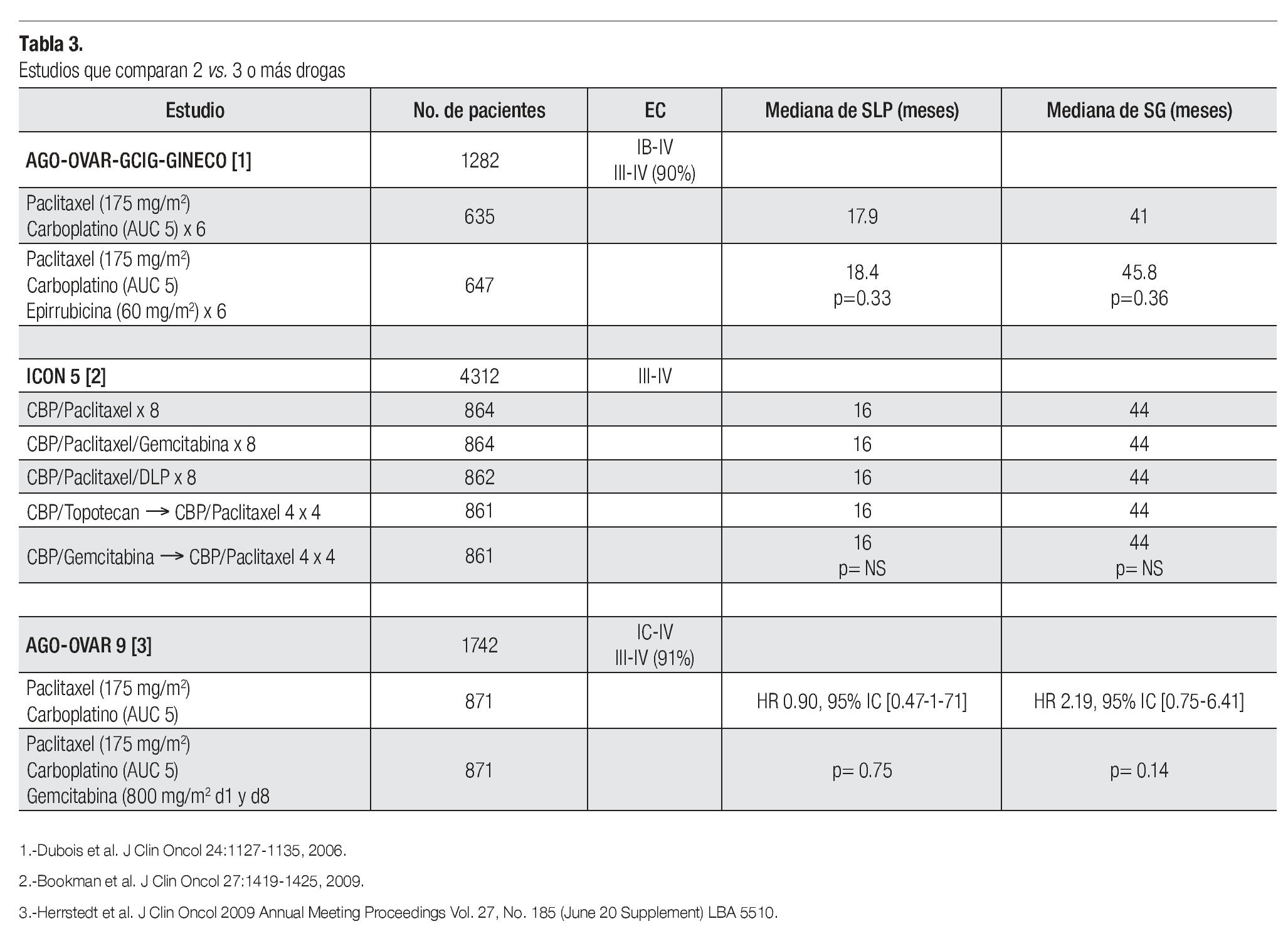
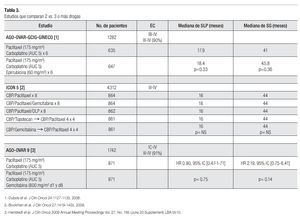
¿ DOS VS. TRES DROGAS
La terapia de combinación con un doblete basado en platino más taxano por seis ciclos se considera en la actualidad el manejo estándar en pacientes con cáncer de ovario en etapas avanzadas. A pesar de los grandes avances que se han logrado en esta enfermedad, los resultados en SG a largo plazo son aun decepcionantes. Por lo tanto se han realizado varias estrategias de tratamiento con miras a mejorar estos resultados y el pronóstico de este grupo de pacientes siendo una de ellas la adición de una o más drogas con resistencia no cruzada a la terapia hasta el momento considerada estándar (carboplatino-paclitaxel). En relación a esto se han publicado tres estudios que evaluaron el agregar una tercera droga en forma de triplete o en forma secuencial (epirrubicina, gemcitabina, topotecan). Desafortunadamente ninguno de ellos ha demostrado ser de utilidad. El agregar una o más drogas sólo aporta mayor toxicidad, por lo que actualmente no se recomienda la administración de una tercera o más drogas (Tabla 3).
¿ PACLITAXEL VS. DOCETAXEL
El SCOTROC-01 es un estudio fase III que comparó el uso de paclitaxel-carboplatino vs. docetaxel-carboplatino en pacientes con cáncer de ovario avanzado. Incluyó a 1077 pacientes de los cuales 80% correspondían a EC III-IV. Paclitaxel se administró a la dosis de 175 mg/m2 y docetaxel a 75 mg/m2 ambos cada tres semanas por seis ciclos, carboplatino se administró a un AUC de cinco. No hubo ninguna diferencia en tasas de respuesta (59% para ambos brazos) y SLP (14.8 vs. 15 meses, p = 0.707). El seguimiento de este estudio fue de tan sólo 23 meses, por lo que no se había determinado la SG media; sin embargo no hubo diferencias en la SG estimada a dos años entre ambos brazos de tratamiento (58.7% vs. 59.5%, p = 0.868).15 En relación con la toxicidad, hubo mayor neutropenia G4 y neutropenia febril con docetaxel y mayor neuropatía sensitiva y motora con paclitaxel.
¿ DOSIS DENSAS
Recientemente se publicó un estudio japonés que evaluó la administración semanal (dosis densas) de paclitaxel en pacientes con cáncer de ovario avanzado. Fue un estudio fase III que incluyó a 631 pacientes en EC II-IV (82% eran EC III-IV). Se aleatorizaron a recibir paclitaxel trisemanal a la dosis de 185 mg/m2 vs. paclitaxel semanal (dosis densas) a 80 mg/m2 por tres semanas. Ambos brazos recibieron carboplatino a un AUC de seis. De acuerdo a los resultados publicados no hubo diferencias en cuanto a tasas de respuesta (56% dosis densas vs. 54% dosis convencional). Sin embargo hubo una mejoría estadísticamente significativa en SLP (28 meses vs. 17.2 meses, p = 0.015) a favor del brazo de dosis densas. El seguimiento de este estudio fue de tan sólo 29 meses por lo que aún no se había determinado la mediana de SG sin embargo se demostró un mayor beneficio en SG estimada a dos y tres años (83.6% vs. 77.7%, p = 0.049 y 72.1% vs. 65.1%, p = 0.03 respectivamente) a favor del brazo de dosis densas.16 En relación con la toxicidad, no hubo ninguna diferencia excepto mayor anemia grado 3-4 para el brazo de dosis densas (69% vs. 44%, p = < 0.0001).
¿ CONCLUSIONES ETAPAS AVANZADAS
Existe superioridad en términos de eficacia con esquemas basados en platino vs. no platino.
Las combinaciones con platino más un taxano superan a las basadas en platino más agentes alquilantes (GOG-111, OV-10).
Carboplatino es igual de eficaz que cisplatino, mejor perfil de toxicidad con carboplatino (GOG-158, AGO, Netherlands/Denmark). Por lo tanto el tratamiento con base en carboplatino más paclitaxel por seis ciclos está considerado el estándar de manejo en pacientes con cáncer epitelial de ovario avanzado
Docetaxel es igual de eficaz que paclitaxel en cuanto a tasas de respuesta, SLP y SG con diferentes perfiles de toxicidad (SCOTROC-01). Aún está pendiente determinar la SG media con un seguimiento mayor.
Carboplatino como monodroga parece ser igual de eficaz (SLP y SG) que los esquemas basados en dos y tres drogas, aunque con menor toxicidad por lo que se considera una opción más de tratamiento (ICON 2, ICON 3).
No existe ningún beneficio en SLP y SG al agregar un tercer fármaco y sí mayor toxicidad (AGO-OVAR-GINECO, ICON 5, AGOOVAR 9).
Carboplatino más paclitaxel semanal (dosis densas) representa una nueva opción de tratamiento ya que demuestra ser superior (en SLP y SG) al esquema convencional trisemanal (JGOG)
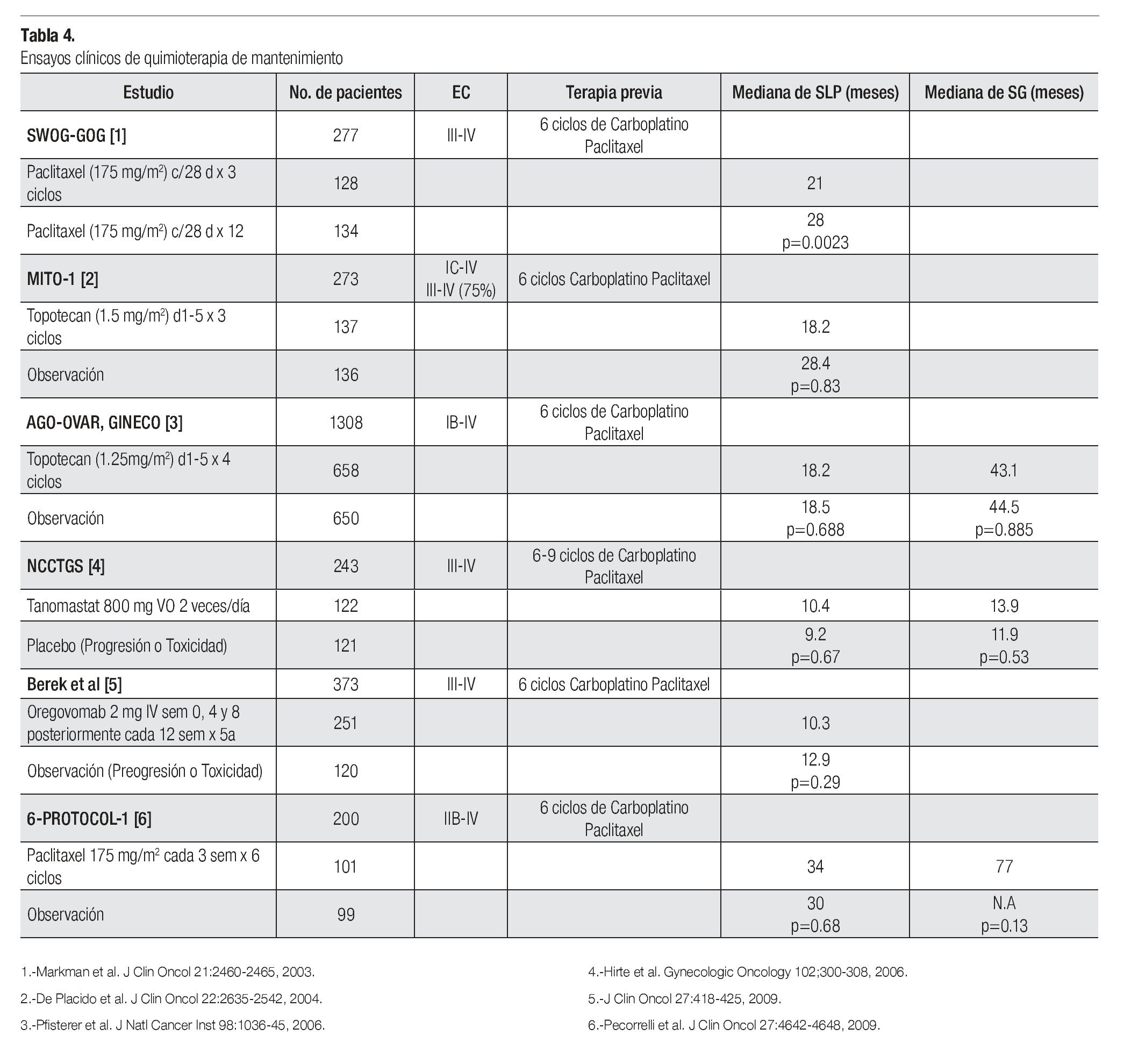
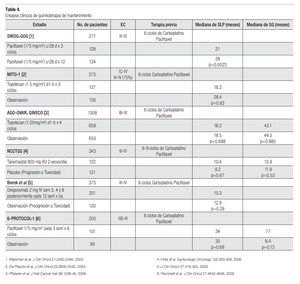
¿ QUIMIOTERAPIA DE MANTENIMIENTO
Está bien establecido que el manejo estándar en pacientes con cáncer de ovario avanzado es a base de quimioterapia con un doblete basado en platino más un taxano (carboplatino-paclitaxel) por seis ciclos. Como se mencionó, a pesar de los avances en el manejo de este grupo de pacientes, los resultados aun son decepcionantes con una SLP media de 15 a 20 meses y una SG media de 35 a 40 meses. Como se mencionó antes, no existe ningún beneficio de administrar una tercera droga y si mayor toxicidad. Otra estrategia utilizada tratando de mejorar los resultados ha sido el administrar quimioterapia de consolidación o de mantenimiento. Se han realizado diversos estudios incorporando paclitaxel, topotecan, Inhibidores de metaloproteinasa de la matriz extracelular (Tanomastat) y con anticuerpos dirigidos específicamente contra el CA-125 (Oregovomab). Desafortunadamente ninguna de estas estrategias ha logrado demostrar beneficios en SLP y SG por lo que actualmente no es una recomendación estándar de tratamiento (Tabla 4).
¿ QUIMIOTERAPIA INTRAPERITONEAL
El concepto de administrar la quimioterapia en forma intraperitoneal (IP) se desarrolló desde hace más de 30 años. Teóricamente la QT IP tiene ciertas ventajas clínicas y farmacológicas sobre la QT intravenosa en pacientes con cáncer epitelial de ovario limitado a la cavidad abdominal y en quienes se realizó citorreducción óptima, y tiene que ver en parte por el comportamiento biológico propio de la enfermedad (principal vía de diseminación: transcelómica). Diversos estudios fase I y II han demostrado que con el uso de QT IP se logran mayores concentraciones intraabdominales de agentes de quimioterapia que con la QT intravenosa, además otros beneficios clínicos incluyen mayor disminución de la carga tumoral y de la ascitis. Durante los últimos 15 años, tres grandes estudios realizados en Estados Unidos han demostrado un mayor beneficio en SLP y SG con el uso de esta modalidad, sin embargo varios aspectos han limitado su adopción como un estándar de tratamiento: Distribución del fármaco y absorción sistémica, dificultades técnicas para la colocación de catéteres, alta incidencia de complicaciones relacionadas al catéter así como la relevancia clínica de esos estudios. El primero de estos estudios, el SWOG 8501/GOG-104, fue publicado en 1996 por Alberts y colaboradores. Incluyó a 546 pacientes con cáncer de ovario EC III con residual < 2 cm y se asignaron al azar para recibir QT intravenosa con base en cisplatino 100 mg/m2 más ciclofosfamida 600 mg/m2 cada tres semanas por seis ciclos (n = 279) vs. QT IP con cisplatino 100 mg/m2 IP, seguido de ciclofosfamida 600 mg/m2 IV cada tres semanas por seis ciclos (n = 267). No hubo ninguna diferencia en cuanto a SLP; sin embargo se demostró beneficio en SG media (49 vs. 41 meses, p = 0.02) con el uso de QT IP.17 El segundo estudio, el GOG-114/ SWOG 9227, un estudio publicado en 2001 por Markman y colaboradores, incluyó a 462 pacientes, EC III con residual ≤ a 1 cm. Los pacientes fueron aleatorizados para recibir QT IV con cisplatino 75 mg/m2 más Paclitaxel 135 mg/m2 en infusión continua de 24 horas cada tres semanas por siete ciclos vs. QT IP con carboplatino IV a un AUC de nueve cada 28 días por dos ciclos seguido de cisplatino 100 mg/m2 IP más paclitaxel 135 mg/m2 en infusión continua de 24 horas cada tres semanas por seis ciclos. Este estudio demostró mayor beneficio en SLP (27.9 meses vs. 22.2 meses, p = 0.01) y SG (63.2 meses vs. 52.2 meses, p = 0.05) a favor del brazo de QT intraperitoneal.18 Finalmente, un tercer estudio, el GOG-192, publicado en 2006 por la Dra. Armstrong, incluyó a 415 pacientes con EC III y residual ≤ a 1 cm. Fueron aleatorizados a recibir cisplatino 75 mg/m2 IV más paclitaxel 135 mg/m2 IV en infusión continua de 24 horas cada tres semanas por seis ciclos vs. paclitaxel 135 mg/m2 IV seguido de cisplatino 100 mg/m2 IP más paclitaxel 60 mg/m2 IP cada tres semanas por seis ciclos. Al igual que en el estudio anterior, hubo mayor SLP (23.8 meses vs. 18.3 meses, p = 0.05) y SG (65.6 meses vs. 49.7 meses, p = 0.03) a favor del brazo de QT intraperitoneal.19 Finalmente existen diversos meta-análisis y revisiones sistemáticas que analizan en forma conjunta los estudios antes mencionados confirmando en forma contundente los resultados previamente mencionados en cuanto a beneficio en SLP y SG.20 Sin embargo también se demuestra un incremento en la toxicidad especialmente fiebre, fatiga, eventos gastrointestinales, infección, dolor, sordera, alteraciones metabólicas y neurológicas.20 De esta forma la QT IP demuestra ser superior en forma contundente a la QT IV y se postula en un futuro como el nuevo estándar de manejo en pacientes con EC III y citorreducción óptima (residual ≤ a 1 cm), teniendo en cuenta las cuestiones técnicas de esta modalidad y toxicidades que aun limitan su uso en forma rutinaria
¿ QT EN RECURRENCIA
En pacientes con cáncer de ovario que han sido previamente tratados y que se encuentran en aparente remisión clínica las Guías NCCN de los Estados Unidos recomiendan la determinación del CA-125 en cada visita de seguimiento siempre y cuando este marcador haya mostrado elevación al momento del diagnóstico inicial. En términos generales una vez documentada la elevación de este marcador la mediana de tiempo para que la recaída clínica se haga manifiesta va en rangos de 2 a 6 meses. A pesar de esto, los resultados de un gran estudio aleatorizado, no demostraron ningún beneficio en términos de SG al iniciar la terapia en forma temprana basándose en la sola elevación del CA-125 poniendo en duda el verdadero valor clínico de la determinación rutinaria de dicho marcador.21 La elección de quimioterapia al momento de la recaída, dependerá de la sensibilidad de la enfermedad al platino. Aunque la definición aceptada de sensibilidad al platino en cáncer epitelial de ovario es aquella en que la enfermedad recurre después de seis meses al último tratamiento basado en platino, las guías NICE definen a cuatro grandes grupos:
1. Platino sensible: Enfermedad que responde a la primera línea de tratamiento basada en platino pero que recae 12 meses o más tras haber completado el tratamiento inicial.
2. Platino parcialmente sensible: Enfermedad que responde a la primera línea de tratamiento basada en platino pero que recae entre seis a 12 meses después de haber completado el tratamiento inicial basado en platino.
3. Platino resistente: Enfermedad que recae dentro de los primeros seis meses de haber completado la terapia inicial basada en platino.
4. Platino refractario: Enfermedad que no responde a la terapia inicial basada en platino. La enfermedad puede incluso progresar durante la terapia inicial basada en platino.22
¿ QT EN PACIENTES PLATINO SENSIBLES
Existen diversas series retrospectivas que han demostrado la actividad del platino como terapia de re-inducción en pacientes ya previamente manejados con esquemas basados en platino siendo una de ellas la publicada por Markman y colaboradores y llevada a cabo en el MSKCC. Esta serie incluyó a 82 pacientes con cáncer de ovario y recaída. El objetivo era definir la incidencia y características clínicas de respuestas secundarias a la terapia basada en platino en pacientes con cáncer de ovario previamente tratados con un esquema de QT basado en platino. Todos los pacientes deberían de tener un intervalo libre de platino (ILP) ≥ 4 meses. Del total de pacientes, más de 90% recibieron una segunda línea de tratamiento basada en cisplatino y sólo 10% recibió QT basada en carboplatino. Las tasas de respuesta objetivas fueron de alrededor de 44% y aunque estas se observaron en los tres subgrupos de pacientes con ILP (5 a 12 meses, 13 a 24 meses y > 24 meses) hubo una asociación directa entre el ILP y las tasas de respuesta: 27%, 33% y 59% para ILP 5 a 12 meses, 13 a 24 meses y > 24 meses respectivamente.23
Con esta base se han realizado diversos estudios fase III de QT basada en platino como re-inducción ya sea como monodroga o poliquimioterapia. El primero de ellos es el estudio ICON 4/AGO-OVAR 2.2 que incluyó a 802 pacientes con cáncer de ovario en recaída y un ILP ≥ a seis meses. Se aleatorizaron a recibir QT convencional basada en platino (n = 410) vs. QT basada en paclitaxel más platino (n = 392). La QT se administro cada tres semanas en cada brazo de tratamiento y el 72% en ambos brazos recibió los seis ciclos planeados. Más de 95% de estos pacientes habían sido previamente tratados con esquemas basados en platino y > de 90% habían recibido solo una línea de QT previa. Las tasas de respuesta se vieron favorecidas para el brazo de platino-paclitaxel aunque esta diferencia no alcanzó significancia estadística (54% vs. 66%, p = 0.06). Sin embargo hubo mayor SLP (13 meses vs.10 meses) y SG (24 meses vs.29 meses) a favor del brazo de paclitaxel. En relación con la toxicidad fue muy similar para ambos brazos de tratamiento aunque mayor neurotoxicidad G3-4 (1% vs.20%) y alopecia G3-4 (25% vs. 86%) en el brazo de paclitaxel24 Otro estudio importante es el realizado por el grupo AGO-OVAR, NCIC CTG, EORTC GCG por Pfisterer y colaboradores que evaluó a 356 pacientes con cáncer de ovario recurrente y con un ILP ≥ a seis meses. Los pacientes fueron aleatorizados para recibir carboplatino monodroga a un AUC de cinco cada tres semanas por seis ciclos (n = 178) vs. carboplatino AUC cinco, más gemcitabina 1000 mg los días uno y ocho cada tres semanas por seis ciclos (n =178). Tras una mediana de seguimiento de tan sólo 17 meses se observó una mejoría en cuanto a tasas de respuestas completas (47.2% vs. 30.9%, p = 0.0016) a favor de la combinación. Igualmente hubo mejoría en SLP (8.6 meses vs. 5.8 meses, p = 0.0031) en el brazo combinado aunque sin diferencias en la SG (18meses vs. 17.3 meses). Hubo mayor toxicidad hematológica grado 3 - 4 en el brazo combinado principalmente anemia, neutropenia y trombocitopenia (p ≤ 0.001).25 El estudio del SWOG-0200 incluyó a un número pequeño de pacientes (n = 61) por lo que se cerró en forma prematura. Esto fue debido a un problema en el reclutamiento de pacientes ya que se encontraba en progreso y en fase de reclutamiento el estudio ICON 4 y el GOG-0182/ICON 5, además hubo disolución del comité organizador. A pesar de esto vale la pena mencionar los resultados de este estudio ya que este dio lugar a uno de gran importancia (CALYPSO) por el impacto clínico que demostró. En el estudio del SWOG-0200 los 61 pacientes de 900 planeados con cáncer de ovario recurrente y con un ILP entre 6 a 24 meses fueron aleatorizados para recibir carboplatino monodroga a un AUC de cinco cada cuatro semanas hasta progresión o toxicidad (n = 30) vs. carboplatino AUC cinco, más doxorrubicina liposomal pegilada (DLP) 30 mg/m2 cada cuatro semanas hasta progresión o toxicidad (n = 31). Los resultados demostraron una mayor tasa de respuestas objetivas a favor del brazo de combinación (67% vs. 32%, p = 0.02). Igualmente hubo ventaja en la SLP (12 meses vs. 8 meses, p = 0.003) y en la SG (26 mese vs. 18 meses, p = 0.03). La toxicidad grado 3 - 4 fue mayor para el brazo de combinación principalmente hematológica con más anemia, trombocitopenia, neutropenia, neutropenia febril e infección con neutropenia, todo con significancia estadística. Los pacientes en el brazo de combinación requirieron de más transfusiones de glóbulos rojos y plaquetas.26 Finalmente, el estudio CALYPSO evaluó a 976 pacientes con cáncer de ovario recurrente con un ILP ≥ a seis meses. Este estudio compara el hasta estos momentos la terapia estándar (carboplatino más paclitaxel) con una terapia basada en platino mas DLP. Los pacientes fueron aleatorizados a recibir carboplatino AUC cinco más paclitaxel 175 mg/m2 cada tres semanas por seis ciclos (n = 509) vs. carboplatino AUC cinco más DLP 30 mg/m2 cada 28 días por seis ciclos. Con una mediana de seguimiento de 21 meses los reportes preliminares demuestran mejoría en la SLP media a favor del brazo de DLP (11.3 meses vs. 9.4 meses). Está pendiente el reporte final incluyendo tasas de respuesta y la SG media.27
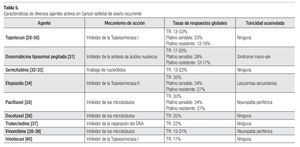
¿ QT EN PACIENTES PLATINO RESISTENTES Y/O REFRACTARIOS
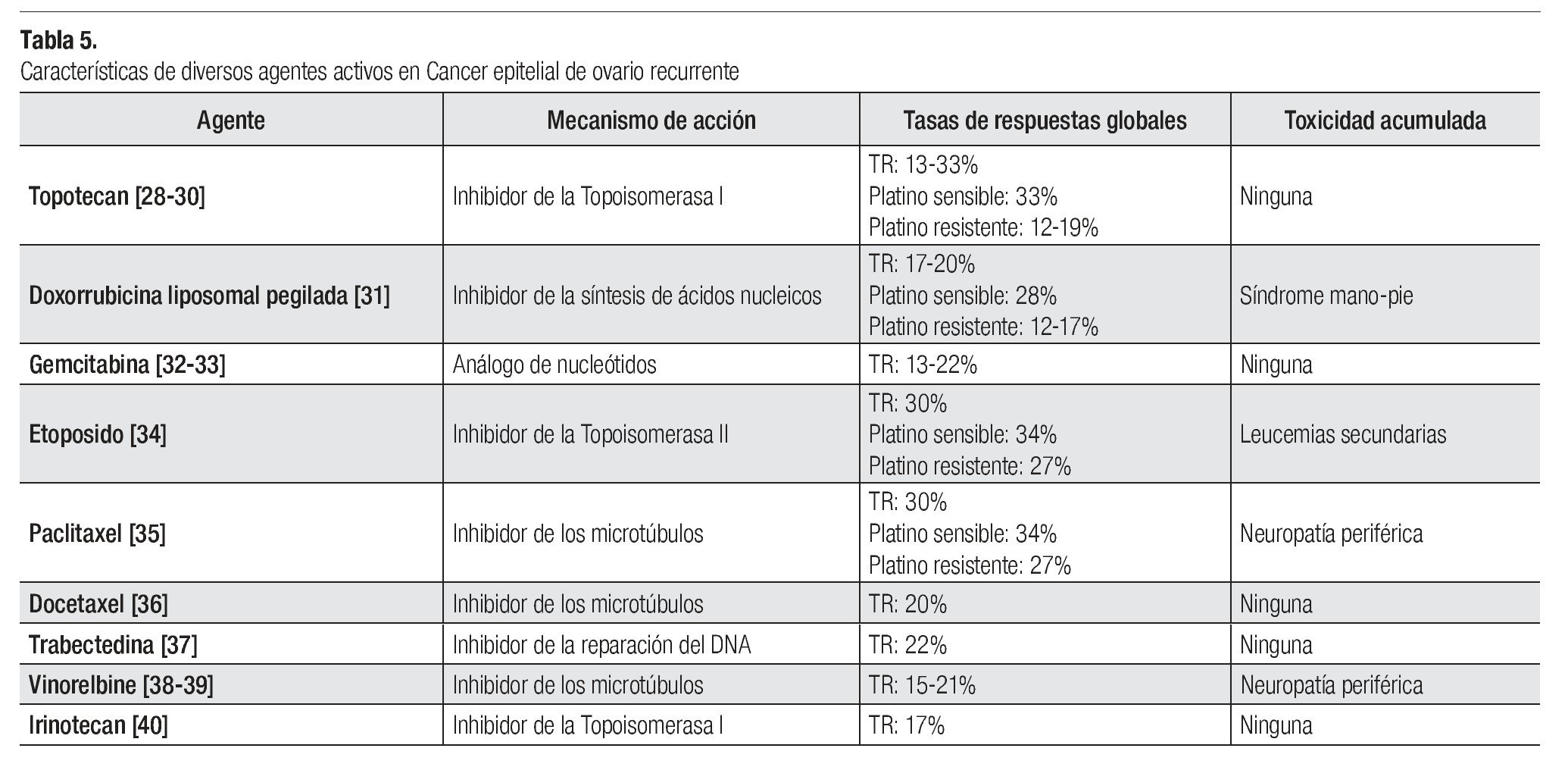
En general se considera a un paciente resistente o refractario a Platino cuando la enfermedad recae en los primeros seis meses de haber completado la terapia inicial basada en platino o aquella que no responde a la terapia inicial basada en platino o que incluso progresa durante la misma. Son varias las drogas que han demostrado actividad en este grupo de pacientes: paclitaxel, docetaxel, topotecan, DLP, gemcitabina, etoposido oral, vinorelbine, irinotecan y trabectedina (Tabla 5).28-40
Topotecan: Hasta un tercio de los pacientes con cáncer de ovario recurrente manejados con topotecan lograran algún tipo de respuesta objetiva. En general estas varían en rangos de 13% a 33%, dependiendo de la sensibilidad al platino. La dosis aprobada por la FDA es de 1.5 mg/ m2 IV al día por cinco días; sin embargo, esta estrategia de tratamiento de cinco días es poco tolerada por el paciente y esto es debido principalmente a la considerable mielosupresión que ocasiona. Debido a esto se han realizado diversos estudios fase II no comparativos y algunas revisiones retrospectivas las cuales han demostrado que es posible alcanzar tasas de respuestas objetivas razonables empleando dosis menores (1 mg/m2 a 1.25 mg/m2 al día durante cinco días), empleando cursos más cortos de tratamiento (esquemas de tres días) o utilizando esquemas semanales.
Doxorrubicina liposomal pegilada: En general las tasas de respuesta con este agente de QT varían en rangos de 12% a 28%, dependiendo de la sensibilidad al platino. La dosis aprobada por la FDA es de 50 mg/m2 IV cada cuatro semanas; sin embargo, al igual que sucede con topotecan, la gran toxicidad observada con esta dosis (síndrome mano-pie, mucositis, estomatitis), ha impulsado a algunos autores a examinar dosis reducidas de tal manera que diversos estudios utilizando dosis de 40 mg/ m2 IV cada cuatro semanas han demostrado tasas de respuesta similares (15%) con substancial menor toxicidad.
Con base en lo anterior, se llevó a cabo un estudio clásico el cual comparó la efectividad de topotecan vs. doxorrubicina liposomal pegilada (DLP) en pacientes con cáncer de ovario recurrente. En este publicado por Gordon y colaboradores (2001), se evaluó a un total de 474 pacientes con cáncer de ovario recurrente que hubieran fallado a una terapia previa basada en platino. El 57% de ellos fueron catalogados como platino refractarios. Se aleatorizaron para recibir topotecan 1.5 mg/m2 IV al día por cinco días cada tres semanas (n = 235) vs. DLP 50 mg/ m2 IV día uno cada cuatro semanas (n = 239), ambos hasta progresión, toxicidad o un máximo de 12 meses. Tras una mediana de seguimiento de 2.3 años, no se demostró diferencia alguna en cuanto a tasas de respuesta (19.7% para DLP vs. 17% para topotecan, p = 0.39). Igualmente no hubo diferencias en la SLP media (16.1 semanas vs. 17 semanas, p = 0.95) y en la SG media (60 semanas vs. 56.7 semanas, p = 0.341). Un análisis de subgrupo de acuerdo a la sensibilidad al platino si logro demostrar beneficio tanto en la SLP media (28.9 vs. 23.3 semanas, p = 0.037) como en la SG media (108 semanas vs. 71.1 semanas, p = 0.008) a favor del brazo de DLP. En relación con la toxicidad, grado 3 - 4; hubo más leucopenia (10% vs. 50%), neutropenia (12% vs. 77%), anemia (5% vs. 28%) y trombocitopenia (1% vs. 34%); en el brazo de topotecan todo con significancia estadística. En el brazo de DLP hubo más síndrome mano-pie (23% vs. 0%) y estomatitis (8% vs. 0.4%) también con significancia estadística. El 78% de los pacientes en el brazo de topotecan amerito retraso, reducción de la dosis o interrupción del tratamiento debido a toxicidad vs. sólo 57% en el brazo de DLP (p = < 0.001).41 Una actualización de este estudio con un seguimiento a cinco años si logro demostrar beneficio en cuanto a la SG media (62.7 semanas vs. 59.7 semanas, p = 0.05), aunque nuevamente el análisis por subgrupo demostró que el beneficio era estadísticamente significativo sólo para el subgrupo de pacientes platino sensibles (107.9 semanas vs. 70.1 semanas, p = 0.017). De tal manera que en forma global existe una reducción en el riesgo de muerte de 18% para los pacientes tratados con DLP y hasta de 33%, en aquellos sensibles al platino.42
Gemcitabina: Existen dos estudios que demuestran la actividad clínica de este recurso en pacientes con cáncer de ovario recurrente. El primero de ellos incluyó a 195 pacientes con cáncer de ovario recurrente, de los cuales 100% se catalogaron como platino resistentes. Fueron aleatorizados para recibir gemcitabina 1000 mg/m2 d1 y d8 cada tres semanas (n = 99) vs. DLP a 50 mg/m2 cada cuatro semanas (n = 96). No hubo diferencias en cuanto a tasas de respuesta (6.1% para gemcitabina vs. 8.3% para DLP, p = 0.589), SLP media 3.6 meses vs. 3.1 meses, p = 0.870) y SG media (12.7 meses vs. 13.5 meses, p = 0.997). El perfil de toxicidad fue distinto entre ambos brazos pero en general bien tolerados [43]. El segundo estudio, el MITO-3, fue muy similar en cuanto al tipo de diseño, incluyó a 153 pacientes con cáncer de ovario recurrente, de los cuales 55% fueron catalogados como enfermedad refractaria a platino. Fueron se asignaron al azar para recibir gemcitabina 1000 mg/m2 d1, d8 y d15 cada cuatro semanas por seis ciclos (n = 77) vs. DLP 40 mg/m2 d1 cada cuatro semanas por seis ciclos (n = 76). En relación a las tasas de respuesta fueron muy similares aunque con tendencia a favor del brazo de gemcitabina (29% vs. 16%, p = 0.056). Aunque no hubo diferencias en cuanto a la SLP media (16 semanas vs. 20 semanas, p = 0.411) sí lo hubo en la SG media (56 semanas vs. 51 semanas, p = 0.048) en favor del brazo de DLP, aunque este efecto se hace aparente a partir del primer año de seguimiento. La toxicidad fue muy similar en ambos brazos, excepto para la neutropenia grado 3 - 4, más frecuente en el brazo de gemcitabina (6% vs. 10%, p = 0.007).44
Tamoxifeno: Esta droga es catalogada como un modulador selectivo de los receptores de estrógenos (MSRE) y es un pilar del tratamiento de pacientes con cáncer de mama y que sobre-expresan receptores de estrógenos y progestágenos. Es bien sabido que algunos tumores ováricos comúnmente sobre-expresan receptores de estrógenos por lo que se ha sugerido que el uso de tamoxifeno pudiera tener cierto beneficio clínico en pacientes con cáncer de ovario. Con base en lo anterior, se han realizado varios ensayos clínicos con resultados no concluyentes. Una revisión sistemática de la bibliografía publicada en Cochrane (2009), identificó 11 series retrospectivas, un estudio fase II no aleatorizado y dos estudios, fase dos aleatorizados, evaluando el papel del uso de tamoxifeno en pacientes con cáncer de ovario recurrente. Los resultados demostraron que este fármaco tiene actividad limitada en este grupo de pacientes con tasas de respuesta objetivas de tan sólo 9.6% (rango de 0% a 56%). Se logró estabilidad de la enfermedad ≥ a cuatro semanas en 31.9% de los pacientes. No hubo datos suficientes para determinar la duración de la respuesta, la SLP y la SG. Por tanto se concluye que la actividad de tamoxifeno en pacientes con cáncer de ovario recurrente es mínima.45
Con base a lo anterior podemos concluir lo siguiente en relación a la QT en recaída:
Es factible re-inducir a los pacientes con esquemas basados en platino cuando el intervalo libre de platino es ≥ 6 meses ya que se obtienen tasas de respuesta de hasta 59% (Markman y colaboradores J Clin Oncol 9;389-93,1991)
Carboplatino/paclitaxel se consolida como la primera opción de tratamiento en este grupo de pacientes (ICON 4/AGO-OVAR 2.2)
Carboplatino/gemcitabina es una opción más de tratamiento y aunque ha demostrado prolongar la SLP no impacto en SG (AGO-0VAR, NCIC-CTG, EORTC-GCG)
Carboplatino/DLP parece ser prometedor, demostró ser superior a CBP monodroga en SLP y SG (SWOG 0200) y superó a carboplatino/ paclitaxel en SLP (CALYPSO), aun están pendientes los resultados de SG
Son varias las drogas activas en pacientes con enfermedad platino refractarios/resistentes: paclitaxel, docetaxel, topotecan, DLP, gemcitabina, etoposido oral, vinorelbine, irinotecan y trabectedina
DLP demostró ser igual de eficaz que topotecan (TR, SLP, SG) aunque con mejor perfil de toxicidad (Gordon y colaboradores J Clin Oncol 2001, Gynecol Oncol 2004)
Gemcitabina demostró eficacia similar a DLP con diferentes perfiles de toxicidad (MITO-3)
Tamoxifeno tiene actividad limitada (tasas de respuesta objetiva 9.6%)
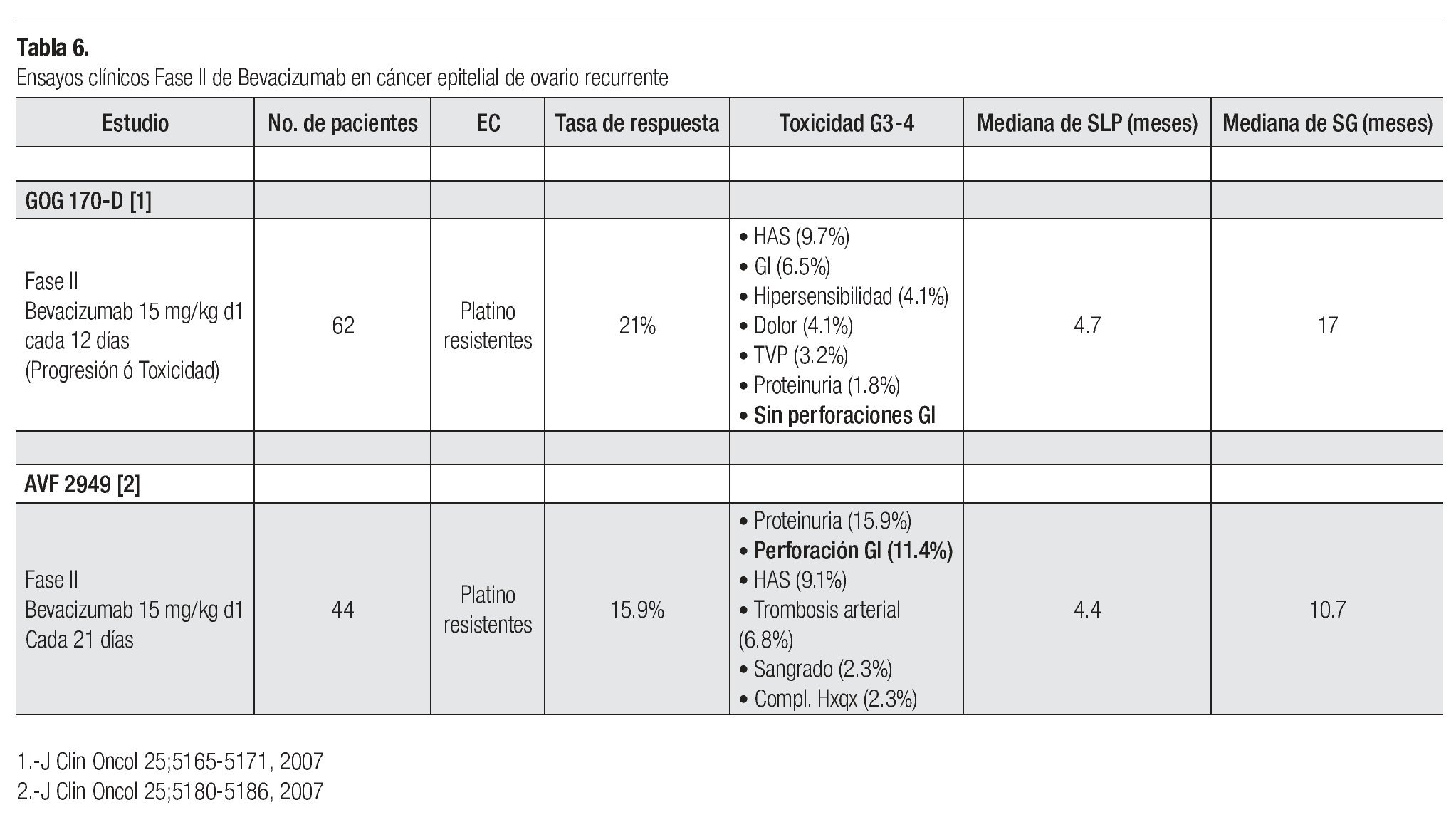
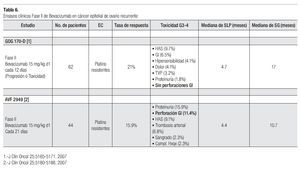
Bevacizumab: Se trata de un anticuerpo monoclonal humanizado que va dirigido en contra del factor de crecimiento del endotelio vascular (VEGF) inhibiendo por tanto la angiogénesis. Es el primer agente denominado terapia blanco en demostrar actividad clínica como agente único en pacientes con cáncer epitelial de ovario recurrente. Las tasas de respuesta como agente único varían en rangos de 16% a 21% independientemente del estatus de sensibilidad al platino. Además la SLP lograda con este agente como monoterapia es superior a la observada con controles históricos, SLP a seis meses: 42% con bevacizumab vs. 16% en controles históricos con QT (Tabla 6).
Actualmente están en marcha dos grandes estudios fase III que evalúan el papel de bevacizumab en pacientes con cáncer de ovario. Esto surgió de los resultados de diversos ensayos pre-clínicos los cuales sugieren que carboplatino es capaz de inducir niveles elevados del VEGF, de tal manera que al agregar la terapia anti-angiogénica dirigida en contra del VEGF conduciría a mejor control tumoral que cuando se utiliza la QT sola. El primero de ellos está siendo conducido por el GOG, en el que se evalúa el uso de bevacizumab en combinación con QT basada en carboplatino más paclitaxel en pacientes con cáncer de ovario recurrente. Este estudio, el GOG-218, es fase III, doble ciego, placebo controlado, en el que los pacientes siéndose asignan aleatoriamente a uno de tres brazos de tratamiento: Brazo 1: Carboplatino más paclitaxel por seis ciclos, más placebo, el cual se inicia a partir del segundo ciclo de QT y se continúa por 10 ciclos más al término de la QT (mantenimiento). Brazo 2: Carboplatino más paclitaxel por seis ciclos, más bevacizumab 15 mg/kg, cada tres semanas, con inicio al segundo ciclo de QT y posteriormente mantenimiento con placebo por 10 ciclos. Brazo 3: Carboplatino más paclitaxel por seis ciclos más bevacizumab 15 mg/kg cada tres semanas iniciando a partir del segundo ciclo de QT y posteriormente mantenimiento con bevacizumab por 10 ciclos. El objetivo de este estudio es básicamente evaluar el beneficio en términos de SG de agregar bevacizumab al tratamiento de QT estándar y además determinar el probable beneficio de bevacizumab como terapia de mantenimiento. El segundo estudio está siendo llevado a cabo por el ICON 7 el cual incluye solamente dos brazos de tratamiento: Brazo 1: Carboplatino más paclitaxel por seis ciclos. Brazo 2: carboplatino más paclitaxel mas Bevacizumab 7.5 mg/kg cada tres semanas, seguido de bevacizumab de mantenimiento a la misma dosis, por 12 ciclos. El objetivo primario de este estudio es la SLP.
Correspondencia: Dr. Alberto Alfonso Pimentel Renteria.
Calle: Amores #1403 Interior 312 Colonia Del Valle. Delegación Benito Juárez C.P. 03100 Mexico D.F. Teléfono: 55 3801 9831.
Correo electrónico: porfiria_2891@hotmail.com