¿ INTRODUCCIÓN
El cáncer en los niños en México es en la actualidad uno de los problemas más importantes de salud pública, la tasa de incidencia del cáncer en edad pediátrica es del orden de 136 casos por millón por año, con lo que ocupa el segundo lugar como causa de morbilidad, en la población pediátrica. En México los tumores del sistema nervioso central ocupan el tercer lugar de las neoplasias malignas en niños. Se estima que anualmente ocurren 17 casos por millón en menores de 15 años, lo que significa aproximadamente 560 nuevos casos por año.1
El meduloblastoma ocupa el segundo lugar en frecuencia y por lo general tiene un comportamiento muy agresivo. Se dividen en alto y bajo riesgo. La histogénesis de este tumor ha sido controversial, por un lado, algunos apoyan el origen primario de las células neuroectodérmicas primitivas en la matriz germinal que rodea los ventrículo, mientras que otros estudios sugieren que éste tumor se origina de las células precursoras de la capa granular externa, específicamente para la variedad nodular, que se origina de la capa granular externa y la variedad clásica, cuyo origen es en la matriz subventricular. La media de presentación de estos tumores es de cinco a siete años.2
Con base en su morfología histológica, existen cinco tipos: 1. Meduloblastoma Desmoplásico-nodular; 2. Meduloblastoma clásico; 3. Meduloblastoma anaplásico; 4. Meduloblastoma melanocítico y; 5. Medulomioblastomas.3
Tradicionalmente los factores asociados a mal pronóstico para los meduloblastomas son: edad al diagnóstico menor de tres años, tamaño o volumen del tumor residual; por su histología, se refiere a la variedad anaplásica. De acuerdo a ello, el North American Children's Oncology Group estableció dos grupos de riesgo (alto y bajo). El tipo de tratamiento se correlaciona con la determinación del grupo de riesgo del paciente.
Más recientemente se han estudiado algunos marcadores moleculares que correlacionan con el pronóstico y respuesta al tratamiento. Se ha asociado con un mal pronóstico la sobre expresión de Ki-67/MIB-1, ERBB2,4 pérdida de la heterocigocidad de 17p, amplificación de MYCC, LDHB, y CCNB1;5 en cuanto a un pronóstico favorable se refiere sobre expresión de TrkC.6
En 1988 Staal y colaboradores identificaron el gen AKT1 en el cromosoma 14q32.3 mediante el análisis de células somáticas de híbrido humano y hámster. Tiene 15 exones de codificación de 480 aminoácidos ácidos.7 En las células en reposo, el AKT reside en el citosol en una conformación de baja actividad. Durante la estimulación celular, AKT se activa a través del reclutamiento en la membrana celular de los productos de PI3K y por la fosforilación del 3'-fosfoinositol- dependiente de quinasa -1 (PDPK1). La activación de AKT controla la supervivencia celular a través de la fosforilación de las dianas que dependen de ella, con el resultado del incremento en la supervivencia celular, proliferación, crecimiento y metabolismo. El AKT fosforila específicamente dos proteínas apoptóticas, BAD y caspasa 9.8
La activación de AKT se ha implicado en la instrucción primaria en cánceres de sistema nervioso central humano. El grado de malignidad tumoral en el glioma correlaciona con la actividad de AKT y activación de los puntos de señalización de AKT hacia una mala evolución clínica. En cuanto al meduloblastoma, ensayos en ratón han revelado que la proliferación de células tumorales depende crucialmente en la activación de la vía PI3K/ AKT, lo cual se refuerza cuando existen mutaciones de PIK3CA en la subunidad p110 de PI3K, tanto en el glioblastoma como en el meduloblastoma.9,10
En la actualidad y en nuestro medio, la estadificación del riesgo en pacientes con meduloblastoma sigue siendo un reto, debido a que los parámetros clínicos son insuficientes para definir el riesgo. Hoy en día los marcadores moleculares son estudiados con interés a partir de que se ha demostrado que proveen información pronostica, poco se ha estudiado acerca del papel que juega la sobre expresión del AKT en el pronóstico del meduloblastoma en la edad pediátrica. El objetivo del presente trabajo fue determinar si existe asociación entre la sobre expresión de la proteína AKT en el pronóstico de los pacientes pediátricos con meduloblastoma.
¿ MÉTODOS
Se incluyeron las muestras de parafina de todos los pacientes con diagnóstico de certeza de meduloblastoma, vírgenes a tratamiento, de cualquier sexo y menores de 17 años, manejados en la UMAE Hospital de Pediatría desde el 01 de enero de 1995 al 31 de diciembre de 2008, con seguimiento mínimo de seis meses a partir del diagnóstico. Se capturaron del expediente los siguientes datos: edad, sexo, localización del tumor, histología del tumor, fecha de diagnóstico, fecha de defunción y tipo de tratamiento recibido. Los pacientes diagnosticados antes de 1998 recibieron manejo con doble droga (carboplatino/VP16), y los pacientes manejados posteriormente recibieron triple esquema (ICE). Posteriormente todos los pacientes mayores de tres años recibieron radioterapia (54 cGy). Tres de los pacientes menores de tres años recibieron radioterapia al cumplir dicha edad.
Las muestras almacenadas en bloques de parafina se realizaron cortes de tres micras de espesor, se desparafinaron mediante baño maría y rehidratación mediante xilol y alcoholes graduados, absoluto, a 70% y 50%, se lavaron las laminillas con agua bidestilada por 30 segundos así como con TBS (1:20, TBS Automation Wash buffer, Biocare Medical), y finalmente se lavaron con agua bidestilada por otros 30 segundos.
Posteriormente se realizó la recuperación de epítopes, mediante el proceso de desenmascaramiento de epítropes, con una solución comercial de citrato de sodio DIVA (1:10, Diva Decloaker, Biocare Medical) en una olla de presión a 125°C de temperatura. Se permitió el enfriamiento a medio ambiente de las muestras y se lavaron con agua bidestilada por 30 segundos.
Se lavaron dos veces las muestras con TBS, permitiendo una incubación a 25ºC por 10 minutos. Se lavó nuevamente con TBS y se aplicó el anticuerpo primario monoclonal de conejo (1:200, AKT phosphorylated, Biocare Medical) incubándolos por una hora a 25°C. Se lavaron con TBS. Se agregó finalmente el anticuerpo secundario (Probe, Biocare Medical) el cuál se incubó por 15 minutos a 25ºC. Se añadió HRP, peroxidasa de rábano (MACH 1 Universal HRP-Polymer Detection) por 30 minutos a 25°C, y posteriormente se reveló con cromógeno DAB (3,3D-aminobencidina, BIOCARE MEDICAL, DAB CHROMOGEN KIT, REF DB801L) incubando por cinco minutos. Finalmente se realizó contratinción con hematoxilina por cinco minutos. Una vez finalizada la inmunohistoquímica se deshidrató el tejido lavándolo durante tres minutos en cada solución con agua bidestilada, alcohol al 50%, 70%, alcohol absoluto y xileno. Finalizamos con el montaje de cada laminilla para observar al microscopio.
Se incluyó un control positivo conocido, para AKT, en nuestro caso cerebelo fetal para evaluar la técnica y la calidad del tejido post-fijado que se sometió a toda la metodología.
Se determinó la reacción en microscopio de luz y se tomaron fotografías, se consideró como sobre expresión cuando más de 50% de cada uno de los campos evaluados mostraron inmuno reactividad positiva.
Para que el médico patólogo determinara el porcentaje de positividad revisó 10 campos de alta resolución, y contó las células tumorales observadas por campo y de éstas, el número de células positivas; de esta manera se estableció el porcentaje de positividad. El patólogo fue cegado sobre la evolución de los pacientes.
¿ RESULTADOS
Veintiún pacientes fueron incluidos en el estudio. Los hombres representaron dos tercios (16 pacientes) y cinco mujeres, con una relación hombre:mujer de 3.2:1. La mediana de edad al momento del diagnóstico fue de 72 meses, con un rango de 12 a 180 meses. Sólo cuatro (19.04%) pacientes fueron menores de 36 meses de edad.
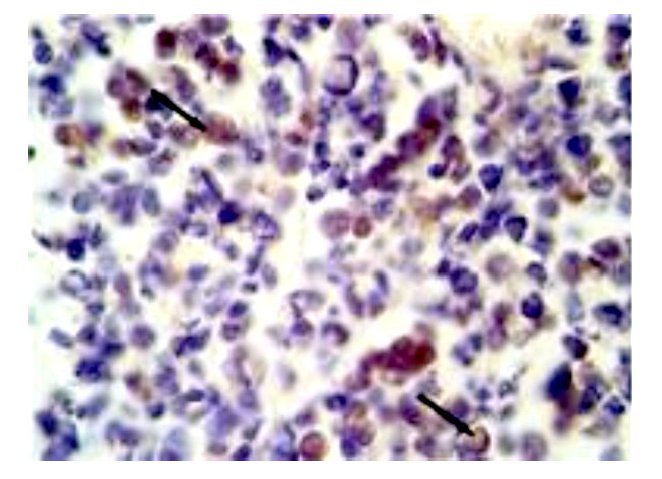
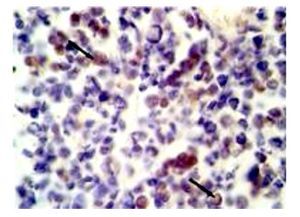
Por su variedad histológica 10 pacientes (47.6%) tuvieron histología clásica, siete (33.33%) fueron desmoplásicos y cuatro (19.04%) anaplásicos. Seis pacientes tuvieron una resección total de la tumoración. Trece pacientes (62%) recibieron manejo con esquema de quimioterapia ICE (Ifosfamida, carboplatino y etopósido) y ocho pacientes con carboplatino/VP16. Posteriormente recibieron radioterapia 20 pacientes. Cinco (23.8%) pacientes, sobre expresaron AKT (Figura 1).
Figura 1. Microfotografía de estudio de inmunohistoquímica con la evidencia de identificación de AKT positivo en citoplasma (flecha) de células neoplásicas de meduloblastoma anaplásico (40 aumentos).
Doce pacientes (57.1%) están vivos. La sobrevida global fue de 75% a los 18 meses; la mediana de supervivencia de todo el grupo fue de 49.52 meses (2 a 172 meses). Nueve pacientes han fallecido (42.9%). De éstos, una niña y ocho niños (p = 0.258; IC 95% 0.065-2.46), lo que determina un riesgo (OR) de morir por ser hombre de 4:1. La sobrevida de las mujeres es de 80% a 170 meses, mientras que la de los varones fue de 22.89 en el mismo periodo (p = 0.1555)
Con respecto a la edad, no se encontraron diferencias ya que 50% de los pacientes menores de 36 meses sobreviven, en comparación con 46.61% (10 pacientes) de aquellos mayores de 36 meses (p = 0.586); OR 1.214 (IC 95% 0.391 - 3.769).
Con respecto al tipo histológico, los pacientes con tumor desmoplásico sobrevivieron 45.71% con una mediana de 66 meses, mientras que en el grupo de pacientes con variedad clásica la sobrevida fue 32% con una mediana de 29 meses. Por último, en el grupo de histología anaplásica la sobrevida fue de 75% con una media de 130.
El tipo de quimioterapia recibida afecta, aunque no significativamente, la sobrevida, siendo de 17.5% a 170 meses en quienes recibieron carboplatino/VP16 y de 67.31% a 172 meses en aquellos que recibieron esquema de ICE (p = 0.2538).
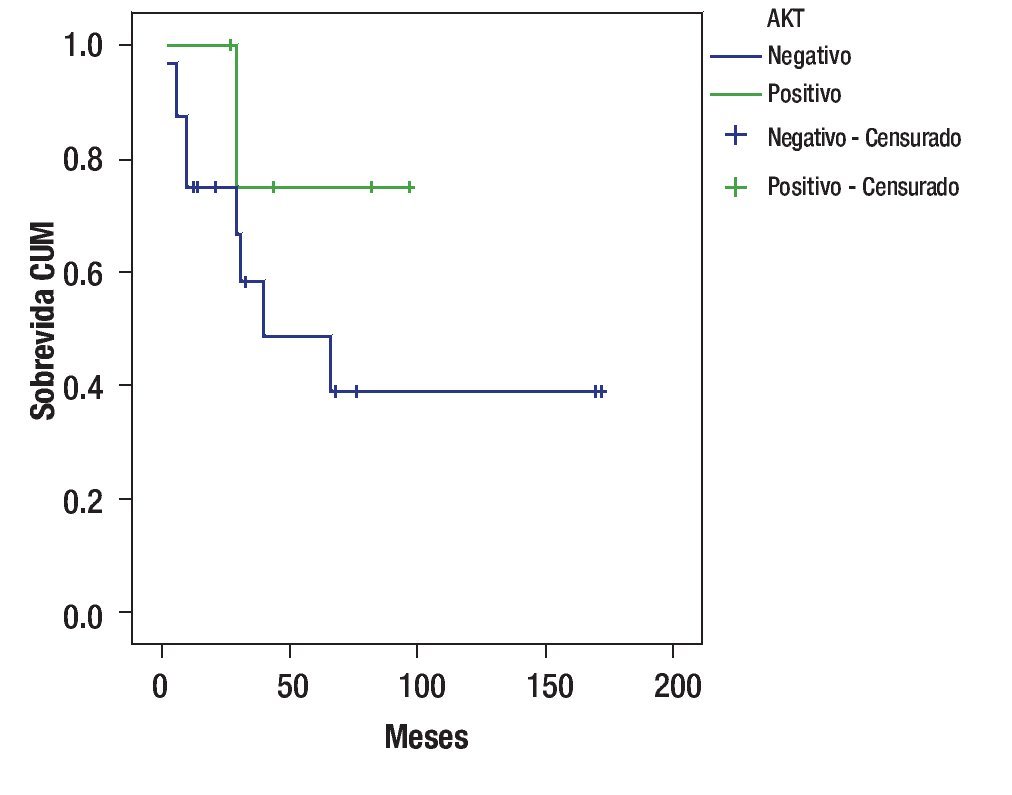
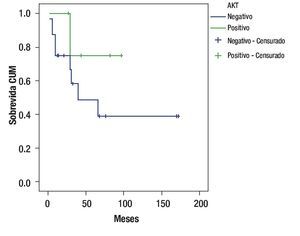
De acuerdo con la sobre expresión de AKT, la sobrevida fue de 75% a 97 meses en pacientes que sobre expresaron AKT, contra un 38.8% a 172 meses en quienes tuvieron AKT negativo: p = 0.2501; OR 0.40; IC 95% 0.65 - 2.469 (Figura 2).
Figura 2. Sobrevida de acuerdo a la sobre expresión de AKT
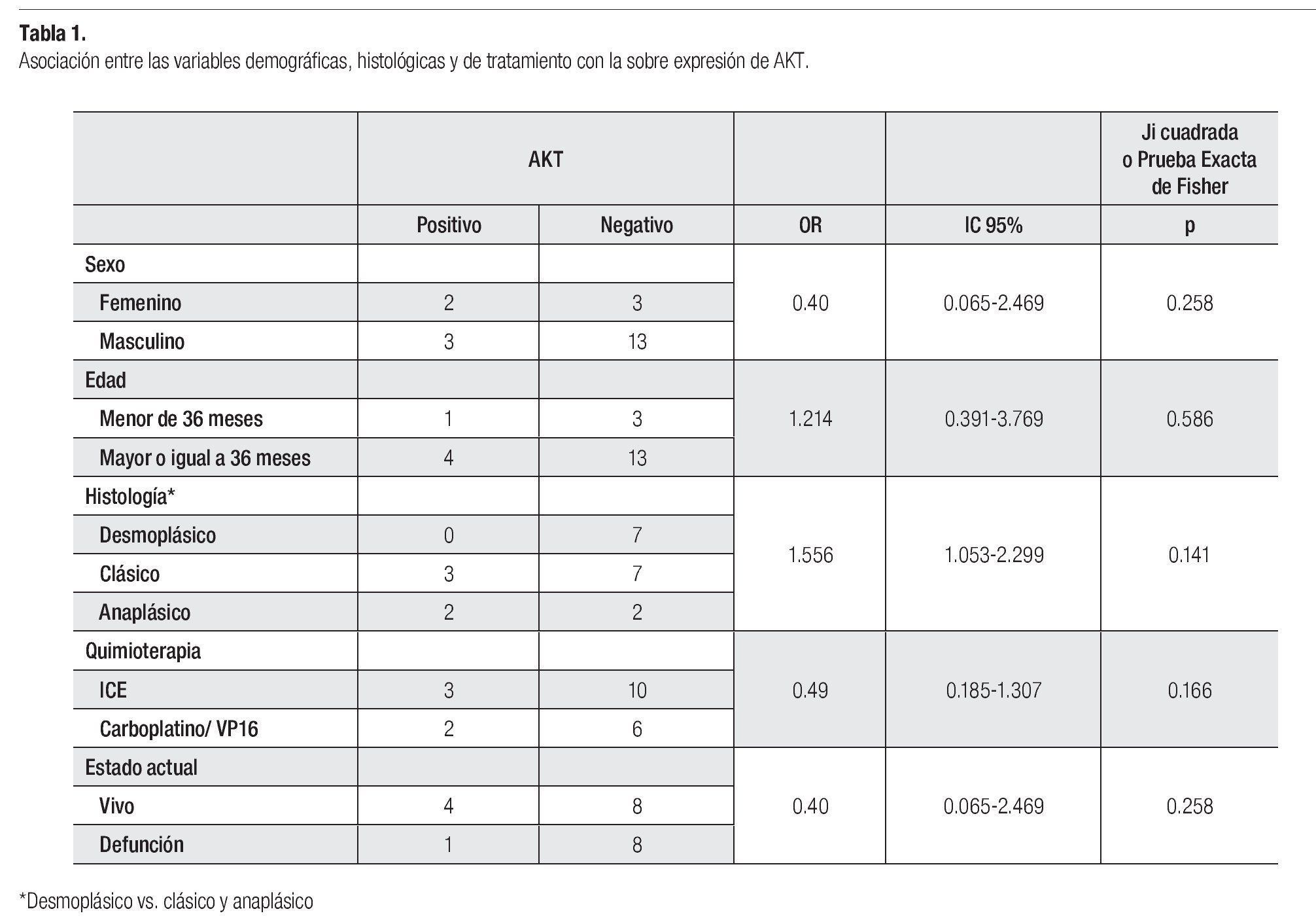
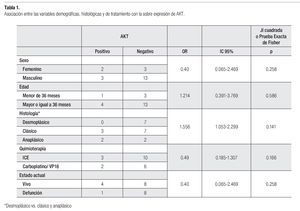
No hubo asociación entre el sexo, la edad, la histología ni la quimioterapia con la sobre expresión de AKT. Sin embargo, cabe destacar que 66% de las niñas sobre expresaron AKT vs. 23% de los varones. De los tumores con variedad clásica y anaplásica respectivamente, 42% y 50% sobre expresaron AKT vs. ninguno de la variedad desmoplásica (Tabla 1).
¿ DISCUSIÓN
El conocimiento de los diferentes mecanismos biológicos implicados en el crecimiento y progresión tumoral alienta hacia un mejor sistema de estratificación. El identificar marcadores moleculares puede conducir al desarrollo de drogas dirigidas, ajustando el tratamiento de acuerdo al nuevo portafolio de biomarcadores moleculares, ofreciendo a los pacientes un mejor pronóstico. Los parámetros clínicos (metástasis, tumor residual y edad) generalmente usados para estratificación de riesgo, no son completamente satisfactorios en predecir la respuesta a la terapia. Uno de los objetivos del presente estudio fue evidenciar al AKT como un oncogén para complementar la estratificación de riesgo en los meduloblastomas. Basados en la experiencia reportada en la literatura internacional de AKT, podemos afirmar que el AKT está implicado tanto en vías de diferenciación celular de linfomas, como tumores de SNC tipo meduloblastoma para proliferación celular y antiapoptótico, el cuál es un oncogén que si se sobre expresa, hay mayor proliferación celular, lo anterior coincide con lo reportado en su estudio por Hartmann W y colaboradores9 que al analizar 22 muestras de meduloblastoma observaron que la proliferación celular dependió de la presencia de AKT.
Llama la atención que nuestros hallazgos son contrarios a esta observación; de hecho, sobre expresar AKT pareciera asociarse a factor protector, encontrando una sobrevida de 75% en aquellos que sobre expresan AKT contra 38.8% de los que no lo expresaron. Estos hallazgos pueden estar determinados por el tamaño de muestra pequeño, en especial en el primer grupo.
La presentación desmoplásica del tumor, que conlleva un mejor pronóstico en general, no sobre expresó AKT en nuestra serie. En contraste, la expresión de AKT se identifico en variedad histológica más agresiva en 42.85% de tipo clásico y un 50% de tipo anaplásico, siendo este último el de peor pronóstico. Aunque ésta asociación no resultó significativa, si se puede observar una tendencia de mayor sobre expresión en aquellos tumores con histologías más desfavorables. Wtodarski P y colaboradores11 encontraron que ocho de 10 tumores evaluados sobre expresaron AKT mediante western blot, siete de los cuales fueron de histología clásica y uno desmoplásico.
Respecto a nuestro porcentaje de sobrevida, 57.1% de los pacientes incluidos en nuestro estudio se encuentran vivos; en los estudios realizados por Crawford JR y colaboradores12 y Raimondi AJ y colaboradores13 refieren una sobrevida similar, donde los pacientes que tienen una resección parcial o total del meduloblastoma no metastásico tienen un mejor pronóstico que los de biopsia, seguidos de radioterapia donde la sobrevida a cinco años es de 78% contra 43%.
En cuanto a la edad de diagnóstico de meduloblastoma, la sobrevida en mayores de 36 meses fue de 46.51%, considerablemente menor con lo reportado por Rossi A y colaboradores,14 donde informan una sobrevida en este mismo grupo de edad de hasta 70% combinado con quimioterapia y radioterapia. Creemos que esto está dado por el diagnóstico tardío de estos tumores, y que en muchas ocasiones tienen involucro de tallo o diseminación a neuroeje al diagnóstico.
El objetivo general del presente estudio fue encontrar una asociación de mayor riesgo en aquellos pacientes con meduloblastoma que expresan AKT y a pesar de no encontrar dicha asociación, hay que considerar que el tamaño de muestra fue pequeño y que sí pareciera existir una asociación entre la sobre expresión de AKT con sus variedades histológicas más agresivas y la asociación de meduloblastoma desmoplásico, al no sobre expresar AKT es de buen pronóstico.
Por lo que consideramos es importante dar seguimiento al estudio hasta tener conclusiones más sólidas y para dar pie a estudios posteriores de terapias moleculares dirigidas.
Correspondencia: Dr. J. Enrique López Aguilar.
Av. Cuauhtémoc No. 330 Col. Doctores, 06720.
Teléfono: 5627 6900, extensión 22528.
Correo electrónico:elopezaguilar@hotmail.com