¿ ANTECEDENTES
Los tumores cerebrales representan el tipo de tumor sólido más frecuente en la edad pediátrica. A nivel mundial, la incidencia se encuentra entre 10 y 18 casos por millón por año. La frecuencia de presentación de los tumores cerebrales es de 12%.1 Los más frecuentes son los que se derivan de la glía, hasta en 60% y de estos los astrocitomas.1,2 La expectativa de vida de acuerdo a la SEER (Surveillance, Epidemiology, End Result) a los cinco años es de 50%.3,4-7
El conocimiento de los factores pronósticos, permite adecuar el tratamiento a éstos pacientes. A pesar de que se conocen algunos factores pronósticos, continúa habiendo un grupo de pacientes con evolución desfavorable, por lo que es importante determinar los factores que llevan a un peor pronóstico, y de esta manera diferenciarlos y tratarlos de una manera más intensiva.
Los factores de mal pronóstico ya conocidos son: edad menor de tres años, ya que a estos pacientes no se les puede ofrecer radioterapia, así como localización e histología. Se han identificado también diversos marcadores biomoleculares que influyen en el pronóstico de estos pacientes. Entre ellos los factores de crecimiento celular que son proteínas que en condiciones fisiológicas regulan el crecimiento y la diferenciación celular. La sobre expresión de estos se asocia por lo general a una mayor agresividad biológica y su identificación ha permitido el diseño de nuevas estrategias terapéuticas.5
La proteína p53 es una cadena de 393 aminoácidos, llamada el guardián del genoma, promueve los mecanismos de reparación del DNA mediante detección y detención de células con daño de DNA en la fase G1 del ciclo celular. Alternativamente, puede inducir también muerte celular mediante la activación de la apoptosis cuando existen daños genómicos irreparables. El gen que codifica para la proteína p53 se ubica en el cromosoma 17, actúa como factor de transcripción uniéndose a promotores de genes implicados en la reparación de ADN.8-12
La detección de una sobreexpresión de productos de p53 mediante IHQ se ha asociado con la identificación de mutaciones en el gen TP53 en un gran número de estudios clínicos.13-26
El objetivo del presente estudio fue determinar si existe asociación entre la sobreexpresión de p53 con la sobrevida de pacientes con astrocitoma y su asociación con la histología de alto o bajo grado.
¿ MÉTODOS
El presente estudio se realizó en el Hospital de Pediatría Centro Médico Nacional Siglo XXI, durante 2010; se analizaron los expedientes de pacientes diagnosticados con astrocitoma durante el periodo comprendido entre 1995 a 2009. El protocolo fue aprobado por el Comité local de investigación (R-2008-3603-26). Se incluyó a todos los pacientes menores de 17 años con diagnóstico de astrocitoma establecido en el servicio de Patología del Hospital de Pediatría del Centro Médico Nacional Siglo XXI, que contaban con expedientes completos así como muestra del tumor en bloque de parafina. Todos los pacientes con astrocitomas de alto grado recibieron tratamiento por el servicio de Oncología del Hospital, con el protocolo ICE (carboplatino: 400 mg/m2/día, en día uno, seguido de ifosfamida: 2 g/m2 días uno, dos, tres y etopósido: 100/mg/m2/día días uno, dos tres cada cuatro semanas por cuatro cursos), seguido de radioterapia (5400 cGy). Aquellos pacientes con astrocitomas de bajo grado recibieron esquema de quimioterapia con carboplatino 350 mg/m2SC días uno y dos, vincristina 2 mg/ m2SC día uno, en cursos repetidos cada cuatro semanas por cuatro cursos seguidos de radioterapia. Se eliminaron a todos aquellos pacientes que abandonaron el tratamiento o cuyas muestras no pudieron ser procesadas por muestra insuficiente.
Se tomaron de los expedientes los siguientes datos: edad al diagnóstico, sexo, diagnóstico histopatológico, localización de la tumoración, tipo de cirugía así como volumen tumoral residual, fecha de diagnóstico y fecha de defunción o última cita.
Luego de la captura de todos aquellos pacientes con diagnóstico de astrocitoma por patología, se buscaron expedientes y se recolectó información sobre edad al diagnóstico, sexo, localización de tumor, fecha de diagnóstico, quimioterapia utilizada, dosis de RT en aquellos casos en que se utilizó, fecha de recidiva en caso de presentarse y estado actual del paciente, obteniendo con ello el periodo libre de enfermedad y sobrevida global.
Mediante técnica de inmunohistoquímica, se realizó la determinación de expresión de p53 en la célula de tejido tumoral conservado en los bloques de parafina y tejido fresco en congelación, los primeros fueron del servicio de patología de éste hospital, en tanto que los segundos, se encontraban en mantenimiento en el laboratorio de investigación de tumores del SNC.
La técnica de inmunohistoquímica se realizó con registro de los siguientes datos: número de biopsia o pieza quirúrgica, nombre del anticuerpo a detectar y nombre del médico solicitante. Se buscó un bloque con un control positivo (testigo) al anticuerpo para p53, en nuestro caso se utilizó como testigo cáncer de mama. Se realizaron los cortes histológicos de los bloques de parafina, de un grosor de cuatro micras, montados en laminillas tratadas con poli-l-lisina y en una sola laminilla se colocaron el caso y el testigo. Previa desparafinación de las laminillas a 60°C durante 30 minutos, colocación posterior en xilol y etanol, se realizó la hidratación de los bloques de parafina. Posteriormente se realizó la recuperación de epítopes, mediante el proceso de desenmascaramiento de epitopes, con solución de desenmascaramiento de citrato de sodio (Diva Decloaker 10X´, Biocare Medical, DV 2004MX, Preparación a 1X´). Se procedió a realizar inmunotinción mediante el sistema de biotina-estreptavidina-peroxidasa, en la que se incubó el anticuerpo primario anti-p53 (de ratón antihumano, CLONA DO7), el anticuerpo secundario biotinilado (DAKO BIOTINYLATED LINK UNIVERSAL, REF K0690) y se aplicó el complejo estreptavidinaperoxidasa con cuatro moléculas de peroxidasa para amplificar la señal (DAKO ESTREPTAVIDIN-HRP, REF K0690), posteriormente se reveló con cromógeno 3,3 D-aminobendicina (DAB) (BIOCARE MEDICAL, DAB CHROMOGEN KIT, REF DB801L).
Realizando una contratinción con hematoxilina de Gill por un lapso de 3 minutos y deshidratación nuevamente de las muestras, se realizó lectura al microscopio de luz.
Se consideró como sobreexpresión cuando más de 50% de los campos estudiados mostraron inmunorreactividad nuclear positiva.
¿ RESULTADOS
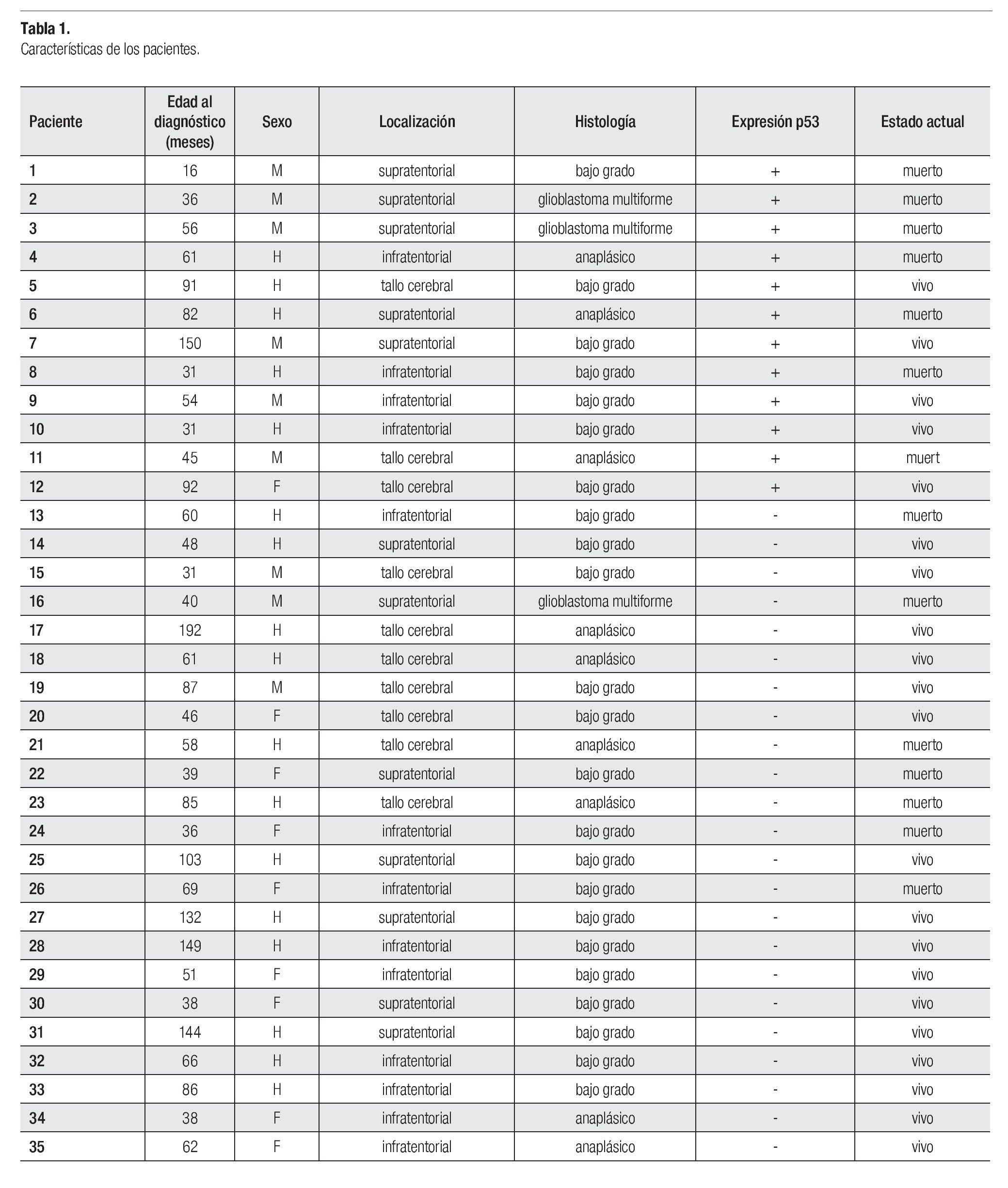
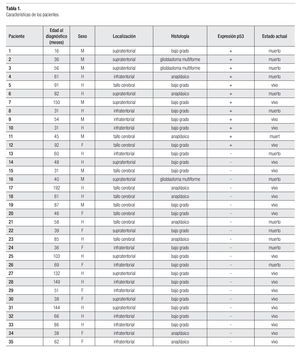
Se incluyó un total de 35 pacientes; 18 niñas (51.4%) y 17 niños, con una relación mujer:hombre de 1.05:1. La media de edad al momento del diagnóstico fue de 70.4 meses (16 a 192 meses). Sólo cuatro pacientes fueron menores de tres años de edad. Con respecto a la localización, 13 pacientes (37.1%) tuvieron astrocitoma de localización infratentorial, 12 (34.3%) fueron supratentoriales y 10 (28.6%) localizados en tallo cerebral. De acuerdo con el grado de malignidad, 23 pacientes (65.7%) cursaron con astrocitoma de bajo grado, nueve pacientes (25.7%) tuvieron astrocitoma anaplásico y tres (8.6%) fueron glioblastoma multiforme (Tabla 1).
De los pacientes incluidos, 21 (60%) están vivos; con 64% de los hombres vivos vs. 55% de las niñas (p = 0.418). La mediana de supervivencia de todo el grupo fue de 32 meses (dos a 169 meses). De acuerdo con la edad, l 25% de los pacientes menores a 36 meses están vivos, en comparación con el 64.5% de aquellos mayores de tres años de edad (p = 0.165).
La mortalidad según la histología fue seis pacientes con astrocitoma de bajo grado (26%). Cinco pacientes con astrocitoma anaplásico (55.5%) y tres pacientes (100%) con glioblastoma multiforme ya murieron (p = 0.026).
De los pacientes con localización supratentorial, 50% murieron, comparado con un 38.4% de aquellos con localización infratentorial y 30% de los de localización en tallo cerebral (p = 0.628).
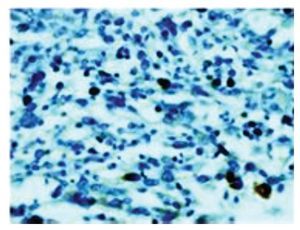
Al realizar la inmunohistoquímica encontramos que 23 pacientes (65.7%) fueron negativos para la sobreexpresión de p53; de los cuáles, 16 (69.5%) están actualmente vivos vs. 41.6% de aquellos con sobreexpresión de p53 positiva (p = 0.109), como se muestra en la Figura 1.
Figura 1. Sobreexpresión p53 en paciente con astrocitoma.
Dos de los tres pacientes (66.6%) con glioblastoma multiforme, sobreexpresaron p53, mientras que solo tres de los nueve pacientes (33.3%) con astrocitoma anaplásico y siete (30.4%) pacientes con astrocitoma de bajo grado, fueron positivos para la sobreexpresión de p53 (p = 0.460).
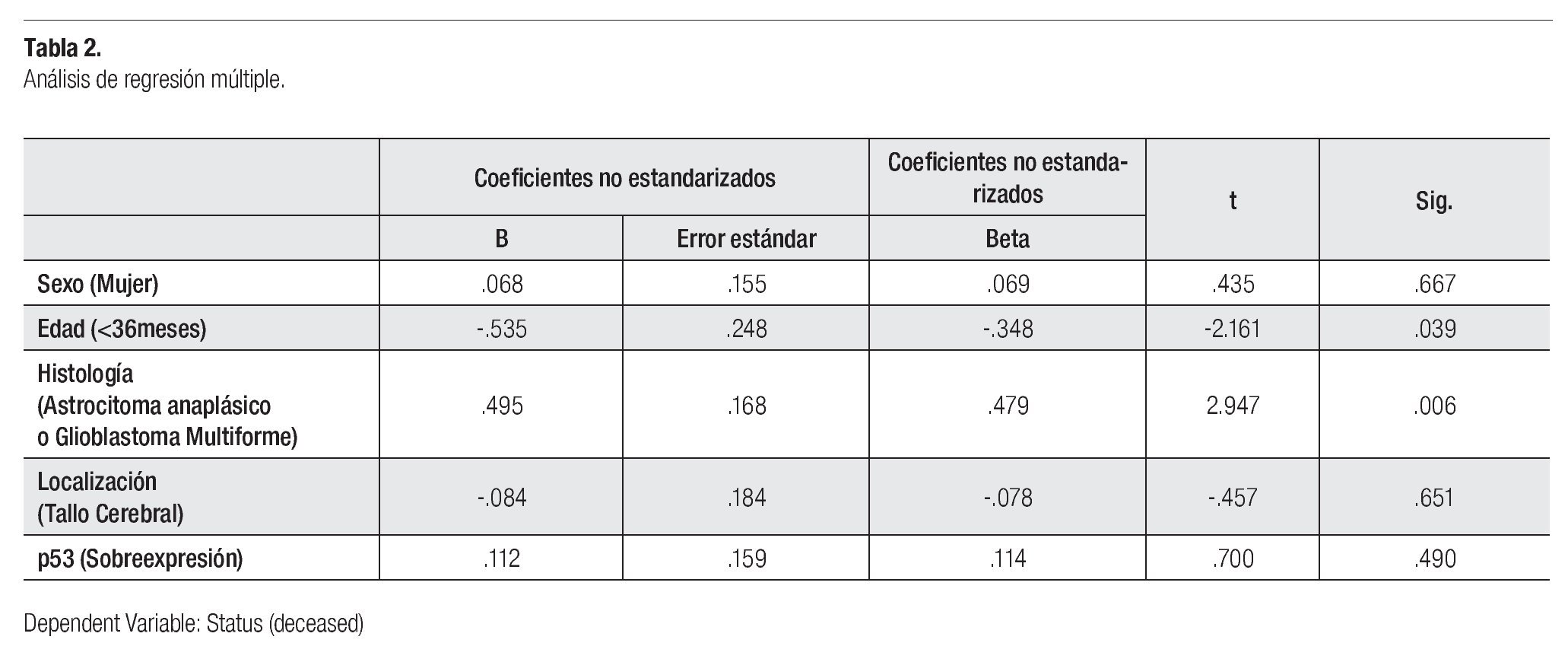
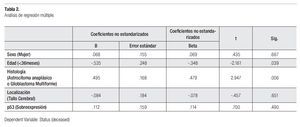
Tras un análisis de regresión múltiple, se evidenció que sólo una edad menor a tres años (p = 0.39) y la histología de alto grado (astrocitoma anaplásico y glioblastoma multiforme) (p = 0.006) fueron predictores independientes de sobrevida (Tabla 2).
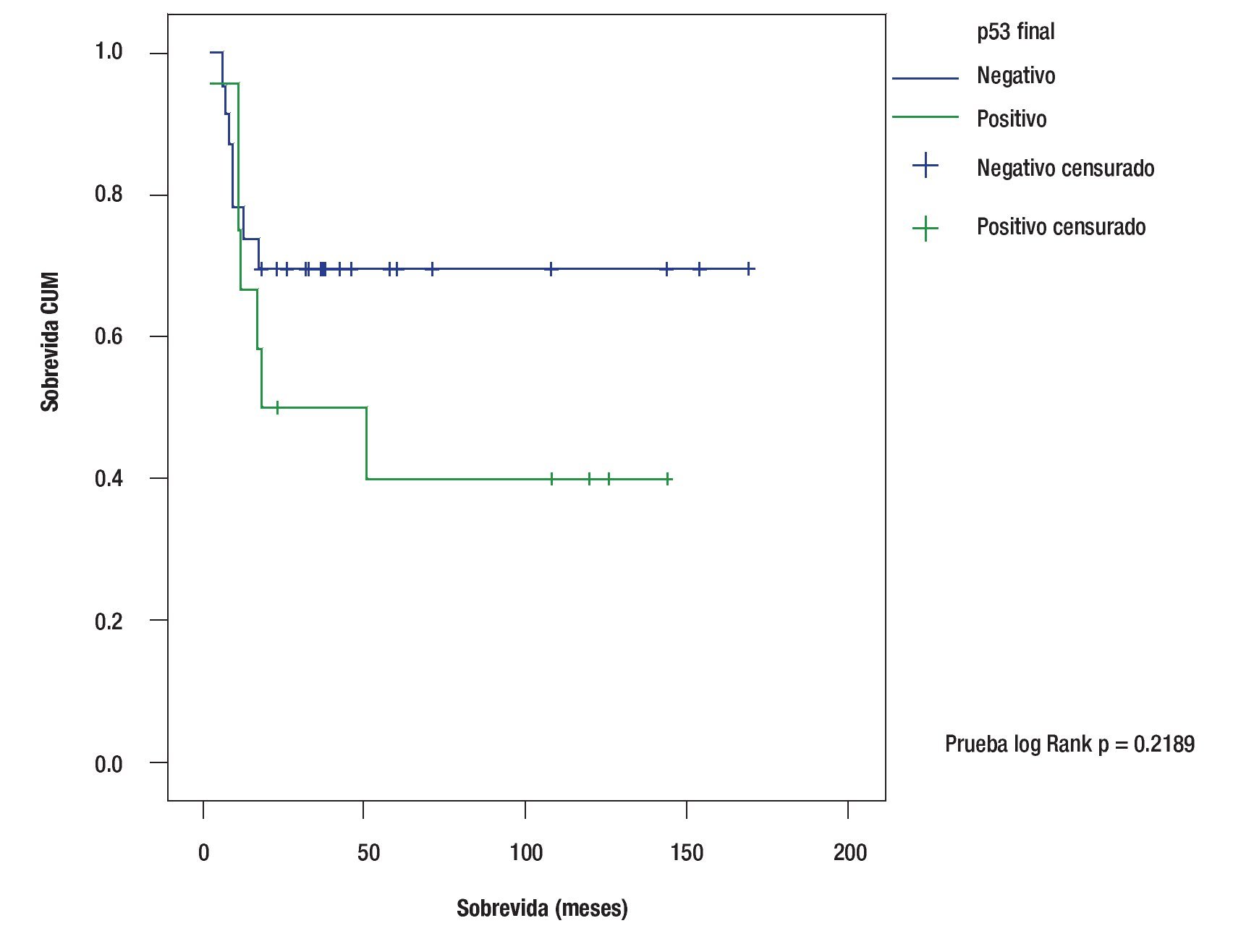
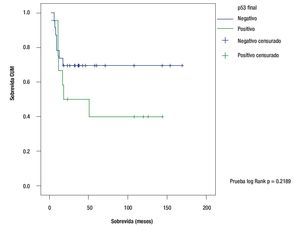
La sobrevida de acuerdo al método de Kapplan Meier para los pacientes que no sobreexpresaron p53 fue 69.5% a 120 meses contra 40% a 120 meses para aquellos con sobreexpresión de p53: Log Rank test p = 0.2189 (Figura 2).
Figura 2. Curvas de sobrevida, con base en sobreexpresión p53.
El riesgo (OR) de desarrollar glioblastoma multiforme cuando existe sobreexpresión de p53 es de 4.4 (0.356 - 54.36).
¿ DISCUSIÓN
Aunque se han probado diferentes abordajes terapéuticos alrededor del mundo para mejorar la sobrevida a largo plazo en pacientes pediátricos con gliomas malignos, ésta no excede 60%. Es bien conocido que tumores histológicamente idénticos tienen diferentes comportamientos biológicos y muestran distintos marcadores biológicos lo que sugiere que estos tumores son un grupo heterogéneo de la misma enfermedad
El conocimiento de los diferentes mecanismos biológicos implicados en el crecimiento y progresión tumoral alienta hacia un mejor sistema de estratificación. La separación en grupos de riesgo de acuerdo a marcadores moleculares permitirá realización de nuevos protocolos terapéuticos, con intensificación de tratamientos quimio y radioterapéuticos para aquellos pacientes ubicados en el grupo de alto riesgo, permitiendo dar tratamientos menos tóxicos a aquellos pacientes de grupos de bajo riesgo. Adicionalmente, el identificar marcadores moleculares puede conducir al desarrollo de drogas dirigidas, lo que -en combinación con la QT y RT- puede ofrecer a los pacientes con astrocitoma y glioblastoma un mejor pronóstico.13-18
La importancia de identificar células de iniciación en tumores cerebrales es que ofrece conocimiento acerca de la fisiopatología en pacientes pediátricos con estas neoplasias; provee una nueva visión o idea de los mecanismos de resistencia de los tejidos cancerosos a los tratamientos actuales e identifica nuevos blancos celulares para el tratamiento.
La sobreexpresión de p53 en gliomas pediátricos malignos ha sido previamente reportada por Pollak y colaboradores y Ganigi PM y colaboradores. Aunque en nuestra serie, la prevalencia de la sobreexpresión de esta proteína fue ligeramente más baja que la reportada por Ganigi, ésta es similar a la reportada por Pollack (34% vs. 53.7% y 35.6% respectivamente), confirmamos que el hallazgo de ambos autores que los pacientes con sobreexpresión de p53 presentan un peor pronóstico (en nuestra serie, 69% en los niños que no expresan p53, están vivos vs. 40% de los que sobreexpresan p53). Nuestro porcentaje de sobrevivencia es mayor que el reportado por el Children´s Cancer Group en 2002 (44% y 17% respectivamente) y puede deberse a los diferentes protocolos quimioterapéuticos y de radiación, con una distribución desigual de astrocitomas de bajo grado y glioblastomas malignos en ambas muestras.19-28
En contraste con Pollack y colaboradores, encontramos que los niños por debajo de cuatro años de edad no sobreexpresaron p53 de manera menos frecuente que los mayores de cuatro años (44% vs 30% respectivamente).
De manera similar, edades menores a tres años, continúan como una variable independiente importante, dado que estos niños no pueden recibir RT durante su tratamiento por el riesgo de importante daño neurológico con la radiación en un cerebro en desarrollo.28
La asociación entre sobreexpresión de p53 y la histología tumoral ha sido también previamente identificada; es mucho más frecuente en glioblastomas que en astrocitomas anaplásicos o gliomas mixtos. En nuestra serie, encontramos un riesgo 4.4 veces mayor de tener glioblastoma multiforme si se sobreexpresa p53, aunque estos resultados deben ser tomados con cautela por el pequeño número de muestra.29-36
Correspondencia: Dr. Enrique López Aguilar.
Av. Cuauhtémoc 330, Col. Doctores, Del. Cuauhtémoc, CP 01620. México, D. F.
Teléfono: 56276 9900 Ext. 22500.
Correo electrónico:elopezaguilar@hotmail.com