¿ INTRODUCCIÓN
En nuestro país los tumores del sistema nervioso central representan 10% de los cánceres infantiles (incluyendo leucemias y linfomas).1 De ellos los astrocitomas son los más comunes.2 Se clasifican según la OMS en una escala de grados según la conducta biológica,3,4 y con esta clasificación se predice: respuesta al tratamiento y pronóstico.4
El pronóstico de los astrocitomas grado IV, en series que contienen pacientes pediátricos y adultos, la supervivencia media raramente excede los 12 meses.3,4 Un estudio realizado en el Hospital de Pediatría del Centro Médico Nacional Siglo XXI, en astrocitomas de alto grado, en el que se utilizó quimioterapia (ifosfamida, carboplatino y etopósido) previo a la radiación, consiguió supervivencia global a 60 meses de 67% de los casos y libre de enfermedad de 56%.5
El comportamiento molecular de los tumores cerebrales en los niños es diferente al de los adultos, por ejemplo, aunque los gliomas de alto grado de adultos sobreexpresan la proteína EGFR, la amplificación del gen es rara en niños. Las observaciones obtenidas de los glioblastomas multiformes en adultos no son extrapolables a la población pediátrica.6-8
La estratificación por riesgo es muy importante. El análisis del riesgo puede diferenciar a los pacientes en un grupo que requiera tratamiento agresivo de un grupo de bajo riesgo para el que es suficiente un protocolo terapéutico de menor agresividad.9
Sólo pocas células atípicas dentro de la masa tumoral son responsables del crecimiento y recurrencia de algunos cánceres cerebrales. Son células troncales, transformadas a tipo celular de sistema nervioso central con habilidad de iniciar cáncer, una célula tumoral cerebral troncal.10 Las células troncales tienen las capacidades que requieren las células para ser cancerosas.11-13
El marcador de células troncales CD133 se describió en células humanas hematopoyéticas14,15 y células neuroepiteliales murinas.16,17 Su función es desconocida, pero se reconoce como marcador de células troncales de tejidos normales y cancerosos.14-25 Este marcador podría tener relación con la carcinogénesis por dos vías: la tumorigénesis y la angiogénesis.
Las células tumorales CD133+ son tumorigénicas. Singh (2003),10 describió in vitro que las células CD133+ de un glioblastoma multiforme de adulto son capaces de generar esferas tumorales y cáncer xenográfico fenotípicamente igual que el del paciente del que se obtuvieron estas células.
Se ha estudiado la expresión de CD133 en astrocitomas de adultos y la expresión no es detectable en tumores de bajo grado, y es positiva hasta 96% en el estadio IV. La expresión de CD133 concede un riesgo de 17.46 (IC 95%, 5.49-55.52) y la organización topológica en agrupamiento un riesgo 5.62 (IC 95%, 2.04-15.51) p <0.001 como elementos pronósticos significativos de menor supervivencia global independientes del grado OMS del tumor, edad, o extensión de la resección, resultados similares para supervivencia libre de progresión con células positivas y con formación en grupos (OR, 8.13; 95% IC, 3.63-18.25; p <0.001) y (OR, 4.67; 95% IC, 1.94-11.23), respectivamente además la expresión elevada de CD133 se asocia a mayor incidencia de recaída tumoral.26
El comportamiento molecular de los astrocitomas en la edad pediátrica, no se ha elucidado por completo y se ha observado que sólo una parte de las células dentro del tumor tiene capacidad carcinogénica en modelos in vivo, y expresan el marcador de células troncales de cáncer CD133. La expresión de este marcador en astrocitomas de pacientes adultos se asocia con el pronóstico y grado de la enfermedad; sin embargo, en población pediátrica, el comportamiento molecular de los gliomas es diferente al de los adultos, y no se ha establecido la expresión de CD133 ni su asociación con el pronóstico de la enfermedad.
¿ OBJETIVO
Determinar si la expresión de la molécula CD133, en los astrocitomas de pacientes pediátricos, se asocia con el pronóstico de los mismos.
¿ MÉTODOS
Se realizó un estudio ambispectivo, observacional, longitudinal y comparativo, constituido por una cohorte que se clasificó y comparó en función de la expresión de CD133. La población que se examinó estuvo constituida por pacientes con astrocitoma de alto y bajo grado que fueron diagnosticados en el Hospital de Pediatría del Centro Médico Nacional Siglo XXI entre enero de 1995 y diciembre de 2008.
Se incluyeron pacientes con diagnóstico de certeza, de género indistinto y que no hubiesen recibido ningún tratamiento al momento de obtenerse la muestra de tejido tumoral que se usó para este estudio, con un tiempo mínimo de observación de dos meses. Se obtuvo muestra del tejido tumoral la cual se mantenía conservada en parafina en el archivo histológico del servicio de patología. De esta muestra, un médico patólogo, ciego a la evolución del paciente, efectuó diagnóstico histológico y determinó el grado de malignidad con la escala de la OMS. Por otro lado se realizó inmunohistoquímica para determinar la expresión de la molécula CD133 en el tumor.
Inmunohistoquímica: De las muestras parafinizadas del tumor se realizaron cortes de tres micras de espesor, se desparafinaron y rehidrataron (tren de alcoholes y agua deionizada). Se expuso el epitope con citrato y presión. Se utilizó anticuerpo policlonal primario de conejo anti CD133 (1:100 clona C24B9, Cell Signaling Danvers, MA, USA) y se incubó por media hora. Se agregó anticuerpo secundario (anti-conejo) que se incubó por una hora. Se reveló la reacción con diaminobenzidina y contra tinción con hematoxilina.
El control negativo se sometió a toda la metodología, excepto la aplicación de anticuerpo primario. Se caracterizó un control positivo de riñón sano pediátrico, en el que se observó tinción positiva para las células glomerulares únicamente. La tinción fue citoplasmática y membranal, con una intensidad adecuada. La reacción se caracterizó como ausencia de expresión, expresión positiva (>1%) y se clasificó en moderada (<50%) y alta (>50%).
La observación de la inmunohistoquímica fue realizada por un médico neuropatólogo experto, quien revisó 10 campos de alta resolución, y estableció el porcentaje de positividad.
Estadística: Se utilizó estadística descriptiva para caracterizar la muestra. Se determinó la kurtosis y lordosis para establecer el tipo de estadística apropiada para el análisis. Se realizó curva de supervivencia con función de supervivencia actuarial y se probó la diferencia entre los grupos con la prueba de Log Rank. Se realizó prueba de Ji cuadrada para determinar la asociación de las variables cualitativas y el OR para determinar el riesgo de morir.
¿ RESULTADOS
Se obtuvo una muestra inicial de 32 casos, dos se tuvieron que descartar por mala calidad de la muestra tumoral (ambos lesiones de bajo grado), el seguimiento fue de seis a 169 meses. La muestra (Tabla 1) se constituyó por pacientes del género masculino en 50% de los casos. Menores de tres años representaron 10% de la muestra, desde tres años y hasta seis años 40% de la muestra, mayores de seis años hasta nueve años 16.7% de la muestra, nueve a 12 años el 13.3% de los casos y mayores de 12 años 20% de los casos, la mediana de edad fue de 78.58 meses (13.2 años) con un rango de 16 a 192 meses. La sobrevivencia global fue de 56.7% (17/30) y el rango fue de dos a 169 meses
Los tumores fueron de bajo grado en 70% de los casos (21/30), astrocitoma anaplásico 20% (6/30) y glioblastoma multiforme 10% (3/10). Respecto a la localización del tumor: supratentorial 33.3% de los casos (10/30), infratentorial 43.3% (13/30) y en el tallo cerebral en 23.3% de los casos (7/30). Catorce fueron positivos para CD133 (Figura 1), la intensidad de la tinción respecto al control positivo fue igual o menor, no hubo ningún caso que rebasara la intensidad del control. Además se notó que las células CD133 positivas tuvieron una tinción citoplasmática y membranal y que las células positivas no se observaron en aglomerados, sino en forma dispersa.
Figura 1. Fotografia de reacción de inmunohistoquímica positiva para CD133. La intensidad de la tinción de la muestra, es menor que el control.
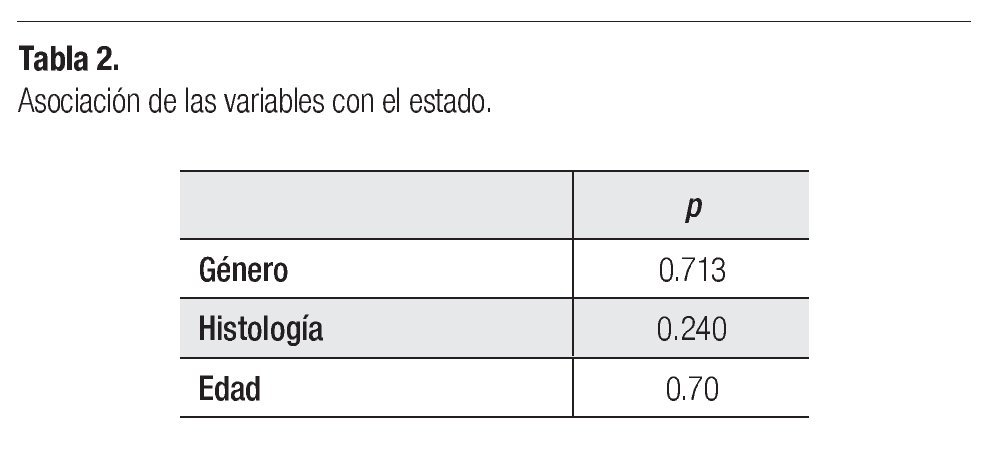
Se buscó asociación entre diversas variables (Tabla 2 y 3). En cuanto al género y la sobrevivencia, encontramos que hubo seis mujeres muertas y siete hombres al final del estudio (p = 0.713). Respecto a la histología tumoral y el estado (Figura 2), hubo siete pacientes con tumor de bajo grado muertos (33.3% de los casos de astrocitomas de bajo grado), de astrocitoma anaplásico murieron cuatro (66.66% de los casos de astrocitomas anaplásicos) y en cuanto a los pacientes con glioblastoma multiforme, 66.6% de los pacientes estuvieron muertos para el final del estudio; la prueba de Ji cuadrada para determinar asociación entre el estado y la histología tumoral resultó con valor p = 0.240. En cuanto a la relación de la edad y el estado, se clasificó la muestra en menores de 36 meses y mayores de esta edad. De los menores de 36 meses, todos estuvieron muertos al final del estudio, y en cuanto a los mayores, murió el 37.03% del grupo de esta edad (10/27 casos; p = 0.70).
Figura 2. Relación entre la expresión de CD133 y la histología tumoral p = 0.632.
En cuanto a la expresión de CD133 y el estado encontramos que los casos CD133- murieron siete pacientes (43.74% de los casos negativos) y de los casos CD133+ murieron seis pacientes (42.85% de los casos CD133+) la p= 0.626, OR 0.984 IC 95% 0.526-1.842)
Los astrocitomas de bajo grado fueron principalmente negativos para al marcador CD133 (52% de los casos); los astrocitomas anaplásicos fueron principalmente positivos en la inmunohistoquímica para CD133 (66.6% de los casos) igualmente en el caso de los glioblastomas multiformes (66.6% de los casos) la mitad del grupo de glioblastoma multiforme con CD133+ estuvo muerto para el final del estudio.
La curva de sobrevida mostró una diferencia entre el grupo CD133+ y el grupo CD133- fue de 22.5%, la prueba estadística Log Rank Test mostró una significancia estadística de 0.2749.
¿ DISCUSIÓN
Los astrocitomas son cánceres que provocan gran morbimortalidad, las características de la muestra que se estudio coinciden con lo reportado de la epidemiología de estas neoplasias en cuanto a la localización tumoral, histología tumoral y pronóstico para la edad en la población pediátrica.2
La molécula CD133, es un marcador de células troncales de cáncer,10 se ha relacionado positivamente con el pronóstico de varias neoplasias, incluida el glioblastoma multiforme.26 En varios tumores pediátricos como neuroblastoma la expresión también se relaciona con mal pronóstico.27
En este estudio logramos demostrar una diferencia de sobrevida de 22.5% entre los tumores CD133+ y CD133- siendo peor para los primeros, como se observa claramente en la curva de Kaplan Meyer; sin embargo, no se logró significancia estadística del resultado debido a que la muestra es heterogénea en cuanto al tipo histológico (sólo 10% de la muestra fueron glioblastomas multiformes). Por otro lado se demostró que los astrocitomas de alto grado (astrocitoma anaplásico y glioblastoma multiforme) expresan en mayor proporción CD133 (66.6% de los casos) que los astrocitomas de bajo grado (52% de los casos). Estos resultados descriptivos coinciden con las observaciones realizadas en adultos en el sentido de que entre mayor agresividad tumoral, mayor expresión de células iniciadoras de cáncer,26 menor supervivencia, y no logramos observar si aquellos tumores de bajo grado con células CD133 positivas degeneraron en progresión tumoral.
Proponemos que el seguimiento de los pacientes que tuvieran astrocitoma de bajo grado con positividad para CD133 deberá ser más prolongada, con el fin de determinar el pronóstico de estos tumores, pues es posible que éstos al contener células troncales de cáncer puedan devenir posteriormente en glioblastomas secundarios como se había notado en los experimentos in vitro10 y las observación in vivo.26
La cantidad de células dentro de un tumor que son capaces de desencadenar cáncer son una minoría, las CD133+, bajo este enfoque, es probable que no siempre se logren observar con la técnica de inmunohistoquímica aún cuando sí existan dentro de la masa tumoral.26 Por lo tanto, proponemos que se empleen técnicas que logren identificar las células CD133+ (la minoría dentro de la masa tumoral) con otras técnicas más sensibles como la citometría de flujo, de la misma manera en que se ha hecho para otras neoplasias.
El marcador CD133 se correlaciona en diversos estudios con angiogénesis, que es un fenómeno indispensable para la supervivencia de un tumor, pues de allí depende su nutrición.13 Estudios de cánceres que dependen de la angiogénesis para determinar su pronóstico como el mieloma múltiple,28 han demostrado que la molécula prominin es un marcador de células endoteliales madre27 y no sólo eso, la agrupación de las células CD133+ alrededor de vasos otorga un peor pronóstico para los glioblastomas.26 Por lo tanto, se hace obligatorio que a los tumores con expresión positiva para CD133 se les otorguen esquemas terapéuticos más agresivos.
Conocer las vías moleculares que subyacen al cáncer ha logrado que se construyan moléculas dirigidas a blancos terapéuticos muy específicos, y que se mejore en forma ostensible el pronóstico de los pacientes. Este tipo de estudios constituyen la primera aproximación al comportamiento biológico de un tumor y son indispensables para determinar hacia dónde se dirigirán los esfuerzos de la investigación básica y clínica dentro de los siguientes años. Nuestra investigación, es la primera en informar la expresión de CD133 en astrocitomas de pacientes pediátricos, lo que constituye un avance importante en el progreso de la oncología pediátrica.
El cáncer del sistema nervioso central tiene un gran impacto en la morbimortalidad de aquellos que lo padecen y es indispensable, dada la incidencia de esta patología, orientar más esfuerzos económicos y humanos a su conocimiento.1
¿ CONCLUSIONES
1. Existe una diferencia de la supervivencia de pacientes con astrocitomas CD133+ respecto a los CD133 negativos de 22.5%, pero no se observó significancia estadística de esta observación
2. La molécula prominin-1 se expresa más en tumores con histología de alto grado que de bajo grado, pero no hay significancia estadística de esta observación
3. A pesar de que no existe significancia estadística en cuanto a la sobrevida, es importante considerar la positividad de CD133 para un tratamiento más intenso con antiangiogénicos (como nimotuzimab y bevacizumab)
Correspondencia: Dr. Enrique López-Aguilar.
Servicio de Oncología Pediátrica. Hospital de Pediatría CMN Siglo XXI. Ave Cuauhtémoc. 330. Delegación Cuauhtémoc, Col. Doctores. 06720.
Teléfono: 5627 6900.
Correo electrónico:elopezaguilar@hotmail.com