Los tumores cerebrales representan el tipo de tumor sólido más frecuente en la edad pediátrica. A nivel mundial, la incidencia se encuentra entre 10 y 18 casos por millón por año, con una frecuencia de presentación de 12%.1 Los más frecuentes son los que se derivan de la glia hasta en 60% y de éstos los astrocitomas.2 La expectativa de vida de acuerdo a la SEER (Surveillance Epidemiology End Result) a los cinco años, es de 50%.3-7
El conocimiento de los factores pronósticos, permite adecuar el tratamiento a estos pacientes. A pesar de que se conocen algunos factores pronósticos, continúa habiendo un grupo de pacientes con evolución desfavorable, por lo que es importante determinar los factores que llevan a un peor pronóstico y de esta manera diferenciarlos y tratarlos de una manera más intensiva.
Los factores de mal pronóstico ya conocidos son: edad menor de tres años, ya que a estos pacientes no se les puede ofrecer radioterapia, así como localización e histología.5 Los indicadores histológicos de anaplasia, y por lo tanto de malignidad, son: atipia nuclear, número de mitosis, proliferación vascular y presencia de necrosis.6 La supervivencia media de los pacientes con astrocitomas, según la clasificación de la OMS, es de cinco a siete años para los de grado I, de 2.5 a tres años para el grado II, de 1,5 a dos años para el grado III, y de un año o menos para el grado IV.7 Con la introducción de la quimioterapia neoadyuvante, la sobrevida se ha visto incrementada, en particular con el esquema de quimioterapia utilizando tres drogas (ifosfamida, carboplatino y etopósido).8
Se han identificado también diversos marcadores biomoleculares que influyen en el pronóstico de estos pacientes. Entre ellos los factores de crecimiento celular que son proteínas que en condiciones fisiológicas regulan el crecimiento y la diferenciación celular.
La sobre expresión de éstos, se asocia por lo general a una mayor agresividad biológica y su identificación ha permitido el diseño de nuevas estrategias terapéuticas.9
Otro campo de estudio, respecto al pronóstico de pacientes con tumores cerebrales, corresponde al estudio de altercaciones en la apoptosis o muerte celular programada. Los mecanismos que regulan la muerte celular son esenciales para el normal desarrollo y mantenimiento de la homeostasia en los tejidos.10 Las células crecen controladamente gracias a la expresión de genes que inducen señales de muerte en estadios definidos de diferenciación y en respuesta a estímulos fisiológicos determinados.11
Debido a que la apoptosis puede considerarse como un proceso de eliminación de células defectuosas, la desregulación de los genes que codifican las proteínas relacionadas con la apoptosis puede ser la causa del desarrollo de diversos tumores.12
El Bcl2 (B cell leukemia/lymphoma 2 gen) fue el primer proto oncogén detectado; está localizado en el cromosoma 18, funciona como un supresor de la apoptosis y puede promover la transformación neoplásica.13 Forma parte de una familia de genes que intervienen en la regulación de la supervivencia de la célula. Los miembros de la familia Bcl-2 están integrados por: Bcl-2, Bax, Bad, Bcl-X1, Bcl-Xs, Mcl-1.14 El destino de una célula de morir o sobrevivir está determinado por las diferencias en la expresión de estas proteínas, actuando algunas como promotoras y otras como inhibidoras de las señales de apoptosis.15
Las alteraciones en este gen pueden provocar un aumento en la expresión de la proteína citoplasmática Bcl-2, que origina inhibición de la apoptosis y da por resultado la supervivencia de la célula transformada.16 Esta proteína, facilita el aumento de la supervivencia de la célula transformada y de este modo aumenta la posibilidad de futuras aberraciones genéticas, que pueden conducir a la progresión maligna.17,18
La expresión de este gen o de su proteína en algunos tipos de cáncer es un marcador de mal pronóstico.19 En 2002, Tyagi en la India, realizó un estudio en el cual comparó la expresión de Bcl2 en pacientes con tumores primarios del SNC, encontrando mayor expresión de esta proteína comparada con pacientes sanos.20
Stregh, en 2008, demostró que la alteración en Bcl2 se correlacionaba con resistencia a quimioterapia y por lo tanto con mal pronóstico, en pacientes adultos con glioblastoma multiforme.21 Liu, en 2007, realizó marcadores tumorales con técnica de inmunohistoquímica, entre ellos Ki67, p53 y Bcl2, en pacientes adultos con diagnóstico de astrocitoma de alto grado, encontrando que la expresión de estos marcadores es importante para carcinogénesis.22
¿ OBJETIVO
Identificar si la sobreexpresión de Bcl2 es un factor pronóstico para la sobrevida en pacientes pediátricos.
¿ MÉTODOS
El presente estudio se realizó en el Hospital de Pediatría Centro Médico Nacional Siglo XXI, analizando los expedientes de pacientes diagnosticados con astrocitoma durante el periodo comprendido entre 1995 a 2009. El protocolo fue aprobado por el Comité Local de Investigación. Se incluyó a todos los pacientes menores de 15 años con diagnóstico de astrocitoma establecido en el servicio de Patología del Hospital de Pediatría del Centro Médico Nacional Siglo XXI, que contaban con expedientes completos, así como muestra del tumor en bloque de parafina o muestra de tejido tumoral ultracongelada y que completaran un seguimiento de por lo menos dos años. Todos los pacientes recibieron tratamiento por el servicio de Oncología del Hospital, con el protocolo ICE (carboplatino: 400 mg/m2/día en día un, seguido de ifosfamida: dos g/m2/día los días uno, dos, tres, y etoposido: 100/mg/m2/día los días uno, dos, tres, cada tres días por cuatro cursos), seguido de radioterapia (5400 cGy). Se eliminaron a todos aquellos pacientes que abandonaron el tratamiento, o cuyas muestras no pudieron ser procesadas por muestra insuficiente. Se tomaron de los expedientes los siguientes datos: edad al diagnóstico, sexo, diagnóstico histopatológico, localización de la tumoración, tipo de cirugía, así como volumen tumoral residual, fecha de diagnóstico y fecha de defunción o última cita. Las muestras de parafina fueron procesadas por inmunohistoquímica y se tomo positivo cuando la inmunoreactividad fuera mayor a 50% de células positivas en un campo de 40 aumentos.
El análisis estadístico se realizó con medidas de tendencia central y dispersión, de acuerdo a la distribución de las variables. Se analizó la asociación de cada variable con la probabilidad de morir mediante prueba de Ji cuadrada, o prueba exacta de Fisher, y cálculo de riesgo mediante razón de momios. Se calculó la sobrevida global y libre de enfermedad a uno, cinco y 10 años de acuerdo al método Kaplan Meier, con prueba log Rank test para determinar diferencias entre grupos.
¿ RESULTADOS
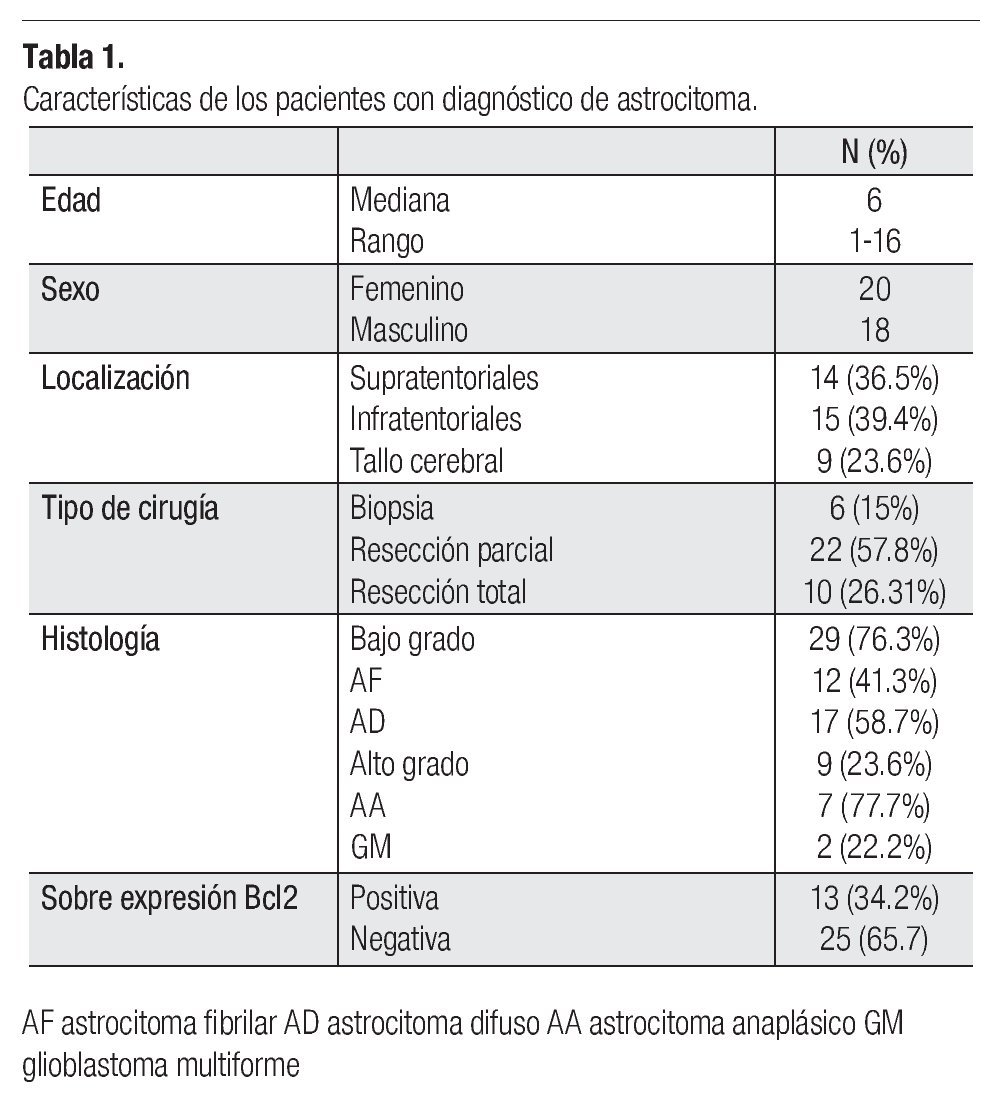
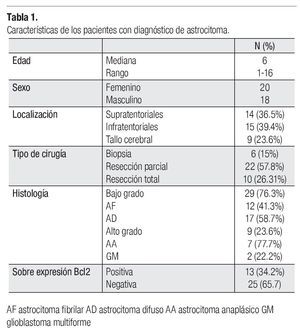
Se estudiaron 47 pacientes, de los que se excluyeron siete, por no contar con los datos necesarios en el expediente y dos en los que la muestra de tejido no fue suficiente para realizar la técnica de inmunohistoquímica, por lo que se presentan los resultados de 38 pacientes. La mediana de edad en los pacientes estudiados, fue de cinco años, con un rango de tres a 16 años. La razón hombre mujer fue de 0.9:1 (18 hombres: 20 mujeres).
En cuanto a la histología, 29 pacientes (76.3%), correspondieron a astrocitomas de bajo grado; 12 (31.5%) astrocitoma fibrilar y 17 (44.7%) a astrocitoma difuso, y nueve astrocitomas de alto grado; siete (18.4%) fueron astrocitomas anaplásicos y dos (5%) glioblastomas multiformes.
Por localización: 14 (36%) fueron supratentoriales, 15 (39.4%) infratentoriales y nueve (23.6%) en el tallo cerebral.
De acuerdo al tipo de cirugía realizada, a seis pacientes (15%) se les realizó biopsia, a 22 (57.8%) resección parcial y a 10 (26.31%) resección total.
Respecto del estado actual: 23 pacientes están vivos (60.5%) y 15 pacientes (39.5%) han fallecido; de acuerdo con la histología, de los 29 pacientes con astrocitoma de bajo grado 20 (68.9%) están vivos y nueve (31.1%) muertos. De los nueve pacientes con astrocitoma de alto grado aquellos con astrocitoma anaplásico tres (33%) están vivos y cuatro (44.4%) muertos; los dos pacientes restantes con glioblastoma multiforme fallecieron. Por localización, de los 14 pacientes con astrocitoma supratentorial siete han fallecido y siete están vivos (50%). Once de 15 pacientes (73.3%) están vivos y cuatro (26.7%) han fallecido. De los pacientes con tumor en tallo cerebral, cinco están vivos y cuatro han fallecido, 55% y 45% respectivamente.
Trece pacientes (34.2%) sobre expresaron Bcl2 y 25 (65.7%) no lo expresaron.
De acuerdo a la histología nueve de los 29 (31%) pacientes con histología de bajo grado sobre expresaron el oncogén Bcl2 mientas que cuatro de los nueve pacientes (44.4%) con astrocitoma de alto grado lo expresaron.
Por localización Bcl2 se sobre expresó en tres de 12 (25%) pacientes con astrocitoma fibrilar sobre expresaron Bcl2, seis de 11 (54%) pacientes con astrocitoma difuso, tres de cuatro (75%) con astrocitoma anaplásico y un (50%) paciente con glioblastoma multiforme (Tabla 1). Por el tipo de cirugía realizada, de los pacientes a los que se realizó biopsia, seis no sobre expresaron Bcl2, 12 de los 22 (54.5%) a los que se realizó resección parcial si lo sobre expresaron y uno de nueve (11.1%) a los que se realizó resección total también lo sobreexpresó.
Respecto de la edad cuatro de cinco (80%) pacientes menores de tres años sobre expresaron esta proteína y nueve de 20 (45%) pacientes mayores de tres años la sobre expresaron.
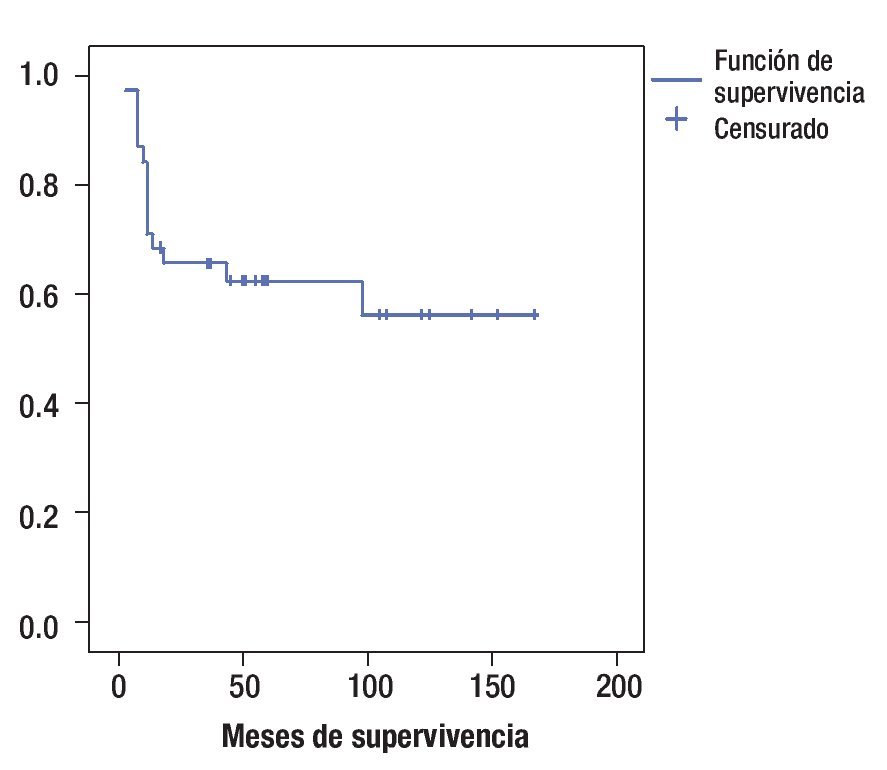
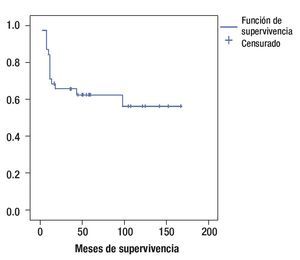
La sobrevida global de acuerdo al método de Kaplan Meier fue de 56% a cinco años (Figura 1). La sobrevida global a cinco años, de acuerdo al género, fue de 51% para sexo femenino y 60% para masculino (p = 0.87).
Figura 1. Curva de sobrevida global.
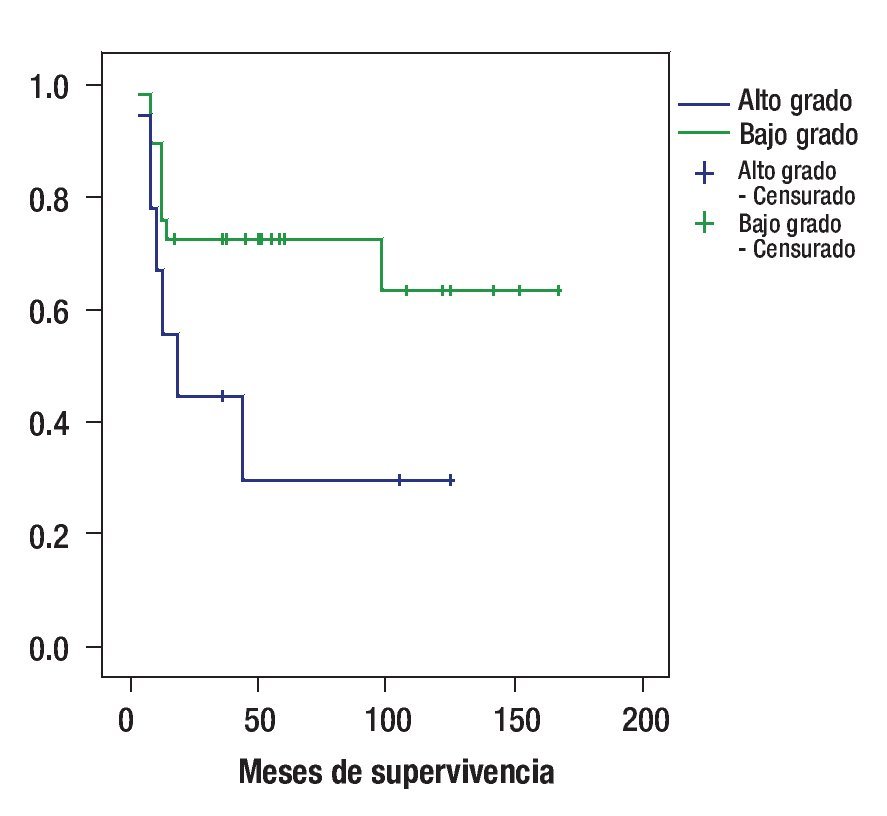
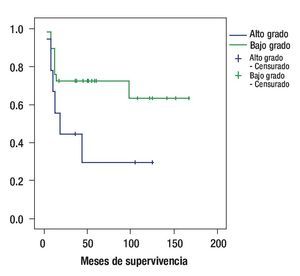
Por histología, la sobrevida a cinco años fue de 44% para los pacientes con astrocitoma fibrilar, de 76% para los pacientes con astrocitoma difuso, 42% para astrocitoma anaplásico y 0% para glioblastoma multiforme (p = 0.511). Por bajo y alto grado la sobrevida a cinco años fue de 60% y 33.3% respectivamente p = 0.483 (Figura 2).
Figura 2. Curva de sobrevida de acuerdo al grado histológico.
Respecto de la localización, la sobrevida global a cinco años fue de 46% para los supratentoriales, 73% para infratentoriales y 35% para tallo cerebral p = 0.546% .
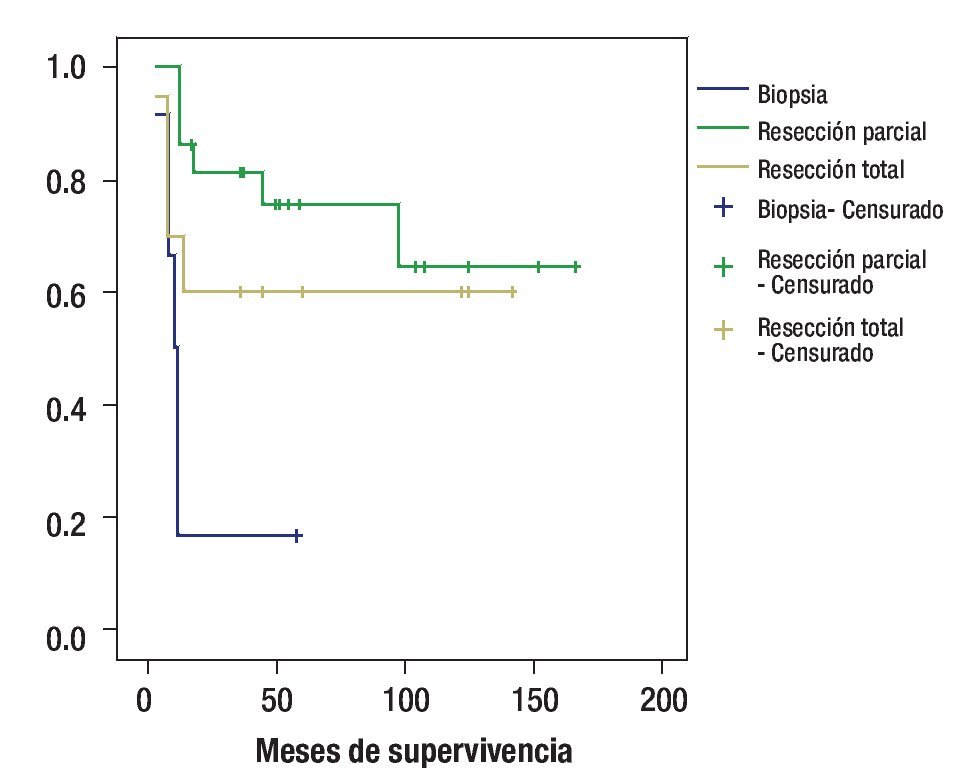
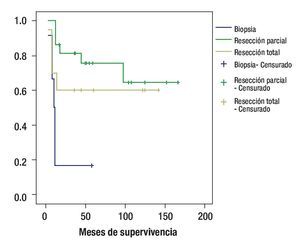
De acuerdo al tipo de cirugía, la sobrevida a cinco años, fue de 16% en los pacientes a quienes se realizó biopsia, 72% en los que se realzó resección parcial y 60% para los que se realizó resección total; p = 0.0036 (Figura 3).
Figura 3. Curva de sobrevida de acuerdo al tipo de cirugía.
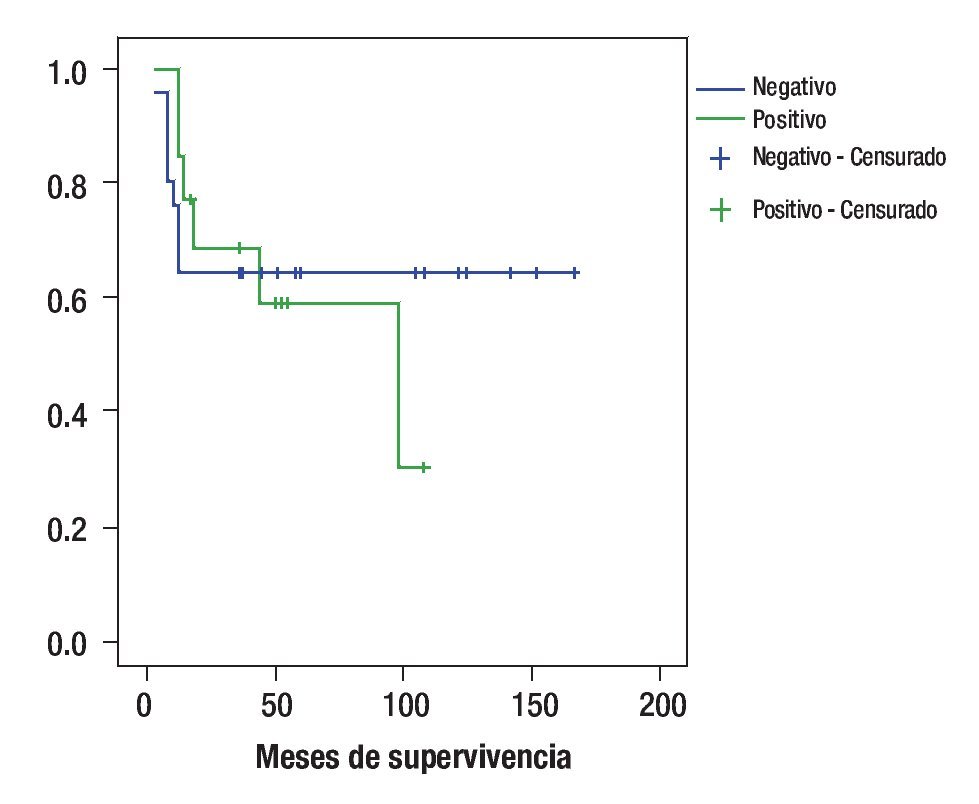
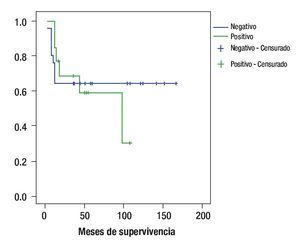
Los pacientes que sobre expresaron Bcl-2 tuvieron una sobrevida de 29% mientras que los pacientes que no lo sobre expresaron la sobrevida fue de 64%; p = 0.97 (Figura 4).
Figura 4. Curva de sobrevida de acuerdo a la expresión de Bcl2.
¿ DISCUSIÓN
La sobrevida de los pacientes con diagnóstico de tumores cerebrales, específicamente con astrocitoma, es reportada en la mayoría de los estudios internacionales de 30% a 40% a cinco años (Figura 5). Ésta ha mejorado en los últimos 15 años, debido al empleo de esquemas de quimioterapia más intensivos, que incluyen fármacos que han probado su efectividad in vitro e in vivo, tal es el caso del carboplatino, que aunado a la sinergia existente entre la combinación de ifosfamida y VP16 ha probado su efectividad en gran número de estudios. La tendencia actual para estos pacientes es el tratamiento individualizado de acuerdo al riesgo que tengan, tanto de morir como de respuesta a tratamientos, para lo cual es muy importante conocer el comportamiento bio-molecular de estos tumores para poder dirigir de manera más acertada un tratamiento. Como resultado de éste conocimiento, han surgido nuevos fármacos, por ejemplo los antiangiogénicos o aquellos dirigidos contra factores de crecimiento epitelial o del endotelio vascular que se encuentran sobre expresados en estas neoplasias.23,24
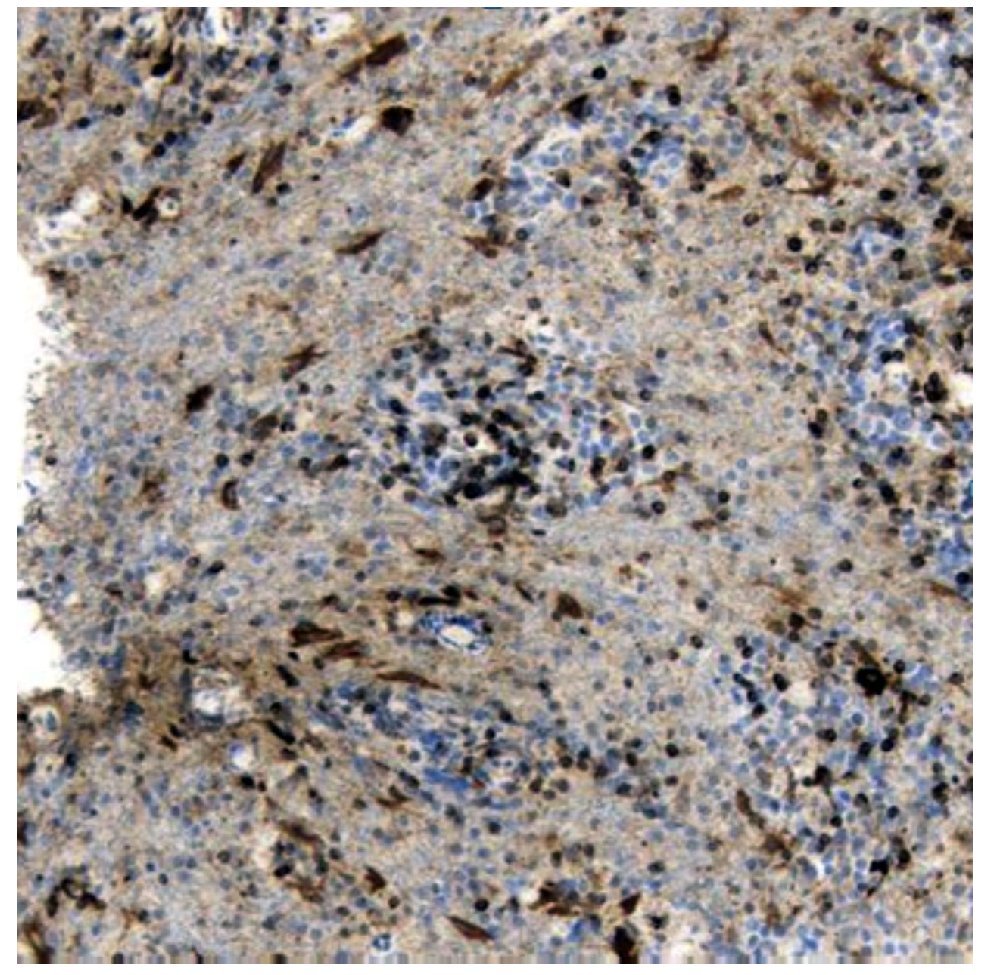
Figura 5. Astrocitoma BCL-2 +.
Un campo de estudio en constante crecimiento para la explicación de biología molecular en pacientes con tumores cerebrales, es el estudio de la apoptosis o muerte celular programada. En condiciones normales, el desarrollo de un tejido guarda un estrecho equilibrio entre las células proliferantes y las que se van muriendo (vía apoptosis) o bien que se diferencian; al presentar una alteración, ya sea aumento de la proliferación o inhibición de la apoptosis, estas células rompen ésta homeostasis y tienden a inmortalizarse, y si este programa de pérdida celular se altera, las células continúan en proliferación de manera indefinida.25
Bcl2 es una familia, compuesta de 19 genes, que pueden promover o inhibir la apoptosis, dentro de los miembros de esta familia se encuentran BAX que favorece la apoptosis y Bcl2 que la inhibe. Se encuentra localizado en el cromosoma 18. Las proteínas de este gen, ejercen un efecto inhibidor sobre la permeabilización de la membrana mitocondrial, que libera el citocromo C hacia el citoplasma de la célula, el cual a su vez inicia la vía intrínseca de la apoptosis a través de la activación de las caspasas 7. Bcl2 es un proto-oncogén que prolonga la sobrevida de las células, al bloquear la apoptosis, y esta inhibición puede promover la trasformación neoplásica.
Trabajos recientes, realizados por Steght, han demostrado que aquellos pacientes que sobreexpresan el Bcl2 previenen la muerte celular inducida por radioterapia.26
Esta molécula a pesar de no ser nueva, dado que desde el 1988 se había visto sobre-expresada en pacientes con LNH, fue hasta fines de los noventas que se le atribuyó un rol en la oncogénesis.
En el presente trabajo, la expresión de este oncogén, se manifestó de manera más frecuente en aquellos pacientes portadores de astrocitoma de alto grado (49%), con respecto de aquellos pacientes portadores de un astrocitoma de bajo en el cual estuvo presente en 30%. A pesar de no existir significancia estadística, si la hay clínica.
Lo anteriormente expuesto se corrobora al hacer una correlación entre la sobreexpresión de oncogén Bcl2 y la sobrevida, en la que encontramos sobrevida de 64%, a cinco años para pacientes que no expresaban esta oncogén vs. 29% que presentaban (p = 0.76). Consideramos que existe significancia clínica con un OR para fallecer de 1.5 para los pacientes que sobre expresan Bcl2, es importante considerar también, que el porcentaje de la sobreexpresión dado que aquellos que presentaron más de 25% de sobre expresión presentaron SV de 31% a 10 años vs. 66% para aquellos que no lo expresaron.
En este trabajo, resulta importante mencionar que se corrobora lo que en múltiples estudios se ha expuesto; el tipo de cirugía realizada en estos pacientes, lo cual se reflejó en la sobrevida, al presentar 64% de supervivencia a cinco años para los pacientes sometidos a resección parcial o total vs 16% de aquellos en quienes se realizó biopsia (p = 0.003).
Por histología, se corroboró un peor pronóstico para el grupo de pacientes con glioblastoma multiforme, la cual fue de 0% a cinco años vs. 76% y 58% para bajo grado (difuso y fibrilar).
Consideramos que el presente trabajo es de utilidad; no obstante, debemos ser juiciosos al tratar de incorporar los nuevos biomarcadores moleculares como factores pronóstico, en este tipo de pacientes. Debe conocerse a profundidad el comportamiento biológico de estos tumores para poder dirigir una terapia adecuada al riesgo; sin embargo, continúan existiendo factores pronósticos clínicos y quirúrgicos ya establecidos que siguen vigentes.
El continuar con este trabajo e incrementar la muestra de pacientes será importante para tratar de disminuir el error estadístico, por tamaño de muestra y contribuirá al mejor entendimiento del comportamiento de este tipo de pacientes.
A pesar de que algunos autores como Tyagi mencionan a Bcl2 como factor pronóstico importante, encontrando en su estudio una diferencia estadística, en cuanto a la expresión de este oncogén en el tejido tumoral resecado al compararlo con el parénquima cerebral adyacente.27 Y aunque tampoco se encontró una correlación con el grado histopatológico, si se considera a la sobreexpresión de este oncogén, como un evento molecular importante que hace a estos tumores quimio y radio resistentes. Lo anterior corrobora, y nos ayuda a concluir la importancia de este trabajo, en el cual el entendimiento biomolecular, nos dicta la pauta terapéutica; esto es, la sobreexpresión de BCL2, aunada a la biopositividad de otros marcadores, nos pueden determinar el empleo de un esquema de quimioterapia más intensivo con respecto de lo pacientes con tumores que sean negativos a estos marcadores.
Correspondencia: Dr. Enrique López Aguilar.
Av. Cuauhtémoc N° 330, Colonia Doctores. Del. Cuauhtémoc. 01620, México, D. F.
Teléfono: 6276 9900 extensión 22500.
Correo electrónico:elopezaguilar@hotmail.com