Introducción: Innovaciones como el ipilimumab para tratar tumores inmunogénicos, como el melanoma metastásico, están disponibles.
Objetivo: Demostrar la eficacia del tratamiento con ipilimumab en términos de supervivencia libre de progresión (SLP) y supervivencia general (SG) con ipilimumab, en pacientes con melanoma metastásico y/o irresecable con falla a uno o más tratamientos sistémicos.
Método: En un estudio de cohorte prospectivo, se reclutaron sujetos con melanoma metastásico y/o irresecable con falla a uno o más tratamientos sistémicos en 6 unidades oncológicas de México. Se cumplieron los aspectos éticos para participar. Se planearon 4 ciclos de ipilimumab (3 mg/Kg de peso), cada 3 semanas.
Resultados: Se incluyeron 41 pacientes, con una edad media de 54.02 ± 17.03 años y mujeres 28 (68.3%). Del total de la serie de casos, a la fecha de última evaluación fallecieron 24 (58.5%) y sobrevivieron 17 (41.5%). Las medianas (IC 95%) fueron para las SLP con ipilimumab de 24.5 (IC 95%=15.3-33.7). La SG en semanas bajo ipilimumab fue de 50.7 (IC 95%=28.4-72.9). La SG de la fecha del diagnóstico a la última evaluación fue 128 (IC 95%=37.5-218.4). En la regresión de Cox, la etapa del melanoma al diagnóstico inicial fue el único predictor significativo para las SLP bajo ipilimumab, con una beta de 0.677 y una significancia de 0.03. Los eventos adversos inmunológicos reportados toxicidad hepática 2 (4.8%), prurito 5 (12.2%), fatiga 8 (19.5%), reacción cutánea 2 (4.8%), endocrinos 3 (7.3%), orquitis 1 (2.4%), diarrea 2 (4.8%) y colitis 1 (2.4%).
Discusión: Los resultados encontrados concuerdan con estudios afines.
Introduction: Innovations such as ipilimumab, for the treatment of immunogenic tumors like metastatic melanoma are available.
Objective: Describe Progression Free Survival (PFS) in weeks and overall Survival (OS) in weeks with ipilimumab in patients with resistant metastatic melanoma.
Method: A prospective cohort study was performed. Subjects were recruited from 6 oncologic units in Mexico with metastatic melanoma resistant to at least 2 treatment interventions. All ethical issues were complied to participate. Four cycles of ipilimumab (dose 10 mg/Kg of weight) at weeks 1, 4, 7 and 10 were administered.
Results: Forty one subjects were included. Mean age 54.02 ± 17.03 years and female 28 (68.3%). At the end point 24 (58.5%) died and 17 (41.5%) survived. Median (95% CI) for the PFS in weeks was 24.5 (95% CI=15.3-33.7) and for OS in weeks was 50.7 (95% CI=28.4-72.9) under ipilimumab treatment. The OS in weeks from the diagnosis date to end-point was 128 (95% CI=37.5-218.4). In Cox regression, the only statistical predictor was disease stage at diagnosis for PFS in weeks (Beta 0.677; p=0.03). Reported immune adverse events were hepatic toxicity 2 (4.8%), pruritus 5 (12.2%), fatigue 8 (19.5%), skin reaction 2 (4.8%), endocrine 3 (7.3%), orchitis 1 (2.4%), diarrhea 2 (4.8%), constipation 1 (2.4%).
Discussion: Findings were similar with previous similar series.
Introducción
A nivel mundial, el melanoma representa el 4% de todos los diagnósticos de cáncer, pero implica el 75% de las muertes relacionadas con el cáncer de piel1.
En México, la información más reciente indica que el melanoma representa el 9.02% del cáncer de piel y la evidencia disponible indica que la incidencia del melanoma se ha incrementado entre 1990 y 20042. En los escenarios metastásicos, los tratamientos son tóxicos y relativamente poco eficaces3.
una vacuna contra el cáncer está compuesta por péptidos restringidos HlA-A*0201 derivados de la proteína melanosomal, glicoproteína 100 (gp100). El tratamiento aislado con esta vacuna induce respuesta inmune, pero con actividad antitumoral marginal; sin embargo, el uso de la vacuna puede incrementar la respuesta con dosis altas de interleucina-2 en sujetos con melanoma metastásico4.
Un principio con suficiente soporte científico es que los tumores pueden evitar su detección y la respuesta del sistema inmune, a pesar que muchas neoplasias son capaces de generar respuestas inmunes potentes, particularmente el melanoma5.
Una de las intervenciones más novedosas ha sido el desarrollo de agentes biotecnológicos que incrementen la capacidad antitumoral del sistema inmune. Uno de esos mecanismos es el bloqueo del antígeno 4 de los linfocitos T citotóxicos (CTLA-4), una de las moléculas primarias de contacto del sistema inmune6.
El ipilimumab es un anticuerpo monoclonal completamente humano, que bloquea el CTLA-4, al unirse a sus ligandos, B/-1 y B7-2, en las células presentadoras del antígeno7.
Estudios realizados en los últimos años han demostrado que ipilimumab (en dosis única o múltiple de 0.1-20 mg/Kg), en monoterapia o terapia combinada, puede inducir respuestas objetivas (or) o estabilización de la enfermedad (SD), entre pacientes con melanoma avanzado. La activación de células T registrada como respuesta justo después del inicio de ipilimumab es evidente, aunque su traducción a un beneficio clínico puede tomar tiempo, e inclusive presentarse cuando el paciente registra progresión de la enfermedad, de acuerdo con los criterios RECIST y de la Organización Mundial de la Salud (OMS), lo que ha llevado a proponerse que la respuesta a estos fármacos sea valorada de manera diferente, en términos de acción y respuesta, y no como se estima a la quimioterapia (QT)8.
En el 2010, se publicó la experiencia de una sola institución de los Estados unidos (Memorial Sloan-Kettering Cancer Center), con la administración compasiva de ipilimumab en pacientes con melanoma avanzado refractario, administrándose 10 mg/Kg/3 semanas, en 4 ocasiones. A la semana 24, aquellos pacientes con mejoría clínica evidente, se asignaron para recibir ipilimumab cada 12 semanas. De 51 pacientes evaluables, sólo un 29% tuvo reacciones adversas, con prurito, diarrea y rash como las más comunes. La tasa de media de supervivencia general o global (SG) fue de 7.2 meses. Los autores del estudio consideran que la actividad clínica de ipilimumab es evidente en una proporción de pacientes con melanoma avanzado refractario a otros abordajes9.
El ipilimumab para el manejo de esta indicación fue autorizado en México el 29 de febrero de 2012. Su autorización fue otorgada en la categoría de "medicamentos huérfanos".
El objetivo de este estudio es describir el comportamiento del tratamiento compasivo con ipilimumab en pacientes con melanoma resistente a diversos tratamientos.
Método
Se evaluó una serie de casos dentro de una cohorte prospectiva, en la que se incluyeron pacientes con el diagnóstico confirmado de melanoma, que recibieron un tratamiento compasivo con ipilimumab, cuando otras maniobras indicadas no funcionaron. Un criterio de exclusión es que no hubiesen sido tratados con ipilimumab previamente.
Se solicitó la participación de especialistas certificados que atienden este tipo de población. Las instituciones que aportaron sujetos fueron: el Instituto Nacional de Cancerología de la Secretaría de Salud Federal en México D.F.; el Hospital regional de Alta Especialidad "Dr. Juan Graham Casasús" dependiente de la Secretaría de Salud del Estado de Tabasco; Fundación Rodolfo Padilla A.C., León, Guanajuato; Hospital ABC, México D.F.; Corporativo de Oncología Médica y Radioterapia del Noroeste, Monterrey, N.L.; el Centro Oncológico "Diana Laura Riojas de Colosio"; Hospital Médica Sur, México D.F.
Se diseñó un formato ad hoc, para recolectar la historia demográfica y evolución clínica con los tratamientos recibidos previamente, así como los resultados obtenidos con las intervenciones administradas.
Se incluyeron pacientes con melanoma metastásico y/o irresecable que presentaron falla o intolerancia a uno o más tratamientos sistémicos. Todos los pacientes dieron su consentimiento para recibir el manejo compasivo.
Se planeó la administración de 4 ciclos de ipilimumab a una dosis de 3 mg/Kg de peso cada 3 semanas, en pacientes sin progresión de la enfermedad o eventos adversos serios.
El estudio fue vigilado por un Comité de Ética independiente. No se puede ignorar, que los estudios compasivos se realizan cuando las condiciones del paciente son de mal pronóstico y no existen alternativas de manejo factibles. La variabilidad de los casos incluidos en este tipo de estudios se sabe que es amplia y los manejos previos no fueron controlados.
Análisis estadístico
La descripción de variables discretas se expresó en número y porcentaje; las continuas, como mediana (intervalo de confianza, IC 95%). Se crearon variables basadas en las fechas capturadas para determinar la sobrevida y el tiempo del nacimiento al diagnóstico. En virtud de que el objetivo era evaluar el manejo compasivo con ipilimumab, se determinaron las semanas libres de padecimiento y la SG con dicho manejo. Se realizaron curvas de Kaplan-Meier para esos indicadores. Igualmente se realizaron 2 análisis de regresión de Cox para determinar las variables que potencialmente explicasen varianza estadísticamente significativa.
Resultados
Se reclutaron 41 sujetos, con una edad general promedio de 54.02 ± 17.03 años. Del sexo femenino fueron 28 (68.3%). El sitio primario del melanoma fue en extremidades inferiores, 20 (48.8%); extremidades superiores, 5 (12.2%); tronco, 9 (22.0%); coroides, 3 (7.3%); y cabeza o cuello, 4 (9.8%).
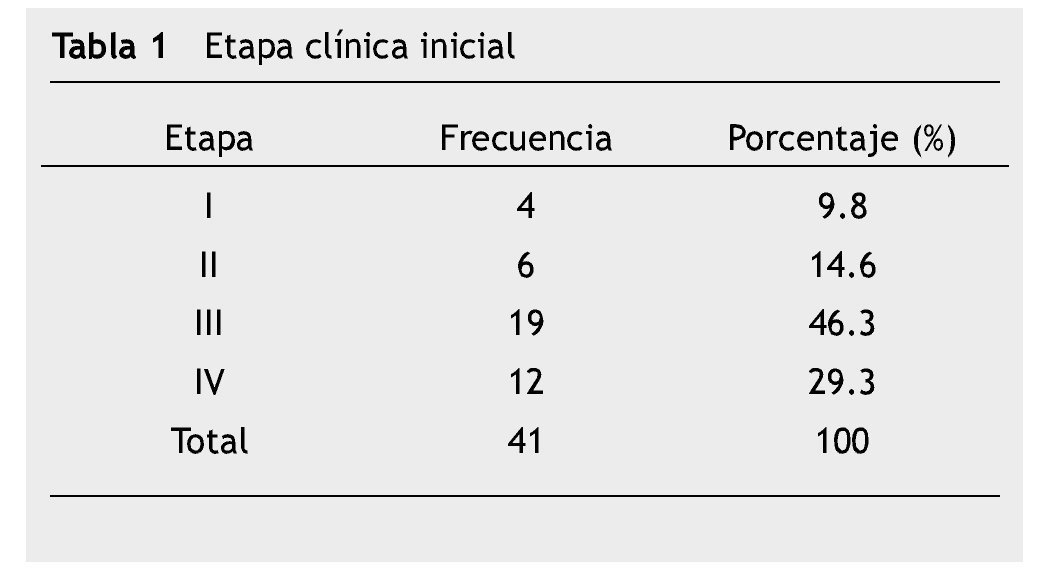
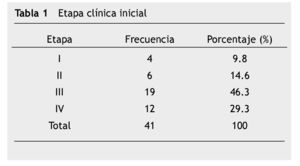
La etapa clínica inicial se ilustra en la tabla 1. Cabe destacar que la mayor parte de los pacientes al momento del diagnóstico se encontraban en etapas avanzadas, el 46.3% (19 pacientes) con enfermedad regional (etapa clínica III) y 29.3% (12 pacientes) con enfermedad metastásica. Los pacientes recibieron, la mayoría de ellos, tratamiento multimodal, cirugía 36 pacientes (87.8%), radioterapia 8 (19.5%), inmunoterapia adyuvante y/o paliativa 8 pacientes (19.5%), y QT en 40 pacientes (97.5%).
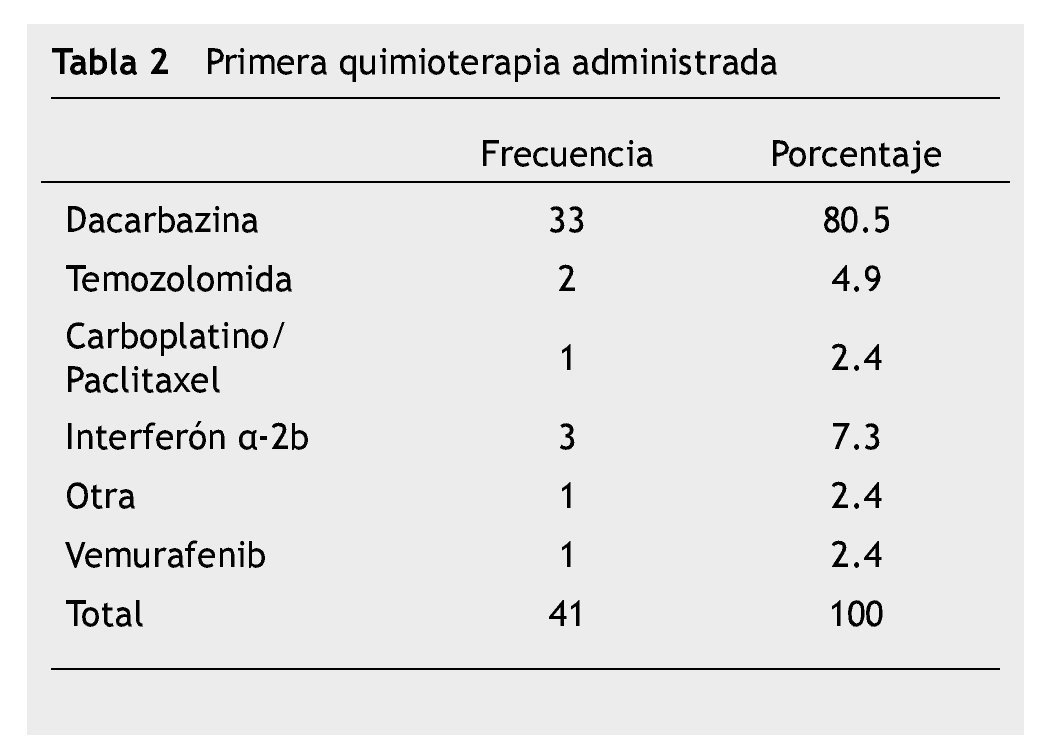
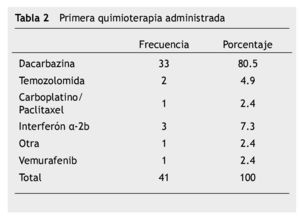
En la tabla 2 se describe el tratamiento sistémico administrado inicial o después de la recaída. La respuesta al tratamiento de primera línea reportado fue: respuesta completa 3 (7.3%), respuesta parcial 3 (7.3%), enfermedad estable 10 (24.4%) y enfermedad progresiva 25 (61.0%), por criterios RECIST versión 1.1.
Sólo 12 (29.3%) sujetos recibieron un segundo esquema de QT. La respuesta tumoral a la segunda línea de QT que predominó fue la progresión de la enfermedad en 8 pacientes (66.5%), seguida por enfermedad estable y la respuesta parcial con frecuencias iguales con 2 pacientes (16.7%) en cada una.
Del total de la serie de casos, a la fecha de última evaluación fallecieron 24 (58.5%) y sobrevivieron 17 (41.5%).
a) Resultados relacionados con el tratamiento con ipilimumab
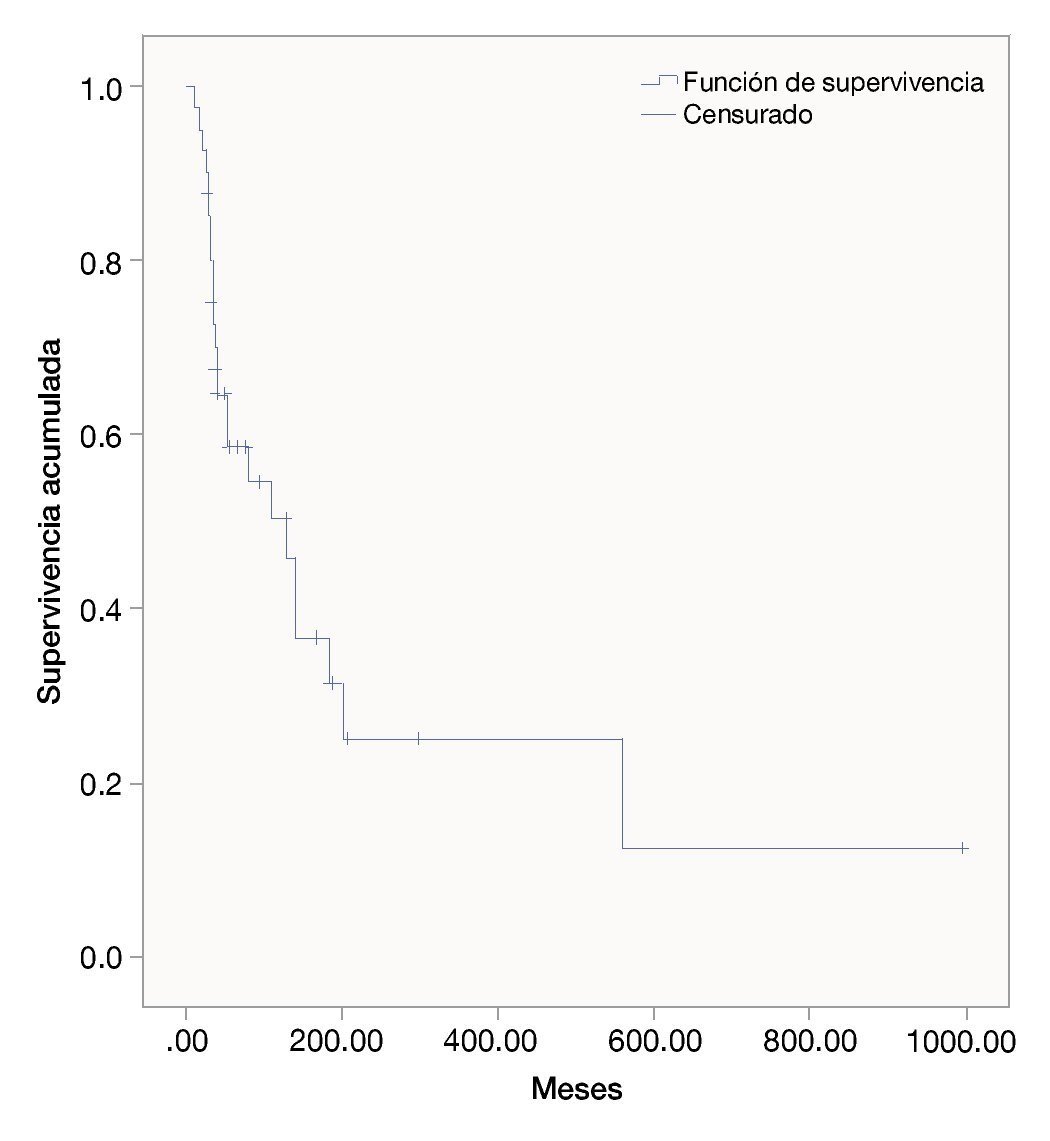
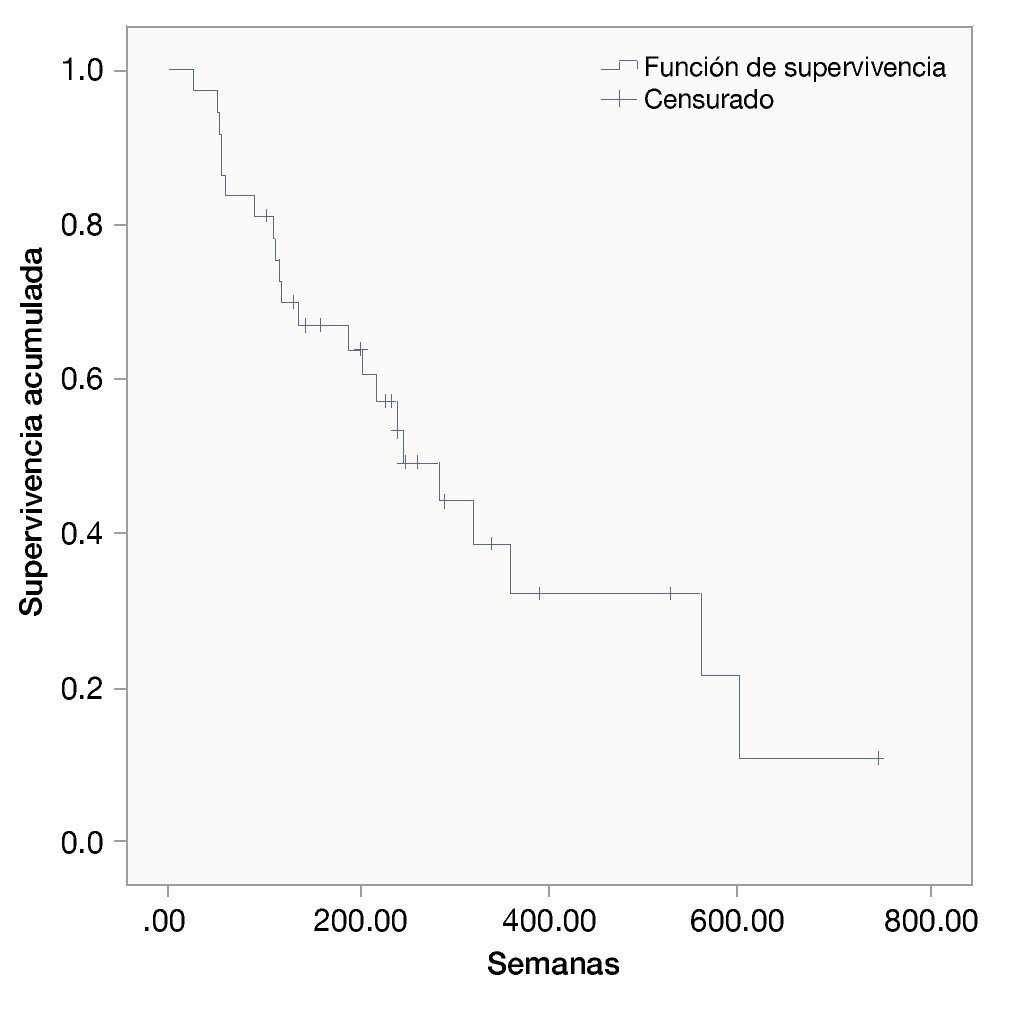
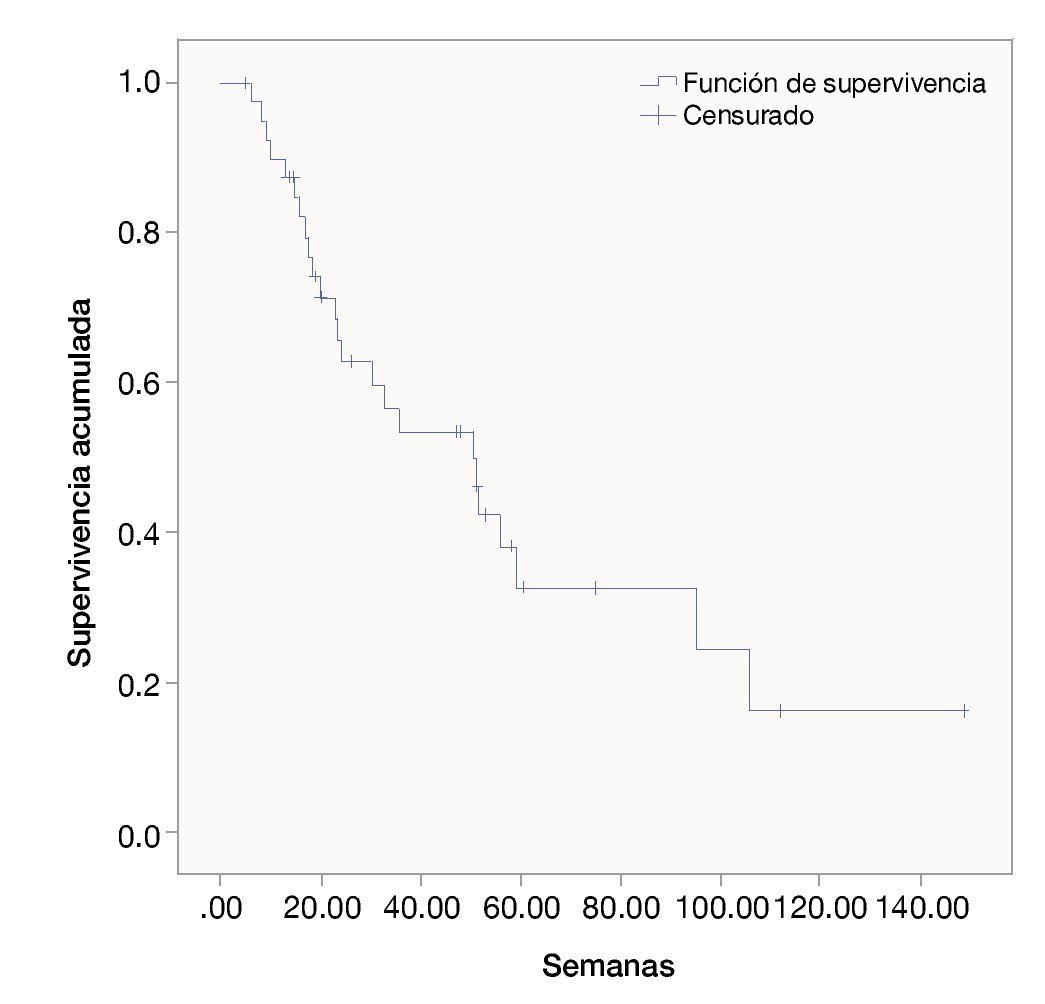
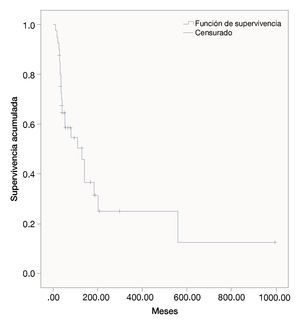
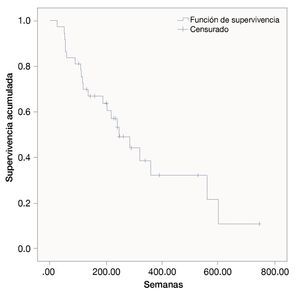
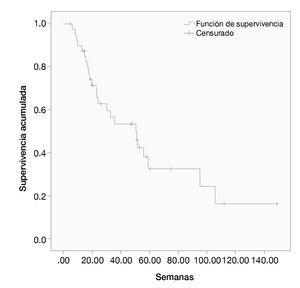
Las semanas libres de progresión bajo el manejo con ipilimumab fue de 19.4 ± 14.9. La sobrevida en semanas bajo el tratamiento fue de 39.5 ± 31.9. La SG de la fecha del diagnóstico a la última evaluación fue 111.3 ± 173.1. Las figuras 1, 2 y 3 muestran las curvas de Kaplan-Meier para cada indicador.
Figura 1 Supervivencia general desde la fecha de diagnóstico (meses).
Figura 2 Semanas de vida libres de padecimientos con ipilimumab.
Figura 3 Supervivencia general bajo tratamiento con ipilimumab.
En los análisis de regresión de Cox, sólo en el que la variable dependiente fue las semanas libres de padecimiento bajo el manejo con ipilimumab se encontraron predictores estadísticamente significativos. Entraron en la ecuación el sexo, la edad, el sitio primario, la etapa y los meses entre el nacimiento y el diagnóstico. La etapa del melanoma al momento del diagnóstico fue el único predictor significativo con una Beta de 0.677 y una significancia de 0.03.
Los eventos adversos inmunológicos asociados al ipilimumab fueron toxicidad hepática (4.8%), prurito 5 (12.2%), fatiga 8 (19.5%), reacción cutánea 2 (4.8%), endocrinos 3 (7.3%), orquitis 1 (2.4%), diarrea 2 (4.8%), colitis 1 (2.4%) y otras 3 (7.2%).
Discusión
En esta serie de casos con melanoma metastásico tratado en diversos centros especializados en México, utilizando ipilimumab en forma compasiva, se encontró que los pacientes fueron tratados mayoritariamente con cirugía en primera instancia; era una población con una edad promedio de diagnóstico superior a los 54 años de edad, con estadios predominantemente en fases III o IV. Todos recibieron al menos 2 tratamientos (uno de ellos fue algún esquema de QT o inmunoterapia). Los resultados obtenidos son congruentes con lo reportado en la literatura médica. La administración del antígeno monoclonal ipilimumab en casos con melanoma metastásico resistente a otras maniobras incrementa la supervivencia libre de progresión (SLP) y la SG de manera discreta.
Es importante resaltar que el ipilimumab fue autorizado dentro del rubro de "medicamentos huérfanos", que son beneficiados de estímulos económicos para su desarrollo, debido a que los pacientes que pueden beneficiarse de ellos son pocos. El melanoma es considerado como una "enfermedad rara", con fuertes elementos genéticos, que lo califican como una neoplasia rara10.
En neoplasias con claros elementos inmunogenéticos, se han desarrollado productos biotecnológicos que han beneficiado a pacientes afectados por diferentes tipos de cáncer. El caso del melanoma, particularmente en fases avanzadas, continúa siendo un desafío para las disciplinas de la salud, en la búsqueda de herramientas eficaces y seguras que incrementen la sobrevida a la enfermedad y su calidad.
Dentro de este contexto, el caso del melanoma metastásico es una de las condiciones con limitadas opciones de manejo. La evidencia indica que para que los leucocitos T, tanto los CD4 (facilitadores) como los CD8 (citotóxicos), deben activarse para responder contra un estímulo agresor (infeccioso o tumoral); sin embargo, se requiere un segundo elemento que genere una reacción completa, la activación en células T por un receptor denominado CD28. El desarrollo de un antígeno monoclonal, antagonista del CTLA-4, el ipilimumab, reveló en estudios preclínicos que podría activar la respuesta inmune total. Los estudios clínicos se iniciaron y los resultados alentadores, en comparación con los aceptados. Al final se autorizó el antígeno para la condición11.
Este reporte evaluó la evolución del uso compasivo del ipilimumab en pacientes con melanoma metastásico resistente a tratamiento. El estudio que es metodológicamente análogo es el publicado por Ku et al.9, pues se realizó en el contexto del uso compasivo del ipilimumab. Pero no debe ser ignorado que su estudio tenía como objetivo adicional el conteo de leucocitos después de la administración de 2 ciclos de tratamiento con el biofármaco. Las cifras de SLP y SG bajo el tratamiento con ipilimumab son similares. No realizaron análisis de predicción con respecto a variables previas. Es relevante la relación con la SG de la fecha de diagnóstico a la fecha de terminación del estudio. Ello limita la posibilidad de inferir la similitud de las muestras12.
Este reporte relaciona la respuesta al tratamiento compasivo con ipilimumab con variables demográficas y clínicas del inicio y manejo del padecimiento. Describe la evolución bajo el manejo compasivo.
Agrega evidencia con respecto al uso del ipilimumab en un contexto naturalístico e interinstitucional que puede resaltar la necesidad de tomar en cuenta otras variables previas que afectan el curso de la enfermedad.
Es relevante sugerir, que en estudios clínicos abiertos, los antecedentes de la población son determinantes para establecer factores que pueden modificar los resultados. El uso de modelos estadísticos como la regresión de Cox, aportan indicadores para futuras investigaciones.
Conflicto de intereses
Bristol-Myers Squibb de México, S. de R.L. de C.V. proporcionó el ipilimumab para el manejo compasivo de este trabajo.
Financiamiento
El Dr. Francisco Páez Agraz (f.paez@focus-salud.mx), instituto para el fortalecimiento de capacidades en salud: Focus Salud México S.C., recibió honorarios para el análisis de resultados, elaboración y redacción del manuscrito.
* Autor para correspondencia:
Instituto Nacional de Cancerología.
Av. San Fernando N° 22, Colonia Sección XVI,
C.P. 14080, México D.F., México.
Celular: (044) 5529703494.
Correo electrónico: calis-fue@hotmail.com (Miguel Ángel Álvarez-Avitia).