¿ INTRODUCCIÓN
Los tumores testiculares son poco comunes, representan 1 a 2% de todos los cánceres en el hombre.1 Sin embargo, el seminoma es el tumor sólido más común entre los 20 y 35 años de edad. Se estima en el mundo que hay más de 48,500 nuevos casos y 8900 muertes reportadas en el 2002.2,3 La incidencia se ha duplicado en los últimos 30 años, con un incremento a nivel mundial de 2.6 a 4.9% en las tres últimas décadas con altas tasas de curación.4 En México, el Registro Nacional Histopatológico de Neoplasias Malignas de 2002, reportó 1265 casos que representan el 1.17%. Se registraron 339 muertes, con una tasa de 1.19 (0.7%).5 Los factores de riesgo para seminoma son: antecedente de criptorquidia que le confiere un riesgo relativo de 5 veces y de 5-20% de desarrollar tumor en el testículo contralateral,6 orquitis, historia de trauma testicular, hernia inguinal antes de los 15 años, inmunosupresión por trasplante de órganos y es la tercera causa de cáncer en los pacientes HIV con una prevalencia de 0.2%.7-9 Las bajas concentraciones de semen, poca movilidad y anormalidades en los espermatozoides confiere un riesgo relativo de 9.3 para cáncer testicular.7,10 Pueden existir anormalidades del brazo corto del cromosoma 12.7 Más del 95% son tumores de células germinales (TCG).
Las manifestaciones clínicas comúnmente se presentan con una tumoración testicular no dolorosa, con signos y síntomas sugestivos de orquiepidimitis aguda en más del 25% de los casos. El diagnóstico diferencial incluye torsión testicular, hidrocele, varicocele, espermatocele y epidimitis.11
Los marcadores séricos alfa-fetoproteína (AFP), fracción b gonadotrofina coriónica (hCG-b) y deshidrogenasa láctica (DHL), deben evaluarse antes y después de la orquiectomía. Son usados para determinar la respuesta del tratamiento, predice la probabilidad de lograr una remisión completa y en el seguimiento indica recurrencia, frecuentemente en ausencia de síntomas, hallazgos físicos o imágenes anormales.12
Se requiere radiografía de tórax, tomografía axial computarizada (TAC) de abdomen y pelvis para evaluar retroperitoneo e hígado, con una sensibilidad del 40% y especificidad del 90%, detectando ganglios de 10 a 20 mm.Laimagen de resonancia magnética (IRM) es equivalente a la TAC en determinar el tamaño y la localización de adenopatía retroperitoneal. La linfangiografía tiene mayor sensibilidad que la TAC (71%), pero con baja especificidad (60%), por lo que su utilidad se ha limitado. En el ultrasonido (USG) se encuentran microlitiasis < 2 mm.13
La tomografía de emisión de positrones (PET) tiene gran sensibilidad (70%) y especificidad (100%), pero no puede detectar lesiones menores de 5 mm o teratomas debido a su baja actividad metabólica, también es útil para detectar enfermedad residual a retroperitoneo con una sensibilidad del 80% y especificidad del 100%.14
La etapa clínica es de valor pronóstico en los estadios tempranos con un riesgo de recaída de alrededor del 20% para pT1 (estadio IA) y 40% para pT2 (estadio IB) con invasión vascular. El tamaño tumoral y la invasión de la rete testis, son los factores pronósticos independientes más importantes, con un riesgo de recaída de 13 y 24% para tumores menores de 4 cm, respectivamente.15
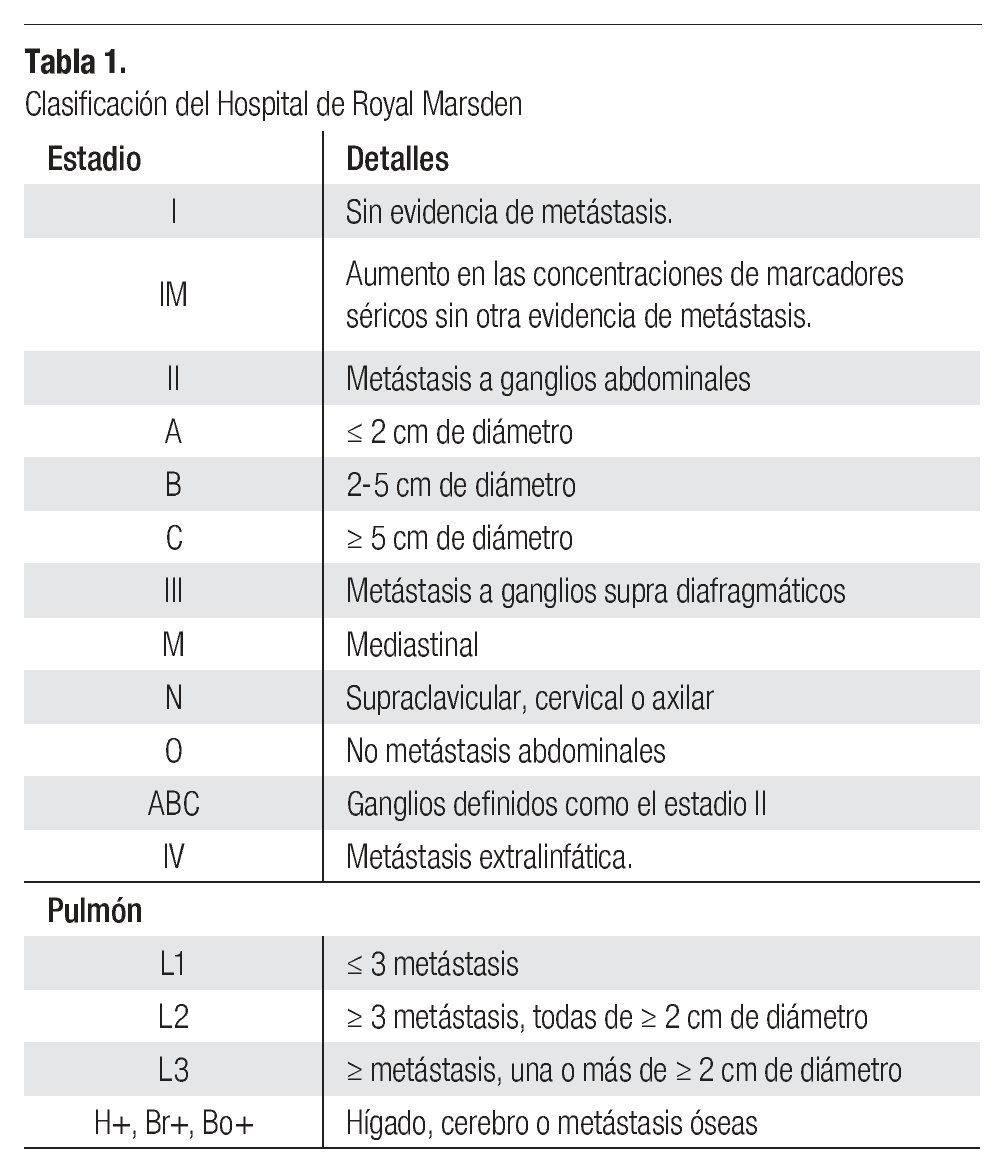
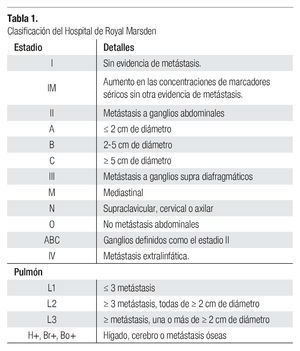
El sistema de clasificación es de acuerdo al TNM de la AJCC (2002), en donde incorpora factores pronósticos anatómicos y no anatómicos (séricos). El Grupo Internacional Colaborativo de Cáncer de Células Germinales, desarrolla un sistema de clasificación que ha sido incorporado dentro del sistema de la AJCC. Los pacientes con tumores de células germinales no seminomatoso (NSGCT) fueron divididos en tres grupos pronósticos (bueno, intermedio o pobre pronóstico) y los seminomas se clasifican en bueno o intermedio.16 Otro sistema de clasificación de cáncer testicular es el del Hospital de Royal Marsden11 (Tabla 1).
El tratamiento inicial es la orquiectomía radical inguinal con ligadura alta del cordón espermático, ofreciendo curación en una alta proporción de los pacientes (60 a 90%) con estadio I,17 seguido de radioterapia externa posoperatoria a los ganglios paraaórticos y ganglios pélvicos ipsilaterales recomendado por el riesgo de enfermedad microscópica.18 El campo de tratamiento más utilizado son dos campos paralelos y opuestos, con una energía de 10 a 18 mV en un acelerador lineal con fotones. El volumen blanco incluye CTV que consiste en los ganglios linfáticos interaortocavales, preaórticos, paraaórticos y ganglios linfáticos pélvicos ipsilaterales. Incluir la cicatriz inguinal, los ganglios inguinales o hemiescroto no está justificado en etapa clínica I. Los ganglios del hilio renal izquierdo son incluidos en el campo al limitar el borde lateral izquierdo del campo. La técnica es llamada "palo de Hockey" en Norteamérica y "pata de perro [dog leg]" en el Reino Unido y Europa, que ofrece tasas de sobrevida del 92 y 99% a 5 años con una sobrevida específica de casi 100%. En varios estudios se ha realizado disminución del campo tradicional de tratamiento, permitiendo disminuir la morbilidad gastrointestinal, cardiaca, conteo espermático y el riesgo de segunda neoplasia sin afectar las tasas de supervivencia.19-21
El objetivo de nuestro estudio fue analizar el papel del tratamiento con radioterapia externa en seminoma clásico en etapas clínicas tempranas con campos de tratamiento convencional (Hemi Y), comparado con la técnica de Hemi Y modificada en el Hospital General de México.
¿ MATERIAL Y MÉTODOS
Se revisaron en forma retrospectiva los expedientes clínicos de 128 pacientes tratados por cáncer testicular en el departamento de Radiooncología entre mayo de 1999 a marzo del 2007. Sólo los pacientes con diagnóstico de seminoma clásico puro fueron incluidos (72 pacientes) en este análisis; pacientes con histología de anaplásico y espermatocítico fueron excluidos. Ningún paciente recibió quimioterapia como parte inicial de tratamiento. Los pacientes fueron estadificados de acuerdo al sistema de la Royal Marsden11 (Tabla 1). Sólo pacientes con seminoma en estadio temprano fueron incluidos, definiendo como enfermedad confinada al testículo (estadio I) o evidencia de metástasis a paraaórticos de 5 cm o menos (estadio IIA). En todos los casos se revisó historia clínica completa, marcadores tumorales antes y después del tratamiento quirúrgico, tomografía abdominopélvica, cirugía realizada, área testicular involucrada, reporte histopatológico, etapa clínica, técnica de tratamiento con radioterapia, tiempo de seguimiento, espermatobioscopia y efectos gastrointestinales (náusea, vómito y diarrea).
Los pacientes se agruparon en dos grupos para el tratamiento con radioterapia; el primer grupo tratado con Hemi Y convencional ("dog leg") con límite superior T10/T11, límite inferior en el foramen del obturador, ancho del campo de 10 a 12 cm, paralelos opuestos (anteroposterior y posteroanterior) y técnica de isocentro, en acelerador lineal con energía de Rx 6 mV o 10 mV, dosis de 30 Gy en 15 fracciones/diariamente, 5 veces por semana. El segundo grupo fue tratado con Hemi Y modificada, con límite superior T10/T11 o T11/T12 y el límite inferior a borde acetabular, con las mismas características técnicas que la Hemi Y convencional.
¿ CRITERIOS DE INCLUSIÓN Y EXCLUSIÓN
Los criterios de inclusión para la Hemi Y modificada son: seminoma estadio clínico I y IIA; cirugía realizada en el servicio de Oncología o de Urología del Hospital General de México. Sin los siguientes antecedentes: Cirugía inguinopélvica, varicocele, hernia inguinal, transgresión escrotal, criptorquidia. Los pacientes que no cumplieron con los criterios, se trataron con Hemi Y convencional.
¿ ANÁLISIS ESTADÍSTICO
Las características de los pacientes fueron informadas como media ± error estándar (ES). Para el análisis se utilizó en software SPSS versión 16.
¿ RESULTADOS
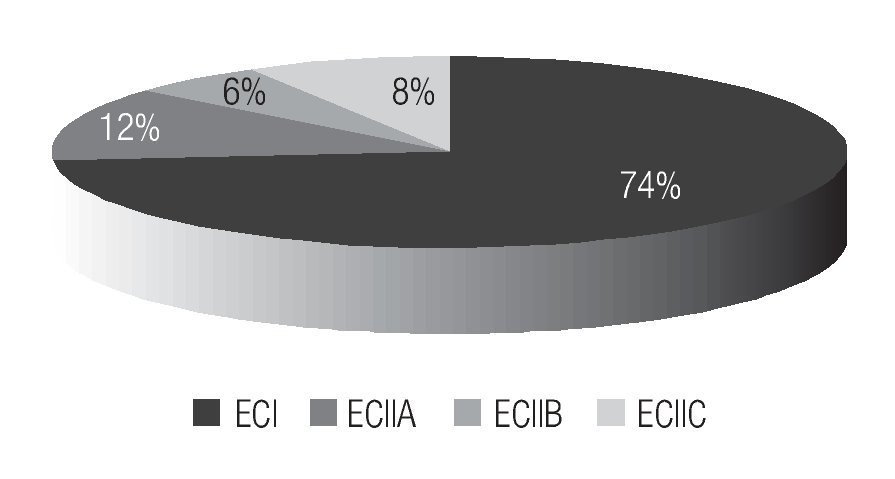
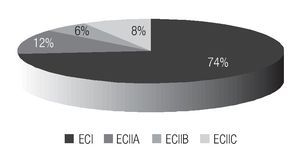
Entre mayo de 1999 a marzo del 2007 existen 128 registros de pacientes con cáncer testicular, de los cuales 72 casos corresponden a seminoma clásico en diferentes estadios. El 73% (53 casos) fueron estadio I y 27% (19 casos) estadio II; 13% (9 casos) estadio IIA, 6% (4 casos) estadio IIB y 8% (6 casos) estadio IIC (Imagen 1).
Imagen 1. Porcentaje de seminoma por estadios clínicos.
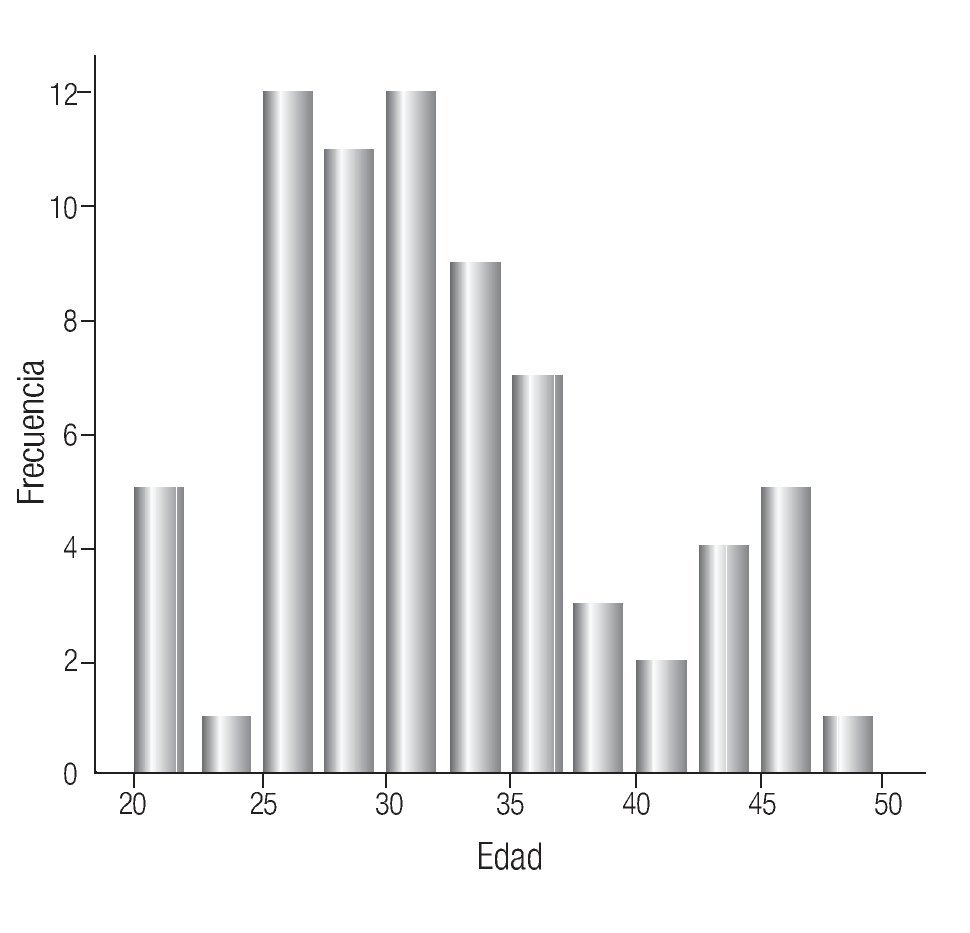
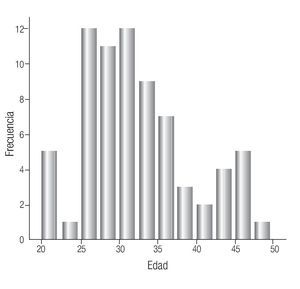
El rango de edad de los pacientes fue de 20 a 48 años con un promedio de edad de 32 años (Imagen 2).
Imagen 2. Edad de presentación de pacientes con seminoma.
En todos los casos se realizó orquiectomía radical, excepto en un paciente que fue operado fuera de la unidad por un cirujano no oncólogo, quien practicó una cirugía transescrotal. La región testicular afectada fue 40% del lado derecho (29 casos), lado izquierdo 57% (41 casos), bilateral 3% (2 casos).
El estudio de tomografía axial computarizada se encontró normal 74% (53 casos), con actividad retroperitoneal paraaórtica 26% (19 casos).
El reporte histopatológico reportó seminoma clásico 83% (60 casos), seminoma clásico con infiltración a túnica albugínea 10% (7 casos), seminoma clásico con invasión capsular 5% (3 casos), seminoma clásico con extensión a epidídimo 1% (1 caso) y seminoma clásico con necrosis extensa 1% (1 caso).
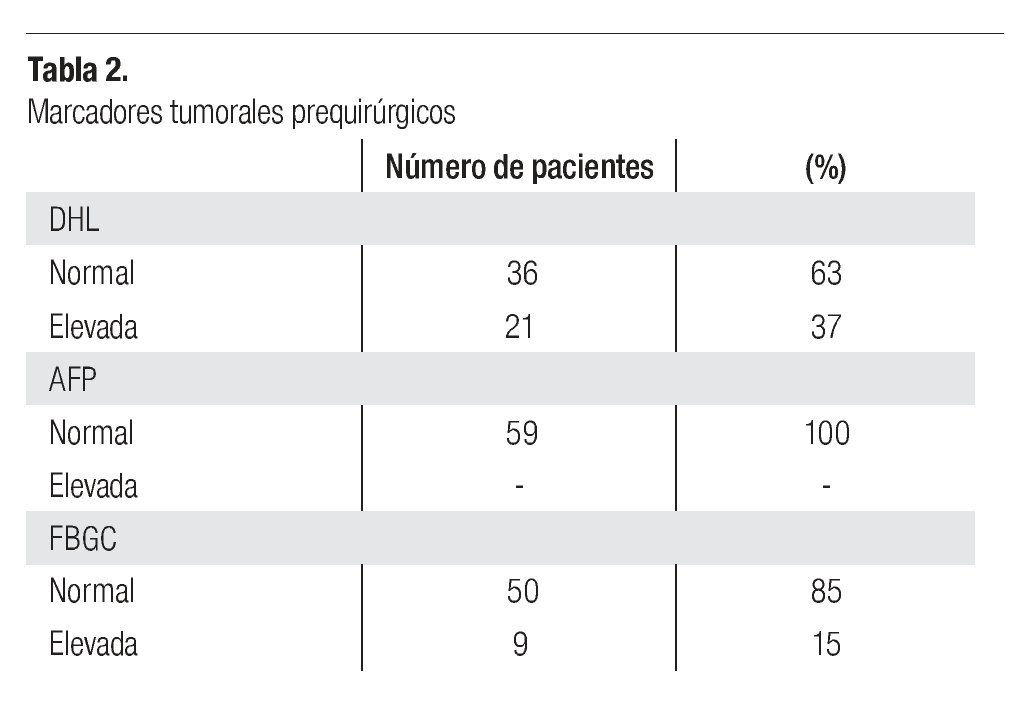
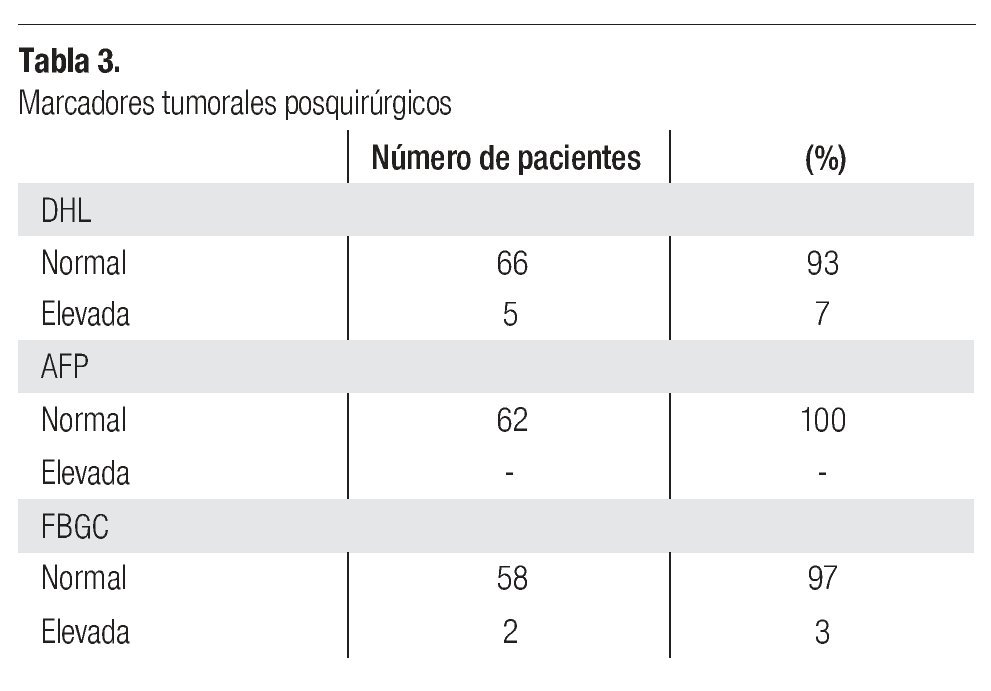
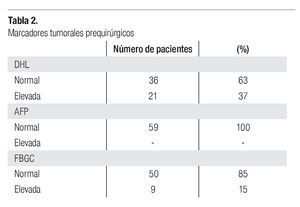
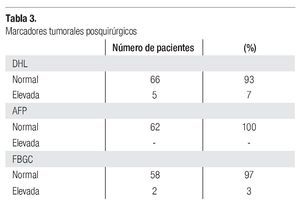
Los marcadores tumorales prequirúrgicos y posquirúrgicos; deshidrogenada láctica (DHL), alfa-fetoproteína (AFP) y fracción b de gonadotrofina coriónica (FBGC), se describen en las Tablas 2 y 3.
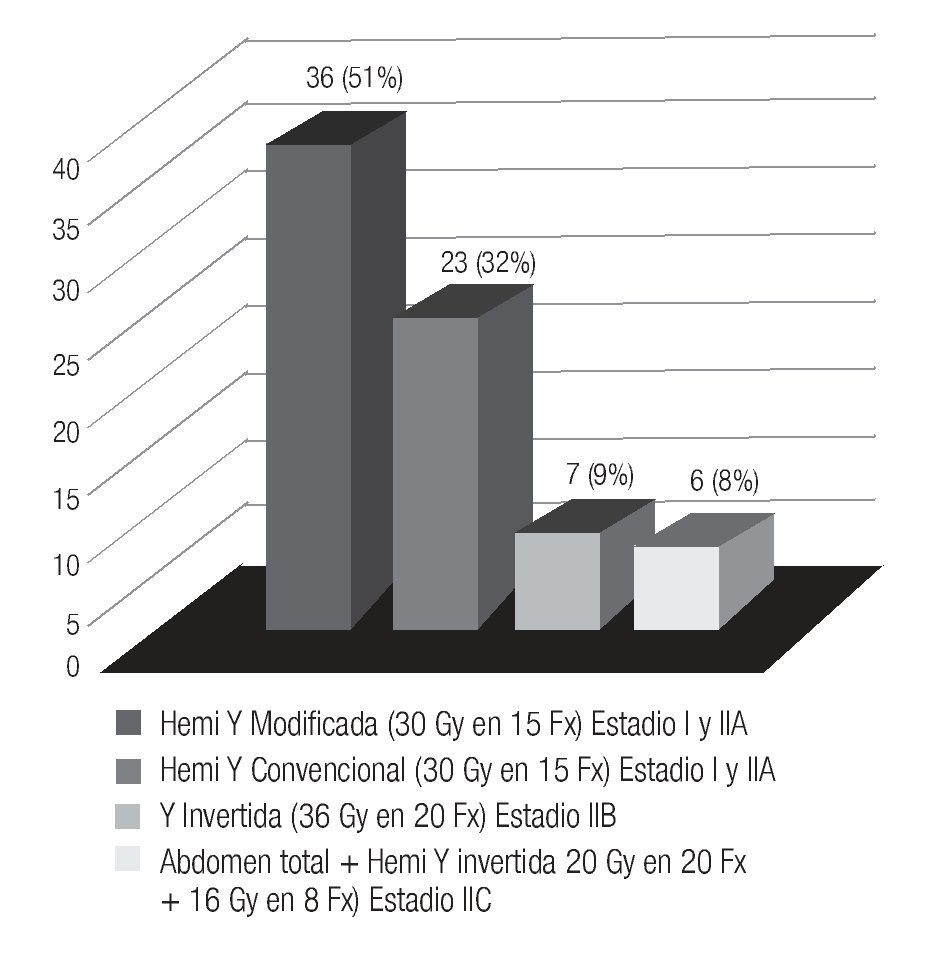
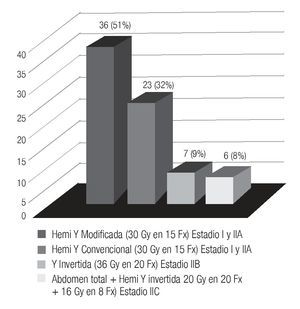
La técnica y dosis de tratamiento utilizadas son Hemi Y modificada 51% (36 casos), dosis 30 Gy en 15 fracciones, Hemi Y convencional 32% (23 casos); dosis de 30 Gy en 15 fracciones para estadio I y IIA, Y invertida 9% (7 casos); dosis de 36 Gy en 20 fracciones para estadio IIB y abdomen total más Y invertida 8% (6 casos); dosis de 20 Gy en 20 fracciones al abdomen total y Hemi Y invertida 16 Gy en 8 fracciones (Imagen 3).
Imagen 3. Técnica de tratamiento y dosis
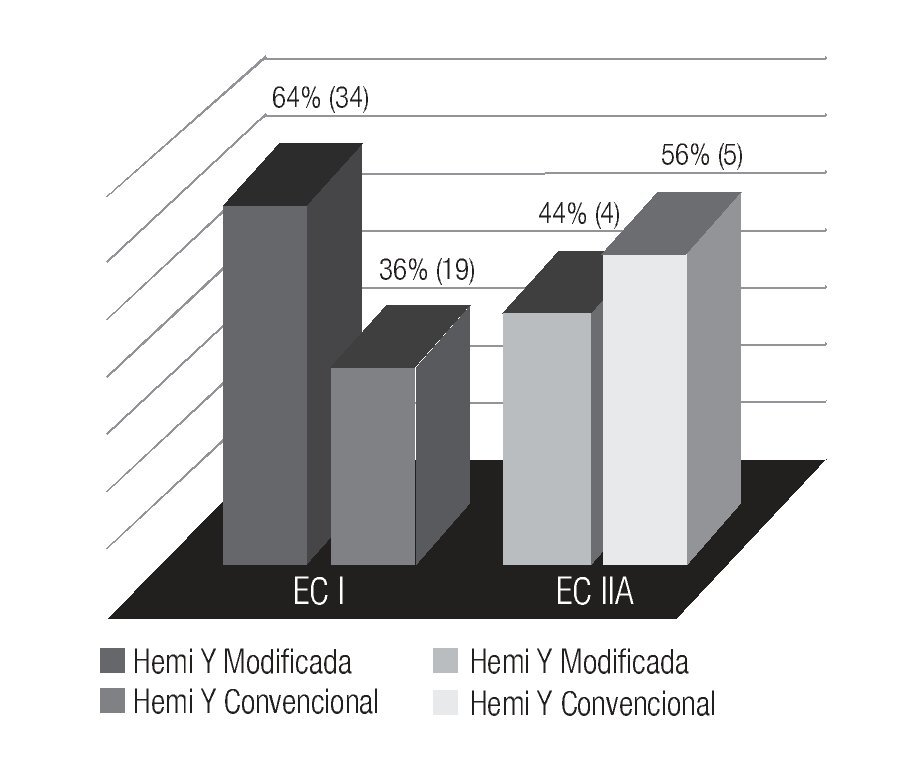
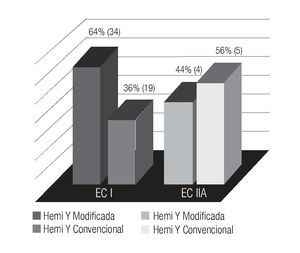
Los pacientes con estadio I fueron tratados con Hemi Y modificada 64% (34 casos) y Hemi Y convencional ("dog-leg") 36% (19 casos). Estadio IIA se trataron con Hemi Y modificada 44% (4 casos) y Hemi Y convencional 56% (5 casos). Ambos grupos tratados con 30 Gy en 15 fracciones (Imagen 4).
Imagen 4. Técnica de tratamiento en seminoma estadio I y IIA.
Los efectos gastrointestinales presentados (náusea, vómito, diarrea) fueron 48% (17 casos) en el grupo de Hemi Y convencional y 23% (6 casos) en el grupo de Hemi Y modificada.
El conteo espermático no fue posible determinarlos en todos los pacientes, ya que algunos no contaban con la espermatobioscopia inicial y en aquellos expedientes que se pudieron analizar, se encontraban con oligospermia antes del tratamiento y postratamiento.
El promedio de seguimiento es de 23.1 meses, el máximo de seguimiento es de 60 meses, el mínimo es de 1 mes y sin datos de actividad tumoral en 100% de los pacientes.
¿ DISCUSIÓN
Ante la sospecha de un tumor de células germinales, deben obtenerse marcadores tumorales prequirúrgicos, deshidrogenasa láctica, alfa-fetoproteína y fracción beta de gonadotrofina coriónica y espermatobioscopia. El tratamiento quirúrgico es el pilar en este manejo con orquiectomía radical con ligadura alta de cordón espermático,22 que es diagnóstica y terapéutica. Con orquiectomía el riesgo de recaída en seminoma etapa clínica (EC I), es del 12-20% a la región paraaórtica.23-25 Por lo que los pacientes con seminoma en EC I, pueden someterse a un tratamiento adyuvante que puede ser: radioterapia o quimioterapia con un nivel de evidencia I.26,27 También es válido la vigilancia considerando el sobretratamiento adyuvante de alrededor del 80% de los casos de las etapas I.
Los programas de vigilancia se han incrementado de 10 a 33%, reportado en el British Columbia Cancer en un periodo de 10 años.28 En Estados Unidos y Canadá los radiooncólogos ofrecen la vigilancia como una opción en 78%.29 Sin embargo, el riesgo de recaída se presenta de 16.9 a 20%, con una mayor incidencia a la región de retroperitoneo (76 a 94%).26 En los pacientes que son sometidos a un programa de vigilancia, se deben considerar los factores pronósticos, como el tamaño tumoral (≤ 4 cm o > 4 cm), edad (≤ 36 o > 36 años), invasión linfovascular, características histológicas (clásico o anaplásico) e invasión de la rete testis; al realizar el análisis univariado, los factores de mayor significancia, son el tamaño tumoral e invasión de la rete testis para riesgo de recaída (p = 0.03).26,30,31 Los pacientes en vigilancia se deben monitorizar en un periodo de 10 años, cada 2 meses en el primer año, 3 meses al segundo año, 4 meses al tercer año y cada 6 meses a partir del 4o. año. Con exploración física, marcadores tumorales y tomografía abdominopélvica.27,32
Sin embargo, en estudios en el Reino Unido y Toronto (Canadá), la vigilancia a 10 años cuesta de 39 a 43% más caro que someterlos a radioterapia.32,33 Considerando las características de la población del Hospital General de México, la mayoría de bajos recursos y algunos referidos de otros Estados de la República, con factores de mal pronóstico, no es posible llevar a cabo de forma precisa y adecuada un programa de vigilancia.
Debido a que el seminoma es un tumor radiosensible y por el riesgo de metástasis microscópica,18 la radioterapia adyuvante continúa siendo el tratamiento estándar a la región de ganglios paraaórticos y pélvicos ipsilaterales. Los resultados que obtuvimos son similares a lo descrito en la literatura encontrando una mayor distribución en el estadio I, la cual fue del 73% y el estadio II de 27%, reportándose en algunos estudios una frecuencia del 70-80% en estadio I, 11% en el estadio II y 4% en el estadio III. La edad de presentación en promedio fue a los 32 años con una mayor distribución de casos de los 25 a los 37 años de edad. Hay un pequeño pico en edades tempranas de la niñez alrededor de los 2 años, con bajas tasas hasta los 15 años de edad y un segundo pico en adultos jóvenes alrededor de los 25 a 40 años de edad, las tasas disminuyen a los 65 y 75 años.34 Aun con el incremento de la incidencia, existe una significativa mejoría en la sobrevida a 5 años y reducción de la mortalidad.35
La radioterapia adyuvante provee excelentes tasas de sobrevida de causa específica entre 92 y 99% a 5 años de casi 100%.36-40 Los resultados encontrados son similares a los nuestros con una sobrevida del 100%, y seguimiento de 60 meses. La morbilidad aguda es relativamente baja. Muchos autores han reportado un incremento de la toxicidad gastrointestinal (enfermedad ácido péptica), reportándose hasta en 16%. Todavía es difícil asegurar si la radioterapia contribuye a un incremento de la enfermedad ácido péptica, ya que ésta se incrementa con la edad.41 La diarrea se desarrolla en la minoría de los pacientes. Las complicaciones tardías severas son raras y usualmente no se presentan, a menos que los pacientes tengan problemas médicos adyacentes o por errores técnicos. Un incremento en la incidencia de úlcera péptica en pacientes tratados con 30 a 45 Gy ha sido reportado. Aproximadamente 60% presentan toxicidad gastrointestinal aguda por la radioterapia con la técnica de Hemi Y convencional y 5% presentan toxicidad crónica.41 Nuestros resultados encontrados fueron de 48% de morbilidad gastrointestinal para el grupo de Hemi Y convencional y 23% en el grupo de Hemi Y modificada. Actualmente, con la propuesta del grupo alemán de sólo tratar región paraaórtica limitando la toxicidad grados 2-3 y 49% no tuvieron toxicidad.42
Datos reportados de la fertilidad de posradiación reportan que omitir la región pélvica disminuye la dosis del testículo contralateral con recuperación a los 18 meses después del tratamiento.43 Los resultados de nuestra serie fueron muy inconsistentes, ya que no en todos los pacientes estaba determinado la espermatobioscopia pre y postratamiento, sólo se puede describir que los pacientes presentaban oligospermia al inicio de la terapia, y en el seguimiento continuaban con la misma, actualmente al unificar criterios se está determinando en conteo espermático pre y postratamiento.
El riesgo de segundas neoplasias e infertilidad, han cuestionado la radiación a los ganglios pélvicos debido a que el principal drenaje es el paraaórtico y el hilio renal.36
Describiéndose en varios estudios que el riesgo de recaída a región pélvica es de sólo 2%.37-39 Por lo tanto, se justifica la reducción del campo de tratamiento, sin irradiación a la región pélvica. Las ventajas de este abordaje incluyen disminución de la dispersión de la radiación al testículo y reducción integral de la dosis, preservando la fertilidad sin requerir una vigilancia a la región pélvica. Disminuyendo el riesgo de segundas neoplasias y morbilidad gastrointestinal.
Las dosis de radiación aún son poco claras; existe un amplio rango de dosis y fraccionamiento aceptados, las dosis oscilan entre 26 a 36 Gy (2 Gy por fracción). En una prueba aleatorizada del Medical Research Council, evalúan la reducción de dosis de radioterapia de 30 Gy vs. 20 Gy en seminoma estadio I, en 625 pacientes de 1995 a 1998. Sin encontrarse diferencia estadísticamente significativa en el control local, pero con disminución en la morbilidad gastrointestinal, hematológica, letárgica y ausencia laboral.40
El uso de la quimioterapia se ha evaluado en varios estudios utilizando carboplatino de uno a dos ciclos, con poca recurrencia reportadas (2-9%). Oliver y cols., evaluaron un estudio multicéntrico aleatorizado al comparar la quimioterapia y radioterapia en 1477 pacientes de 1996 al 2001, sin encontrarse diferencia estadística en la tasas libres de recaída.44 Sin embargo, al evaluar un estudio prospectivo, se encontró que los pacientes con el uso de carboplatino tienen una alta mortalidad cardiovascular y riesgo de segunda neoplasia de testículo contralateral en 4%.45 En nuestra institución no se tiene experiencia reportada por el uso de quimioterapia adyuvante en seminoma, debido a las características de la población de bajos recursos. La radioterapia continúa siendo el tratamiento estándar adyuvante para los pacientes con seminoma en estadios tempranos.
¿ CONCLUSIONES
El control de nuestra serie es del 100% con un seguimiento de 60 meses. La dosis de 30 Gy en 15 fracciones administradas a estadios I y IIA ofrece un control local, de acuerdo a lo reportado en la literatura. La dosis con la técnica de Hemi Y modificada a nivel de la base del pene y región testicular, son menores. Por lo que la probabilidad de infertilidad y esterilidad se reduce en comparación a los campos convencionales utilizados. Al comparar la técnica de tratamiento de Hemi Y convencional y la modificada no se afecta el control local, pero sí se disminuyen los efectos gastrointestinales. Con este trabajo se planteará disminuir la dosis a 2520 cGy en 14 fracciones, conservando la técnica de Hemi Y modificada y utilizando la técnica convencional en los que no cumplan los criterios de inclusión.
Correspondencia: Dr. Óscar Rubio Nava.
Juan de la Cierva. Mz. 68 Lt.
10. Colonia Fuego Nuevo. C.P. 09800.
Correo electrónico: drorn2003@yahoo.com.mx