¿ INTRODUCCIÓN
El dolor en el paciente oncológico representa una de las mayores amenazas en la evolución de esta patología, ya que es el síntoma más temido e incapacitante; afecta el bienestar biopsicosocial. De los pacientes con patología oncológica, 30% a 40% son sujetos a algún tratamiento y presentan dolor.1 En etapas terminales, se incrementa hasta 74% a 80%.2 El paciente con cáncer puede experimentar la combinación de dos o más tipos de dolor, con lo que aumenta la complejidad para su tratamiento.
Cerca de 80% de los pacientes con enfermedad metastásica, sufren de dolor causado por la infiltración tumoral directa. El dolor es un indicador importante de la progresión de la enfermedad. Aproximadamente 20% de los casos puede ser atribuido a la cirugía, radioterapia o quimioterapia.2
El médico de primer contacto, así como los especialistas, en muchos casos se enfrenta al reto terapéutico para el control del dolor en un enfermo con cáncer. Esta comunicación presenta las recomendaciones clínicas para el manejo del dolor en pacientes oncológicos. Se debe enfatizar que es un resumen de todas las opciones de tratamiento que existen para el control del dolor. En situaciones complejas, deberán ser evaluados por subespecialistas en algología y en la clínica del dolor, para recibir un tratamiento altamente especializado y multidisciplinario que incluya no sólo al grupo oncológico.
¿ MÉTODOS
Se realizó una revisión de la bibliografía médica sobre artículos en inglés en las bases de datos Medline, PubMed, Cochrane, Medigraphic, con la palabra clave cancer pain; se incluyeron los artículos originales y las guías de manejo en oncología que tuvieran un alto nivel de evidencia durante el periodo de 1997 a 2009. Se incluyen las recomendaciones actuales para manejo del dolor en el paciente con cáncer, según la clasificación del dolor de la Organización Mundial de la Salud (OMS) en el paciente oncológico.
¿ CLASIFICACIÓN DEL DOLOR
El dolor es una sensación desagradable, sensorial y emocional, a la vez, que se asocia a un daño tisular real o potencial o simplemente descrito como tal.3 El dolor siempre es subjetivo y tiene varias clasificaciones.4,5
Según su origen: El dolor asociado al tumor, en forma directa como una obstrucción intestinal causante de distensión; obstrucción de conductos de órganos sólidos; crecimiento en órganos sólidos. Por metástasis a otros órganos como hueso, hígado e incluso sistema nerviosos central y/o periférico; incluyendo dolor por necrosis o ulceración de la mucosa de vasos sanguíneos.
El dolor asociado al tratamiento quirúrgico (mastectomía, disecciones radicales de cuello, entre otros), postquimioterapia (polineuritis, neuropatía periférica), postradiación (neuritis, osteoradionecrosis, plexopatias, enteritis/mucositis).
El dolor no relacionado a ninguno, como el dolor psicógeno, no tiene una base fisiopatológica real y no existe ninguna evidencia de lesión o daño tisular.
Evolución: Agudo o crónico, como el que evoluciona por más de tres a seis meses y que puede afectar de forma perjudicial al comportamiento del paciente.
Fisiopatología: Depende del daño a estructuras somáticas y/o viscerales o al sistema nervioso:
Nociceptivo:
Somático: producido por lesión de piel, pleura, peritoneo, músculo, periostio o hueso. Es bien localizado y descrito como punzante u opresivo y continuo.
Visceral: es mal localizado, sordo, irradiado y muy difícil de describir.
Neuropático: causado por lesión, compresión o daño a estructuras del sistema nervioso central o periférico. Se describe como urente, quemante, transfictivo, lancinante, eléctrico como una sensación de picadura, entumecimiento u hormigueo y en algunos casos acompañado de alteración de la sensibilidad (disestesia, parestesia, alodinia, hiperestesia, hiperalgesia).
Intensidad: Leve, Moderado, Severo, Insoportable.
¿ MODULACIÓN DE LA NOCICEPCIÓN
La nocicepción es la integración de una serie de cambios bioquímicos y neurales que ocurren en respuesta a estímulos dañinos, internos y/o externos.
El estímulo generado por daño tisular (térmico, mecánico o químico), activa a las terminales nerviosas libres o nociceptores. A este nivel se desencadena una cascada de múltiples mediadores de la respuesta inflamatoria como son derivados del ácido araquidónico, prostaglandinas, histamina, serotonina, iones de potasio e hidrógeno, sustancia P.
Las neuronas de primer orden (aferentes periféricas), tienen su cuerpo celular en el ganglio de la raíz dorsal y emite proyecciones axonales dentro del asta dorsal y otras áreas de la médula espinal, a través de la activación de fibras nerviosas. Estas fibras son de dos tipos: fibras C, amielínicas de transmisión lenta (dolor sordo, difuso, abundantes en vísceras) y fibras A-δ mielinizadas de transmisión rápida (dolor agudo, punzante, bien localizado, presente en piel, músculo y articulaciones).6-8
La transmisión medular de los mensajes nociceptivos se halla bajo el efecto de equilibrio entre influencias excitadoras e inhibitorias. Al romperse este equilibrio se presenta el dolor. La modulación en el asta dorsal de la médula espinal resulta de la acción de sustancias neurotransmisoras o por reflejos raquídeos. Los aminoácidos excitatorios que se utilizan son el L-glutamato y aspartato.
Además de varios neuropéptidos como el péptido intestinal vasoactivo (VIP), colecistocinina (CCK), péptido liberador de gastrina, angiotensina II, el péptido ligado al gen de la calcitonina (CGRP) y la sustancia P. Las sustancias inhibitorias involucradas en la regulación de los impulsos aferentes a este nivel incluyen las encefalinas, endorfinas beta, somatostatina y noradrenalina. El cuerpo celular de la neurona de segundo orden, ubicado en el asta dorsal, emite proyecciones axonales que cruzan el hemisferio contralateral de la médula espinal hasta hacer sinapsis con el tálamo y llegar a la neurona de tercer orden hasta la corteza sensorial.
¿ EVALUACIÓN DEL DOLOR
El correcto tratamiento del dolor comienza con una evaluación integral del mismo y sobre las consecuencias que tiene en el estado funcional del paciente.
Se debe comenzar por una historia clínica completa, una semiología minuciosa del dolor: fecha de inicio, modo de inicio, sitio, tipo, intensidad,9 duración, frecuencia, irradiación, progresión fenómenos que lo precipitan, fenómenos que lo aumentan, fenómenos que lo disminuyen, impacto en actividades cotidianas, medicación empleada, dosis y vía de administración, tiempo y frecuencia del tratamiento, resultados y reacciones secundarias.
Las evaluaciones conductuales valoran las impresiones subjetivas y constituyen el grupo de mayor objetividad en la cuantificación de la intensidad del dolor, como la aplicación de escalas verbales, numéricas y analógico-visuales.5,10
El tratamiento del dolor oncológico debe ser continuo, evaluado en cada visita. Abarcar los aspectos físicos, psicológicos y sociales; el dolor debe ser abordado de manera inmediata así como de un tratamiento de la causa subyacente y valorar las diferentes alternativas terapéuticas farmacológicas y no farmacológicas.
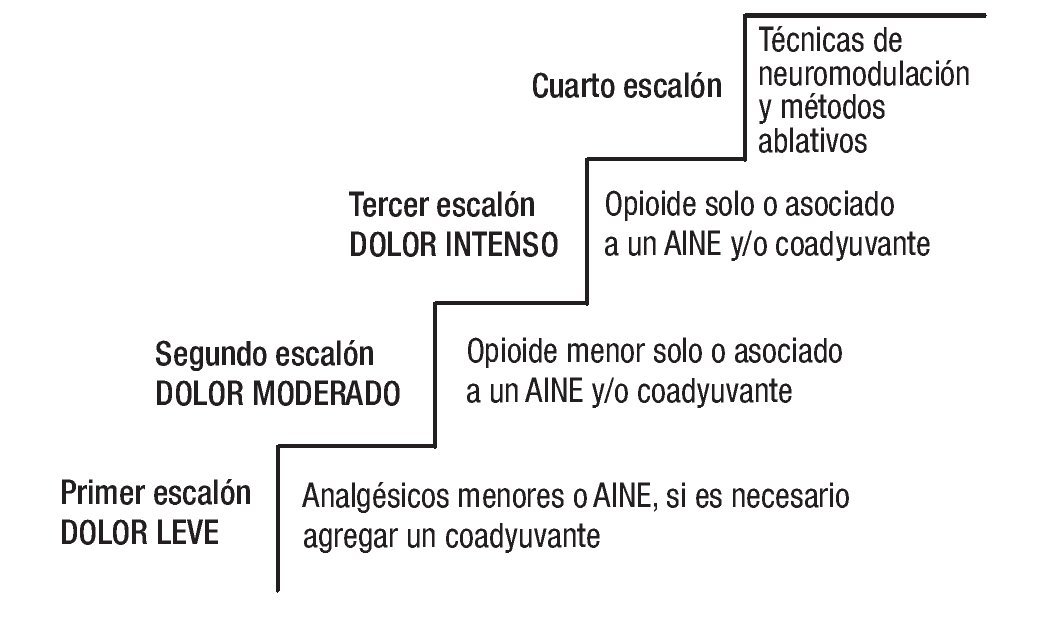
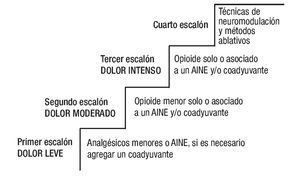
Las recomendaciones para el tratamiento del dolor oncológico se basan en la escalera analgésica de la OMS2 (Figura 1).
Figura 1. Escalera analgésica de la Organización Mundial de la Salud.
Con base en la Escala Verbal Análoga, el dolor se cataloga como: leve de uno a tres, moderado cuatro a seis, e intenso cando es mayor de siete.12
Los fármacos útiles en el tratamiento del dolor se clasifican en tres grupos: analgésicos no opioides, analgésicos opioides y adyuvantes.
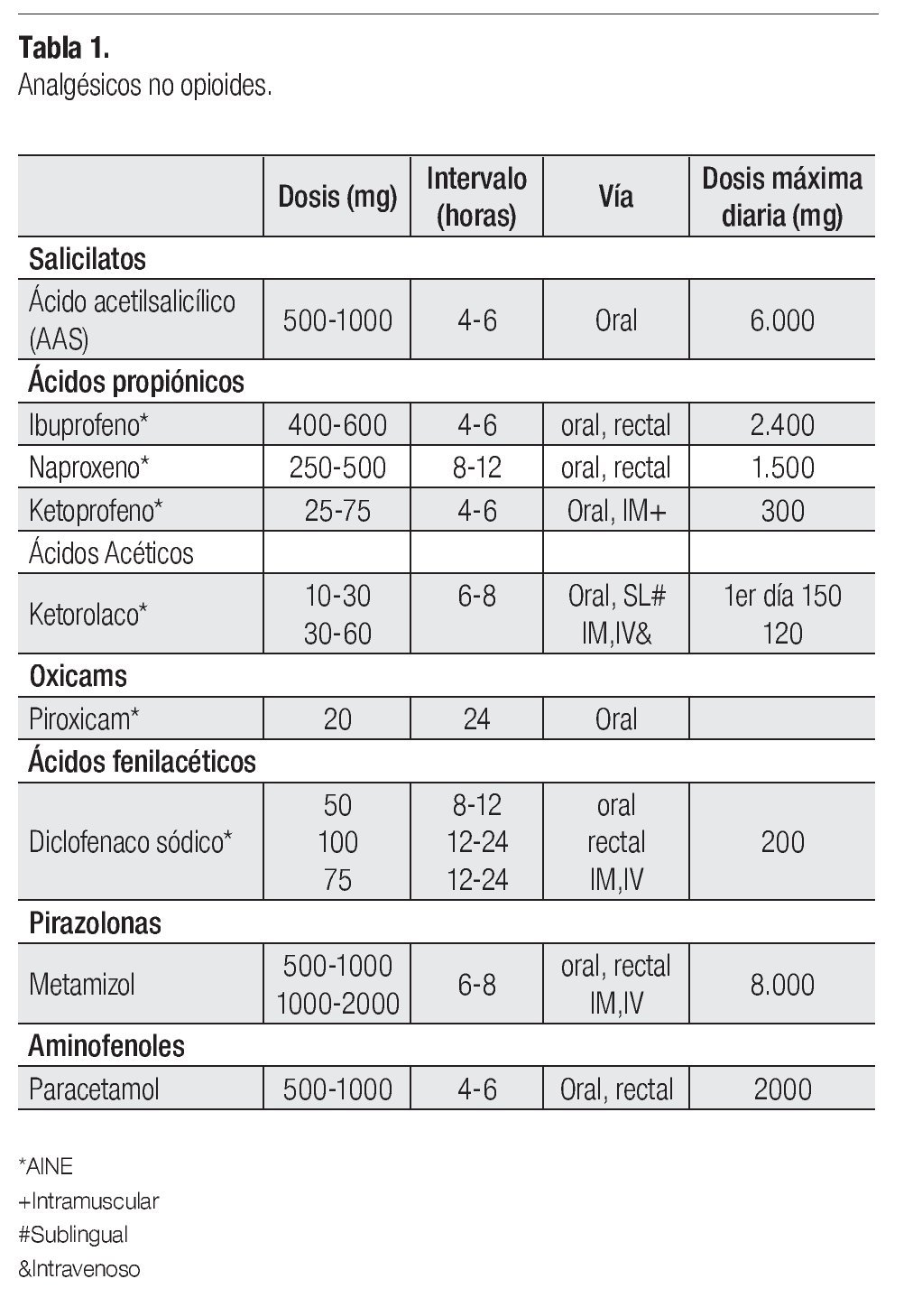
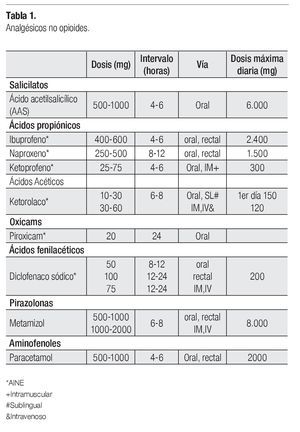
Analgésicos no opioides: Incluyen paracetamol, ácido acetilsalicílico y los antiinflamatorios no esteroideos (AINEs) (Tabla 1). Constituyen un grupo amplio de medicamentos, químicamente heterogéneos. Poseen techo terapéutico, es decir, una dosis máxima diaria por encima de la cual no se consigue un mayor efecto analgésico. No existe una evidencia clara que demuestre eficacia superior de un AINE, respecto a otro.11
Están indicados en dolor de intensidad leve o moderada, con afección ósea, músculo-tendinosa y en la compresión mecánica de pleura o peritoneo.
Pueden potenciar la acción analgésica de los opioides (menores o mayores)13 y tienen efectos secundarios:
Gastrointestinales: dispepsia, pirosis, úlcera gastroduodenal, hemorragia. Estos efectos varían en intensidad según el AINE. Los inhibidores selectivos de la COX-2 no tienen estos efectos durante periodos de tiempo cortos.
Renales: insuficiencia renal, nefritis intersticial, síndrome nefrótico, necrosis papilar.
Pulmonares: broncoespasmo.
Hematológicos: interfieren en la agregación plaquetaria (excepto los inhibidores selectivos de la COX-2).
Reacciones de hipersensibilidad: shock anafiláctico, urticaria. Pueden existir reacciones alérgicas cruzadas entre AINE.
¿ ANALGÉSICOS OPIOIDES DÉBIDES
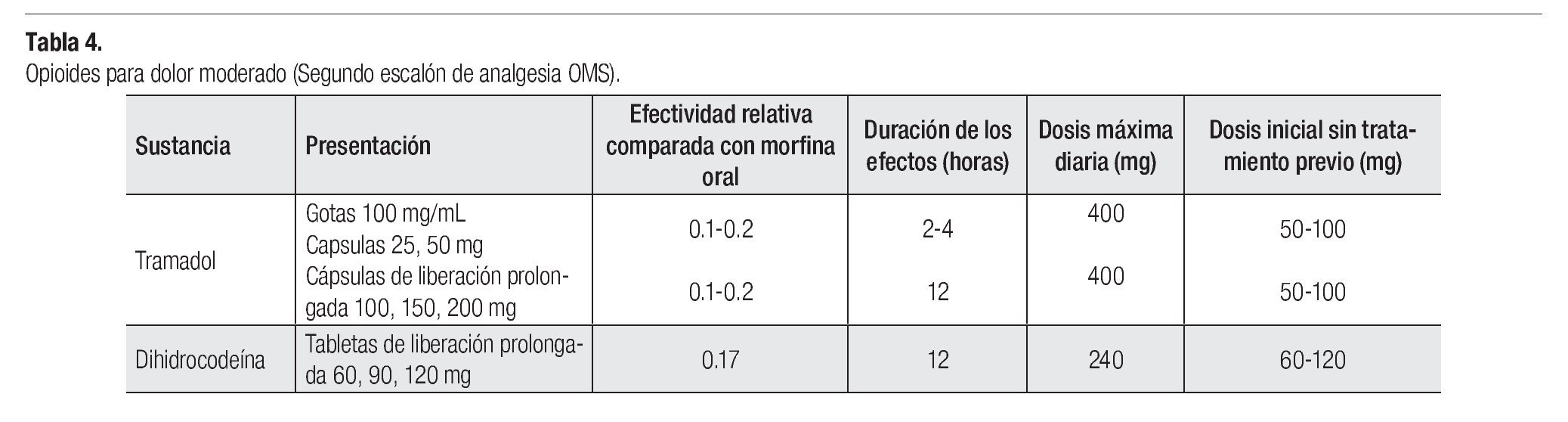
TRAMADOL
Dosis inicial: 50 mg cada seis a ocho horas, con una dosis máxima de 400 mg diarios. Su administración puede ser por vía oral, rectal, subcutánea, intramuscular o intravenosa. Su potencia analgésica es: 10 mg de tramadol oral, equivalen aproximadamente a 2 mg de morfina oral. Precauciones: Es prudente evitarlo en pacientes predispuestos a sufrir ataques epilépticos, ya que disminuye el umbral convulsivo (por ejemplo, pacientes con tumores o metástasis cerebrales).14 En pacientes con insuficiencia renal, puede acumularse y aumentar sus efectos secundarios.
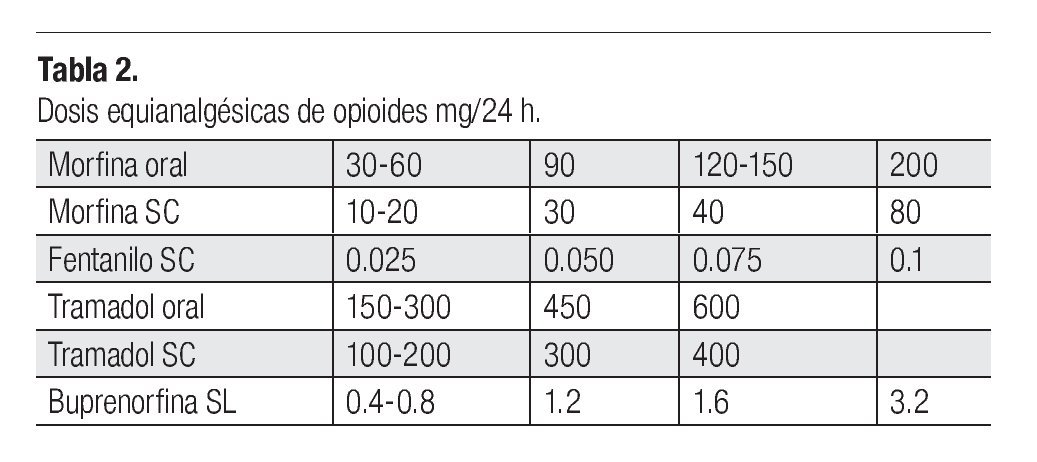
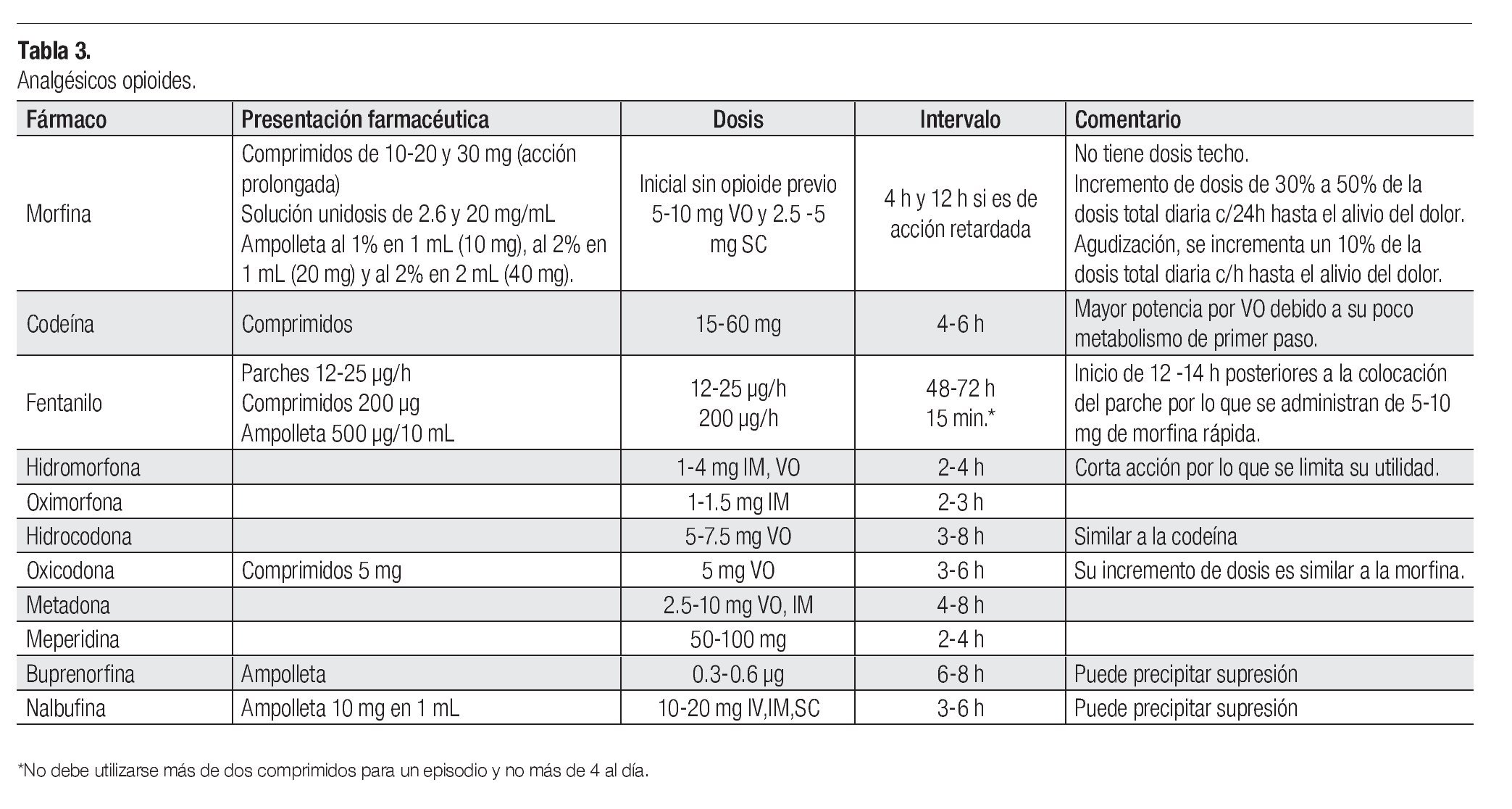
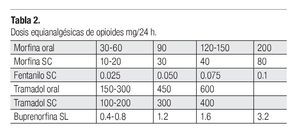
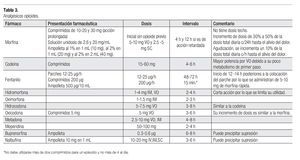
Analgésicos opioides: Administrados en dosis equianalgésicas, es decir, aquella que controla el dolor con mínimos efectos secundarios (Tabla 2). Son igual de efectivos, sin embargo los efectos secundarios pueden variar; un opioide puede tener un índice terapéutico mayor que otro en un paciente en particular o en un tipo concreto de dolor (Tabla 3).15 El cambio de opioide se planteará si los efectos secundarios son intolerables o no se obtiene un alivio adecuado.16 Si existe insuficiencia renal, los opioides deben ser utilizados con precaución.
Existe una amplia variabilidad interindividual, de los efectos secundarios de los opioides:17-20
Estreñimiento. Debe establecerse adecuada profilaxis con laxantes de acción osmótica (polietilenglicol, lactilol, lactulosa) o estimulantes (bisacodilo).
Náuseas y vómitos. Si son postprandiales están indicados los antieméticos procinéticos (domperidona, metoclopramida). Si ocurren con el movimiento, cinarizina. En ausencia de estas asociaciones pueden ser útiles el haloperidol, los corticoides o los antagonistas de la serotonina (ondansetrón).
Sedación y alteración de las funciones cognitivas: Descartar posibles alteraciones metabólicas o patología del sistema nervioso central. Las alteraciones cognitivas son tratadas con neurolépticos.
Depresión respiratoria: Es mínimo aunque puede tratarse con naloxona; se disuelve una ampolleta de 0.4 mg en 10 mL de solución fisiológica y se administran 0.5 mL por vía intravenosa o subcutánea, cada dos minutos y hasta el restablecimiento de una respiración satisfactoria.
Prurito. Se trata con antihistamínicos.
Mioclonias. Pueden revertir con clonazepán (0.5 - 2 mg cada ocho horas) e hidratación adecuada. Sudoración, puede responder a corticoides o anticolinérgicos.
Retención urinaria. Llega a requerirse la aplicación de sonda vesical.
Tratamiento no farmacológico: Existen diferentes tratamientos no farmacológicos que pueden ser útiles en los pacientes con cáncer.15
Radioterapia. Es especialmente útil en el dolor por metástasis óseas,21 de tejidos blandos, en la compresión del sistema nervioso y en metástasis cerebrales. La radioterapia es importante en el manejo del dolor radicular.
Ablación con radiofrecuencia: Consiste en la aplicación de energía térmica en lesiones tumorales en las que el tratamiento con radioterapia o cirugía no puede ser aplicado o no ha sido efectivo. Existe gran experiencia en tumores primarios y metastásicos de hígado. También es utilizada en metástasis óseas y de tejidos blandos.
Técnicas neuroablativas: Existen una serie de procedimientos que se basan en la interrupción de las vías de transmisión del dolor. Están indicadas en pacientes seleccionados que tienen el dolor bien localizado y no ha respondido a otros tratamientos.
Cirugía paliativa: Es un tratamiento a tener en cuenta en las siguientes situaciones: Fracturas patológicas, plexopatías metastásicas, resección del tumor y tejidos circundantes. Obstrucción intestinal, Descompresión epidural de la médula espinal.
Terapia con modalidades físicas: frío, calor, estimulación eléctrica y acupuntura.
Terapia psicológica: El dolor es una experiencia multidimensional (física, psicológica, afectiva y conductual). La depresión y las alteraciones psicológicas son frecuentes en los pacientes con cáncer y dolor. Es indispensable el uso de psicoterapia y de terapia cognitiva-conductual.
¿ TRATAMIENTO DEL DOLOR LEVE (PRIMER ESCALÓN ANALGESIA OMS)
El dolor moderado se trata con analgésicos no opiodes, como paracetamol, o un antiinflamatorio no esteroideo (AINE).2 Cuando se utilizan los AINE por un tiempo prolongado se recomienda emplear medicamentos para proteger la mucosa gástrica. Se debe tener precaución al usar medicamentos nefrotóxicos y en pacientes con riesgo de cáncer (Tabla 1).22-25
¿ TRATAMIENTO DEL DOLOR MODERADO (SEGUNDO ESCALÓN DE ANALGESIA OMS)
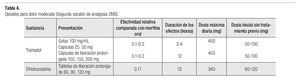
Para los pacientes con dolor moderado, se recomiendan tratamientos combinados que contienen paracetamol, ácido acetilsalicílico o un AINE, asociado con un opioide como la codeína, dehidrocodeina, tramadol o propoxifeno (Tablas 3 y 4). También puede asociarse un AINE con un opioide potente, como la oxicodona o morfina. Recientemente han aparecido nuevos productos que mejoran el apego al tratamiento farmacológico, con productos de liberación controlada, como el caso de la codeína; dehidrocodeina, tramadol, morfina y oxicodona en dosis apropiadas para dolor moderado. Asimismo existen formulas de dosis bajas en parches transdérmico de fentanilo y buprenorfina.2,26-28
¿ TRATAMIENTO DEL DOLOR SEVERO (TERCER ESCALÓN DE ANALGESIA OMS)
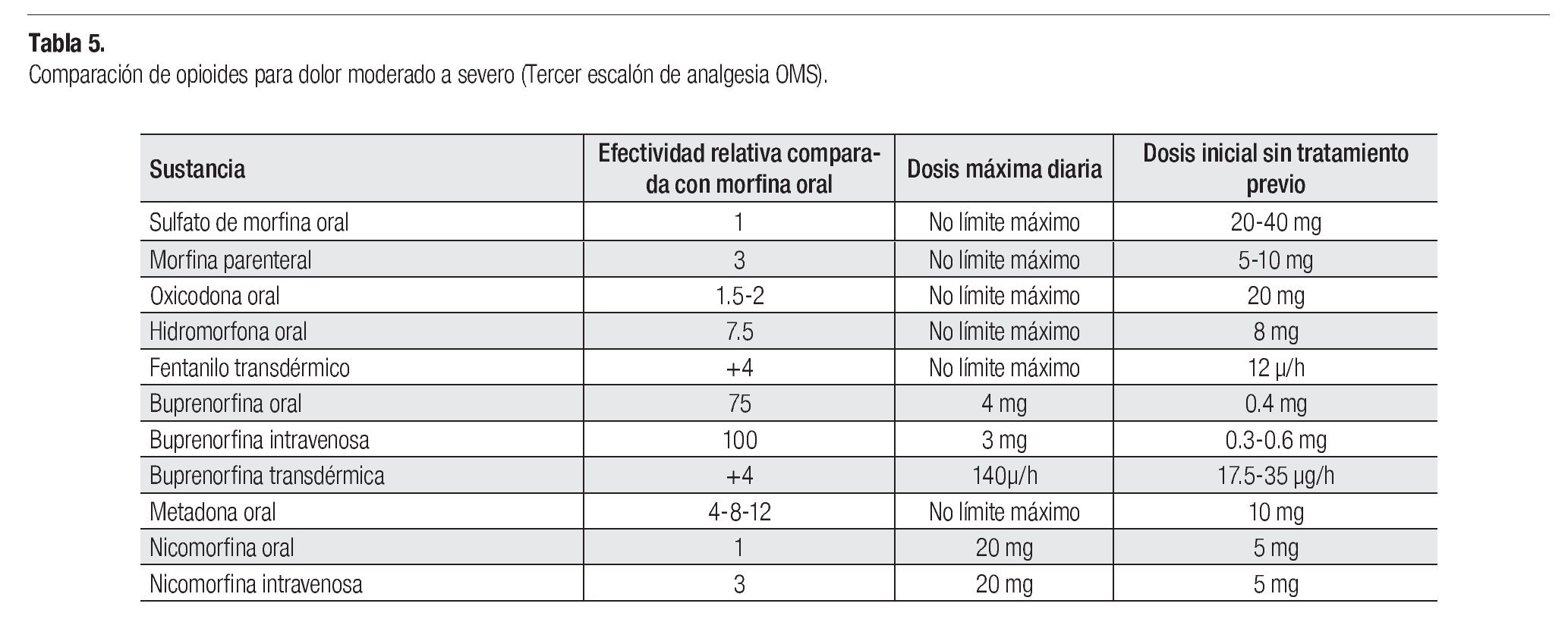
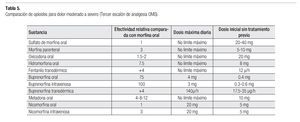
La morfina se usa comúnmente en el dolor severo; se prefiere la administración oral; si se emplea la vía parenteral, la dosis es un tercio a la administrada por vía oral. Los medicamentos alternativos a la morfina oral son: oxicodona o hidromorfona, tanto de liberación inmediata como de liberación prolongada.
En pacientes cuya dosis de morfina se mantiene estable, se recomienda utilizar parches transdérmicos de fentanilo o buprenorfina. Los parches son el tratamiento de elección para los pacientes con incapacidad para utilizar la vía oral, con pobre tolerancia a la morfina o con poco apego al tratamiento.
Los opioides potentes pueden ser combinados con analgésicos no opioides (1er escalón). Aquellos pacientes con dolor severo que requieran alivio del dolor de forma urgente, deben tratarse con opioides parenterales, administrados por vía subcutánea o intravenosa (Tabla 5). Las inyecciones intramusculares son dolorosas y no tienen ventaja farmacocinética.29-31
Muchos pacientes desarrollan efectos adversos, como constipación, náusea, vómito, retención urinaria, prurito y toxicidad del sistema nervioso central (por ejemplo, somnolencia, deterioro cognitivo, confusión, alucinaciones, movimientos mioclónicos e hiperalgesia inducida por opioides). En algunos casos, una reducción en la dosis puede mejorar los efectos adversos y se debe asociar con un AINE, o emplearse algún tratamiento alternativo, como bloqueo nervioso o radioterapia.
La naloxona es un antagonista de la acción de los opioides para usarse por vía intravenosa; revierte los síntomas de la sobredosis accidental por opioides.2, 28,30,31
¿ TRATAMIENTO EN RESISTENCIA AL DOLOR Y DOLOR NEUROPÁTICO
En algunos pacientes, en quienes el dolor no puede ser controlado de forma adecuada, se pueden beneficiar con la anestesia invasiva y tratamientos neuroquirúrgicos. Existe poca evidencia para el uso de dosis subanestésicas de ketamina en dolor intratable.
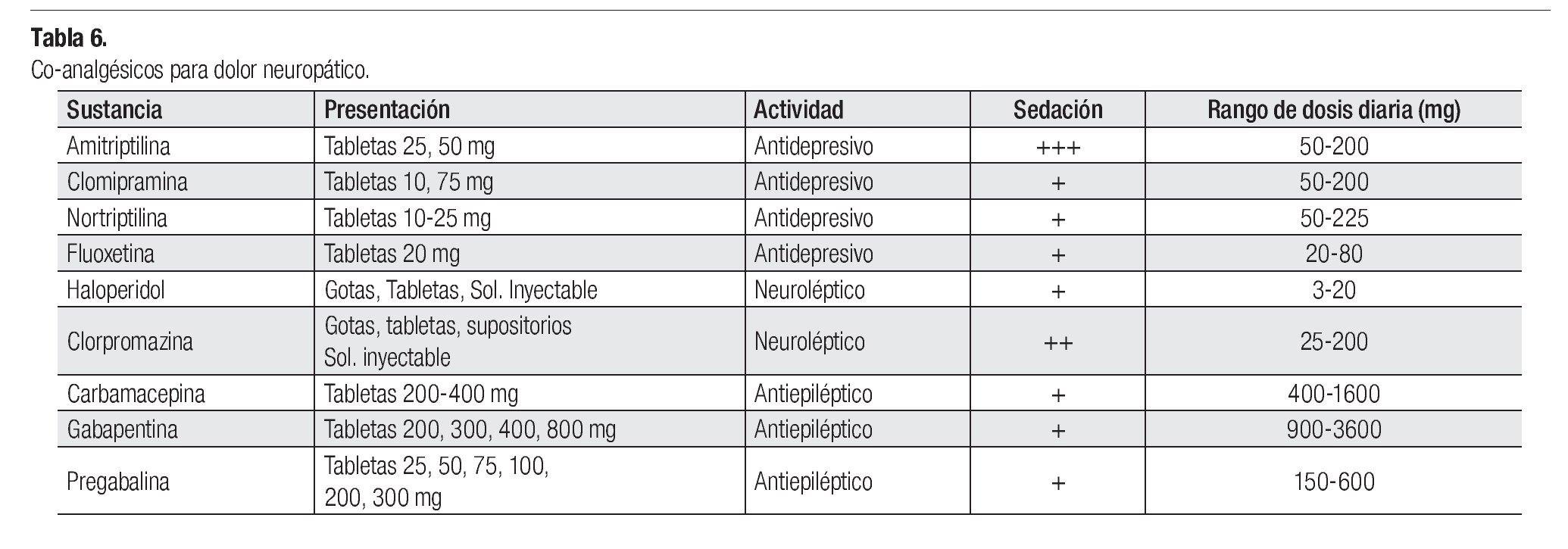
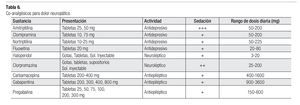
El dolor neuropático, causado por infiltración del tumor, síntomas paraneoplásicos o polineuropatía, frecuentemente es difícil controlar con el uso exclusivo de opioides. Se recomienda combinar un AINE y un opioide con antidepresivos o anticonvulsivantes (Tabla 6).
El uso de esteroides debe ser considerado para casos de compresión nerviosa; existe suficiente evidencia para el uso de bifosfonatos para dolor óseo refractario en pacientes con cáncer.2,24-29
¿ DOLOR REFRACTARIO
El dolor se considera refractario cuando presenta las siguientes características:
Incapacidad para proporcionar alivio
Está asociado con morbilidad aguda o crónica excesiva e intolerable
Hay poca probabilidad de alivio dentro de un marco de tiempo tolerable
Esta situación converge frecuentemente ante el estado terminal del caso; el dolor puede ser refractario. En estos casos, la sedación puede ser la única opción posible para proporcional alivio. Los medicamentos usados comúnmente ante este reto incluyen: opioides, neurolépticos, benzodiacepinas, barbitúricos y propofol.2,31
¿ CONCLUSIONES
Muchos pacientes con cáncer pueden alcanzar una disminución satisfactoria del dolor a través de manejo integral, que incluya tratamiento primario anti-tumoral, terapia analgésica sistémica y otras técnicas no invasivas, como tratamiento psicológico o de rehabilitación.
Las situaciones complejas, deberán ser evaluadas por especialistas en algología en clínicas estructuradas para el diagnóstico y tratamiento del dolor, para recibir un manejo altamente especializado y multidisciplinario que incluya no sólo al grupo oncológico.
Correspondencia: Dr. Efraín A. Medina Villaseñor.
Hospital Ángeles Metropolitano. Tlacotalpan No. 59 Torre Diamante, Consultorio 735. Col. Roma Sur, 06760 México, D.F. Teléfonos: 5265 1800. Extensión: 4735. Directo: 5858 4039.
Correo electrónico:efra73@hotmail.com. www.oncologiabetania.com