Acute-on-Chronic Liver Failure (ACLF) es una entidad de reciente introducción que se define como un deterioro agudo y grave de una hepatopatía crónica conocida. Suele aparecer tras un acontecimiento precipitante agudo. Sus principales manifestaciones clínicas son el síndrome hepatorrenal, la encefalopatía hepática y el fracaso orgánico, y comporta un elevado riesgo de muerte a corto plazo.
La incidencia de ACLF, aunque es difícil dar cifras por su confusa definición, parece ser del 40% a los 5 años en pacientes con cirrosis avanzada, lo que implica más de 4.000 casos en Europa durante este período.
El trasplante hepático se plantea como la terapéutica de elección en estos casos; no obstante, la falta de suficientes órganos adecuados para trasplante y la morbimortalidad del trasplante en pacientes en esta situación hacen que nos veamos obligados a tratar a estos pacientes con opciones distintas al trasplante.
Acute-on-Chronic Liver Failure (ACLF) is a recently introduced term defined as severe acute deterioration of an established liver disease. This entity usually develops after an acute insult. The main clinical manifestations are hepatorenal syndrome, hepatic encephalopathy and organ failure, with a high risk of death in the short term.
The true incidence of ACLF remains difficult to determine due to confusions surrounding the definition of this entity, but seems to be 40% at 5 years in patients with advanced cirrhosis, which translates into 4,000 cases in Europe within this time span.
The treatment of choice is liver transplantation. However, due to the shortage of suitable organs and morbidity and mortality in these patients, other options must be used.
Acute-on-Chronic Liver Failure (ACLF), o simplemente Acute-on-Chronic, es un término de reciente introducción y sobre el que existen múltiples referencias sin que hasta la fecha se haya dado una definición clara y consensuada. De hecho, las definiciones propuestas y utilizadas en los distintos estudios publicados no coinciden. Esto también dificulta un cálculo exacto de su incidencia y prevalencia, aunque se estima que un 40% de los pacientes con cirrosis avanzada va a desarrollar ACLF en un período de 5 años, lo que implica más de 4.000 casos en Europa durante este período.
A pesar de esta indefinición, existen numerosos ensayos terapéuticos sobre esta enfermedad, que incluyen poblaciones muy heterogéneas1–3.
Para nosotros, ACLF significa un deterioro agudo y grave de una hepatopatía crónica. Sobre esta amplia definición, vamos a hacer las siguientes consideraciones:
- 1.
Todos los autores coinciden en que debe presentarse en un paciente con una cirrosis hepática conocida (por criterios clínicos, analíticos y de imagen o histológicos). A pesar de esto, diversos estudios publicados incluyen pacientes con hepatitis alcohólica aguda grave sin demostración histológica de cirrosis subyacente.
- 2.
Debe desarrollarse tras un acontecimiento precipitante agudo. En este sentido se descarta la evolución natural de la cirrosis hacia etapas terminales de la enfermedad. El episodio precipitante debe haber acontecido en las 2–4 semanas previas al inicio del cuadro, si bien esta consideración es arbitraria y no existe consenso al respecto. La naturaleza del episodio precipitante puede estar relacionada o no con la enfermedad de base. Así, se incluyen desde hepatitis sobreañadidas (víricas, toxicomedicamentosas) hasta hemorragias digestivas, sepsis, traumatismos o intervenciones quirúrgicas de cualquier índole.
- 3.
Se trata de un cuadro de extrema gravedad y que comporta un riesgo elevado de muerte en los siguientes ¿3 meses?, ¿6 meses?, otra vez queda por definir. Los parámetros que nos permiten definir la situación del paciente como de extrema gravedad pueden ser criterios clínicos o puntuaciones/clasificaciones pronósticas.
En este último punto es en el que parece existir un mayor consenso basado en las múltiples referencias y conocimientos existentes sobre factores de mal pronóstico en la cirrosis hepática. Así, dentro de los criterios clínicos que se conoce que traducen un mal pronóstico a corto plazo, cabe destacar:
- –
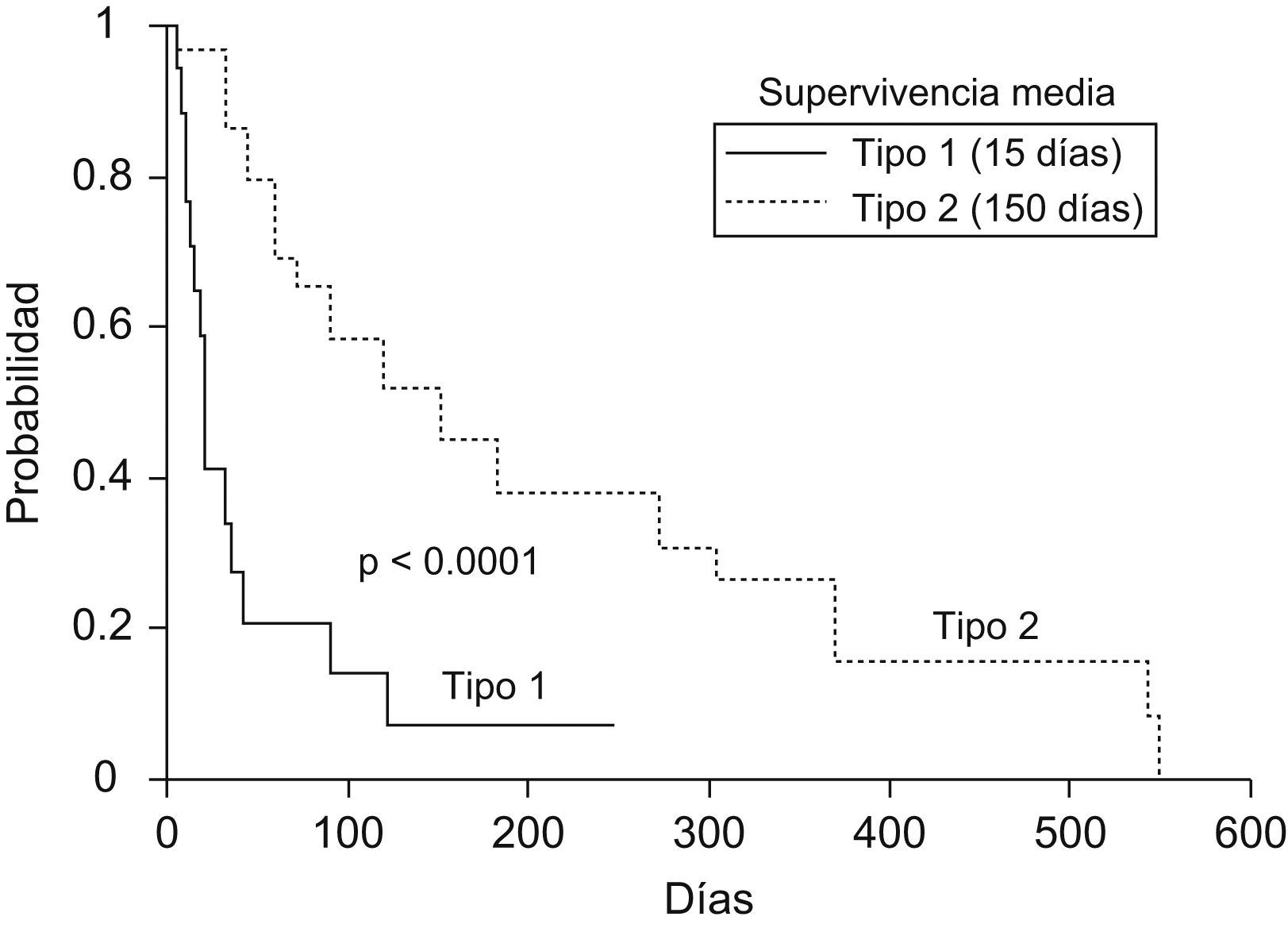
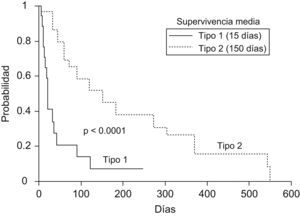
Síndrome hepatorrenal. Como puede observarse en la figura 1, la aparición de síndrome hepatorrenal de tipo 1 (en especial) y de tipo 2 comporta un riesgo de muerte muy notable en pacientes con cirrosis4. En el apartado correspondiente se comenta la fisiopatología, el diagnóstico y el tratamiento del síndrome hepatorrenal.
Figura 1.Probabilidad de supervivencia en pacientes con cirrosis que desarrollan síndrome hepatorrenal de tipo 1 y de tipo 2 (Ginès P, Guevara M, Arroyo V, Rodés J. Hepatorrenal syndrome. Lancet. 2003;362:1819–27). Leyenda figura castellano: probabilidad de supervivencia. Supervivencia media. Tipo 1. Tipo 2.
(0.1MB). - –
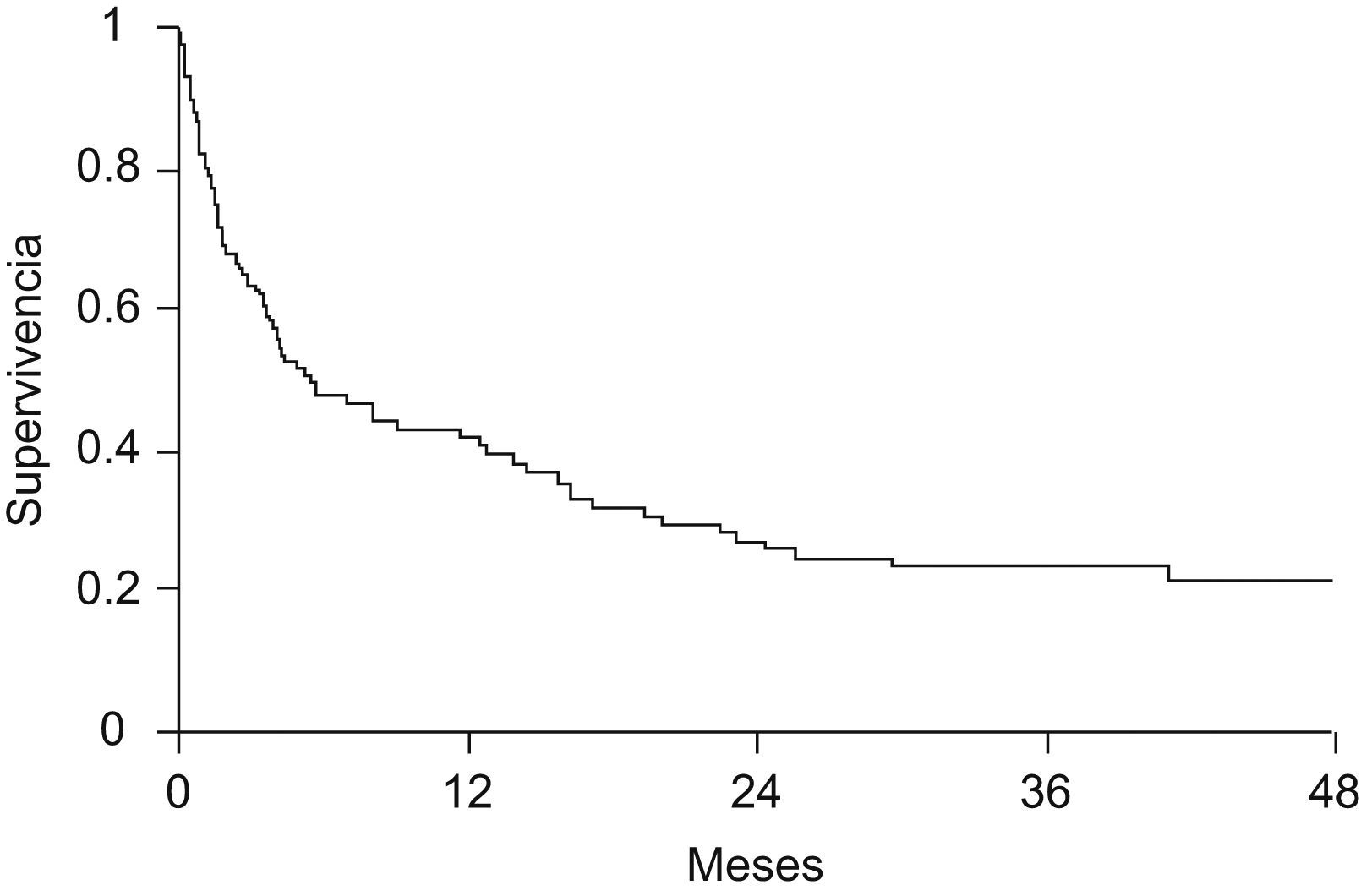
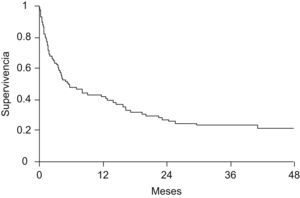
Encefalopatía hepática (EH). Se considera criterio de valoración para trasplante hepático la aparición de encefalopatía en un paciente con cirrosis, pues comporta un mal pronóstico (fig. 2)5. De manera arbitraria, la mayoría de los estudios terapéuticos sobre ACLF consideran EH “clínicamente relevante” aquélla de grado ii o superior.
Figura 2.Probabilidad de supervivencia en pacientes con cirrosis que desarrollan un primer episodio de encefalopatía hepática. Cabe destacar que la mortalidad a los 3 meses de este episodio se acerca al 30%5. Leyenda figura castellano: supervivencia. Meses.
(0.06MB). - –
Fracaso orgánico. Como en cualquier enfermedad, la presencia de fracaso orgánico se relaciona con un peor pronóstico. Los datos en la cirrosis hepática se basan en un estudio presentado como comunicación a un congreso6 en el que se estudiaron de manera retrospectiva 497 pacientes con cirrosis admitidos en el hospital por un deterioro rápido de su hepatopatía. De éstos, 317 no presentaron fracaso orgánico (distinto del hepático) asociado, y entre ellos la mortalidad durante el ingreso hospitalario fue del 8%. En los 180 pacientes restantes en los que se apreció el desarrollo de fracaso de algún órgano, la mortalidad fue del 53%. Dentro de este último grupo se observó que la mortalidad era especialmente elevada (78%) en pacientes que habían requerido ingreso hospitalario durante los últimos 6 meses, frente al 34% en aquellos que no lo habían requerido.
- –
En lo que hace referencia a clasificaciones pronósticas en la cirrosis, las más ampliamente utilizadas son el Sepsis-related Organ Failure Assessment (SOFA) y el Model for End-stage Liver Disease (MELD).
El SOFA es una puntuación diseñada para valorar el pronóstico de los pacientes ingresados en unidades de críticos. Sin embargo, dada su amplia utilización, se ha intentado validar para otros grupos de pacientes como los que nos ocupan. En este sentido, Wehler et al7 compararon el valor pronóstico de la puntuación SOFA con la puntuación Acute Physiology and Chronic Health Evaluation (APACHE II) y el baremo de Child-Pugh (obtenidos en las primeras 24h de ingreso) en 143 pacientes con cirrosis hepática admitidos en una unidad de cuidados intensivos por razones médicas. El estudio demostró que la puntuación SOFA era la que presentaba un mejor perfil predictivo de muerte en esta población. En concreto, se tomaron 8 puntos de SOFA como valor de corte y se observó una mortalidad hospitalaria del 4% en pacientes con puntuación inferior o igual a 8, frente al 88% en el resto de los pacientes. A pesar de estos excelentes resultados, no existe un estudio posterior que refrende estos datos, quizás por la falta de familiaridad de los hepatólogos con baremos específicos de cuidados intensivos como el SOFA.
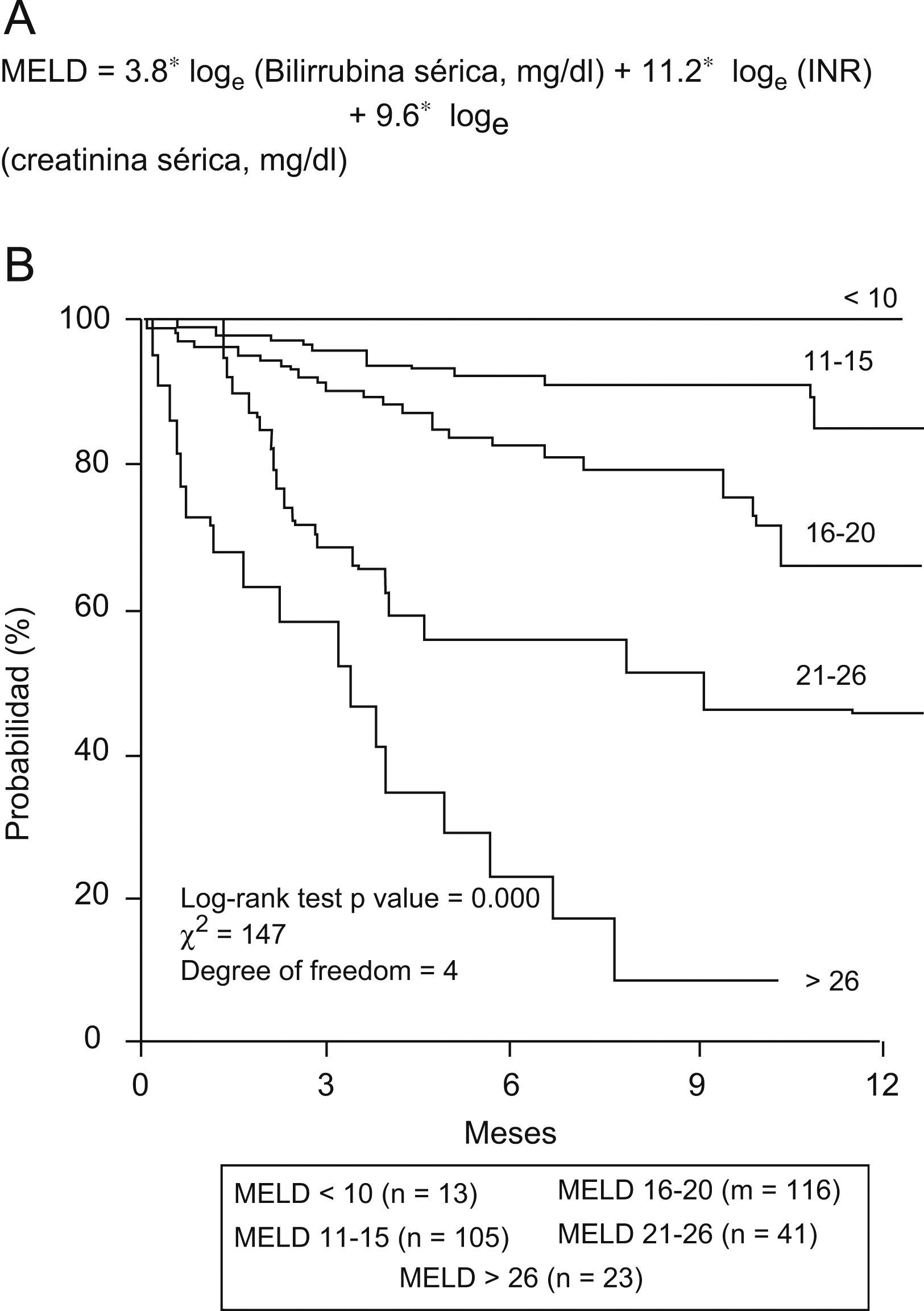
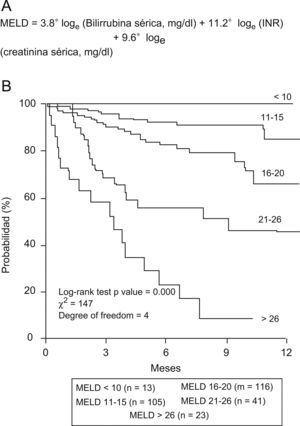
Este último punto supone una clara ventaja para la puntuación MELD: se trata de un baremo diseñado específicamente para pacientes hepatópatas en fases avanzadas de la enfermedad; en todo el mundo se utiliza para establecer prioridades según gravedad en las listas de trasplante hepático8. En la figura 3 se especifica el cálculo del baremo MELD y se muestra un gráfico de supervivencia derivado de un estudio en pacientes con cirrosis en lista de espera de trasplante9.
Variables incluidas en el cálculo de la puntuación Model for End-stage Liver Disease (MELD) (panel A) y supervivencia actuarial según valor del baremo MELD al ingreso en 308 pacientes con cirrosis hepática incluidos en lista de trasplante (panel B)9. Leyenda figura en castellano. Probabilidad de supervivencia. Valores de la p en el log-rank test. Grados de libertad=4.
En el presente artículo, además de revisar las principales manifestaciones clínicas de ACLF y su tratamiento, haremos un breve repaso de los sistemas de soporte hepático artificial y su potencial utilidad en esta entidad.
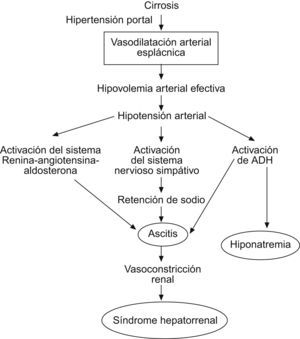
Síndrome hepatorrenalLa insuficiencia renal es una complicación frecuente en los pacientes con cirrosis evolucionada. Se define insuficiencia renal en la cirrosis hepática como aquella que se acompaña de cifras de creatinina sérica superiores a 1,5mg/dl, aunque cifras entre 1 y 1,5mg/dl ya pueden traducir cierta afectación renal en pacientes con hepatopatía crónica y, a menudo, pérdida de masa muscular10.
El síndrome hepatorrenal es sólo una de las causas de insuficiencia renal en la cirrosis. Su diagnóstico se basa en los criterios publicados por el International Ascites Club y que, en definitiva, van a establecer el diagnóstico diferencial respecto a otras entidades causantes de fallo renal: nefrotoxicidad (por fármacos principalmente), hipovolemia, infecciones bacterianas (que se acompañan de insuficiencia renal en el 30% de los casos), enfermedades renales intrínsecas, etc10.
El síndrome hepatorrenal de tipo 1 y de tipo 2 tienen los mismos criterios diagnósticos pero la evolución es menos progresiva en el tipo 2. Para diagnosticar un tipo 1, la creatinina debe aumentar más de un 100% respecto al valor basal hasta alcanzar un valor superior a 2,5mg/dl en menos de 2 semanas10,11.
TratamientoMedidas generalesEn primer lugar, cabe destacar que un diagnóstico precoz es fundamental en la evolución del cuadro. Es más, en pacientes con cirrosis avanzada que ingresen en el hospital por cualquier motivo, deben monitorizarse de manera estrecha las constantes vitales, en especial la presión arterial y la diuresis, la clínica y la exploración física (en busca de signos de infección, encefalopatía, etc.) y la analítica (creatinina sérica, sodio y potasio plasmáticos y equilibrio acidobásico).
La presencia de inestabilidad hemodinámica o insuficiencia renal implica la colocación de una sonda urinaria para controlar la diuresis y un catéter para medida de la presión venosa central. Las determinaciones analíticas deben ser, en principio, horarias, y espaciarse o incrementarse en caso necesario.
En la mayoría de los pacientes con cirrosis, el aporte de sodio y líquidos debe reducirse por la expansión del volumen extracelular que comporta la enfermedad hepática y que se traduce en la presencia de ascitis, edemas e hiponatremia (sodio plasmático inferior a 130mEq/l) dilucional. Esta última obedece a la marcada incapacidad de eliminar agua libre que presenta el paciente hepatópata y que supera su incapacidad, también importante, de eliminar sodio12. No obstante, en el menos cuantioso grupo de pacientes que presentan insuficiencia renal relacionada con una diuresis excesiva en el contexto de toma de diuréticos, debe considerarse el diagnóstico diferencial con la hiponatremia vera, cuyo tratamiento exigiría la administración de suero fisiológico. Los principales rasgos diferenciales corresponden a los signos de hipovolemia y deshidratación presentes en la hiponatremia vera.
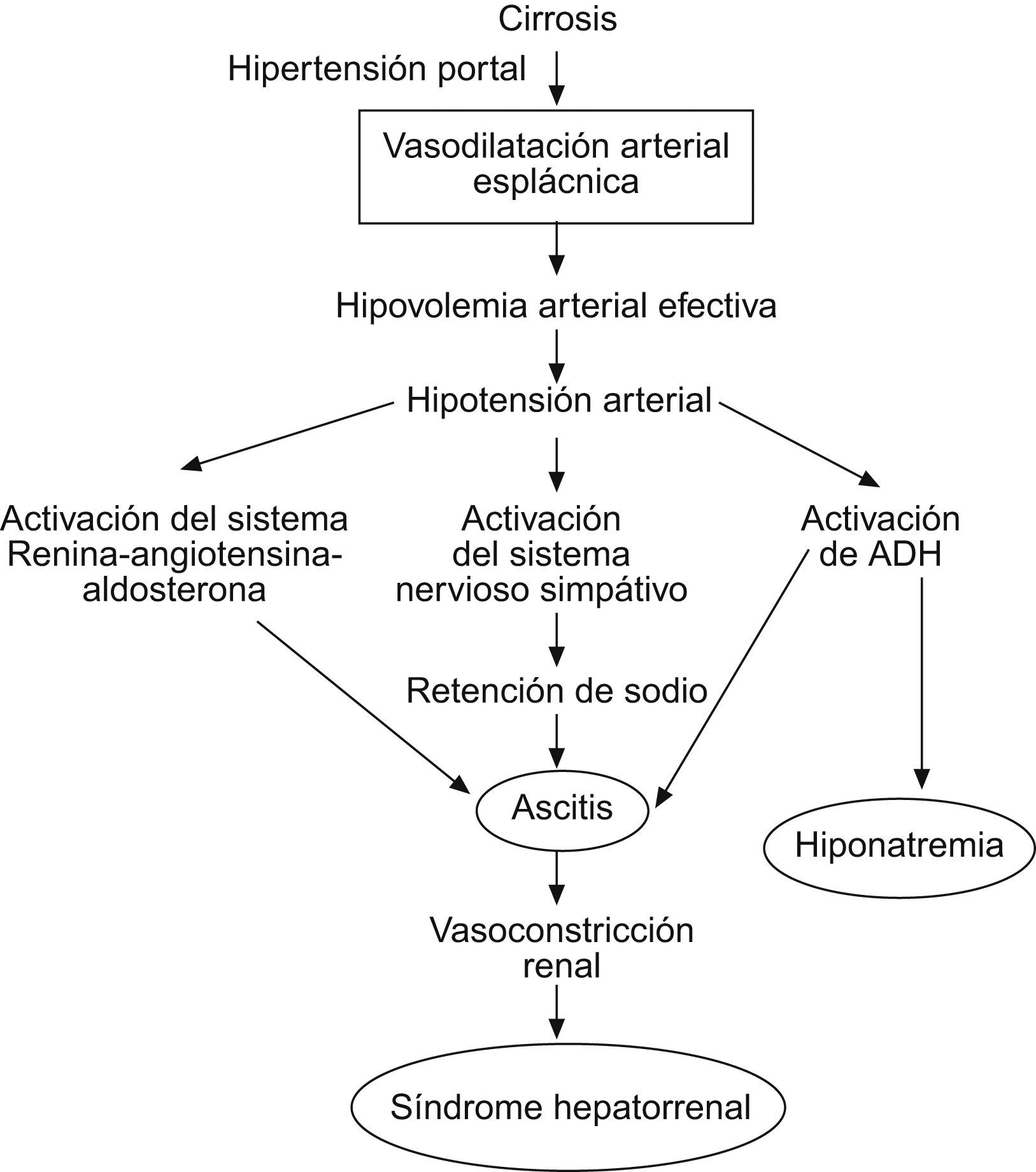
Tratamiento específicoEste tratamiento es de reciente introducción y obedece a la fisiopatología del síndrome hepatorrenal que se muestra en la figura 4.
La primera opción terapéutica en el síndrome hepatorrenal es la combinación de vasoconstrictores, en especial terlipresina, y albúmina. Este tratamiento consigue revertir el síndrome hepatorrenal en el 40–70% de los casos, lo que conlleva un aumento de la supervivencia de estos pacientes13. El tratamiento debe indicarse sólo en pacientes que cumplan los criterios diagnósticos de síndrome hepatorrenal según el International Ascites Club10,11. El tratamiento se inicia con dosis bajas de terlipresina (0,5–1mg/4h) i.v. junto con albúmina (1g/kg de peso por vía i.v. lenta durante 24h). La dosis de albúmina posterior es de 20–40g/día, se ajusta a la volemia del paciente y se suspende en caso de hipervolemia (presión venosa central >15cm H2O). La dosis de terlipresina se mantiene inalterada durante 48h. En ese momento, si no se observa respuesta positiva (descenso de la cifra de creatinina superior o igual al 25% respecto al valor basal), se incrementa la dosis hasta el máximo permitido (2mg/4h). El tratamiento se mantiene hasta obtener creatininas inferiores a 1,5mg/dl o hasta un máximo de 7 días13. Cabe recordar que terlipresina está contraindicada en pacientes con enfermedad coronaria y que, durante su administración, deben monitorizarse constantes vitales con frecuencia así como realizar un estudio clínico exhaustivo buscando signos de isquemia periférica. En el 10–20% de los casos en que aparecen estas complicaciones, el tratamiento con terlipresina debe suspenderse10,11.
Otros agentes vasoconstrictores también utilizados en el tratamiento del síndrome hepatorrenal han sido midodrina y noradrenalina. Si bien los estudios realizados muestran su eficacia para revertir esta entidad, el número de pacientes limitado y las pocas publicaciones existentes no permiten extraer conclusiones fehacientes11.
Como tratamientos alternativos al uso combinado de vasoconstrictores y albúmina existe la derivación percutánea portosistémica intrahepática y la diálisis con albúmina (en concreto, los estudios existentes se han realizado con molecular adsorbent recirculating system [MARS]). Ambos métodos han presentado buenos resultados en series aisladas, si bien la experiencia es aún limitada11.
El tratamiento definitivo del síndrome hepatorrenal es el trasplante hepático, aunque es sabido que el trasplante en pacientes con fallo renal presenta peores resultados que en pacientes con función renal normal. Es por esto que en pacientes con síndrome hepatorrenal, el objetivo debería ser revertir el síndrome con un tratamiento que sirviera de puente hacia el trasplante13.
Encefalopatía hepáticaLa EH comprende una serie de manifestaciones neurológicas de diferentes tipos, habitualmente reversibles, que aparecen o pueden aparecer en hepatopatías agudas o crónicas. Obedecen a 2 factores fisiopatológicos: la insuficiencia hepatocelular y el shunting portosistémico. La importancia relativa de cada una de ellas es variable según el paciente. En definitiva, lo que sucede es que sustancias nitrogenadas de origen intestinal, no depuradas a nivel hepático, pasan a circulación sistémica y alteran la función del sistema nervioso. De estas sustancias destacaría el amonio. Otras posibles alteraciones incluyen aumento de los sistemas inhibidores de la neurotransmisión (glutamatérgico, serotoninérgico, GABA-érgico), cambios en el flujo sanguíneo y en la permeabilidad cerebral a ciertos productos, aumento de manganeso en los ganglios de la base, etc. Muchas de estas alteraciones van a incidir en la morfología y función de los astrocitos, fundamentales en el metabolismo del amonio intracerebral.
Clasificación y manifestaciones clínicasLa EH que acompaña a la cirrosis puede presentarse en 3 formas clínicas14: la EH aguda, desencadenada por un factor precipitante y cuyos síntomas suelen retrogradar con rapidez; la EH recurrente o permanente, en la que no es posible identificar ninguno de estos factores (los pacientes presentan episodios repetidos de EH separados por períodos de normalidad neurológica, o mantienen algún tipo de alteración, respectivamente) y podrían considerarse casos de EH crónica, y, finalmente, la EH mínima o subclínica, relevante desde el punto de vista científico pero no clínico.
La EH se clasifica según las manifestaciones neurológicas presentes según la clasificación de West Haven14. No obstante, en pacientes en grado iv, es decir, en coma, se considera más adecuado utilizar la escala de Glasgow.
DiagnósticoEl diagnóstico es básicamente clínico. Las exploraciones complementarias van dirigidas a establecer el diagnóstico diferencial respecto a otras enfermedades potencialmente causantes de alteraciones neurológicas en el paciente cirrótico (lesiones estructurales del sistema nervioso, meningitis o meningoencefalitis, epilepsia, intoxicaciones exógenas, etc.). Así, el diagnóstico de EH se realiza por exclusión de otras enfermedades en un paciente cirrótico conocido que presenta alteraciones neurológicas compatibles. La actitud tras el diagnóstico de EH implica evaluar la insuficiencia hepatocelular del paciente mediante analítica y realizar una búsqueda exhaustiva de posibles factores precipitantes (presentes en más del 70–80% de los episodios de EH aguda)14. Dentro de estos factores precipitantes destacaríamos los siguientes:
- •
trastornos de la función renal y el equilibrio hidroelectrolítico (a menudo secundarios al tratamiento diurético);
- •
hemorragia digestiva;
- •
infecciones bacterianas (es obligada la paracentesis para descartar una peritonitis bacteriana espontánea ante cualquier paciente cirrótico con EH y ascitis);
- •
ingesta de fármacos depresores del sistema nervioso central,
- •
y estreñimiento.
En gran parte van a depender de la situación neurológica del paciente, es decir, del grado de EH. En este sentido, cabe remarcar que al paciente en coma (grado iv) se lo deberá intubar para evitar la broncoaspiración.
En la EH avanzada (grado ii a iv) es necesaria la colocación de una sonda nasogástrica para la administración de medicación o alimentación.
Dentro de las medidas generales deberíamos considerar una nutrición adecuada, más aun si se considera que tratamos con pacientes cirróticos, con una elevada incidencia de malnutrición, y que van a tener la ingesta limitada durante un período de tiempo por la alteración del nivel de consciencia. De manera contraria a lo que se creía previamente, la reducción de la ingesta proteica (inferior a 1–1,2gproteína/kg/día) está contraindicada en este grupo de pacientes, pues, por un lado, puede contribuir a aumentar la malnutrición y, por otro lado, se conoce que el amonio puede eliminarse a nivel muscular y una malnutrición puede empeorar la capacidad muscular de metabolizar amonio15.
Tratamiento del factor precipitanteEs un aspecto fundamental del tratamiento de la EH e incluso más eficaz que el tratamiento farmacológico “específico”16. Este tratamiento depende, claro está, de cuál es el factor precipitante en el caso que nos ocupa. Así, debemos suspender el tratamiento diurético para tratar o evitar trastornos de la función renal e ionograma, debemos iniciar antibióticos de manera empírica ante la mínima sospecha de infección (febrícula, leucocitosis, síndrome de respuesta inflamatoria sistémica [SIRS], etc.). No obstante, debemos considerar que en un 20–30% de los casos no podremos identificar un factor precipitante claro.
Tratamiento específicoDisacáridos no absorbibles. La lactulosa y el lactitol por vía oral o en forma de enemas, son el tratamiento más utilizado en la EH, a pesar de la falta de evidencias científicas respecto a su eficacia, que asistencialmente se cifra en un 70%. Su potencial eficacia obedece tanto al efecto catártico como a la acidificación del colon, lo que conlleva un paso neto de amonio a la luz intestinal y su incorporación a determinadas cepas bacterianas. Todo esto acarrea un descenso de las cifras de amonio circulante.
La dosis oral (o por sonda nasogástrica) debe ser la suficiente para conseguir 2-3 deposiciones blandas diarias. Se suele iniciar el tratamiento con 20ml de lactitol cada 8h. En caso de aparecer diarrea intensa, debe reducirse o suspenderse la administración de lactulosa/lactitol. Los enemas deben contener 300ml de lactulosa en 700ml de agua (o 200g de lactitol en 1l de agua), y deben administrarse mediante algún mecanismo de retención (sonda rectal con globo)16.
Antibiótico poco o no absorbible. Su eficacia se basa en la inhibición de la flora proteolítica del colon, causante de la producción de amonio. Se han utilizado, entre otros, neomicina, paromomicina, metronidazol y amoxicilina-clavulánico. No existen evidencias de que Helicobacter pilorii, productor de amonio a nivel gástrico, desempeñe ningún papel en la patogenia de la EH, por lo que no es necesario erradicarlo en este contexto.
Debemos considerar los efectos adversos de estos fármacos, entre los que destaca la posible aparición de resistencias, en especial en casos de tratamiento prolongado16.
Recientemente se han publicado diversos estudios con rifaximina, un antibiótico no absorbible que se ha mostrado más eficaz que el lactitol en el tratamiento de la EH aguda, en especial en la reducción de los niveles de amonio en sangre. Un metaanálisis reciente ha detectado una eficacia superior de los antibióticos no absorbibles respecto a los disacáridos en esta situación17.
Las dosis de neomicina son de 1g/6h, y las de rifaximina son de 400mg/8h, por vía oral o por sonda nasogástrica.
Fármacos que modifican el ciclo de la urea. Son la L-ornitina L-aspartato, el benzoato sódico y el cinc (cofactor de diversas enzimas que intervienen en el metabolismo de la urea). Existen escasos estudios clínicos sobre la eficacia de estos tratamientos16.
Antagonistas de las benzodiacepinas. La hipótesis de un aumento del tono GABA-érgico, y la presencia de sustancias inhibidoras de la neurotransmisión de origen endógeno similares a las benzodiacepinas motivaron el estudio de la posible eficacia de antagonistas como el flumazenil, que consigue una mejoría transitoria del grado de EH en una proporción escasa de pacientes (el 15%, aproximadamente). La utilidad clínica del flumazenil (en dosis de 1mg por vía i.v.) es clara, en cambio, en casos de EH desencadenada por la administración de benzodiacepinas exógenas, en especial si tenemos en cuenta que su vida media puede estar muy incrementada en la insuficiencia hepatocelular avanzada16.
Diálisis con albúmina (MARS). Un estudio aleatorizado y controlado publicado de manera reciente demuestra una mayor eficacia del MARS, un sistema de depuración extrarrenal que utiliza albúmina, en comparación con el tratamiento convencional en la EH aguda (véase más adelante)18.
Consideraciones tras la resolución de un episodio de encefalopatía hepática agudaIncluyen el control y prevención de factores precipitantes (hemorragia digestiva, peritonitis bacteriana espontánea, uso de diuréticos, evitar medicación depresora del sistema nervioso, etc.), la administración continuada de disacáridos no absorbibles (aun a pesar de la falta de evidencia de su eficacia) y la valoración de la necesidad de trasplante hepático, dado que la presencia de un episodio de EH comporta un mal pronóstico en la cirrosis, tal como se muestra en la figura 25.
Sistemas de soporte hepático artificialDada la trascendencia que están adquiriendo estos métodos, creemos indicado dedicarles un apartado específico en la terapéutica del ACLF. Los sistemas de soporte hepático se dividen en soporte artificial (fundamentalmente diálisis con albúmina) y bioartificial. Este último se caracteriza por incorporar al sistema células hepáticas de distinto origen y se reservan para casos con insuficiencia hepática aguda grave o hepatitis fulminante, es decir, sin hepatopatía previa.
Base racional para el uso de los sistemas de soporte hepático artificialLos sistemas de soporte artificial, sin presencia de material celular, persiguen desintoxicar el organismo de componentes tóxicos de metabolismo hepático y, como veremos, también renal. Su uso se justifica en la llamada “teoría tóxica”, por la que estos componentes tóxicos no eliminados desencadenarían daño celular con necrosis y apoptosis de células hepáticas, liberación de más componentes tóxicos y, finalmente, disfunción cerebral, renal, circulatoria y fracaso multiorgánico.
Entre los componentes tóxicos que se acumulan en la insuficiencia hepatocelular destacaríamos ácidos biliares, bilirrubina, prostaciclina, óxido nítrico, ácidos grasos, triptófano, amonio, lactato, citoquinas proinflamatorias, etc. Como puede observarse, la mayor parte de estos componentes circulan unidos a albúmina. Esto justificaría la baja eficacia de los sistemas basados exclusivamente en la eliminación de sustancias hidrosolubles, entre los que se incluyen el recambio sanguíneo y plasmático, la hemofiltración venovenosa continua, la hemoperfusión a través de carbón activado o macrorresinas, la hemodiálisis de alto flujo, la plasmaféresis e incluso el sofisticado sistema BioLogic DT, que no ha demostrado ninguna eficacia en cuanto a supervivencia en pacientes con fallo hepático19,20.
En la actualidad, pues, los sistemas de soporte hepático artificial utilizados son aquéllos capaces de eliminar sustancias tanto hidrosolubles como unidas a proteínas, y esto se consigue mediante la diálisis con albúmina o el fraccionamiento del plasma y posterior filtración. A estos sistemas nos referiremos a continuación.
Tipos de sistemas de soporte artificialEn la actualidad, los sistemas de soporte hepático artificial utilizados en clínica son MARS (Gambro, Suecia) y Fractionated Plasma Separation, Adsorption, and Dialysis System (FPAD, Prometheus®, Fresenius Medical Care, Germany). El método Single Pass Albumin Dialysis (SPAD) está en desuso respecto a los 2 anteriores.
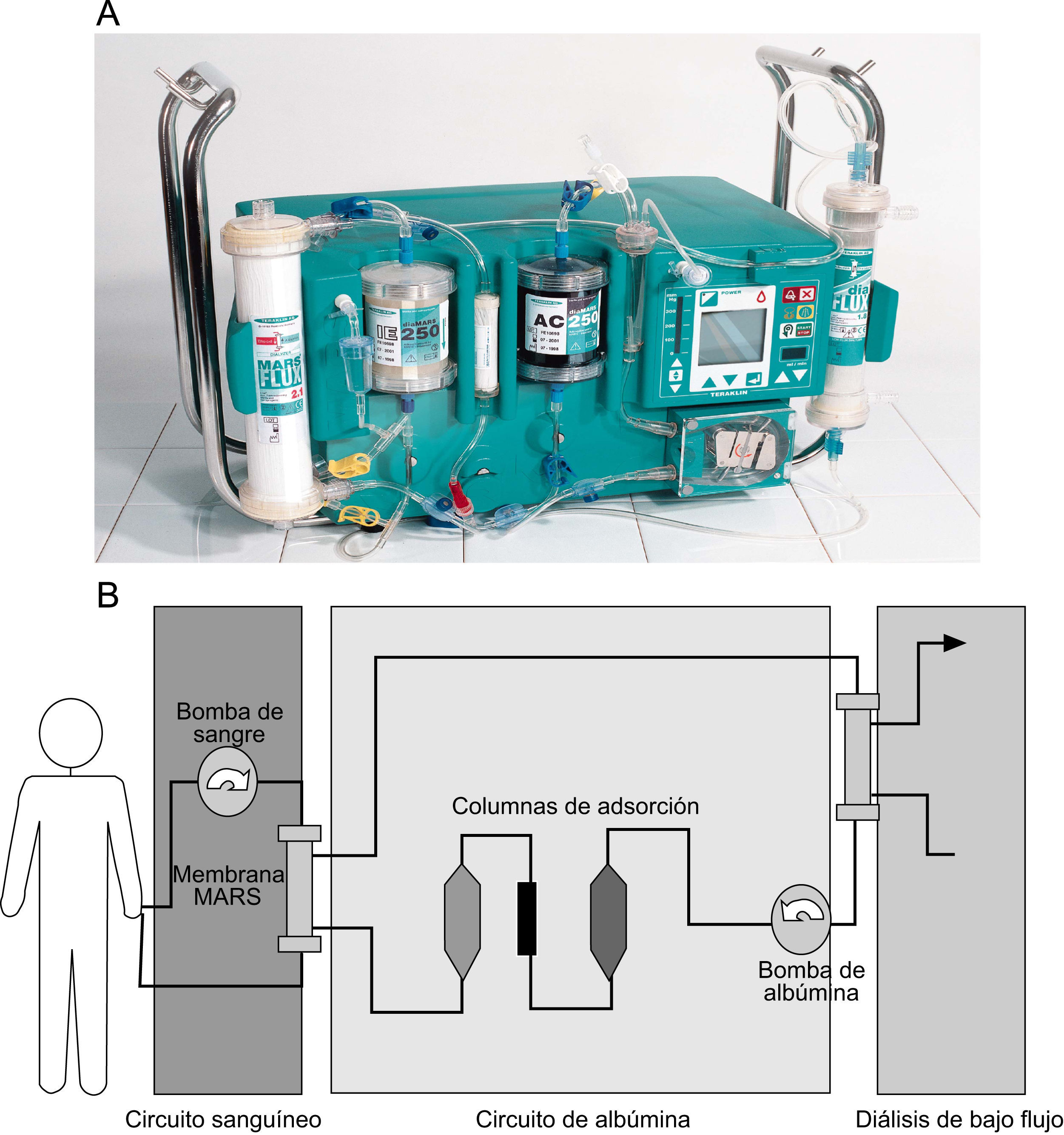
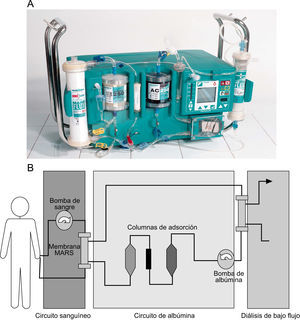
El sistema MARS es el más ampliamente estudiado y utilizado (fig. 5). Se desarrolló inicialmente en Rostock (Alemania) y utiliza albúmina exógena al 10–20% y una membrana de polisulfona perforada con una superfície de adsorción de 2,2m2 y poros que no permiten el paso de sustancias con un peso molecular mayor de 50kD21. El sistema Prometheus presenta como diferencia esencial respecto al anterior, el uso de la albúmina propia del paciente. Esta albúmina es separada del plasma mediante una membrana que permite el paso de sustancias de ∼300kD y que posteriormente se recircula a través de 2 columnas con diferentes adsorbentes22. Al igual que MARS, se añade también una diálisis convencional, en este caso de alto flujo, a fin de separar las sustancias hidrosolubles.
Sistema Molecular Adsorbent Recirculating System (MARS). A) Apariencia real del sistema, que debe conectarse a un equipo de diálisis convencional. B) Esquema de funcionamiento del sistema MARS. El paciente se conecta a un circuito sanguíneo que contiene el módulo con la membrana MARS. La solución de albúmina con toxinas ligadas a sus receptores es regenerada en el circuito de albúmina, que contiene 600ml al 20%, mediante columnas de adsorción (carbón activado y resinas de intercambio aniónico). A este segundo circuito se añade un módulo de diálisis convencional de bajo flujo con bicarbonato para controlar el balance hidroelectrolítico.
En este apartado vamos a diferenciar 2 tipos de estudios. Los primeros son estudios para consolidar la base racional para el uso de estos sistemas, es decir, analizan su eficacia en la depuración de sustancias tóxicas y sus consecuencias (efectos clínicos). Los últimos son estudios sobre la eficacia clínica de estos sistemas (resultados clínicos).
Efectos clínicosEstudios iniciales muestran que el sistema MARS es capaz de depurar las sustancias que se detallan a continuación21:
- •
Ligadas a albúmina: ácidos biliares, bilirrubina, aminoácidos aromáticos, ácidos grasos de cadena corta y media, sustancias similares a benzodiacepinas, indoles, fenoles, triptófano, mercaptanos, cobre, interleucinas 6 y 10, TNF-α.
- •
Hidrosolubles: amonio, creatinina, urea.
También se ha mostrado capaz de reducir los niveles de sustancias vasoactivas como los metabolitos del óxido nítrico. En consecuencia, se produce una desactivación de los sistemas vasoactivos endógenos con descenso de los niveles de angiotensina, actividad renina plasmática, aldosterona, norepinefrina y vasopresina. Esto se traduce en un mejoría hemodinámica sistémica tras la instauración de tratamientos con MARS en pacientes con ACLF (aumento de la presión arterial media)23. En cuanto a la hemodinámica hepática, MARS reduce la presión portal24 y aumenta el flujo sanguíneo hepático25. A nivel renal existe un aumento del flujo sanguíneo renal independiente de la presión arterial media25. Una única sesión de MARS también es capaz de aumentar la velocidad del flujo sanguíneo cerebral en pacientes con ACLF26.
El sistema Prometheus se ha mostrado capaz de arrastrar o depurar tanto sustancias ligadas a proteínas (bilirrubina, ácidos biliares) como hidrosolubles (amonio, colinesterasa, creatinina y urea)27. También, al igual que MARS, elimina citoquinas aunque sin traducción en el nivel de citoquinas circulantes23.
Se han comparado ambos sistemas en estudios de corta duración. Así, un análisis retrospectivo mostró un mayor aclaramiento de ciertas toxinas (bilirrubina, ácidos biliares, urea) con Prometheus, mientras que la eliminación de metabolitos del óxido nítrico era superior con MARS23,28. El uso de Prometheus, pues, no se acompaña de desactivación de los sistemas vasoactivos endógenos y no mejora la hemodinámica sistémica23,29. Queda por ver si esto puede ser secundario al efecto de la albúmina sobre la estabilización de las membranas. No obstante, no existen datos clínicos de relevancia que apoyen la superioridad clínica de un sistema respecto al otro.
Resultados clínicosLas primeras series de tratamiento con MARS, publicadas en el año 2000, mostraron una reducción significativa de la bilirrubina, el grado de EH y la puntuación de Child-Pugh30. El primer estudio prospectivo controlado en el que se utilizó MARS mostró una mejoría de la función renal, la EH y la presión arterial, así como un aumento de la supervivencia a los 30 días. Sin embargo, resulta difícil extraer conclusiones fehacientes de este estudio por su inclusión de pacientes muy heterogéneos y en escaso número31. Con posterioridad se realizó un metaanálisis incluyendo 4 estudios aleatorizados y 2 no aleatorizados que no mostró ningún beneficio en cuanto a supervivencia del uso de MARS frente a tratamiento convencional. No obstante, parece prematura la realización de metaanálisis cuando no existen suficientes estudios controlados de calidad al respecto25.
Hassanein et al18 publicaron en 2007 los resultados de un estudio multicéntrico, prospectivo, aleatorizado y controlado, que comparaba MARS (6h diarias durante 5 días) y tratamiento médico convencional en 70 pacientes con cirrosis hepática avanzada y encefalopatía grado iii–iv. Los pacientes tratados con MARS presentaron mayor porcentaje de éxito del tratamiento (definido como una mejoría ≥2grados en la encefalopatía) respecto al resto (el 34 versus el 19%; p=0,044). Además, esta mejoría se alcanzó de manera mucho más rápida. Dado su corto seguimiento, el estudio no ofrece datos respecto a supervivencia, aunque los mismos autores habían observado, en un estudio anterior, mejoría de la sobrevida en los pacientes que respondían al tratamiento32.
Por lo que respecta al síndrome hepatorrenal existe un único estudio aleatorizado y controlado, que incluye un número escaso de pacientes (8 en grupo MARS y 5 en grupo control) que mostró la eficacia de MARS en cuanto a descenso de creatinina y bilirrubina, aumento del sodio sérico, índice de protrombina, presión arterial y volumen urinario, así como de la supervivencia acumulada33. Nuevamente, la escasez de la muestra no permite obtener conclusiones irrevocables.
Un último estudio en esta población, que comparaba MARS y Prometheus, aunque no de manera aleatorizada, mostró una supervivencia sin trasplante, a los 3 meses de tratamiento por insuficiencia hepática grave, del 48% en los pacientes tratados con MARS y del 33% en el grupo Prometheus. No existe grupo control34.
Contraindicaciones y efectos adversosDe las observaciones y estudios publicados se deriva que los sistemas de soporte hepático artificial presentan escasos efectos adversos y estos acostumbran a ser bien tolerados21. Ahora bien, siempre deben respetarse unos criterios de exclusión que, si bien son relativos, aconsejan prudencia. Entre ellos destaca la coagulopatía grave, como sería en el caso de la coagulación intravascular diseminada y la hemorragia no controlada. Esto se debe tanto a un efecto intrínseco de estos sistemas que reduce la cifra de plaquetas (descenso leve pero significativo) como a la necesidad de utilizar heparina sódica, epoprostenol o citrato, a fin de evitar la coagulación del circuito de diálisis.
La otra contraindicación relativa es la presencia de sepsis activa. Se recomienda la utilización de profilaxis antibiótica en los pacientes que se someten al procedimiento y la resolución previa del cuadro infeccioso en los que están a la espera de iniciar éste. Esto se debe más a la futilidad del tratamiento en pacientes con ACLF y sepsis activa que a un aumento del riesgo de infección directamente relacionado con la diálisis con albúmina35.
A fin de minimizar el desarrollo de efectos adversos, se recomienda la monitorización hemodinámica del paciente durante el tratamiento así como determinaciones frecuentes de parámetros de coagulación, electrolitos, equilibrio acidobásico y fármacos de fijación proteica21.
Estudios en marchaEn la actualidad existen 2 estudios independientes en marcha sobre la eficacia y seguridad de MARS y Prometheus en pacientes con ACLF. Se encuentran en fase de análisis de datos. Ambos estudios son aleatorizados, controlados y multicéntricos, e incluyen pacientes de características similares: cirrosis hepática con una descompensación aguda y grave. Esta gravedad se define por la presencia de una bilirrubina sérica ≥5mg/dl junto con la presencia de EH > grado ii o síndrome hepatorrenal (estudio MARS) o Child-Pugh ≥10 puntos (estudio Prometheus). Aunque estén definidos de manera distinta, estos criterios de inclusión corresponden a pacientes comparables. También ambos estudios excluyen pacientes con mayor riesgo de presentar los efectos adversos descritos en los estudios previos, a saber, coagulopatía grave, hemorragia activa, cirugía mayor reciente, y necesidad de drogas vasoactivas por inestabilidad hemodinámica.
El cálculo de la muestra en ambos estudios es lo suficientemente amplio como para responder al objetivo primario de los 2 estudios: aumento de la supervivencia libre de trasplante a los 28 días. En el transcurso del próximo año creemos que podremos disponer de los resultados preliminares de ambos estudios.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.