La enfermedad celíaca (EC) es una enteropatía autoinmune desencadenada por la ingestión de gluten en individuos con susceptibilidad genética. Se ha observado la existencia de una hipertransaminasemia en aproximadamente el 40% de los pacientes celíacos no tratados, que suele resolverse al excluir el gluten de la dieta. La forma más frecuente de afectación hepática en estos pacientes es una hepatitis reactiva inespecífica, y es menos común su asociación con las hepatitis virales o las hepatopatías autoinmunes, como la hepatitis autoinmune, la cirrosis biliar primaria o la colangitis esclerosante primaria. Por tanto, sería recomendable la búsqueda de hepatopatía en enfermos celíacos y, de igual modo, la realización de pruebas diagnósticas de EC en pacientes con hipertransaminasemia o colestasis de causa no filiada.
Celiac disease (CD) is an autoimmune enteropathy triggered by gluten ingestion in genetically susceptible individuals. Hypertransaminasemia has been observed in up to 40% of untreated celiac patients and is usually resolved by a gluten-free diet. The most common type of liver disease associated with CD is non-specific reactive hepatitis, while association with viral hepatitis or autoimmune-mediated liver diseases such as autoimmune hepatitis, primary biliary cirrhosis or primary sclerosing cholangitis is less frequent. Therefore, a practical recommendation would be to look for liver disfunction in patients with CD as well as to perform diagnostic tests for CD in patients with hypertransaminasemia or cholestasis of unknown etiology.
La enfermedad celíaca (EC) es consecuencia de la intolerancia permanente a ciertas proteínas de los cereales, que produce una atrofia de la mucosa del intestino delgado. Estas proteínas constituyen el gluten, que se obtiene al extraer con agua el almidón de los cereales. Las proteínas del gluten implicadas en esta enfermedad son las fracciones obtenidas mediante su disolución en alcohol y se denominan de forma genérica prolaminas; cada una recibe un nombre específico en función del cereal del que proceden: gliadina en el trigo, secalina en el centeno, hordeína en la cebada y avenina en la avena1. Otros cereales no contienen gluten, como el arroz, el maíz o la soja.
La prevalencia de la enfermedad no está bien establecida, ya que varía según los distintos países, y se estima que en los casos de EC no diagnosticada se encuentra en torno al 1%2,3.
El mecanismo etiopatogénico es desconocido, aunque se han involucrado factores ambientales, genéticos e inmunológicos. En cuanto a los factores genéticos, parece tratarse de una herencia poligénica, con varios genes implicados, fundamentalmente del sistema HLA4,5. Así, se ha observado que ciertos antígenos de este sistema (B8, DR3, DR4, DQ2, DR5/DR7) son más frecuentes en los pacientes celíacos, en especial los alelos que codifican el heterodímero DQA1*0501/DQB1*02, que se halla presente en el 90% de estos pacientes.
Los factores ambientales a los que se ha asociado son, además del gluten, determinados virus, en especial el adenovirus serotipo 12, que posee una proteína que comparte cierta similitud con la secuencia de aminoácidos de la fracción tóxica de la alfagliadina.
La teoría etiopatogénica más aceptada en la actualidad se basa en las alteraciones inmunológicas que presentan los pacientes celíacos. Algunos datos a favor de esta hipótesis son la presencia de abundantes células inflamatorias en la mucosa intestinal, su asociación con otras enfermedades autoinmunes (dermatitis herpetiforme, cirrosis biliar primaria, diabetes mellitus tipo 1), y la presencia en sangre y heces de títulos elevados de algunos anticuerpos, tanto IgA como IgG (anticuerpos antigliadina, antiendomisio, antirreticulina y antitransglutaminasa), aunque no son específicos de esta enfermedad y no está clara su implicación patogénica. Sin embargo, parece que la alteración del sistema inmunitario celular es la causa primaria de la EC, ya que la mayoría de los linfocitos de la lámina propia presentan fenotipo TCD4+, la mayoría de los linfocitos intraepiteliales son TCD8+ y hay una elevada presencia de linfocitos CD45 RO+, tanto intraepiteliales como circulantes, con una producción aumentada de mediadores inflamatorios6,7.
En resumen, podemos decir que se trata de una enfermedad producida por una alteración en la inmunidad celular, y hay determinados factores predisponentes (genéticos) y desencadenantes (gluten)2,4–8.
El diagnóstico de la EC se basa en la combinación de síntomas clínicos (un síndrome de malabsorción real o potencial), hallazgos histológicos (a través de la endoscopia con toma de biopsias en el duodeno distal) y datos analíticos1–7,9–11. Las biopsias de intestino delgado ponen de manifiesto la lesión de la mucosa intestinal y también nos sirven para valorar la existencia de una buena respuesta terapéutica (mejoría clínica e histológica) con supresión completa del gluten en la dieta, así como su reaparición tras la reintroducción de éste1. Las pruebas serológicas disponibles, aunque tienen una alta sensibilidad y especificidad, sólo apoyan el diagnóstico9–11, por lo que su positividad no excluye la realización de una endoscopia con toma de biopsias.
PRESENTACIÓN Y FORMAS CLÍNICAS DE LA ENFERMEDAD CELÍACAEl espectro clínico de la celiaquía es muy variable, y se puede agrupar en las siguientes categorías12–14:
- 1.
Síntomas clásicos (que caracterizan la enfermedad): diarrea, flatulencia, distensión abdominal, vómitos y pérdida de peso.
- 2.
Síntomas generales (secundarios a la malabsorción de los diferentes nutrientes), como la anemia y la osteoporosis.
- 3.
Síntomas secundarios a las enfermedades asociadas (dermatitis herpetiforme, diabetes mellitus tipo 1, hepatitis autoinmune [HAI]).
- 4.
Síntomas digestivos extraintestinales (hepatitis, hipoesplenismo, enfermedad inflamatoria intestinal).
- 5.
Complicaciones evolutivas, como el linfoma intestinal. Aunque se trata de una enfermedad de naturaleza congénita, puede presentarse a cualquier edad de la vida y afecta más frecuentemente a las mujeres que a los varones (en una proporción aproximada de 2-3:1). En cuanto a la edad de aparición, la mayoría de los estudios muestran una mayor prevalencia en niños, situación que está cambiando en los últimos años debido a diversos factores, de modo que actualmente se diagnostica un mayor número de pacientes adultos1,2,15.
Por tanto, hay diferentes formas clínicas de la enfermedad, en función de los síntomas y la edad de su aparición16,17:
- 1.
Forma clásica (comienzo en la infancia, entre los 2 y los 5 años): enteropatía inducida por gluten, con síntomas de malabsorción y biopsia intestinal alterada en individuos genéticamente predispuestos.
- 2.
Forma de comienzo precoz: inicio a los 12-18 meses, en especial cuando se retiró precozmente la lactancia materna.
- 3.
Forma silente: pacientes con biopsia intestinal alterada que se encuentran asintomáticos, o bien con síntomas discretos o manifestaciones extraintestinales de la enfermedad. Suelen ser familiares de primer grado de pacientes celíacos.
- 4.
Forma latente: pacientes genéticamente predispuestos con una mucosa intestinal normal, que consumen gluten, y pueden desarrollar o han desarrollado previamente la enfermedad.
- 5.
Formas inespecíficas con síntomas generalmente extradigestivos.
- 6.
Crisis celíaca (en niños con una enfermedad extensa no tratada): puede cursar con hemorragias, tetania, acidosis metabólica, etc.
Dada la alta incidencia de la EC (media de 1/1.000 nacidos vivos), ésta se ha relacionado con muchas otras enfermedades, la mayoría de etiología inmune, pero la asociación más clara la presenta con la dermatitis herpetiforme. No obstante, el hígado es uno de los órganos que más frecuentemente presenta una enfermedad asociada en pacientes con EC. En los últimos años se han publicado varias series de pacientes con EC y alteraciones hepáticas, así como revisiones al respecto. Todas ellas coinciden en la aparición de una hipertransaminasemia en aproximadamente el 40% de los pacientes con EC17–21. En ocasiones, sobre todo en las formas de presentación no clásicas y paucisintomáticas, puede ser la única o la primera manifestación de la enfermedad, siendo la causa de una hepatopatía hasta entonces criptogenética, especialmente en niños. Asimismo, se ha observado una excelente respuesta en los pacientes con esta enfermedad tras la supresión del gluten de la dieta22–24.
El mecanismo de daño hepático en estos pacientes es desconocido, pero se han propuesto varias teorías al respecto. En primer lugar, un aumento de la permeabilidad del intestino delgado daría lugar a la absorción de antígenos y péptidos de origen intestinal responsables de una respuesta inmunológica en el hígado. Por otro lado, esta respuesta inmunológica podría estar ocasionada por neoantígenos originados por un sobrecrecimiento bacteriano secundario a un tránsito intestinal prolongado, o producidos por la transformación de antígenos y péptidos de la dieta mediante la transglutaminasa. También se ha descrito la existencia de alteraciones en las células de Kupffer, que son fundamentales para la defensa del hígado frente a los productos bacterianos intestinales, aunque se tienen pocos datos al respecto8,12,23,24.
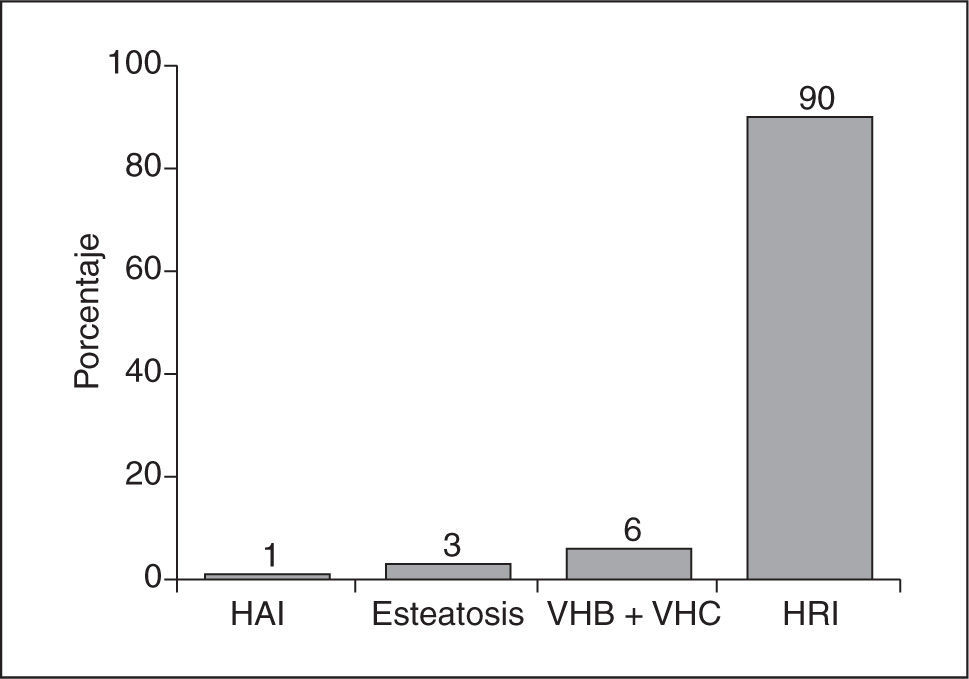
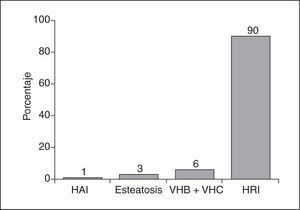
El espectro de posibles lesiones hepáticas en un paciente con EC y transaminasas elevadas es muy variable. Así, podemos encontrar una hepatitis reactiva inespecífica, esteatohepatitis, hepatitis crónicas virales (B y C), hepatopatías de base inmune (como la cirrosis biliar primaria [CBP], la colangitis esclerosante primaria [CEP] o la HAI), y otras lesiones20 (fig. 1).
La hepatitis reactiva inespecífica (HRI) es la más común de todas ellas, y es la causa de más del 90% de las hipertransaminasemias de los pacientes con EC8,23–25. Asimismo, se cree que es la causa de las hepatopatías criptogenéticas presentes en estos pacientes. Las lesiones histológicas que podemos encontrar son variadas y, por lo general, inespecíficas; se pueden observar tanto alteraciones en el espacio porta (ensanchamiento, destrucción de los conductos biliares, infiltrado mononuclear, necrosis en sacabocados, proliferación biliar) como del lobulillo hepático (aumento de las células de Kupffer, infiltrados mononucleares, necrosis focal, regeneración hepatocitaria). Otras lesiones menos frecuentes son los granulomas, o trombos hiliares26. En estos casos, la instauración de una dieta sin gluten, aparte de la mejoría de la lesión de la mucosa intestinal y de la clínica acompañante, conlleva una recuperación de las lesiones hepáticas con normalización de los valores séricos de las transaminasas22–24. Por tanto, en estos pacientes no sería necesario realizar una biopsia hepática, la cual sólo se llevaría a cabo en el caso de no producirse una normalización bioquímica con la dieta y de no haber obtenido un diagnóstico de la hepatopatía mediante la determinación de pruebas serológicas y autoanticuerpos.
Se ha descrito una prevalencia aumentada de EC en adultos con hepatitis autoinmune y en pacientes con enfermedades autoinmunes de la vía biliar intrahepática, extrahepática, o ambas, como la CBP, la CEP y la colangitis autoinmune17.
Así, en algunas series de pacientes con HAI se ha encontrado, hasta en un 20% de los casos, una atrofia vellositaria intestinal (aunque se estima una media de en torno al 5%). Sin embargo, la prevalencia estimada de HAI en paciaentes celíacos es inferior al 1%24,27. La posible asociación entre ambas entidades podría tener una base inmunitaria, ya que estos pacientes presentan con más frecuencia que la población general el haplotipo HLA DR3/DQ2. En los casos de pacientes con HAI y EC asociada, los síntomas digestivos son escasos, quizá debido al tratamiento inmunosupresor. No parece que en estos pacientes la dieta sin gluten afecte a la evolución de la hepatopatía.
En cuanto a las enfermedades colestásicas autoinmunes, se cree que los pacientes celíacos presentan un riesgo aumentado de desarrollar CBP y CEP respecto a la población general22,27–29. La CBP es la hepatopatía específica que más frecuentemente se ha asociado con la EC (quizá debido a la base inmunitaria de ambos procesos y a la coexistencia de ambas con otras enfermedades autoinmunes) 11,27,28,30. Se ha descrito una mayor prevalencia de EC en pacientes con CBP, aunque ésta oscila en torno al 5%. En pacientes celíacos la prevalencia de CBP encontrada, aunque los resultados son contradictorios, también es baja (0-30%). Por ello, se precisaría el estudio de grandes grupos de pacientes para establecer actualmente una relación entre ambas enfermedades y esclarecer su posible asociación etiopatogénica. La dieta sin gluten no afecta a la evolución de la CBP y, por tanto, ésta debe sospecharse en pacientes con hipertransaminasemia, colestasis y síntomas de enfermedad hepática que no se normalizan con la dieta.
También se ha planteado la asociación entre la EC y la CEP, pero se han descrito poco más de una docena de casos de esta última entidad en pacientes celíacos, y la mayoría de ellos también presentaba una colitis ulcerosa, enfermedad claramente asociada a la CEP8,31,32. Por ello, es difícil demostrar una relación directa entre ambas entidades. Sí es cierto que ambas comparten con frecuencia determinados antígenos HLA (B8, DR3, DQ2) y que los pacientes con CEP presentan anticuerpos antigliadina. Sólo ocasionalmente se ha observado una mejoría de la clínica con la dieta sin gluten.
Con cierta frecuencia se detectan anticuerpos antigliadina en pacientes con hepatitis C crónica, quizá debido a una activación autoinmune inespecífica33. Sin embargo, en estos pacientes también parece ser más frecuente la presencia de anticuerpos antiendomisio e, incluso, de lesiones duodenales compatibles con EC. También se han descrito casos aislados de EC detectada durante el tratamiento de la hepatitis C con interferón alfa, quizá debido al efecto inmunomodulador de este fármaco, pero puede tratarse de enfermos de novo o más probablemente pacientes celíacos con enfermedad latente o silente.
Se han descrito casos de enfermedad vascular hepática en pacientes celíacos, con una posible patogenia de base inmunitaria por depósito de inmunocomplejos en el endotelio o fenómenos de hipercoagulabilidad. Entre ellos se encuentran las vasculitis, la tromboangeítis obliterante o la trombosis de las venas mesentérica, esplénica, porta o hepática. También se han descrito casos de síndrome de Budd-Chiari, aunque generalmente se asocian a otros trastornos, como trombocitosis, déficit de antitrombina III y proteína C o síndromes mieloproliferativos34.
Es aún controvertida la asociación entre la EC y la cirrosis hepática. En dos estudios recientes se encontró una asociación entre las alteraciones hepáticas en pacientes en lista de espera para trasplante, o trasplantados, y la presencia de EC22.
Otras asociaciones aisladas con la EC son el linfoma hepatoesplénico, la enfermedad de Castleman, la hepatitis granulomatosa y, rara vez, el fallo hepático fulminante8,35,36.
Como conclusión, podemos decir que la presencia de hipertransaminasemia en los pacientes celíacos es un fenómeno común (aproximadamente en un 30% de ellos), que suele deberse en la mayoría de casos a una hepatitis reactiva inespecífica que revierte con la dieta sin gluten. A su vez, la EC parece ser una causa significativa de hepatitis criptogenética (hasta un 10% de los casos). Por tanto, podrían establecerse varias recomendaciones: buscar la presencia de afectación hepática en pacientes con EC (mediante la determinación de transaminasas y enzimas de colestasis) y, asimismo, investigar la presencia de EC –incluida la determinación de anticuerpos antiendomisio y antitransglutaminasa en el protocolo diagnóstico– en niños con enfermedad hepática criptogenética o en adultos con hepatopatías crónicas de origen no conocido (p. ej., incluyéndolo como una prueba más en el protocolo de trasplante hepático). La asociación de la EC con otras hepatopatías, en especial de base inmunitaria, podría ser fortuita y, para confirmarla, sería necesario realizar estudios multicéntricos con series amplias de pacientes.