La cirrosis es una enfermedad crónica y progresiva que se caracteriza por complicaciones asociadas a la hipertensión portal e insuficiencia hepática. Una complicación común de los pacientes con cirrosis son los trastornos de la función renal que están asociados a una alta morbilidad y un mal pronóstico. Las alteraciones en la función renal de estos pacientes incluyen la retención de sodio y agua, así como la vasoconstricción renal. La retención de sodio es responsable de la formación de ascitis y edemas, mientras que la retención de agua libre de solutos origina una hiponatremia dilucional, y la vasoconstricción renal da lugar al desarrollo del síndrome hepatorrenal (SHR). Debido a su mal pronóstico, la presencia de ascitis, hiponatremia dilucional y SHR son indicaciones de trasplante hepático (TH). Estudios recientes han permitido identificar nuevos factores pronósticos en estos pacientes, aplicar nuevos tratamientos para la hiponatremia dilucional y SHR y, finalmente, describir la relación que tienen estas complicaciones con la evolución antes y después del TH. En esta revisión se describen conceptos nuevos sobre la fisiopatología, la evaluación y el tratamiento de los pacientes cirróticos con hiponatremia dilucional y SHR, así como su relación con el TH.
Cirrhosis is a chronic, progressive disease characterized by complications associated with portal hypertension and liver failure. Renal function disorders are a common complication in patients with cirrhosis and are associated with high morbidity and mortality and poor prognosis. Renal function alterations in these patients include sodium and water retention and renal vasoconstriction.
Sodium retention causes the formation of ascites and edema, solute-free water leads to dilutional hyponatremia, and renal vasoconstriction gives rise to the development of hepatorenal syndrome (HRS). Due to their poor prognosis, the presence of ascites, dilutional hyponatremia and HRS are indications for liver transplantation (LT). Recent studies have allowed new prognostic factors in these patients to be identified, novel treatments for dilutional hyponatremia and HRS to be applied, and the association of these complications with disease course and outcome before and after LT to be described. The present review discusses new concepts of the physiopathology, evaluation and treatment of cirrhotic patients with dilutional hyponatremia and HRS and the relationship of these entities with LT.
Los pacientes cirróticos con ascitis pueden desarrollar diferentes tipos de alteraciones de la función renal. La retención de sodio es la primera alteración de la función renal que ocurre en la historia natural de la cirrosis. En la cirrosis compensada esta alteración se manifiesta exclusivamente en condiciones de una sobrecarga de sodio (p. ej., dieta hipersódica y/o administración de solución salina intravenosa). Al progresar la cirrosis, la retención de sodio se hace más intensa y los pacientes son incapaces de excretar el sodio de la dieta, lo que determina que aumente el volumen del líquido extracelular y se acumule como ascitis y/o edema. Con el tiempo, los pacientes desarrollan una disminución de la capacidad renal de excretar agua libre de solutos. Inicialmente esta alteración sólo puede ponerse de manifiesto mediante pruebas de sobrecarga acuosa. No obstante, en fases avanzadas, el trastorno es intenso y los pacientes son incapaces de excretar el agua ingerida con la dieta desarrollando un balance positivo de agua que determina la aparición de hiponatremia dilucional e hipoosmolaridad. Finalmente, en los últimos estadios de la cirrosis se produce una vasoconstricción renal grave que causa el síndrome hepatorrenal (SHR). Tanto la hiponatremia dilucional como el SHR tienen un mal pronóstico a corto plazo. La introducción del Model for End-Stage Liver Disease (MELD) –modelo matemático de 3 variables que incluye los valores séricos de bilirrubina, creatinina y la relación internacional normalizada (INR) para el tiempo de protrombina– en Estados Unidos y otros países, para asignar prioridad del trasplante de hígado (TH), ha dado más importancia a las alteraciones de la función renal en la cirrosis1. Tanto la hiponatremia dilucional como el SHR se asocian a un aumento de la morbilidad y la mortalidad, tanto antes como después del TH. En este artículo se revisan los aspectos relacionados con la patogenia, la prevención, el tratamiento y las consecuencias de la hiponatremia dilucional y el SHR en los pacientes sometidos a TH.
HIPONATREMIA DILUCIONALDefinición y epidemiologíaLa hiponatremia dilucional (o hipervolémica) se define como la concentración sérica de sodio < 130 mEq/l en pacientes con cirrosis y ascitis que no estén deshidratados2. Este trastorno debe distinguirse de la hiponatremia hipovolémica que puede producirse en los pacientes que presentan una respuesta muy positiva a los diuréticos, lo que comporta una deshidratación e insuficiencia renal. El riesgo de desarrollar hiponatremia dilucional en pacientes con cirrosis y ascitis es del 14% a un año y del 37% a 5 años3. La prevalencia de hiponatremia dilucional en pacientes cirróticos ingresados con ascitis oscila entre y el 22 y el 30%4,5.
FisiopatologíaEn condiciones fisiológicas, la generación de agua libre de solutos ocurre en la rama ascendente del asa de Henle, donde se produce una reabsorción de solutos sin reabsorción de agua, y después la reabsorción de agua se produce en el túbulo colector. La hormona antidiurética, o arginina vasopresina (AVP), es el principal factor que determina la reabsorción de agua en el segmento distal de la nefrona. Cuando se administra una sobrecarga acuosa en sujetos normales, se suprime la secreción de AVP por parte de la neurohipófisis y el túbulo colector se vuelve impermeable al agua, lo que determina que la orina diluida generada en el asa de Henle se excrete prácticamente inmodificada. Por el contrario, en condiciones de restricción acuosa en personas sanas, se estimula la secreción de AVP, lo que produce un aumento de la permeabilidad al agua en el túbulo colector y permite la reabsorción de agua que llega a las partes distales de la nefrona.
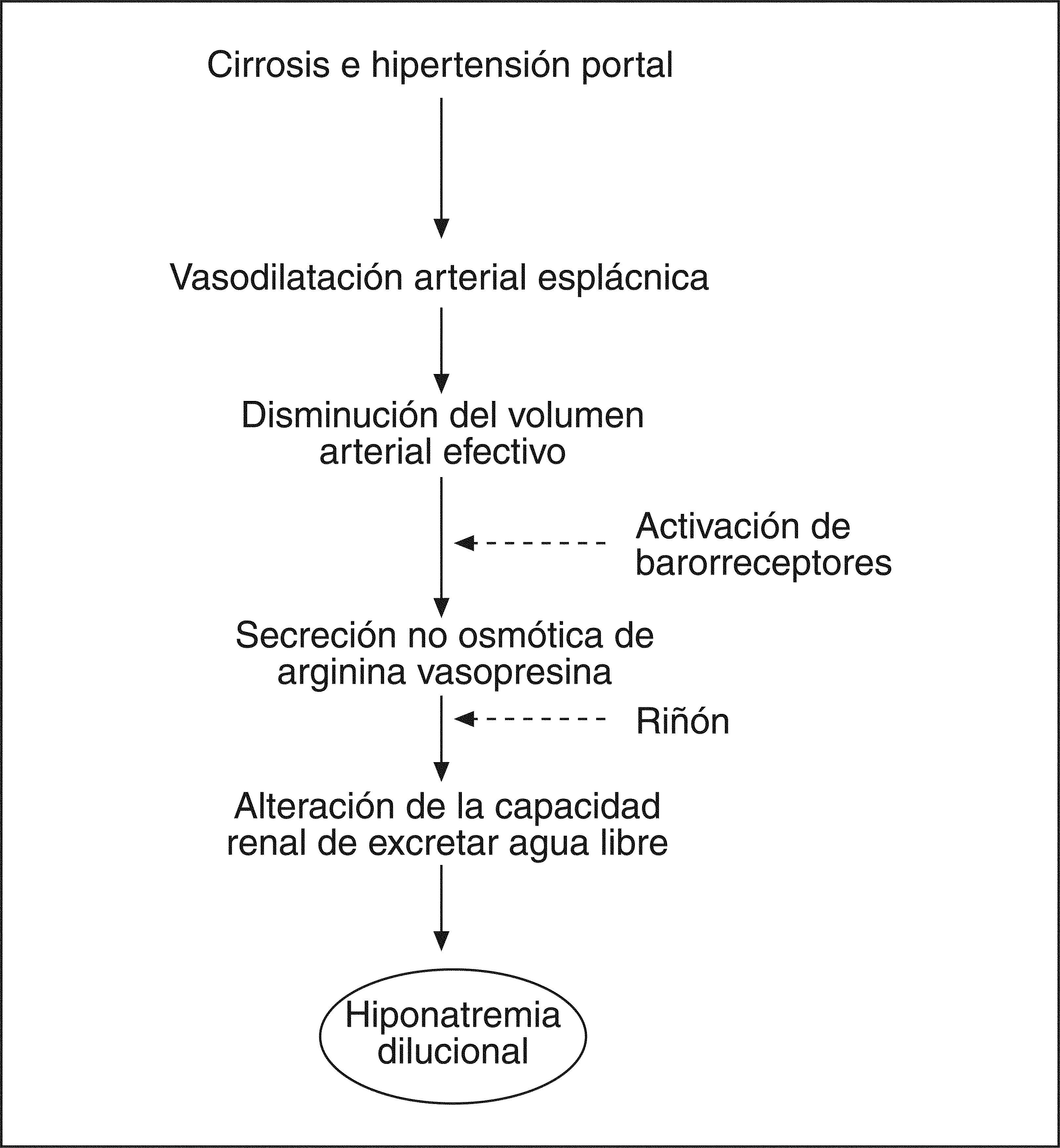
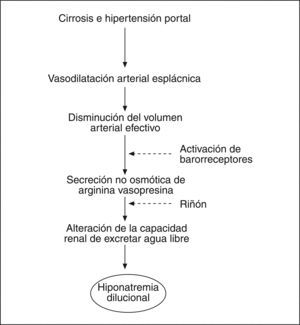
La patogenia de la retención de agua en la cirrosis es compleja e involucra a diferentes factores, pero el principal es la secreción no osmótica de AVP; otros factores, como la disminución de la síntesis renal de prostaglandinas y la reducción del aporte de filtrado al asa de Henle, es posible que también desempeñen un papel en la patogenia6. Los elevados valores plasmáticos de AVP son consecuencia de la hipersecreción no osmótica de esta hormona, debido a la vasodilatación esplácnica existente en la cirrosis que estimula la producción de sustancias vasoactivas, como la renina, la noradrenalina y la AVP6 (fig. 1).
Fisiopatología de la hiponatremia dilucional en los pacientes con cirrosis. La vasodilatación arterial esplácnica y la subsiguiente reducción del volumen arterial efectivo determinan una hipersecreción no osmótica de la arginina vasopresina (AVP) por mecanismos hemodinámicos secundarios a la hipertensión portal.
La información disponible acerca del curso y las consecuencias clínicas de la hiponatremia dilucional en la cirrosis es limitada. Algunos pacientes no presentan síntomas, mientras que otros pueden tener una encefalopatía hepática asociada, lo cual hace difícil la identificación de síntomas específicos. En la mayoría de los pacientes los síntomas están relacionados con el sistema nervioso central (SNC) y varían entre los hallazgos inespecíficos, como anorexia, letargia, náuseas y dificultad para la concentración, hasta signos mayores, como déficit neuronales focales, convulsiones y coma, aunque estos últimos son muy raros en los pacientes con cirrosis7,8. La hiponatremia en pacientes con cirrosis se desarrolla, en general, de forma lenta y suele ser moderada. La mayoría de pacientes con hiponatremia tiene valores de sodio sérico que oscilan entre 125 y 130 mEq/l4.
Los efectos de la hiponatremia dilucional sobre el SNC en la cirrosis son difíciles de diferenciar de la encefalopatía hepática, ya que los pacientes con encefalopatía hepática pueden tener una hiponatremia dilucional asociada. Hay la posibilidad de que los cambios metabólicos que produce la hiponatremia en las células cerebrales (astrocitos) puedan actuar como un factor desencadenante de la encefalopatía hepática9. A escala cerebral, la hiposmolaridad plasmática, al causar una reducción compensatoria de osmolitos orgánicos intracelulares para prevenir el edema cerebral, podría precipitar la aparición de una encefalopatía hepática. La posible relación entre la hiponatremia y la aparición de encefalopatía hepática deriva de varias observaciones: a) la presencia de hiponatremia es un factor de riesgo para desarrollar encefalopatía en pacientes con cirrosis y ascitis refractaria10; b) en pacientes con ascitis tratados con diuréticos, la hiponatremia es un factor de riesgo para desarrollar encefalopatía11, y c) un estudio reciente indica que la hiponatremia es un factor predictivo independiente del desarrollo de encefalopatía hepática en la cirrosis12.
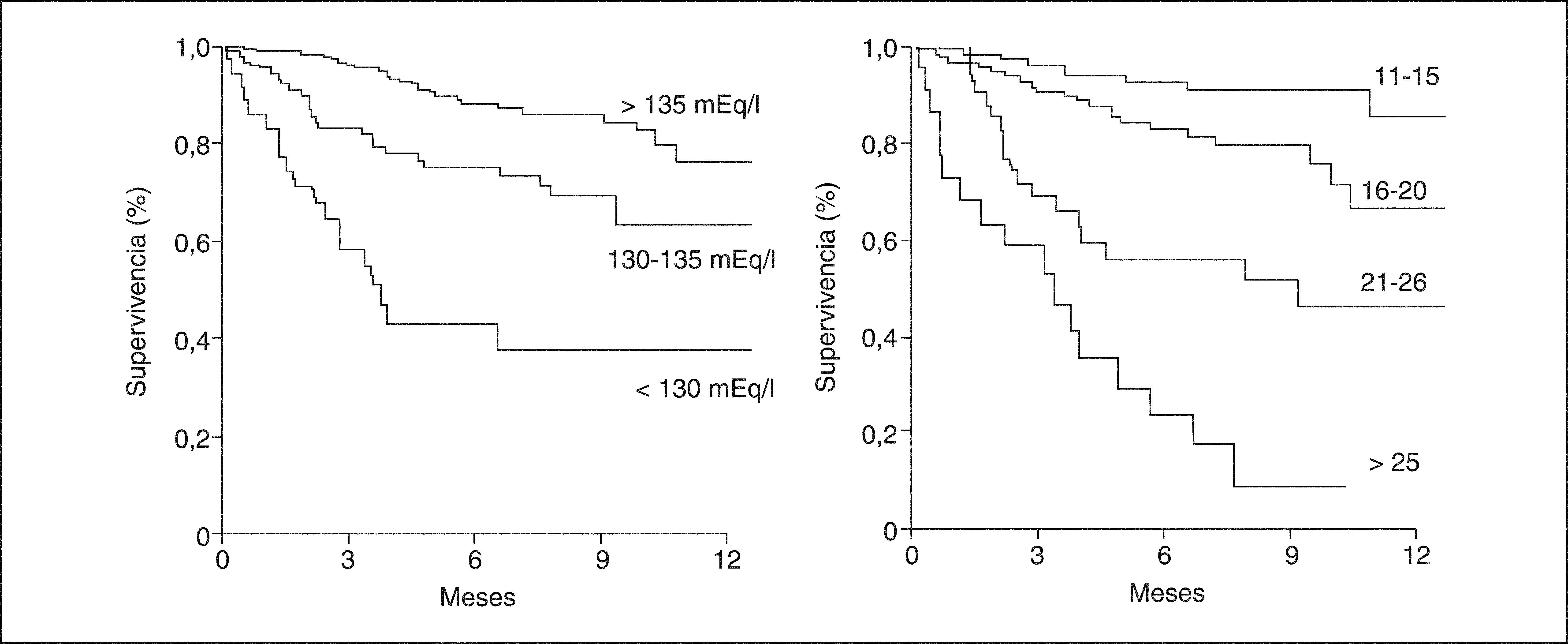
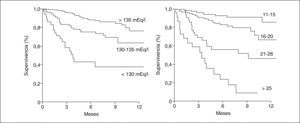
Valor pronósticoLos valores bajos de sodio sérico fueron descritos como un marcador de mal pronóstico en la cirrosis hace varias décadas13,14. Recientemente, el interés del sodio sérico como marcador pronóstico en pacientes cirróticos ha sido reanalizado en el contexto del TH. Esto deriva de varias observaciones. En primer lugar, el sodio sérico (< 130 mEq/l) predice la mortalidad en los pacientes con cirrosis y ascitis en lista de espera para TH15–19. En segundo lugar, el valor predictivo del sodio sérico en algunos estudios ha demostrado ser independiente del MELD15,17,19. En tercer lugar, la adición del sodio sérico al modelo MELD (fórmula MELD-Na) parece mejorar el valor predictivo del MELD para la mortalidad en lista de espera para TH18, pero sobre este punto no todos los estudios coinciden, y en algunos la mejoría de esta predicción es pequeña15,19. Tanto el sodio sérico como el MELD son factores predictivos de supervivencia a corto plazo (3 meses) y a largo plazo (12 meses) en estos pacientes (fig. 2)19. No obstante, es importante señalar que la adición del sodio al MELD puede conllevar importantes problemas:
1. La concentración sérica de sodio puede tener fluctuaciones notables que no necesariamente reflejan un empeoramiento del pronóstico de la enfermedad. Por ejemplo el uso de diuréticos y/o líquidos intravenosos en los pacientes con cirrosis puede reducir de forma notable la concentración sérica de sodio. Por este motivo, la concentración de sodio sérico es fácilmente modificable y, por tanto, no sería un buen parámetro para utilizar en una fórmula pronóstica con importantes implicaciones en la distribución de órganos.
2. El tratamiento farmacológico de la hiponatremia, en un futuro próximo, con los antagonistas del receptor V2 de la AVP podría afectar de forma significativa el cálculo del pronóstico de la fórmula MELD-Na.
Probabilidad de supervivencia a un año antes de un trasplante ortotópico de hígado en un grupo de pacientes con cirrosis (n = 308) en lista de espera de trasplante hepático de acuerdo con la concentración sérica de sodio (izquierda) y el valor del MELD (derecha).
El tratamiento convencional de la hiponatremia dilucional es la restricción de líquidos a 1-1,5 l/día2. Sin embargo, esta medida es difícil de realizar y raramente es eficaz. La administración de sodio en forma de solución salina intravenosa se desaconseja porque lleva inevitablemente a la acumulación de más ascitis y edema7.
El futuro del tratamiento de la hiponatremia dilucional en la cirrosis son los fármacos acuaréticos, que antagonizan de forma selectiva el receptor V2 de la AVP en los túbulos renales y, por tanto, inhiben la reabsorción de agua. Estos agentes aumentan la excreción renal de agua libre de solutos y son útiles para mejorar la hiponatremia en los pacientes con cirrosis u otras enfermedades asociadas con retención de agua libre, como la insuficiencia cardía- ca congestiva o el síndrome de secreción inapropiada de AVP20. Aunque hay varios estudios sobre estos antagonistas del receptor V2 en modelos animales de cirrosis, los datos en pacientes con cirrosis son todavía escasos. Los estudios clínicos disponibles indican que los acuaréticos son seguros, aumentan la excreción de agua libre y mejoran la hiponatremia y el control de la ascitis en pacientes con cirrosis20–24. Estos fármacos actualmente están siendo evaluados en estudios clínicos en fase 3.
HIPONATREMIA Y TRASPLANTE HEPÁTICOAntes del trasplanteTal como se ha descrito con anterioridad, el sodio sérico es un factor pronóstico importante en los pacientes en lista de espera para TH, y los valores secuenciales < 135 mEq/l indican un mal pronóstico19. Un estudio retrospectivo de 241 pacientes cirróticos sometidos a TH en nuestra unidad demostró que 19 de ellos (8%) presentaban hiponatremia (sodio sérico < 130 mEq/l) en el momento del trasplante25. Estos 19 pacientes tuvieron más episodios de ascitis, encefalopatía hepática y una puntuación de Child- Pugh y MELD más elevadas que los pacientes sin hiponatremia. Actualmente se desconoce si la mejoría de la concentración sérica de sodio en sujetos con hiponatremia dilucional podría contribuir a mejorar la evolución de los pacientes antes del TH. Esta posibilidad debería investigarse en el futuro.
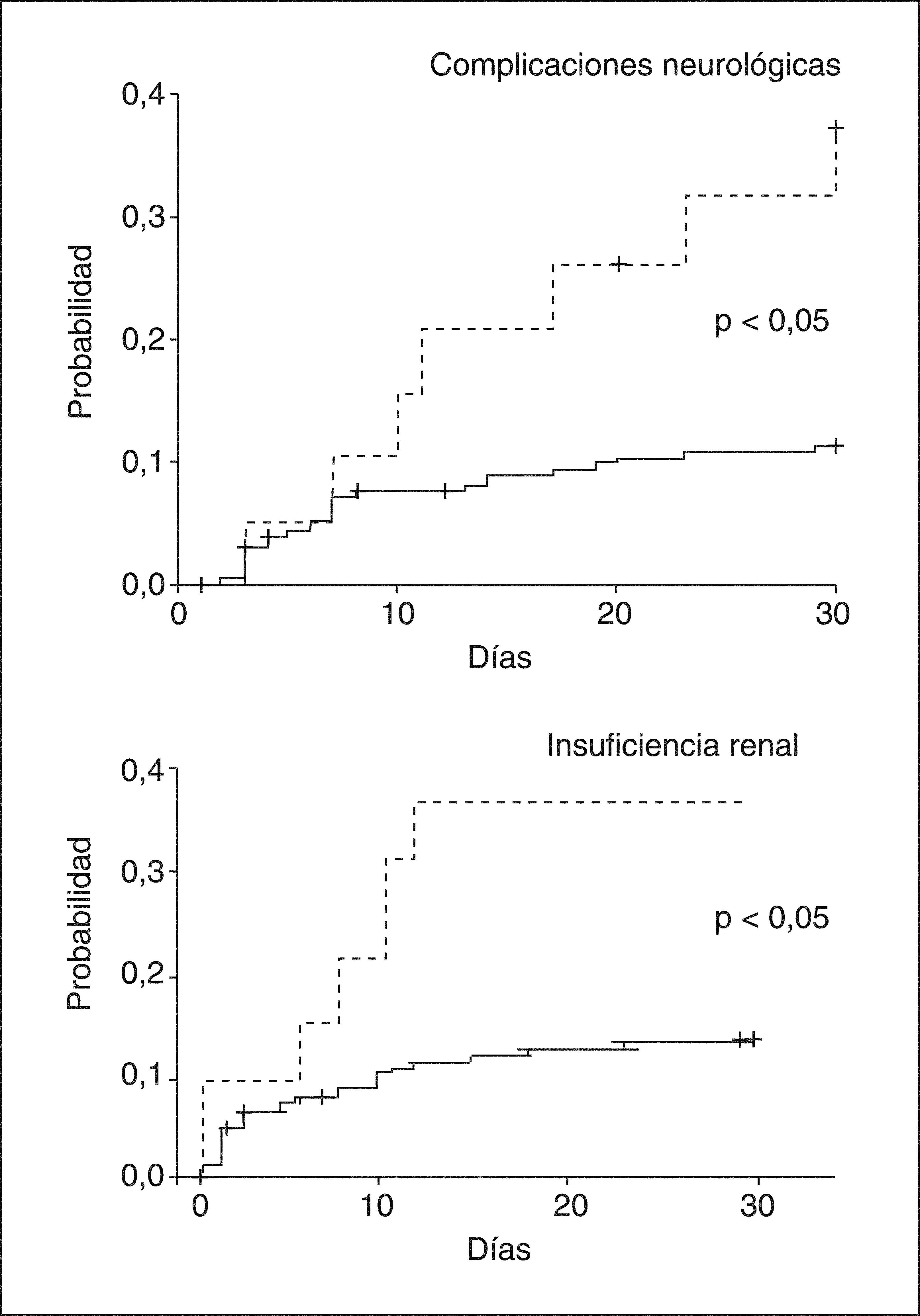
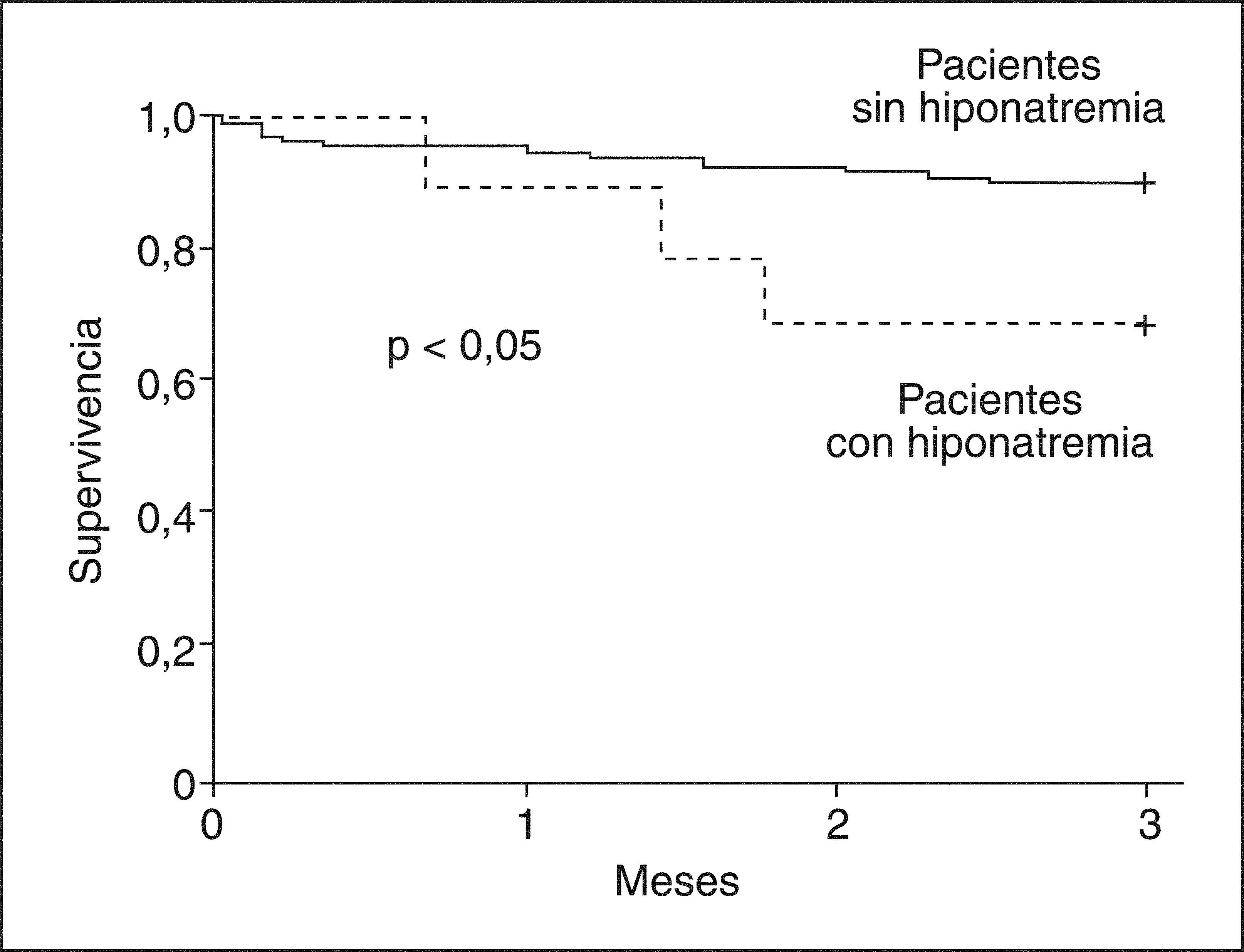
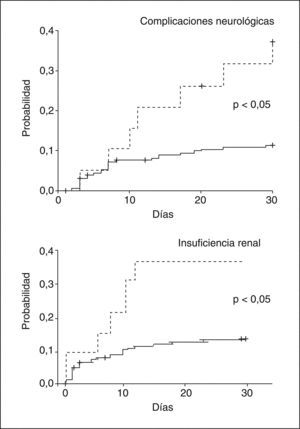
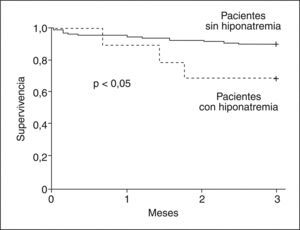
Después del trasplanteEn la serie de pacientes con cirrosis en espera de TH antes mencionada25, los pacientes con hiponatremia desarrollaron más complicaciones neurológicas, renales y más infecciones después del TH que los sujetos sin hiponatremia. La hiponatremia en este grupo de pacientes fue un factor predictivo independiente del desarrollo de complicaciones neurológicas e insuficiencia renal post-TH (fig. 3). Más importante aún fue que la supervivencia a los 3 meses post-TH de los pacientes con hiponatremia en elmomento del TH fue significativamente menor comparada con la de los pacientes sin hiponatremia25 (fig. 4).
Probabilidad de desarrollar complicaciones neurológicas e insuficiencia renal en pacientes con cirrosis tras el trasplante hepático (TH), en función de la existencia o no de hiponatremia en el momento del TH. Líneas discontinuas: pacientes con hiponatremia (sodio sérico < 130 mEq/l); líneas continuas: pacientes sin hiponatremia (sodio sérico ≥ 130 mEq/l).
Efecto de la hiponatremia pretrasplante en la supervivencia de pacientes cirróticos con ascitis después del trasplante hepático (TH). La supervivencia a 3 meses después del TH es menor en los pacientes con hiponatremia en comparación con la de los pacientes sin hiponatremia.
Algunos estudios en pacientes cirróticos con hiponatremia sometidos a TH han descrito el desarrollo de complicaciones neurológicas, como la mielinólisis central pontina, una desmielinización de la sustancia blanca cerebral, que puede ocurrir al corregirse de forma brusca, en el postrasplante inmediato, una hiponatremia preexistente26–28. Esta complicación se calcula que ocurre en aproximadamente el 2% de los pacientes con cirrosis sometidos a TH, y puede ser difícil de reconocer porque suele diagnosticarse erróneamente como trastorno del nivel de conciencia, de modo genérico, o encefalopatía27,29. En la mayoría de los casos, la mielinólisis central pontina se asocia con un incremento rápido del sodio sérico después del TH, excediendo una corrección mayor de 20 mEq/l en un período de 24 h. No obstante, también se ha descrito en pacientes que han presentado fluctuaciones pequeñas de la concentración sérica de sodio. A pesar de ello, es muy importante prevenir fluctuaciones rápidas del sodio en pacientes con hiponatremia sometidos a TH.
SÍNDROME HEPATORRENALDefinición y epidemiologíaEl SHR es una afección clínica que aparece en pacientes con enfermedad hepática avanzada, insuficiencia hepática e hipertensión portal, y está caracterizada por un deterioro de la función renal, una intensa alteración de la circulación arterial y la activación de los sistemas vasoactivos endógenos30. En el riñón se produce una notoria vasoconstricción renal que reduce el filtrado glomerular. La incidencia de SHR en pacientes cirróticos con ascitis es de alrededor del 10%5. La probabilidad de desarrollar SHR en pacientes con cirrosis y ascitis sin insuficiencia renal es del 18% a un año y del 39% a 5 años5.
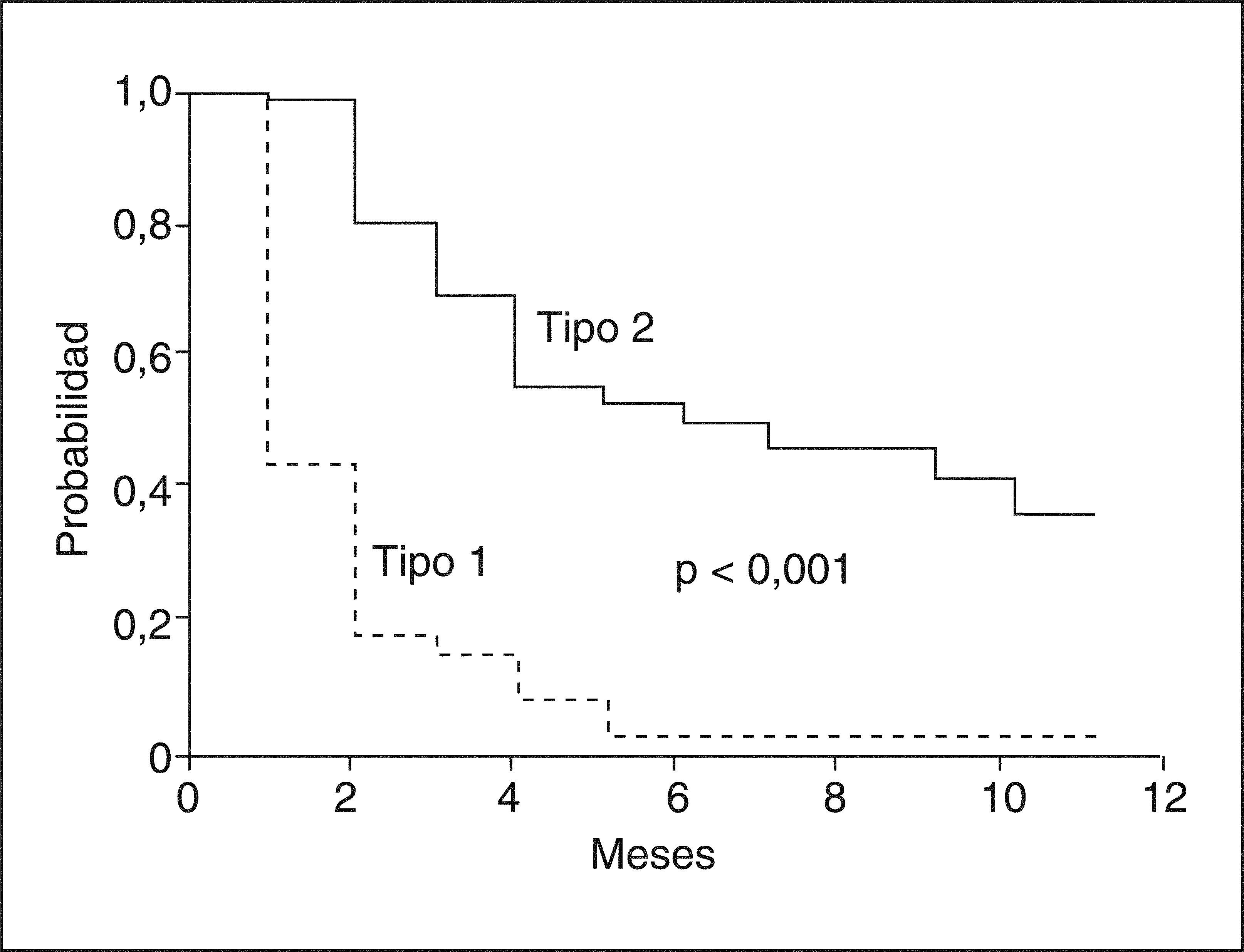
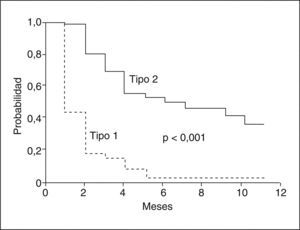
Hay dos tipos de SHR. El SHR tipo 1 se caracteriza por una insuficiencia renal grave y rápidamente progresiva, definida por un aumento _ 100% de la creatinina sérica inicial hasta un valor > 2,5 mg/dl en menos de 2 semanas5. El pronóstico de estos pacientes es muy malo, con una supervivencia mediana sin tratamiento inferior a 4 semanas. El SHR tipo 2 se caracteriza por un aumento moderado de la creatinina sérica (> 1,5 mg/dl) que no cumple los criterios de SHR tipo 1. La supervivencia mediana de estos pacientes es más prolongada que la de los pacientes con SHR tipo 1, aproximadamente de 6 meses (fig. 5).
FisiopatologíaLa hipertensión portal sinusoidal genera cambios vasculares en el área esplácnica, posiblemente secundarios al estrés endotelial y la translocación bacteriana31. Estos dos eventos aumentan la producción local de vasodilatadores, en especial óxido nítrico, y generan una vasodilatación esplácnica. Esta vasodilatación disminuye el volumen arterial efectivo, originando una activación progresiva, mediada por barorreceptores, de los sistemas vasoconstrictores (sistema renina-angiotensina y sistema nervioso simpático), que son responsables, al menos en parte, de la vasoconstricción renal y la reducción del filtrado glomerular32. Estudios recientes indican que la disminución del gasto cardíaco también tiene probablemente un papel en la patogenia del SHR33,34. Los pacientes con cirrosis descompensada pueden deteriorar su condición clínica, por ejemplo, ante una infección bacteriana que puede causar una disminución del gasto cardíaco y del volumen arterial efectivo, disminuyendo así la perfusión renal y contribuyendo a la aparición del SHR.
Manifestaciones clínicas y diagnósticoLa mayoría de pacientes con SHR tiene signos de insuficiencia hepática avanzada, que se caracterizan por la presencia de ascitis, ictericia, disminución de la masa muscular, encefalopatía hepática y coagulopatía. En general, los pacientes con SHR tipo 1 tienen una enfermedad hepática más avanzada que los pacientes con SHR tipo 2. El diagnóstico del SHR es de exclusión, y se basa en los criterios propuestos por el Club Internacional de Ascitis30 (tabla I). Otras causas de insuficiencia renal en la cirrosis, que deben excluirse antes de realizar el diagnóstico de SHR, son las infecciones bacterianas, el uso de fármacos que pueden deteriorar la función renal, como los diuréticos en altas dosis, los antiinflamatorios no esteroideos o los aminoglucósidos, la insuficiencia renal prerenal por depleción de volumen, la necrosis tubular aguda y las glomerulopatías.
Criterios diagnósticos de síndrome hepatorrenal
| Criterios mayores |
|
La administración de vasoconstrictores representa el tratamiento de elección del SHR. La base racional para el uso de estos fármacos en pacientes con SHR es mejorar la función renal a través del aumento de las resistencias vasculares sistémicas. Los vasoconstrictores utilizados en la actualidad son la terlipresina, la midodrina y la noradrelanina. El fármaco más estudiado es la terlipresina (un análogo de la vasopresina). Múltiples estudios (3 controlados y los otros no controlados) han confirmado la utilidad de la terlipresina para revertir la insuficiencia renal y las alteraciones hemodinámicas en pacientes con SHR35–41. La expansión simultánea de volumen con albúmina (40 g/día) parece ser necesaria para obtener una respuesta positiva37–41. La combinación de terlipresina y albúmina mejora la función renal en aproximadamente un 45% de los pacientes37–41. La incidencia de efectos colaterales isquémicos es baja (< 10%). La posibilidad de recidiva del SHR después de interrumpir el tratamiento con terlipresina y albúmina es de alrededor del 17-50%, pero todos los pacientes responden al retratamiento37,40. La información disponible acerca de la midodrina y la noradrenalina (también asociados a albúmina intravenosa) es limitada, pero sugiere que estos dos fármacos también mejoran la función renal en los pacientes con SHR42–44. Las dosis y las recomendaciones para el uso de vasoconstrictores en el SHR están resumidas en la tabla II.
Recomendaciones para el uso de vasoconstrictores en el tratamiento del síndrome hepatorrenal
|
La derivación percutánea portosistémica intrahepática (DPPI) es una técnica que consiste en colocar una prótesis autoexpandible por vía transyugular entre una rama de las venas suprahepáticas y la vena porta. En pacientes con cirrosis, la DPPI disminuye la presión portal sinusoidal y, de esta forma, ayuda a controlar algunas de las complicaciones relacionadas con la hipertensión portal. La DPPI se ha utilizado en pacientes con hemorragia por varices esofagogástricas, ascitis refractaria, hidrotórax refractario y SHR. En pacientes con SHR, la DPPI, al disminuir la presión portal, mejora el volumen arterial efectivo y disminuye la activación de los sistemas vasoconstrictores, lo cual produce un aumento moderado del flujo sanguíneo renal y del filtrado glomerular. Hay 4 estudios no controlados que demuestran que este método mejora la función renal y revierte el SHR en el 60-70% de los pacientes44–47. Sin embargo, debido a que el uso de la DPPI se asocia con efectos secundarios significativos, particularmente encefalopatía e insuficiencia hepática, los pacientes que se sometan a esta intervención deberían tener, idealmente, un estado de función hepática moderadamente preservado, lo cual es difícil ya que muchos pacientes con SHR suelen tener una puntuación Child-Pugh > 12.
PrevenciónEl SHR puede prevenirse en la peritonitis bacteriana espontánea (PBE), una afección que con frecuencia se complica con el desarrollo de SHR a pesar de la resolución de la infección. Se ha demostrado que la administración de albúmina i.v. (1,5 g/kg en el momento del diagnóstico de la infección y 1 g/kg 48 h después), junto con el tratamiento antibiótico en pacientes con cirrosis y PBE, disminuye de forma notoria la incidencia de SHR en comparación con los pacientes que sólo reciben tratamiento antibiótico (el 33 frente al 10%)48. Mas aún, la administración de la albúmina también mejora la supervivencia intrahospitalaria (el 29 frente al 10%) y a 3 meses (el 41 frente al 22%) en estos pacientes. El efecto beneficioso de la albúmina probablemente se relaciona con su capacidad para prevenir el deterioro en el volumen sanguíneo circulante efectivo y la posterior activación de sistemas vasoconstrictores que ocurren durante la infección. Los expansores sintéticos, tipo hidroxietilalmidón, no parecen ser eficaces para prevenir el SHR en el contexto de la PBE49. El SHR también puede prevenirse en la hepatitis alcohólica aguda50. En estos pacientes, la administración de pentoxifilina (400 mg/8 h), un inhibidor del factor de necrosis tumoral alfa, reduce la aparición de SHR (el 35 frente al 8%) y la mortalidad hospitalaria (el 46 frente al 24%) en comparación con placebo.
SÍNDROME HEPATORRENAL Y TRASPLANTE HEPÁTICOAntes del trasplanteLa presencia de SHR es un factor de mal pronóstico en pacientes a la espera de TH51–55. No obstante, no se dispone de información actualizada acerca del pronóstico de los pacientes con SHR desde que el tratamiento con vasoconstrictores y albúmina fue introducido como terapia establecida del SHR. Por tanto, sería deseable disponer de esta información, puesto que es muy posible que el tratamiento farmacológico mejore la evolución y el pronóstico de los pacientes con SHR en lista de espera para TH.
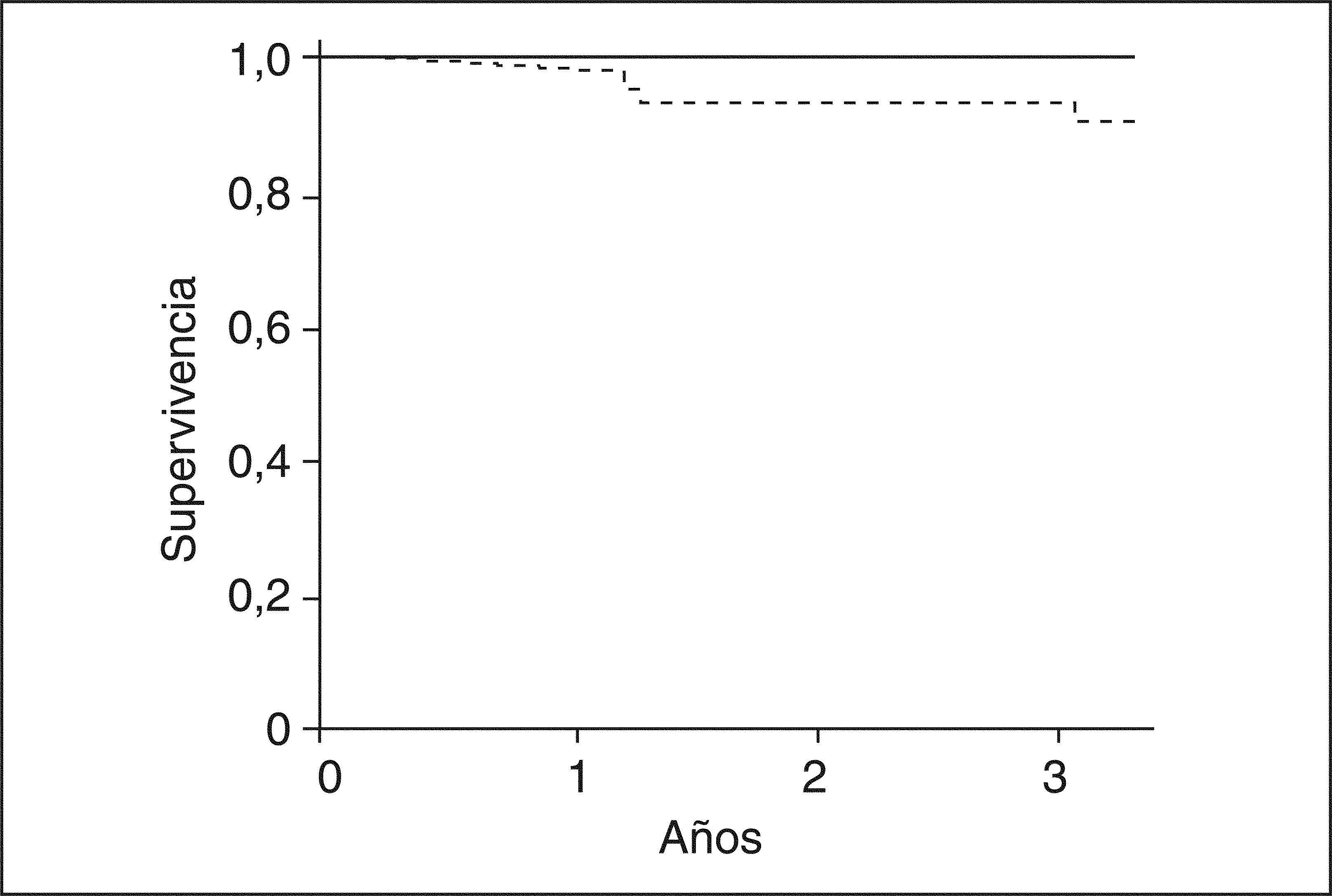
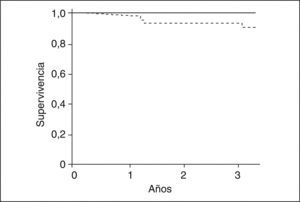
Después del trasplanteLos pacientes con SHR sometidos a TH tienen un mayor número de complicaciones, en especial infecciones, hemorragia y requerimiento de hemodiálisis, que llevan a una peor supervivencia respecto a los pacientes trasplantados sin SHR56. Por este motivo, es probable que el tratamiento del SHR antes del TH cambie de forma radical la evolución de estos pacientes en el período postrasplante. El único estudio que ha evaluado este concepto sugiere que el tratamiento en pacientes cirróticos con SHR en lista de espera con terlipresina y albúmina se asocia a una evolución postransplante similar a la de los pacientes trasplantados sin SHR57. La supervivencia a 3 años de los pacientes tratados pre-TH exitosamente es excelente (100%), y por esta razón los pacientes con SHR deberían ser tratados antes del TH (fig. 6)57,58.
Probabilidad de supervivencia después del trasplante hepático en pacientes con cirrosis y síndrome hepatorrenal tratados con terlipresina y albúmina intravenosa antes del trasplante (línea continua) y pacientes sin síndrome hepatorrenal (línea discontinua).