Las técnicas de aféresis leucocitaria actúan depurando diferentes poblaciones leucocitarias activas y modificando mediadores que intervienen en el proceso inflamatorio.De esta manera y en función de su teórico efecto inmunomodulador, se han empezado a utilizar en enfermedad inflamatoria intestinal. Existen 2 tipos de dispositivos, el de granulocitoaféresis, que realiza una adsorción selectiva de granulocitos y monocitos, y el de leucocitoaféresis, que efectúa una filtración no selectiva. La pauta convencional de tratamiento consiste en efectuar entre 5 y 10 sesiones, normalmente una por semana, para inducir la remisión. Aunque no existe evidencia del máximo nivel que posicione este tratamiento, sí puede considerarse como una opción válida en situaciones seleccionadas en la colitis ulcerosa, principalmente en enfermedad dependiente o resistente a los corticoides cuando otros tratamientos inmunosupresores o biológicos, más consolidados, fracasan. Además de su capacidad de ahorro de corticoides, su excelente perfil de seguridad le confiere un papel atractivo cuando se persigue evitar riesgos de estos otros tratamientos mencionados o en pediatría.
En esta revisión se analizan los datos de su eficacia y seguridad centrados en aquellos escenarios en enfermedad inflamatoria intestinal donde puede ser aplicable en la práctica clínica.
Leukocyte apheresis works by purifying distinct populations of active leukocytes and by modifying inflammatory mediators. Based on their theoretical immunomodulatory effect, these techniques have begun to be used in inflammatory bowel disease. There are two types of devices: granulocytapheresis, which performs selective granulocyte and monocyte absorption, and leukocytapheresis, which carries out non-selective filtration.
Conventional treatment regimens consist of between 5 and 10 sessions, normally one session per week, to induce remission. Although the indications for apheresis have not been clearly defined, this technique can be considered a valid option in selected patients with ulcerative colitis, mainly those with corticosteroid-dependent or corticosteroid-refractory disease when other, better-established immunosuppressive or biological treatments have failed. In addition to avoiding the use of corticosteroids, due to its excellent safety profile, apheresis is an attractive option to avoid the risks of immunosuppressive and biological treatments and for use in the pediatric population.
The present reviews analyzes the data on the safety and efficacy of apheresis in those patients with inflammatory bowel diseases who could benefit from this technique.
La enfermedad inflamatoria intestinal (EII) incluye básicamente la colitis ulcerosa (CU) y la enfermedad de Crohn (EC). Estas entidades característicamente tienen un curso recidivante con brotes de actividad1. El objetivo del tratamiento de la EII persigue inducir la remisión del brote y mantenerla con la mayor eficacia y seguridad posible y mejorar la calidad de vida del paciente. Los corticoides continúan siendo el tratamiento de elección en la fase aguda, pero a largo plazo no modifican la historia natural de la enfermedad y presentan importantes efectos secundarios y riesgo de infecciones2. Además, al año, alrededor del 50% de los pacientes desarrollan resistencia o dependencia de los corticoides3,4. En estas situaciones, los inmunomoduladores (IMM) tiopurínicos constituyen la principal opción terapéutica, pero a largo plazo al menos en un 40% de los casos son ineficaces5. La terapia antifactor de necrosis tumoral (anti-TNF) ha supuesto un avance crucial en el tratamiento de estos pacientes, pero no está exenta de riesgos y la remisión completa no se logra en más del 40% de los casos6. Por tanto en una significativa proporción de pacientes con EII aún es preciso recurrir a la cirugía y es conveniente disponer de otras alternativas terapéuticas. Una de ellas es la leucocitoaféresis que comenzó a utilizarse en Europa, principalmente en CU, hacia el año 2003, a raíz de los favorables resultados descritos por investigadores japoneses con este procedimiento7,8.
En la EII la actividad inflamatoria se asocia a un incremento en sangre periférica del número de granulocitos y monocitos activados y a una infiltración mucosa por células inflamatorias9. El grado de infiltración mucosa por neutrófilos se ha asociado con la gravedad clínica y se ha definido como un factor predictivo de recidiva10. Por tanto, las técnicas que realizan una depuración de diferentes poblaciones leucocitarias activadas pueden tener un potencial efecto beneficioso sobre la EII y otras enfermedades de base autoinmunitaria11.
Tipos de aféresis leucocitariaSistemas de adsorciónEn estos sistemas, la sangre del paciente pasa a través de una columna o filtro donde diversas subpoblaciones leucocitarias quedan adsorbidas. En Europa y Japón están comercializados 2 dispositivos de este tipo. El sistema de granulocito-monocito aféresis (GMA) con Adacolumn® (Japan Immnunoresearch Laboratories, JIMRO, Takasaki, Japón) consiste en una columna de 335ml de capacidad, constituida por 35.000 cuentas de acetato de celulosa de 2mm de diámetro bañadas por suero salino, donde se adsorben de forma selectiva granulocitos (65%) y monocitos (55%), y solo un 2% de linfocitos12. El sistema de leucocitoaféresis (LCAP) con Cellsorba® (Asahi Kasei Medical Co. Ltd, Tokio, Japón) contiene una membrana de fibra de poliéster no tejida que permite filtrar un 99% de granulocitos y monocitos, un 70% de linfocitos y un 35% de plaquetas13.
Sistemas de centrifugaciónEn algunos casos en EII se han empleado métodos de centrifugación que permiten eliminar una fracción rica en linfocitos tras centrifugar un importante volumen de plasma del paciente14.
Mecanismo de acción de la aféresis leucocitariaLa pauta de tratamiento más generalizada de aféresis es la realización de una sesión semanal de una hora de duración durante 5 semanas consecutivas (en algunos casos 10).Durante las sesiones la sangre del paciente se hace circular por un circuito vena a vena periférica.Este circuito se anticoagula con heparina y cuenta con los adecuados dispositivos de seguridad. El sistema más empleado en nuestro medio es la GMA. En ella, los leucocitos que expresan el receptor Fcγ y receptores del complemento (Mac-1,CD11b/CD18) se adhieren a las cuentas de acetato de celulosa a través de la activación de la cascada del complemento. La disminución del reservorio de leucocitos activados en la circulación sistémica se compensa por la movilización, desde la médula ósea al torrente circulatorio, de leucocitos jóvenes, no activados (CD 10— ), sin capacidad de migrar al foco inflamatorio. Además de ello, se produce un cambio funcional en los monocitos activados, que expresan marcadores CD14+CD16+, que en su conjunto conlleva una reducción de la producción de citocinas proinflamatorias y un incremento de mediadores antiinflamatorios circulantes, en definitiva, un fenómeno de inmunomodulación y secundariamente una disminución del infiltrado inflamatorio y del daño tisular. En este procedimiento se han descrito mecanismos de acción a diferentes niveles del proceso inflamatorio que quedan resumidos en la tabla 1 y que han sido recientemente revisados15.
Mecanismos de acción descritos en aféresis leucocitaria
| • Movilización de granulocitos jóvenes (CD 10—) al reservorio intravascular |
| • Reducción de la migración leucocitaria |
| • Modulación de la expresión de moléculas de adhesión (L-selectina) |
| • Modulación de la expresión de receptores de chemocinas (CXCR3) |
| • Disminución de monocitos activados (CD14+CD16+) y reducción de la producción de citocinas proinflamatorias (TNF-α, IL-1β, IL-6, IL-8) |
| • Disminución de la expresión de toll-like receptors tipo 2 en granulocitos |
| • Liberación de mediadores antiinflamatorios (sTNFR, IL-10, IL-1ra, HGF) |
| • Incremento de linfocitos con capacidad inmunorreguladora (CD4+CD25+) |
| • Inducción de apoptosis granulocitaria |
Tomada de Hanai H, et al. Clin Exp Immunol. 2011;163:50-58.
Una opción terapéutica es tanto más válida cuanto mayor eficacia y menores efectos secundarios demuestre. La aféresis leucocitaria no se ha consolidado aún definitivamente en la EII principalmente debido al coste del tratamiento y a la limitada calidad metodológica de los estudios clínicos iniciales. La mayoría de los estudios clínicos sobre aféresis son observacionales sin grupo control, con escaso número de pacientes y,como sucede muchas veces en EII, muestran una importante heterogeneidad en aspectos como: la pauta de corticoides asociada, el esquema de aféresis empleado, los índices clínicos utilizados para valorar la eficacia, la definición de dependencia o resistencia a los corticoides, o la proporción de pacientes con fracaso previo a tratamientos inmunosupresores.
Disponemos de 2 ensayos clínicos doble ciego, controlados frente a columna ficticia. En el primero de ellos la aféresis muestra una tasa significativamente mayor de respuesta global (80 vs 33%; p<0,05) aunque no de remisión completa (20 vs 11%) y el estudio incluye un número muy reducido de pacientes con CU resistente a los corticoides16. En el estudio pivotal de Sands et al.17 se incluyeron un importante número de pacientes con CU moderada-grave con «respuesta inadecuada a tratamiento convencional». La aféresis no mostró una eficacia significativa ni en la remisión clínica ni en la remisión endoscópica 3 semanas después de finalizar el tratamiento. No obstante, los criterios de inclusión del ensayo resultan bastante imprecisos, tratándose de una población no seleccionada (alrededor de la mitad de los pacientes presentaban valores normales de PCR, menos del 50% llevaban corticoides concomitantes, y no fueron estratificados en función de la gravedad clínica). Así, en el análisis post-hoc, el subgrupo de pacientes con mayor grado de inflamación aguda histológica mostró resultados favorables.A la vista de esta evidencia la aféresis no puede recomendarse en el tratamiento de la CU activa moderada-grave de una forma general; pero cada vez disponemos de más datos provenientes de estudios observacionales prospectivos, bien diseñados, que con bastante uniformidad revelan un papel favorable de la aféresis en escenarios específicos en CU. El GETECCU elaboró un documento de consenso con las recomendaciones para el uso de la granulocitoaféresis en el año 200618, posteriormente actualizado19. Así mismo, otras publicaciones han tratado de posicionar la aféresis en el tratamiento de la EII20–22.
Colitis ulcerosaAunque aún se necesitan estudios clínicos de calidad, 3 recientes revisiones sistemáticas y metaanálisis de ensayos controlados confirman el beneficio que la aféresis puede aportar en CU respecto al tratamiento convencional con esteroides en términos de efectos adversos y de eficacia clínica23–25. El metaanálisis de Habermalz y Sauerland23 revela un efecto beneficioso respecto a la continuación o intensificación del tratamiento corticoideo en cuanto a remisión a 12 semanas (NNT=5) y en cuanto al porcentaje de pacientes libres de esteroides a 12 y 24 semanas (RR=3,74; IC 95% 1,94-7,22).
Colitis ulcerosa dependiente de corticoidesEstas revisiones sistemáticas y algunos ensayos controlados abiertos26,27 ponen de relevancia que una de las principales propiedades de la aféresis es el efecto ahorrador de corticoides. Frente al tratamiento esteroideo convencional la asociación de aféresis a los esteroides permite inducir la remisión con menores dosis de los mismos, limitando por tanto sus efectos adversos. Por este motivo la dependencia de corticoides es el escenario donde la aféresis parece más válida y su tasa de respuesta global es de alrededor del 70%, aunque los estudios son difíciles de comparar por su heterogeneidad24,28–34. En aquellos en que la retirada completa de corticoides se incluye en la definición de remisión clínica,esta se sitúa en el 37-60%32-34. Los registros poscomercialización presentan potenciales sesgos; pero por otra parte, permiten recoger una amplia cohorte de pacientes tratados de forma uniforme en condiciones de práctica clínica. Este es el caso del reciente registro nacional (SiMAC) donde se incluyeron 142 pacientes con CU dependiente de corticoides tratados con aféresis leucocitaria, mostrando una tasa de mejoría inicial del 68%, con un 37% de remisión clínica completa al mes de la última sesión. En el seguimiento a largo plazo el 41% del total de la cohorte tratada a los 6 meses y el 36% al año mantuvieron la remisión clínica libre de corticoides35. El GETECCU ha promovido un estudio controlado multicéntrico internacional, actualmente en desarrollo, que ayudará a evaluar el papel de la aféresis en este escenario.
Panés et al.36 realizaron, mediante un modelo de decisión, un estudio de costes con la incorporación de la aféresis en el manejo de la CU de moderada a grave. Este estudio posiciona la aféresis como una opción coste-efectiva en los pacientes dependientes de corticoides, pudiendo evitar tratamientos de segunda y tercera línea en un 18,5% de pacientes y cirugía en un 4%.
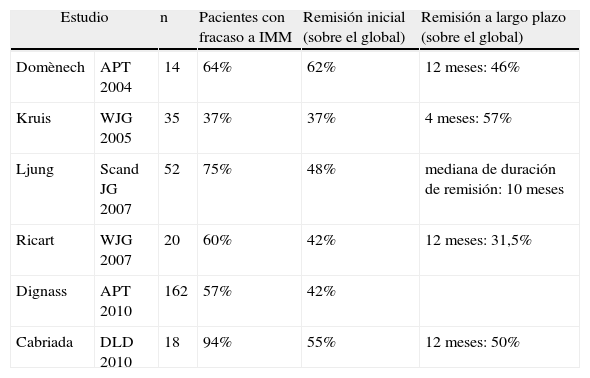
A diferencia de las series japonesas, en las europeas el mayor colectivo de pacientes dependientes de corticoides tratados con aféresis lo constituyen aquellos con fracaso del tratamiento con azatioprina (y en algunos casos con infliximab) (tabla 2). Al menos un tercio de este tipo de pacientes de difícil control, pueden ser rescatados con aféresis (normalmente manteniendo el tratamiento inmunomodulador previo) pudiendo así constituir una alternativa al tratamiento biológico cuando este ha fracasado o ante situaciones donde presenta mayor riesgo de complicaciones, evitando o retrasando, de esta manera, la cirugía.
Aféresis leucocitaria en la colitis ulcerosa tras fracaso de inmunomoduladores: estudios prospectivos europeos
| Estudio | n | Pacientes con fracaso a IMM | Remisión inicial (sobre el global) | Remisión a largo plazo (sobre el global) | |
| Domènech | APT 2004 | 14 | 64% | 62% | 12 meses: 46% |
| Kruis | WJG 2005 | 35 | 37% | 37% | 4 meses: 57% |
| Ljung | Scand JG 2007 | 52 | 75% | 48% | mediana de duración de remisión: 10 meses |
| Ricart | WJG 2007 | 20 | 60% | 42% | 12 meses: 31,5% |
| Dignass | APT 2010 | 162 | 57% | 42% | |
| Cabriada | DLD 2010 | 18 | 94% | 55% | 12 meses: 50% |
IMM: inmunomoduladores.
En función de su efecto de ahorro de esteroides otro posible escenario, poco estudiado, para el empleo de aféresis, son los pacientes dependendientes de corticoides que inician tratamiento con tiopurínicos durante el periodo de latencia hasta que estos inician su acción22. En el registro nacional, 38 casos siguieron este esquema de tratamiento mostrando tasas de remisión inicial de 32% y a los 6 y 12 meses de 42 y 45%, respectivamente37. Si bien la tasa de remisión a los 6 meses es ligeramente inferior a la descrita con azatioprina en la dependencia de corticoides5, la aféresis pudiera limitar la readministración de corticoides en este periodo de latencia; pero hoy día no disponemos de datos que indiquen en qué caso este tratamiento «puente» puede estar más indicado y si su empleo pudiera incrementar la remisión a largo plazo de la azatioprina.
Colitis ulcerosa resistente a los corticoidesSon menores en número los estudios que han evaluado la eficacia de la aféresis en pacientes resistentes a los corticoides. Aunque con las limitaciones mencionadas, sobre todo en lo referente a la definición de «resistencia a los corticoides», la tasa de remisión clínica está en torno al 45%, y la de repuesta global al 69%38. En general, los resultados son peores que en la dependencia de corticoides28–31,39 y pueden depender del tipo de pacientes tratados; así, en series europeas, un importante porcentaje de pacientes tratados con aféresis por resistencia a los corticoides son también resistentes a azatioprina, ciclosporina e incluso infliximab31,40.
Los datos procedentes del registro español corroboran los de algunos otros estudios28,31 en el sentido de objetivar escasa eficacia en obtener la remisión clínica en caso de actividad grave, probablemente por tratarse de situaciones donde es necesario lograr una remisión completa mediante tratamientos de acción rápida,cosa que no sucede con la aféresis. Estudios japoneses han comparado en CU leve-moderada un «tratamiento intensivo» con 2-3 sesiones semanales las primeras semanas frente a la pauta convencional de una sesión semanal. La pauta intensiva se mostró segura, con una eficacia igual o mayor y una mayor rapidez de acción41,42. El empleo de estas pautas más intensivas, o la combinación de la aféresis con ciclosporina o antifactor de necrosis tumoral (anti-TNF) en caso de actividad grave pudiera ser una posibilidad, pero este aspecto no está suficientemente evaluado.
En resumen, una proporción de pacientes con CU resistente a los corticoides, incluso tras fracaso o contraindicación a IMM y biológicos, pueden beneficiarse de la aféresis y evitar la cirugía; no obstante, su eficacia parece muy limitada en presencia de actividad grave.
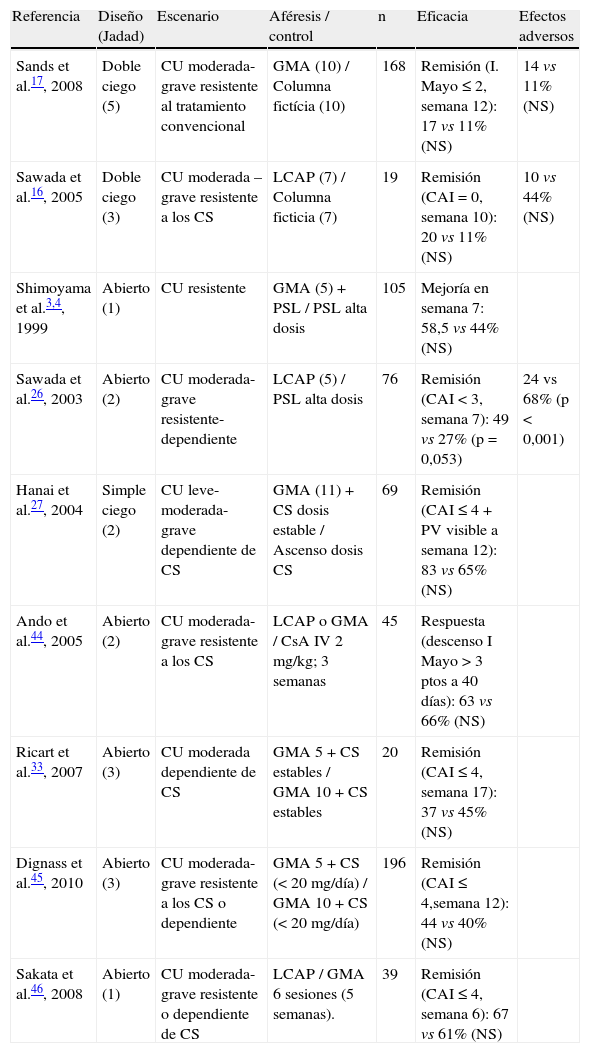
La tabla 3 recoge los ensayos controlados publicados en estos escenarios de dependencia y resistencia a los corticoides43–45.
Estudios controlados publicados que evalúan la aféresis leucocitaria en colitis ulcerosa resistente o dependiente de corticoides
| Referencia | Diseño (Jadad) | Escenario | Aféresis / control | n | Eficacia | Efectos adversos |
| Sands et al.17, 2008 | Doble ciego (5) | CU moderada-grave resistente al tratamiento convencional | GMA (10) / Columna fictícia (10) | 168 | Remisión (I. Mayo ≤ 2, semana 12): 17 vs 11% (NS) | 14 vs 11% (NS) |
| Sawada et al.16, 2005 | Doble ciego (3) | CU moderada –grave resistente a los CS | LCAP (7) / Columna ficticia (7) | 19 | Remisión (CAI=0, semana 10): 20 vs 11% (NS) | 10 vs 44% (NS) |
| Shimoyama et al.3,4, 1999 | Abierto (1) | CU resistente | GMA (5) + PSL / PSL alta dosis | 105 | Mejoría en semana 7: 58,5 vs 44% (NS) | |
| Sawada et al.26, 2003 | Abierto (2) | CU moderada-grave resistente- dependiente | LCAP (5) / PSL alta dosis | 76 | Remisión (CAI<3, semana 7): 49 vs 27% (p=0,053) | 24 vs 68% (p<0,001) |
| Hanai et al.27, 2004 | Simple ciego (2) | CU leve-moderada-grave dependiente de CS | GMA (11) + CS dosis estable / Ascenso dosis CS | 69 | Remisión (CAI ≤ 4 + PV visible a semana 12): 83 vs 65% (NS) | |
| Ando et al.44, 2005 | Abierto (2) | CU moderada-grave resistente a los CS | LCAP o GMA / CsA IV 2 mg/kg; 3 semanas | 45 | Respuesta (descenso I Mayo>3 ptos a 40 días): 63 vs 66% (NS) | |
| Ricart et al.33, 2007 | Abierto (3) | CU moderada dependiente de CS | GMA 5 + CS estables / GMA 10 + CS estables | 20 | Remisión (CAI ≤ 4, semana 17): 37 vs 45% (NS) | |
| Dignass et al.45, 2010 | Abierto (3) | CU moderada-grave resistente a los CS o dependiente | GMA 5 + CS (< 20 mg/día) / GMA 10 + CS (< 20 mg/día) | 196 | Remisión (CAI ≤ 4,semana 12): 44 vs 40% (NS) | |
| Sakata et al.46, 2008 | Abierto (1) | CU moderada-grave resistente o dependiente de CS | LCAP / GMA 6 sesiones (5 semanas). | 39 | Remisión (CAI ≤ 4, semana 6): 67 vs 61% (NS) |
CAI: Clinical Activity Index o índice de Rachmilewitz; CS: corticoides; CsA: ciclosporina A; CU: colitis ulcerosa; GMA: granulocito/monocito aféresis-Adacolumn®; I. Mayo: Índice de la Clínica Mayo. LCAP: leucocitaféresis-Cellsorba®; PSL: prednisolona; PV: patrón vascular.
Normalmente la aféresis se asocia a corticoides y su eficacia inicial así debe interpretarse. No obstante, también se ha empleado sin corticoides asociados (pacientes libres de corticoides). Dos estudios controlados abiertos del mismo grupo italiano, encuentran como en CU activa no dependiente de ni resistente a corticoides, la granulocitoaféresis (GMA) puede ser tan eficaz como los corticoides sistémicos en inducir remisión a 5 semanas e incluso en mantenerla al año, con menor tasa de efectos secundarios46,47. Yamamoto et al.48 utilizaron 5 sesiones de GMA como tratamiento de primera línea, no asociado a corticoides, en 30 casos de CU distal leve-moderada, refiriendo una tasa de remisión clínica del 70%. Los esquemas de tratamiento corticoideo (dosis y tiempo) establecidos en nuestro medio49 junto al coste económico hacen que, a diferencia de Japón, la aféresis no se haya consolidado como una alternativa a los corticoides sistémicos para tratar los brotes de actividad50, pero pudiera constituir un tratamiento de primera línea en casos seleccionados donde el empleo de corticoides esté contraindicado o se deban evitar sus efectos secundarios, aspectos de especial interés en pediatría.
En algunos estudios japoneses, con un número limitado de pacientes, se ha utilizado la aféresis para inducir remisión en el primer brote de actividad de la enfermedad (esteroides naive), con porcentajes de remisión de alrededor del 80%51. Esta situación de enfermedad poco evolucionada es en la que la aféresis presenta mejores resultados con cifras de remisión superiores a los casos resistentes o dependientes de corticoides52,53.
Duración de la respuesta. Resultados a largo plazoLa duración media de la remisión clínica obtenida con la aféresis se sitúa en torno a 10 meses31. Dos factores han confirmado ser importantes en este sentido:
- 1.
El primero es la obtención de remisión completa inicial, siendo el periodo libre de recidiva significativamente mayor en este caso que en caso de lograr solo una respuesta parcial inicial. Es preciso considerar en este sentido que una cierta proporción de pacientes que inicialmente solo presentan una respuesta parcial, alcanzan la remisión tardía, a los 3-6 meses, sin otras medidas asociadas30,35. En los distintos estudios la eficacia de la aféresis se ha evaluado entre una semana y un mes tras la última sesión; pero la aféresis actúa de forma lenta al menos con las pautas convencionales de una sesión semanal y diversos mecanismos involucrados en ella, como la disminución en la expresión de los receptores de chemocinas o el incremento de linfocitos CD4+, se han confirmado varias semanas después de aplicar el tratamiento.
- 2.
El segundo factor es la obtención de cicatrización mucosa. En un estudio de Yamamoto et al.54 sobre 124 pacientes con CU moderada-grave tratados con GMA, la remisión clínica se obtuvo en el 45% y esta se mantuvo, tras un seguimiento medio de 22 meses, de forma significativamente superior en los pacientes que presentaron cicatrización endoscópica a la semana de la última aféresis que en los que no la presentaron (80 vs 41%; p=0,0005).
Algunos autores han planteado la necesidad de realizar aféresis de mantenimiento en los pacientes respondedores, generalmente con una sesión al mes. A este respecto los estudios existentes son limitados y con resultados discordantes55,56. Tres estudios prospectivos en nuestro medio indican que el 75% de los pacientes dependientes de corticoides con remisión clínica inicial tras 5 o 10 sesiones de GMA se mantienen en remisión libre de corticoides a los 12 meses sin nuevas sesiones de aféresis ni otros tratamientos adicionales32–34. Por tanto, no parece necesario el tratamiento de mantenimiento de forma generalizada. Los pacientes que obtienen remisión y recidivan antes de 6 meses pudieran beneficiarse de ello; pero el subgrupo de pacientes respondedores candidatos a mantenimiento está aún por definir. En un estudio controlado, abierto, se ha descrito la eficacia preventiva de la GMA en pacientes con CU inactiva con alto riesgo de recidiva, riesgo establecido por presentar valores de calprotectina fecal elevados más de cinco veces su valor normal (> 250μg/g)57. Recientemente también se han comunicado los buenos resultados de los retratamientos con aféresis de forma episódica en pacientes seleccionados con remisión inicial a esta terapéutica58. El empleo de mantenimiento o de retratamientos siempre debiera individualizarse en función de la historia previa de cada paciente y las opciones terapéuticas que le resten.
Factores predictivos de eficaciaEn la tabla 4 se recogen diversos factores descritos en algunos estudios39,53,59,60, como predictivos de una mejor respuesta a la aféresis en CU. Ya se ha referido la importancia de la remisión inicial completa y la cicatrización mucosa en la duración de la respuesta.
Factores descritos de respuesta favorable a la aféresis leucocitaria en colitis ulcerosa
| • Dependencia de corticoides (mayor eficacia que en resistencia a los corticoides) |
| • Actividad leve o moderada. Ausencia de úlceras profundas |
| • Respuesta rápida (3 sesiones) |
| • Menor dosis acumulativa de corticoides. Esteroides naïve |
| • Mayor nivel de PCR (controvertido) |
| • Duración de las sesiones 90 min (controvertido) |
| • Tratamiento «intensivo», con más de una sesión semanal |
| • Número de sesiones de aféresis (controvertido) |
| • Fracción de la volemia procesada |
La valoración endoscópica puede ser determinante para decidir utilizar esta opción terapéutica. La existencia de una importante lesión tisular y de úlceras profundas constituye un factor de mala respuesta, hasta el punto de que, en su presencia, hay autores que no recomiendan su empleo29,55,61. Directamente relacionada con el grado de lesión mucosa, la presencia de una actividad clínica grave condiciona pobres resultados.
Algunos estudios indican que la respuesta clínica puede predecirse tras las primeras 3 sesiones de aféresis. En concordancia con ello, el descenso de PCR tras 3 sesiones se asocia a una mayor probabilidad de respuesta inicial y puede ser un parámetro útil en la toma de decisiones, especialmente en situaciones donde sea preciso una actuación rápida35,49.
Respecto al número de sesiones, 2 estudios controlados abiertos no encuentran diferencias de eficacia entre el empleo de 5 o de 10 sesiones33,45. No obstante, Hanai et al.52 describen cómo la remisión se incrementa del 40% con 5 sesiones al 80% con 10 sesiones en una serie de pacientes resistentes a corticoides.
Las sesiones de aféresis depuran un volumen sanguíneo prefijado, así, en el caso de GMA con Adacolumn®, con la pauta estándar, se filtran 1.800ml por sesión, lo que supone una fracción del volumen sanguíneo circulante variable de unos pacientes a otros en función de su peso, talla y sexo. Establecer la fracción de la volemia a tratar y calcular un tiempo de duración de las sesiones individualizado en función de las características antropométricas de cada paciente pudiera permitir un tratamiento más uniforme y optimizar los resultados de la aféresis61. En este sentido se ha comunicado alguna experiencia con GMA en la que la tasa de remisión ha sido numéricamente superior (88% vs 60%) procesando el volumen sanguíneo por sesión en función del peso del paciente (60ml/kg), en lugar de los convencionales 1.800ml/sesión, sin que esto haya repercutido sobre la seguridad del procedimiento62.
Enfermedad de CrohnEn la enfermedad de Crohn (EC) disponemos de menos datos y los resultados de la aféresis parecen ser inferiores que en la CU31 Los estudios al respecto son en su mayoría retrospectivos, con pocos pacientes o muy heterogéneos32,63–65. Normalmente se ha recurrido a la aféresis tras el fracaso de todas las opciones terapéuticas disponibles. En el estudio de Domènech et al.32 se incluyeron prospectivamente pacientes con EC dependiente de corticoides que se trataron con dosis plenas de prednisona y 5 sesiones de aféresis, obteniéndose una tasa de remisión inicial libre de corticoides del 70%, similar a la de los pacientes con CU; pero a diferencia de ellos, solo un paciente de 10 se mantuvo en remisión a los 12 meses. La duración de la respuesta en EC parece ser inferior que en CU31,32,65. Recientemente se ha descrito una remisión a 12 meses del 40% en 30 casos de EC resistente a 8 semanas de corticoides, pero que no cumplían criterios de dependencia de corticoides ni habían recibido tratamiento inmunomodulador o biológico previo66.
En el único estudio controlado en EC, se empleó la linfocitoaféresis mediante centrifugación y en él se incluyeron 28 pacientes en remisión tras tratamiento corticoideo que fueron aleatorizados para seguir la pauta de descenso habitual de la dosis de corticoides con o sin tratamiento complementario con 9 sesiones de linfocitoaféresis. La linfocitoaféresis mostró una tendencia favorable en disminuir el desarrollo de dependencia de corticoides, pero no fue eficaz en cuanto a la prevención de la recidiva a los 18 meses67
Seguridad de la aféresis leucocitariaEfectos adversosLa experiencia acumulada muestra como la aféresis es un procedimiento seguro. Los efectos adversos se describen en 1 a 27% de los pacientes y son generalmente leves y transitorios: cefalea, sensación de fatiga, mialgias, mareo, enrojecimiento facial, palpitaciones, hipotensión, febrícula. Menos frecuentemente se han reseñado: ansiedad, molestias torácicas inespecíficas, dolor abdominal, náuseas o vómitos20. La cefalea es el efecto adverso mejor documentado. Si se presenta, resulta útil la administración de 500-1.000mg de paracetamol antes de iniciar cada procedimiento, al igual que cuando se asocia a mialgias o sensación de fatiga. La frecuencia de efectos moderados que precisan tratamiento o llevan a interrumpir las sesiones es del 1,6%68. Los efectos adversos más graves descritos (embolia, neumotórax, sepsis) se han relacionado principalmente con la necesidad de recurrir a una vía central31,32,69. Algunos efectos adversos descritos se han debido a la utilización del anticoagulante mesilato de nafamostat, que no se emplea en nuestro medio70.
Los efectos adversos del tratamiento convencional con corticoides son más frecuentes e importantes como se ha constatado en estudios que los comparan27,47. Este aspecto, junto con su capacidad para reducir las necesidades de esteroides, ha contribuido a considerar a la aféresis como un procedimiento seguro y eficaz en pediatría71,72. En el embarazo se ha utilizado de forma eficaz y segura en casos aislados, pero los datos disponibles son muy limitados73.
ToleranciaEl procedimiento es bien tolerado y cuando no se completan las sesiones previstas, suele ser más por falta de eficacia que por intolerancia. Probablemente la principal limitación sean los problemas de aplicabilidad condicionados por la falta de accesos venosos periféricos adecuados, especialmente en pacientes de edad avanzada o con fragilidad vascular, muchas veces favorecida por el empleo de corticoides durante largo tiempo11. Si no fuera posible el acceso venoso periférico, se puede recurrir a una vía central teniendo en cuenta los riesgos que puede implicar su permanencia durante el tiempo necesario para completar las sesiones.
ContraindicacionesLas contraindicaciones son muy escasas y generalmente comunes a todos los procedimientos de aféresis. La historia de alergia a la heparina y la trombocitopenia dependiente de heparina constituyen una contraindicación formal. No debiera utilizarse en caso de leucopenia (< 2.000/mm3) ni de anemia grave (Hb<8 g/dl) sin haber remontado la misma, ni en condiciones de infección activa o enfermedad cardiaca o renal grave. Deben tenerse en cuenta las situaciones de hipercoagulabilidad (fibrinógeno mayor de 700mg/ml) o deshidratación que se deben corregir convenientemente. Es aconsejable la ingesta abundante de agua durante el periodo de tratamiento74.
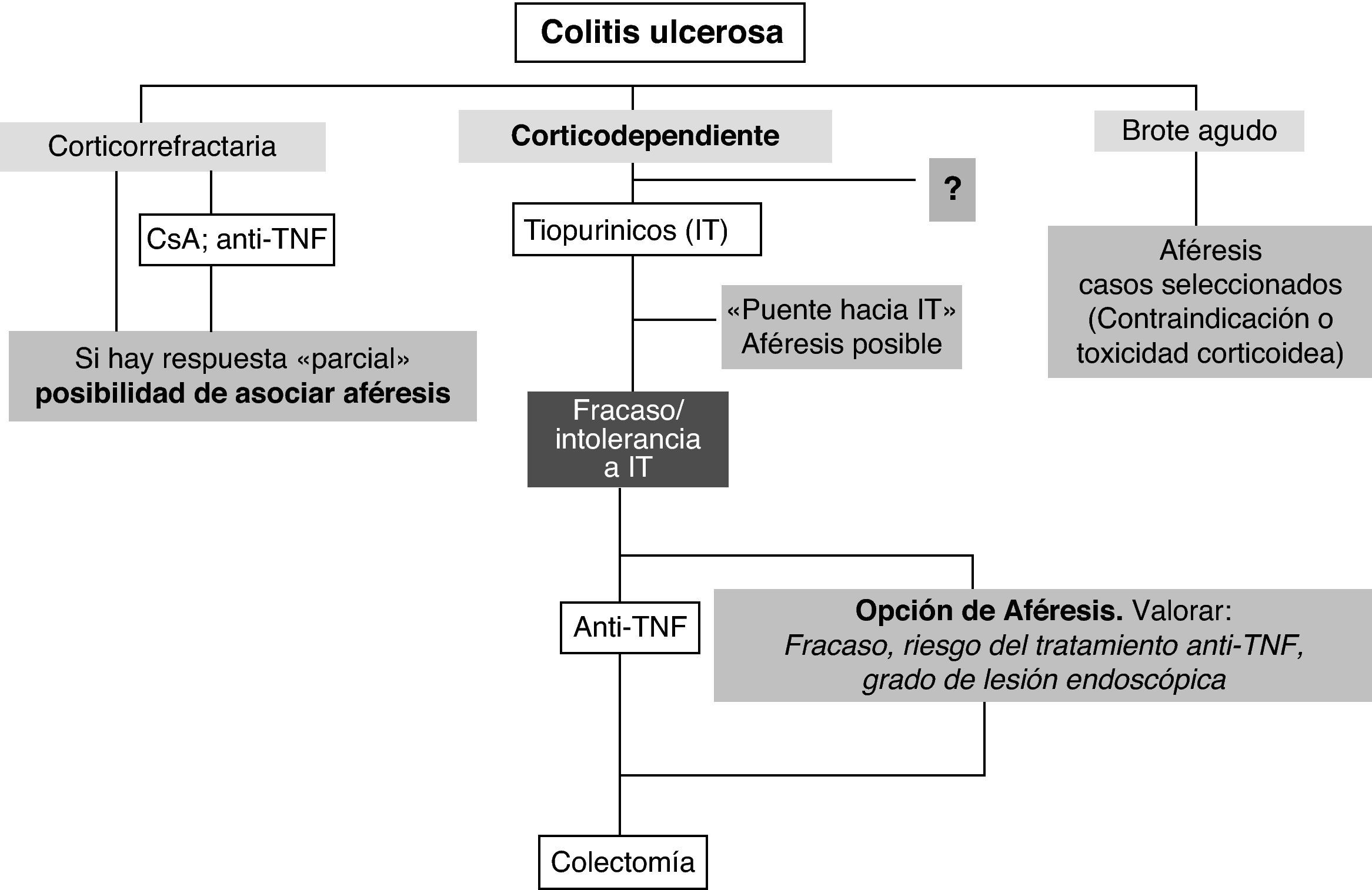
ConclusionesCon las limitaciones mencionadas, la aféresis puede constituir una opción válida en el tratamiento de la CU en pacientes seleccionados. El efecto ahorrador de esteroides probablemente sea su característica más consistente, por lo que la dependencia de corticoides, especialmente tras fracaso o intolerancia a fármacos inmunosupresores, constituye el principal escenario para su empleo. También puede constituir una alternativa previa a la cirugía en situaciones de resistencia a los corticoides con actividad de leve a moderada. El otro punto fuerte lo constituye su perfil de seguridad frente a corticoides, inmunomoduladores y biológicos por lo que puede ser una opción válida ante problemas con estos tratamientos o si existen comorbilidades que supongan un riesgo para su empleo (principalmente de tipo infeccioso o neoplásico). Otros escenarios posibles para la aféresis (puente al inicio de inmunomoduladores, adyuvante a otros tratamientos, mantenimiento mensual, enfermedad de Crohn, etc.) necesitan aún mayor confirmación. Con estos condicionantes, un posible posicionamiento de la aféresis en la CU se recoge en la figura 1.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.