INTRODUCCION
La alergia e intolerancia alimentaria representan un importante problema sanitario al que se dedican importantes cantidades de dinero, tiempo y esfuerzo de los profesionales de la salud. En muchos casos, aunque los mecanismos fisiopatológicos subyacentes a las reacciones alérgica y de intolerancia alimentaria son completamente diferentes, las manifestaciones clínicas pueden ser indistinguibles. Si a esto le añadimos la carencia de pruebas diagnósticas definitivas, el diagnóstico de la alergia alimentaria en muchos casos se convierte en un reto diagnóstico difícil de superar.
El denominador común de los procesos de alergia alimentaria es la existencia de una predisposición genética, una barrera gastrointestinal alterada y una mala regulación de las respuestas inmunológicas frente a los epítopes alimentarios implicados. Gracias al empleo de tecnologías y métodos cada vez más sofisticados de experimentación animal y clínica, en los últimos años nuestro entendimiento de las bases moleculares y genéticas de las reacciones alérgicas se ha multiplicado y el progreso en el conocimiento de la biología de los mastocitos y de la regulación de la síntesis de IgE ha sido sustancial. Pese a ello, se desconocen los mecanismos últimos causantes de las manifestaciones clínicas de los pacientes.
Debido al incremento casi epidémico en la prevalencia y morbilidad mundial de la alergia alimentaria y otras enfermedades alérgicas, el compromiso de identificar y desarrollar estrategias efectivas para prevenir y tratar estas enfermedades es cada vez más necesario. En el presente artículo se revisa la patogenia de las reacciones de hipersensibilidad inmediata a alimentos y sus repercusiones clínicas y se delinean las perspectivas futuras en el tratamiento y prevención de las enfermedades alérgicas gastrointestinales.
DEFINICIONES Y PREVALENCIA
La alergia alimentaria es percibida por la población general como un problema frecuente de salud y a veces grave1. El sentimiento de frecuencia queda claramente reflejado en los resultados de tres estudios epidemiológicos recientes que demuestran que entre el 20 y el 45% de la población adulta refiere haber experimentado en algún momento alguna reacción adversa a alimentos, que en muchos casos consideran de naturaleza «alérgica»2-4. Que la alergia alimentaria es un problema grave de salud está avalado por el hecho de que las reacciones anafilácticas a alimentos pueden tener consecuencias fatales y han experimentado en la última década un crecimiento progresivo5,6.
La prevalencia real de la alergia alimentaria se desconoce, aunque se ha estimado que alrededor del 2-8% de la población infantil y el 1-3% en la población adulta la padecen4,7-10. Dos circunstancias fundamentales explican la divergencia entre las cifras de prevalencia percibida y prevalencia real. En primer lugar, a pesar de los esfuerzos académicos por establecer una terminología normalizada7,8, el desconocimiento de los mecanismos básicos implicados en la patogenia de las reacciones alérgicas ha llevado en numerosas ocasiones en la literatura al empleo inadecuado de términos como intolerancia, hipersensibilidad o anafilaxia para describir diferentes reacciones adversas alimentarias. En segundo lugar, el diagnóstico de la alergia alimentaria se basa en la combinación de datos de laboratorio y clínicos. Estos datos son con frecuencia inespecíficos y su interpretación está cargada de subjetividad, hechos que pueden conducir a asunciones erróneas acerca de la patogenia de una determinada reacción adversa. Más aún, la prueba de provocación a doble ciego controlada con placebo, que es considerada como el estándar de referencia para el diagnóstico de alergia alimentaria11, si es positiva, no asegura la naturaleza inmunológica de una reacción12. En este sentido, el diagnóstico de la alergia alimentaria permanece como una de las empresas más complicadas de la medicina moderna.
Para obviar la confusión terminológica parece prioritario definir los conceptos que se van a manejar en esta revisión. Así, tomando como referencia las definiciones establecidas por las Academias Europea y Americana de Alergia e Inmunología Clínica7,8, debemos dividir las reacciones adversas alimentarias en reacciones tóxicas y no tóxicas. Las reacciones tóxicas dependen de la contaminación de los alimentos por productos nocivos y siempre son dosis-dependiente. Las reacciones no tóxicas dependen de la susceptibilidad del individuo y a menudo son dosis-independiente. Incluidas en las reacciones no tóxicas podemos distinguir la intolerancia y la alergia alimentaria. Debemos entender por intolerancia alimentaria toda reacción adversa producida por la ingestión de un alimento específico y mediada por mecanismos no inmunológicos. Estas reacciones se relacionan con deficiencias enzimáticas y con propiedades farmacológicas de sustancias vasoactivas contenidas en determinados alimentos. En otros casos no son producidas por las propiedades fisiológicas ni farmacológicas del alimento (reacciones idiosincrásicas) o se relacionan con alteraciones psicológicas (aversión alimentaria) (tabla I).
La alergia alimentaria se puede definir como toda reacción adversa resultante de la ingestión de un componente aditivo alimentario específico y que esté mediada por mecanismos inmunológicos.
PATOGENIA DE LAS REACCIONES ALÉRGICAS ALIMENTARIAS
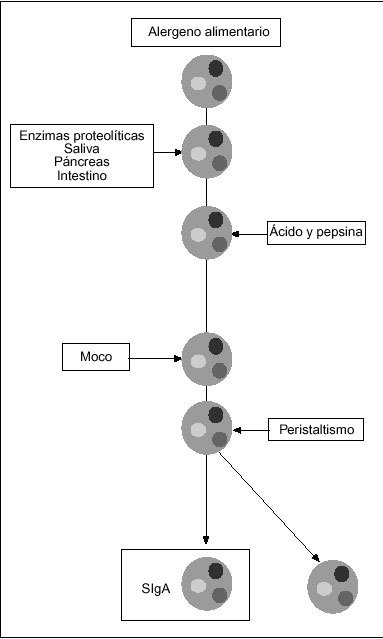
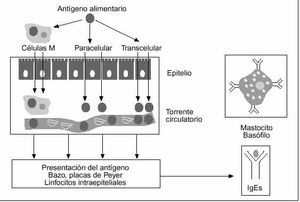
La superficie intestinal está continuamente en contacto con una enorme cantidad y variedad de macromoléculas derivadas de virus, bacterias y de las 100 toneladas de alimentos que ingerimos a lo largo de nuestra vida13. Por sus características fisicoquímicas (tabla II), la mayoría de estas macromoléculas se pueden convertir en antígenos alimentarios si alcanzan intactas el sistema inmunológico. Sin embargo, sólo una mínima proporción de estas proteínas alimentarias, apenas un 2% de la dosis ingerida, atraviesa en estado nativo la barrera epitelial y finalmente se convierte en antígenos circulantes14,15. Esto es debido a la existencia de una barrera protectora que contribuye a re ducir la carga de antígenos procesables. Esta barrera está formada por factores inespecíficos y por otros específicos, es decir, sometidos a control inmunológico (fig. 1)16,23. Así, además de las enzimas digestivas, que son extraordinariamente eficaces en el proceso de degradación de las proteínas alimentarias a di y tripéptidos sin capacidad inmunógena, el intestino del adulto recibe cada día más IgA secretora (40 mg/kg) que la producción corporal total de IgG (30 mg/kg)16,17.
Fig. 1. Mecanismos que integran la barrera gastrointestinal para limitar la absorción de antígenos alimentarios. SIgA: inmunoglobulina A de tipo secretor.
Además, para proteger la superficie intestinal del continuo bombardeo antigénico, el sistema inmune entérico y, en concreto, la lámina propia del intestino dispone del 80% de las células productoras de inmunoglobulinas, de tantos linfocitos como el bazo y de un complemento único de mastocitos24,25.
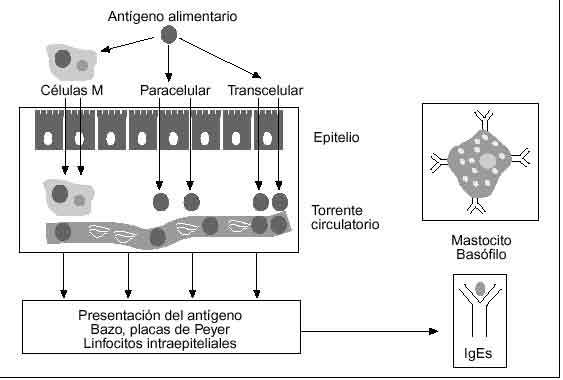
La integridad de estos factores es necesaria para evitar el paso excesivo de antígenos al torrente circulatorio. En pacientes con predisposición genética, en situaciones patológicas (p. ej., inflamación de la mucosa gastrointestinal), en pacientes con déficit de IgA y cuando los mecanismos defensivos son inmaduros, la barrera protectora puede ser sobrepasada. De esta manera, el exceso antigénico puede alcanzar el sistema inmune, tras rebasar el epitelio a través de las uniones intercelulares estrechas (ruta paracelular), atravesando las células epiteliales mediante endocitosis (ruta transcelular) o siendo transportados por las células M situadas sobre las placas de Peyer18-23. Estudios muy recientes sugieren que el transporte transepitelial de antígenos alimentarios en animales sensibilizados es un proceso muy complejo que al menos se compone de 2 fases bien diferenciadas26,27. Una primera fase, detectable 2 min después de la exposición antigénica, en la que se produce la endocitosis del antígeno en la célula epitelial intestinal y su posterior transporte a la lámina propia subyacente y que es independiente de los mastocitos intestinales y, una segunda fase, dependiente de la activación de los mastocitos, en la que el paso transepitelial y paracelular de antígenos se multiplica y que es aparente 30 min después de la exposición antigénica27.
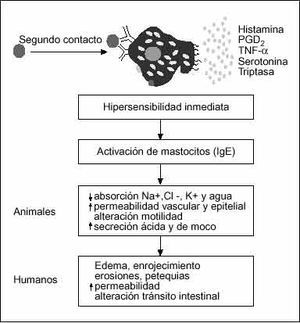
Una vez rebasado el epitelio, se produce la presentación del antígeno, la secreción de inmunoglobulinas específicas y la sensibilización de los mastocitos y basófilos frente a esas proteínas por la unión de la IgE específica con el receptor de alta afinidad (Fc*RI) situado en la superficie de estas células28. Un segundo contacto con el mismo alergeno puede desencadenar una reacción inmunológica local o sistémica, dirigida a la eliminación del factor agresor (fig. 2). Pero el papel de la IgE específica parece mucho más complejo, ya que a través de la activación del receptor de baja afinidad (Fc*RII/CD23) puede inducir reacciones de citotoxicidad, facilitar la captura del antígeno, aumentar la eficacia de la presentación del mismo y modificar el patrón de secreción de citocinas29.
Fig. 2. Representación esquemática del proceso de sensibilización de los mastocitos intestinales. Una vez rebasada la barrera protectora del tracto gastrointestinal, el antígeno alimentario accede al sistema inmunológico intestinal y sistémico, produciéndose la generación de inmunoglobulinas específicas contra el antígeno implicado. Estas inmunoglobulinas, unidas a los receptores de superficie del mastocito, actúan como mecanismos de alerta inmunológica. Si se produce un segundo contacto con el mismo epítope, se puede desencadenar una reacción inmunológica en menos de 30 min. Ig: inmunoglobulina.
Sin embargo, a pesar del paso de antígenos alimentarios al torrente circulatorio, sólo una mínima cantidad de los mismos es capaz de desencadenar reacciones de hipersensibilidad. Esto es debido a la existencia de un estado inmunológico de hiporrespuesta frente a la mayoría de sustancias extrañas conocido como tolerancia30. El desarrollo de tolerancia inmunológica es un fenómeno complejo y multifactorial que depende de una predisposición genética moldeada por la intervención de numerosos factores ambientales, no bien conocidos. Aunque estudios realizados en ratones sugieren que la tolerancia es un fenómeno connatal en el que están involucradas las células presentadoras de antígeno del sistema reticuloendotelial y los linfocitos T supresores (CD8+)31, la causa última de este proceso de selección se desconoce.
Los mastocitos, residentes habituales del tracto gastrointestinal normal, desarrollan un papel clave en las reacciones alérgicas32. Tanto en humanos como en roedores, la población mastocitaria es heterogénea en sus propiedades tintoriales histoquímicas, en el contenido de mediadores y en la sensibilidad a agentes farmacológicos33-35. Así, de acuerdo al contenido citoplasmático de proteasas neutras, se pueden distinguir dos subpoblaciones mastocitarias36,37. Una, localizada en la mucosa del tracto respiratorio y gastrointestinal, contiene sólo triptasa mientras que la otra, presente en la submucosa de la piel e intestino delgado, contiene triptasa, quimasa, catepsina G y carboxipeptidasa32,36-38.
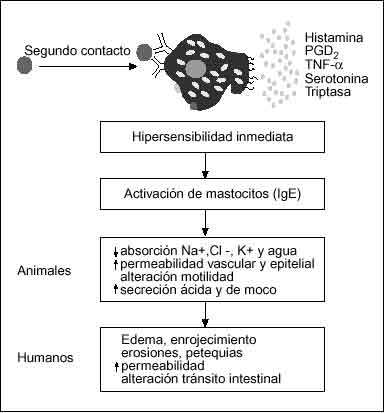
La mayoría de las alergias alimentarias son reacciones de hipersensibilidad inmediata, mediadas por el entrecruzamiento de la IgE específica en las células sensibilizadas con epítopes comunes del alergeno alimentario9,10,19. Este entrecruzamiento activa el mastocito y basófilo, desencadenando una cascada bioquímica que conduce a la liberación de su contenido granular (fig. 3).
Numerosos estudios experimentales en diferentes especies animales han establecido claramente que los mediadores mastocitarios son capaces de inducir cambios marcados en la ultraestructura y en la función epitelial y motora del tracto gastrointestinal19,39,40. En particular, en modelos animales de hipersensibilidad inmediata, la exposición antigénica induce una reducción de la absorción intestinal de agua y electrólitos41-43, un incremento de la permeabilidad epitelial y vascular intestinal19,44-46 y una alteración generalizada del patrón motor gastrointestinal19,47,48. Estos efectos son mediados en parte por la acción directa de los mediadores mastocitarios sobre las células musculares y epiteliales y en parte por activación indirecta del sistema nervioso entérico o de otras células inmunes intermediarias19,39,49.
Estudios correlativos en humanos indican que la exposición a antígenos alimentarios en sujetos sensibilizados produce cambios macroscópicos y funcionales de la mucosa gastroduodenal y colónica incluyendo edema, enrojecimiento, erosiones, hemorragias, engrosamiento de pliegues, aumento de la motilidad y de la permeabilidad a macromoléculas19,50,51. Estudios bioquímicos y morfológicos en pacientes alérgicos han demostrado que la exposición directa de la mucosa gastrointestinal a alergenos alimentarios produce una reducción en el número de mastocitos y de histamina asociados a los cambios macroscópicos52-58. Estudios realizados en nuestro laboratorio demuestran que la perfusión intestinal con antígenos alimentarios, en pacientes alérgicos, produce un aumento marcado y sostenido de la secreción de agua en el yeyuno, asociado a un incremento paralelo de la liberación de mediadores mastocitarios en la luz intestinal59. En su conjunto, estos estudios apoyan la idea de que los mastocitos, a través de la liberación de sus mediadores, desempeñan un papel clave en los cambios morfofuncionales asociados a las reacciones de hipersensibilidad inmediata frente a los alimentos en el tracto gastrointestinal y tal vez podrían explicar algunas de las manifestaciones clínicas de los pacientes con alergia alimentaria.
Sin embargo, algunos síndromes relacionados con la ingesta de alimentos no se pueden explicar por reacciones inmediatas por IgE. Así, las reacciones alérgicas se caracterizan por una respuesta bifásica. Después de la fase inicial, mediada por mastocitos y basófilos, a veces se desarrolla una fase tardía, entre 6-12 h después, caracterizada por infiltración por linfocitos T, granulocitos y células mononucleares y que también es mediada por IgE60,61. En contraste con la fase tardía en la piel o vías respiratorias, estudios recientes sugieren que en el estómago del ratón la infiltración celular es detectable 2 h después de la activación mastocitaria62. Además, evidencias recientes sugieren la participación de otros mecanismos inmunológicos en las reacciones alérgicas a alimentos. En concreto, se ha descrito la existencia de anticuerpos con propiedades anafilácticas diferentes de las mediadas por IgE. En su mayoría estos anticuerpos pertenecen al tipo IgG y en particular a la subclase IgG4. Estos anticuerpos se encuentran especialmente en pacientes con alergia alimentaria a la leche, donde las manifestaciones gastrointestinales o respiratorias pueden ser bifásicas, unas de inicio inmediato y otras tardío63. También se ha descrito la formación de complejos IgE/IgG y otros mecanismos inmunológicos en respuesta a la provocación antigénica con alimentos53,64, pero en la actualidad su papel fisiopatológico todavía no está bien definido.
MANIFESTACIONES CLINICAS DE LA ALERGIA ALIMENTARIA
La lista de alimentos que se han relacionado con reacciones adversas alimentarias es interminable. Sin embargo, la existencia de una base inmunológica en esas reacciones sólo se ha comprobado para un grupo reducido de alimentos: el huevo, la leche, los frutos secos, los pescados y el marisco, los cítricos y los cereales65.
Las manifestaciones clínicas de la alergia alimentaria son inespecíficas y a menudo de aparición inmediata (tabla III). Estas manifestaciones pueden afectar a la mayoría de órganos y sistemas de la economía19,66,67 y pueden presentarse de manera aguda o de manera sindrómica, dando lugar a cuadros clínicos crónicos o subagudos (tabla IV).
Los cuadros agudos generalmente son autolimitados. Así, el síndrome de la alergia oral, asociado a la ingesta de frutas frescas, vegetales y frutos secos se acaracteriza por la aparición de manifestaciones limitadas a la boca y orofaringe en forma de prurito e irritación oral, edema de lengua, labios, paladar y garganta68,69. Este síndrome afecta a niños con rinitis polínica, síntomas respiratorios severos y concentraciones elevadas de IgE total y específica frente al abedul y la ambrosía69. Otro cuadro agudo de reciente descripción, el síndrome látex-fruta, tiene manifestaciones clínicas similares70. En ambos casos existe una reactividad cruzada entre los alimentos implicados y alergenos polínicos o del látex, respectivamente. Sin embargo, a pesar de la naturaleza autolimitada de estos procesos agudos, conviene recordar que, en pacientes sensibilizados, la ingesta inadvertida de antígenos alimentarios o la realización de ejercicio físico tras la ingesta de ciertos alimentos como el apio, el trigo o el camarón puede desencadenar reacciones anafilácticas, potencialmente fatales71,72.
La absorción continuada y excesiva de antígenos alimentarios puede provocar cambios inflamatorios crónicos de la mucosa gastrointestinal y en algunos casos la aparición de síndromes de malabsorción. En la población infantil se han descrito síndromes de malabsorción en asociación con las proteínas de la leche de vaca, de la soja, del trigo, del arroz, del huevo y del pescado10. En estos casos, al igual que en la enfermedad celiaca, la etiopatogenia es compleja, aunque datos recientes sugieren un papel preponderante de los mecanismos celulares sobre los humorales73. La gastroenteritis eosinofílica con afectación predominante de la mucosa cursa como un síndrome de malabsorción. En esta entidad, la mitad de los pacientes tienen antecedentes atópicos y de alergia alimentaria74,75. Se ha sugerido que en la etiopatogenia de esta enfermedad desempeña un papel clave la activación IgE-dependiente de los eosinófilos por la exposición crónica a antígenos alimentarios75. Los eosinófilos pueden dañar el tracto gastrointestinal directamente mediante la liberación de mediadores tóxicos76 o indirectamente, potenciando la síntesis de leucotrienos77 o activando los mastocitos intestinales78, lo que, unido a un aumento basal de la permeabilidad intestinal, puede explicar alguno de los cambios clinicopatológicos asociados a esta entidad74.
La patogenia de la enfermedad del intestino irritable y de la enfermedad inflamatoria intestinal es muy compleja y desconocida. Algunos datos apuntan la posibilidad de que las manifestaciones clínicas de algunos de estos pacientes pudieran relacionarse con la existencia de fenómenos de alergia alimentaria. Así, en los últimos años se ha descrito la existencia de hiperplasia e hipersensibilidad mastocitaria en la mucosa intestinal de estos enfermos79-81, un incremento marcado de toxinas del eosinófilo en heces82, una mayor prevalencia de atopia83,84 y una respuesta clínica positiva a las dietas de exclusión alimentaria85-87 y a los fármacos estabilizadores del mastocito85,88,89. Todos estos hallazgos apoyan la participación de reacciones de alergia alimentaria en la patogenia de un subgrupo de pacientes de ambas entidades, aunque se desconocen los mecanismos últimos implicados.
En el lactante algunos cuadros específicos de enterocolitis y colitis parecen desencadenarse con la ingesta de leche de vaca o proteínas de la soja. Aunque los factores implicados son múltiples, algunos estudios sugieren la participación de la activación mastocitaria IgE dependiente en su patogenia en un 10-15% de los casos10,18,90.
En raras ocasiones se ha descrito la aparición de pancreatitis en relación con reacciones de hipersensibilidad alimentaria91,92.
Algunos cuadros clínicos extradigestivos parecen claramente relacionados con la ingesta de alimentos. Así, la hemosiderosis pulmonar del lactante (síndrome de Heiner) se caracteriza por la aparición de infiltrados pulmonares, hemosiderosis y anemia por pérdidas digestivas ocultas de sangre y se relaciona con la ingesta de leche, huevos y cerdo93. Aunque se desconoce su patogenia el cuadro mejora con la retirada de los alimentos implicados. La dermatitis atópica es una forma de eccema que predomina en la infancia y que se caracteriza por su distribución, prurito externo, curso crónico recurrente y asociación con asma y rinitis alérgica. Las manifestaciones cutáneas de la dermatitis atópica se peden reproducir tras la ingestión de alimentos específicos en un 20-50% de los pacientes y la eliminación de esos alimentos de la dieta se relaciona con una mejoría marcada de las manifestaciones cutáneas94-96, lo que sugiere la participación de fenómenos de alergia alimentaria en la patogenia de esta entidad.
La dermatitis herpetiforme es una enteropatía sensible al gluten pero con clínica fundamentalmente cutánea y depósitos de IgA en la unión dermoepidérmica. La eliminación del gluten de la dieta conduce a la mejoría de los síntomas cutáneos y de las lesiones intestinales97, lo que indica la participación de reacciones de alergia alimentaria, probablemente tipos II y IV, en la patogenia de la enfermedad.
Finalmente, la alergia alimentaria se ha relacionado con otros cuadros clínicos como artritis, síndrome nefrótico, migraña, epilepsia y úlcera péptica. Sin embargo, en la actualidad no se puede establecer una relación causal con alimentos específicos en la mayoría de los casos.
DIAGNOSTICO
A pesar de los innegables avances realizados en la investigación de los procesos alérgicos en los últimos años, todavía no disponemos de una prueba diagnóstica ideal. Así, en la práctica clínica diaria, el diagnóstico se basa en la combinación de datos clínicos y analíticos. La realización de una rigurosa y completa historia constituye uno de los pilares del diagnóstico diferencial. Aunque a menudo no hay una gran concordancia entre los datos recogidos en la anamnesis y las pruebas de confirmación, se debe tener en cuenta que los pacientes que refieren síntomas gastrointestinales asociados a manifestaciones dermatológicas y respiratorias tienen grandes posibilidades de padecer una alergia alimentaria98.
La realización de pruebas cutáneas con extractos alergénicos o con el alimento en su estado natural está ampliamente extendida. Sin embargo, los estudios realizados indican una correlación variable con la provocación antigénica a doble ciego, entre el 30 y el 90%, siendo el valor predictivo positivo escaso y variable con la edad del paciente y el alimento empleado y el valor predictivo negativo superior al 95%10,67,98.
A pesar de que muchos pacientes con alergia alimentaria y base atópica tienen concentraciones basales elevadas de IgE total y específica en suero y a menudo eosinofilia en sangre periférica, su determinación aislada carece de valor y debe interpretarse en el contexto clínico99-101.
En determinados casos puede ser útil la realización de un diario dietético y, ocasionalmente, es aconsejable la realización de estudios dirigidos a comprobar la respuesta sintomática en períodos de 2 semanas o más de exclusión dietética. Sin embargo, la interpretación de este tipo de estudios a menudo es confusa y puede conducir a la eliminación innecesaria y prolongada de alimentos esenciales, sólo justificable ante una reacción anafiláctica y cuando se desestima la realización de pruebas diagnósticas más concluyentes.
La prueba de confirmación diagnóstica de referencia es la provocación oral a doble ciego controlada con placebo8,10,11. La reproducción del cuadro clínico por la administración ciega del alimento prueba confirma la existencia de una reacción alérgica pero no es útil para establecer el mecanismo patogenético de la misma11,102. Además, su realización es engorrosa y prolongada y la interpretación de los resultados complicada, ya que en muchos casos depende de datos subjetivos11.
La mayor parte de las reacciones alérgicas se desarrolla inicialmente en el lugar de contacto del antígeno con el sistema inmunológico. Por esto, en los últimos años se han diseñado múltiples pruebas destinadas a investigar las reacciones bioquímicas en diferentes fluidos corporales. Muchas de estas pruebas se basan en la determinación de las concentraciones de diferentes mediadores de los mastocitos, eosinófilos y basófilos, en estos fluidos corporales. Cabe citar aquí, entre otras, la determinación de histamina y sus metabolitos en orina y plasma, la prostaglandina D2 en plasma y secreciones, el factor de necrosis tumoral-* (TNF-*) en plasma y heces, la proteína catiónica (ECP) y peroxidasa (EPX) del eosinófilo, la mieloperoxidasa (MPO), la elastasa, la lactoferrina y las proteínas de 40 kD del neutrófilo, el factor de crecimiento nervioso (NGF) en plasma, el receptor soluble de IL-2, la lisozima, la ß-tromboglobulina, el factor IV plaquetario, la interleucina 5, y las moléculas de adhesión (ELAM-I, VCAM-I)100. Estas pruebas se emplean en el área de investigación y su utilidad en la rutina diaria está por establecer. Mención aparte merece la determinación de la triptasa, como marcador específico de activación mastocitaria en humanos103. Su determinación en el suero, en el líquido conjuntival, cutáneo, pulmonar, nasal e intestinal puede ser de utilidad para el diagnóstico diferencial de las reacciones alérgicas en humanos59,104-109.
TRATAMIENTO
El mejor tratamiento es evitar la ingesta de los alimentos implicados y por ello es prioritario poder establecer un diagnóstico correcto de alergia alimentaria.
El tratamiento detallado de las reacciones agudas, especialmente las anafilácticas, está lejos del alcance de esta revisión. Se basa en el empleo de antihistamínicos, corticoides y especialmente adrenalina para abortar la cascada inmunológica y combatir los efectos sistémicos de dicha reacción.
Aunque algunos estudios farmacológicos empleando estabilizadores del mastocito, como el ketotifeno o el cromoglicato, o inhibidores de la síntesis de prostaglandinas, sugieren una potencial utilidad de estos fármacos en la profilaxis a largo plazo en la prevención de aparición de manifestaciones secundarias a alergia alimentaria, no existen evidencias definitivas que apoyen su utilización sistemática110,111. La utilización de bacterias probióticas, como Lactobacillus GG, en conjunción con fórmulas proteicas extensamente hidrolizadas, parece tener efectos beneficiosos aditivos en la modulación de las reacciones de hipersensibilidad alimentaria en pacientes con eccema atópico112.
En los últimos años, se han empleado diferentes estrategias para optimizar la prevención primaria y secundaria de la alergia alimentaria (tabla V)113. Entre éstas sólo el empleo de dietas hipoalergénicas combinadas en la madre y el bebé durante el período perinatal114 y el uso de proteínas hidrolizadas115 parecen tener algún efecto beneficioso en la prevención de alergias alimentarias en niños de alto riesgo durante el primer año de vida.
El futuro del tratamiento y prevención de las alergias alimentarias parece estar dirigido al desarrollo de terapias monoclonales contra la IgE y su receptor, a la modulación farmacológica de la actividad de los linfocitos T, mastocitos y eosinófilos, al desarrollo de antagonistas de diferentes citocinas como IL-2, IL-4, IL-5, a la vacunación y quizá a la intervención genética.
Correspondencia: Dr. J. Santos.
Intestinal Disease Research Programme. Health Sciences Centre, Room 3N5C. McMaster University. 1200 Main Street West. Hamilton, Ontario. L8N 3Z5 Canada.