HEPATITIS A
La hepatitis A es una enfermedad transmisible endemoepidémica de distribución universal, producida por un virus ARN muy resistente a la acción de los agentes externos (luz solar, calor, desinfectantes, etc.). La enfermedad se propaga a través de la vía fecal oral mediante mecanismos directos (contacto persona a persona) e indirectos (formites, alimentos y agua). La importancia relativa de estos modos de transmisión está relacionada con los niveles higiénicos y de saneamiento de cada comunidad. En los países poco desarrollados es una enfermedad infantil, de modo que la práctica totalidad de los adultos posee anticuerpos protectores (anti-VHA) formados en la infancia como respuesta a una infección generalmente asintomática. En los países desarrollados, donde el saneamiento del medio es alto, la enfermedad afecta con frecuencia a los adultos, mayoritariamente susceptibles y en los que la expresividad clínica de la infección es más notoria.
EPIDEMIOLOGIA DESCRIPTIVA
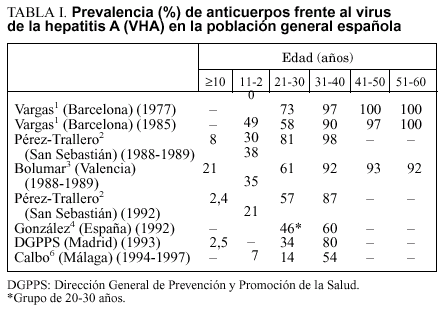
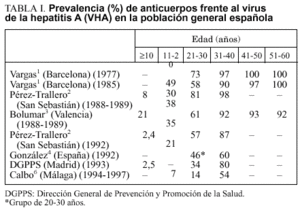
Las mejoras higiénico-sanitarias registradas en España en las últimas décadas, especialmente desde el inicio de los años setenta, hacen que nuestro país sea actualmente de endemicidad intermedia, en el que la prevalencia de infección por virus de la hepatitis A (VHA) disminuye de forma rápida y progresiva en los grupos de edad inferior a 50 años1-6 (tabla I), aproximándose rápidamente al patrón epidemiológico característico de las áreas de baja endemicidad. Actualmente la situación epidemiológica de la hepatitis A se caracteriza por una relativa baja incidencia de la enfermedad, con una creciente proporción de adultos susceptibles de contraer una hepatitis A7-9.
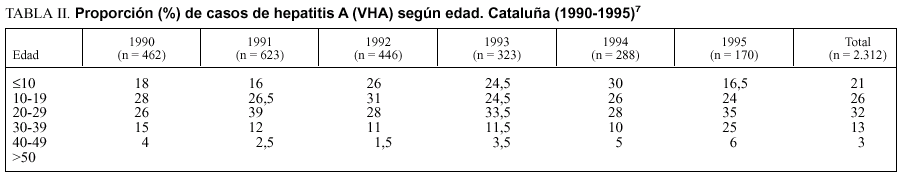
En la tabla II se muestra la incidencia declarada (Sistema de Enfermedades de Declaración Obligatoria) de hepatitis A en Cataluña durante el período 1990-199510. Puede observarse el desplazamiento de la enfermedad hacia edades progresivamente más elevadas. Para el conjunto del período, el 45% de los casos notificados corresponde a adultos de 20-39 años. En la tabla III se presentan los casos de hepatitis A (Sistema de Información Microbiológica) notificados en Vizcaya en 1996. Al igual que en Cataluña, casi el 50% de los casos (48,6%) inciden en el grupo de 21-30 años de edad.
Este cambio de patrón epidemiológico tiene importantes consecuencias sanitarias, económicas y sociales. La hepatitis A es frecuentemente asintomática en los niños, mientras que en los adultos se acompaña de manifestaciones clínicas más intensas, más prolongadas en el tiempo y a menudo recidivantes. La letalidad, asociada a formas fulminantes de presentación de la enfermedad, es también más elevada en los adultos. Todo ello representa importantes costes económicos tanto directos (atención médica) como indirectos (bajas laborales).
HEPATITIS A EN GUARDERIAS Y ESCUELAS
En áreas geográficas de endemicidad intermedia y baja se registran con cierta frecuencia brotes epidémicos en niños atendidos en guarderías, así como entre el personal que les atiende y los contactos familiares (padres y hermanos) de los niños. Dada la escasa sintomatología que la infección depara en los niños, en ocasiones los brotes son identificados por la afectación de los educadores y padres. Las guarderías que acogen a niños pequeños que usan pañales tienen, sobre todo cuando las condiciones higiénicas son deficientes, más probabilidades de sufrir brotes de hepatitis A11-13.
En la tabla IV se recoge, para el período 1991-1995, el número total de brotes de hepatitis A notificados en Cataluña así como el número de personas afectadas14. Algo más de la mitad de los brotes epidémicos afectaron a guarderías o escuelas, representando dos tercios del total de los casos detectados en estos brotes.
En 1996 se registró en el barrio de Gracia de Barcelona un gran brote de hepatitis A15. Iniciado en un grupo familiar, donde enfermaron 15 de sus 23 miembros (tasa de ataque del 65%) llegó a la guardería a la que acudían dos de ellos, de 1 y 2 años de edad. En la guardería, donde la tasa de ataque fue del 18%, se afectaron los tres únicos educadores susceptibles y el 6% de los contactos familiares de los niños. El total de casos identificados fue de 63.
PREVENCION DE LA HEPATITIS
Tradicionalmente la prevención de la hepatitis A se ha basado en actuaciones de control ambiental de aguas y alimentos (Protección de la Salud) y en medidas de higiene personal. Ya ha sido comentado el efecto paradójico de estas medidas al retrasar la infección a la edad adulta.
La inmunoglobulina estándar (Ig) ha sido empleada con éxito tanto en la profilaxis de preexposición como en situaciones de postexposición (inmunización pasiva). No obstante, la protección conferida es transitoria, no siempre completa y, además, no es posible habitualmente precisar el momento de la exposición al VHA.
En los últimos años se han desarrollado al menos tres vacunas inactivadas frente al VHA: HAVRIX® (SmithKline Beecham), VAQTA® (Merck Sharp Dohme) y AVAXIM® (Pasteur Mérieux). En España está registrada una HARVIX® y una vacuna combinada frente a la hepatitis A y la hepatitis B: TWINRIX®, SmithKline Beecham.
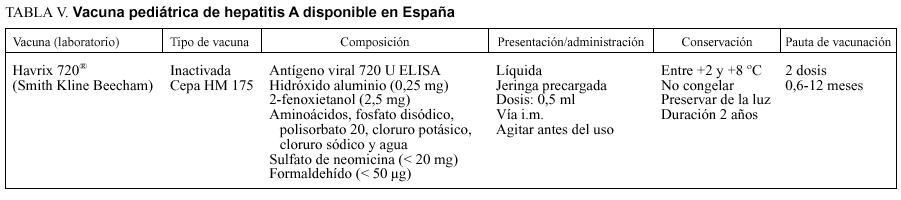
La vacuna de la hepatitis A se ha obtenido a partir de la cepa HM175 inoculada en células diploides humanas. Está inactivada con formol y adsorbida con hidróxido de aluminio. Existen preparados de 1.440 y de 720 unidades ELISA de antígeno viral, que corresponden a la presentación para adultos (más de 18 años) e infantil (1-18 años), respectivamente.
La vacuna es segura y carece de contraindicaciones específicas. La inmunogenicidad después de una dosis se aproxima al 100%16-18. Posee una alta eficacia protectora, de duración probablemente superior a 15 o 20 años19.
La posología recomendada actualmente es de 2 dosis (1.440 o 720 unidades ELISA, según edad) separadas por un intervalo de 6-12 meses.
ESTRATEGIAS DE VACUNACION
Vacunación universal
La vacunación universal es la única estrategia capaz de conseguir la erradicación de la enfermedad20. El coste actual de la vacuna de la hepatitis A no debería limitar su implantación.
La vacunación universal frente a la hepatitis A podría facilitarse utilizando la vacuna combinada hepatitis A/hepatitis B21 como alternativa a la vacuna de la hepatitis B, aprovechando la infraestructura de la vacunación escolar de los preadolescentes que se realiza actualmente en España en todas las comunidades autónomas.
Resulta inevitable establecer analogías con la vacunación frente a la hepatitis B. Sólo después de una década de estrategias realmente poco útiles, basadas en la vacunación de grupos de riesgo, se adoptó la vacunación universal22,23. En el caso de la hepatitis A, sería deseable que la transición desde la vacunación selectiva de los grupos de riesgo hasta la vacunación universal fuera lo más breve posible.
Vacunación de grupos de riesgo
Las estrategias de vacunación selectiva deberían ser complementarias a la vacunación universal, en las siguientes situaciones20:
Protección de los viajeros internacionales.
Disminución del riesgo de brotes epidémicos (p. ej., los relacionados con guarderías o manipuladores de alimentos).
Protección de personas con enfermedades subyacentes que podrían agravarse en el curso de una hepatitis A.
USOS DE LA VACUNA EN ESPAÑA
La Circular 12/97 de la Dirección General de Farmacia y Productos Sanitarios contiene diversas recomendaciones e instrucciones sobre el uso de la vacuna, entre las que se señala que «las determinaciones de anticuerpos estarían justificadas, sobre todo, a partir de los 30 años de edad, antes de proceder a la vacunación»24.
La circular incluye los siguientes grupos de población a proteger25-34:
1. Viajeros que se desplacen a zonas endémicas de hepatitis A o personas que vayan a residir en las mismas.
2. Varones homosexuales que tengan contactos sexuales múltiples.
3. Personas drogodependientes por vía parenteral.
4. Pacientes hemofílicos.
5. Familiares o cuidadores que tengan contacto directo con pacientes afectados de hepatitis A.
6. Trabajadores en contacto con aguas residuales no depuradas.
7. Personal médico y paramédico de hospitales e instituciones asistenciales.
8. Personal de guarderías infantiles.
9. En las situaciones que determinen las autoridades sanitarias.
La circular recoge ciertamente la indicación de vacunar a importantes grupos pero se echa en falta: a) la inclusión de personas con enfermedades subyacentes que podrían presentar un curso desfavorable por la infección por VHA (p. ej., pacientes con hepatopatías crónicas o candidatos a trasplantes)35,36; b) una mayor concreción sobre qué personal sanitario debe ser incluido y cuál no37, y c) un enfoque más realista sobre el papel de las guarderías en la propagación de la infección y de la enfermedad20.
USO DE LA VACUNA EN LAS GUARDERIAS
En EE.UU. donde la epidemiología de la hepatitis A es similar a la nuestra, las guarderías infantiles representan una fuente importante de infección, ya que suponen un 15% de los casos notificados afectando a niños, familiares y cuidadores8,9,11. El riesgo está en relación con la presencia de niños que utilizan pañales, y también de muchos niños y poco espacio.
En España el papel de las guarderías en la difusión del VHA está subestimado. En niños pequeños la infección pasa a menudo desapercibida por su escasa expresividad clínica, por lo que sólo son evidentes las formas sintomáticas de infección de los padres y hermanos mayores.
Por todo ello, el empleo de la vacuna antihepatitis A no debiera sólo limitarse a los trabajadores de las guarderías, sino incluir también a los niños que asisten a las mismas, para su propia protección y sobre todo la de los familiares que con ellos conviven20.
Recomendaciones específicas
En relación a los trabajadores de guarderías
1. La Circular 12/97 de la Dirección General de Farmacia y Productos Sanitarios (Ministerio de Sanidad y Consumo) considera entre los grupos de riesgo de infección por VHA al «personal de guarderías infantiles» (punto 8, instrucción 1), propugnando por ello la vacunación específica.
Los trabajadores de guarderías (educadores, personal de limpieza, etc.) deberían acudir a su médico para que éste valorara la indicación de la vacuna de la hepatitis A y, en los casos en los que estuviera indicada, la prescribiera.
Los directores de guarderías deberían fomentar y favorecer, mediante todos los medios a su alcance, la vacunación antihepatitis A del personal de su centro.
2. Las personas en período de formación, futuros trabajadores de guarderías mayoritariamente susceptibles a la infección por VHA, deberían ser vacunadas frente a hepatitis A durante el período de aprendizaje, al igual que se hace con los estudiantes de profesiones sanitarias38,39. El Ministerio de Educación y las Consejerías de Educación de las comunidades autónomas deberían velar por el seguimiento de esta recomendación.
En relación a los niños y a los padres
1. Los niños mayores de un año que acuden a guarderías deberían beneficiarse de la administración de la vacuna de la hepatitis A. Idealmente, la vacunación se realizará antes del ingreso del niño en la guardería. Los niños que acuden a la guardería a edades más tempranas no serán vacunados hasta que tengan 12 meses de edad, edad mínima recomendada para la administración de dicha vacuna.
2. Antes de la inscripción de un niño en la guardería, sus padres deberían ser informados del beneficio de la vacunación frente a la hepatitis A, tanto para el propio niño como para su medio familiar.
3. Sería conveniente que cada guardería dispusiera de un registro actualizado de los niños que han sido vacunados frente a la hepatitis A con el fin de facilitar las actuaciones sanitarias en caso de infecciones de otros niños y de favorecer el control de eventuales incidencias epidémicas. La vacunación se acreditará mediante el carné de vacunación o certificado médico.
En relación a los pediatras y otros facultativos
1. Los pediatras y médicos de atención primaria deberían informar a los padres de niños que asisten a guarderías de las consecuencias que puede tener la infección por el VHA en las diferentes edades (niños de guardería y niños y adultos del medio familiar que podrían contagiarse) y de la utilidad demostrada de la aplicación de la vacuna de la hepatitis A.
2. Los pediatras de guardería deben desempeñar un papel clave, informando a la dirección del centro del interés de la vacunación y actualizando y supervisando el registro de niños vacunados.
3. El personal facultativo responsable de los programas de salud individual de los trabajadores de las guarderías indicará la vacunación específica frente al VHA en los menores de 30 años. En los mayores de 30 años se solicitará determinación analítica (anti-VHA total o IgG) para valorar el estado inmunitario específico frente al VHA, y de ello deducir la necesidad o no de prescripción de la vacuna de la hepatitis A24.
VACUNA DE LA HEPATITIS A PARA USO PEDIATRICO
Las características de la vacuna de la hepatitis A para uso pediátrico se describen en la tabla V.
Eficacia e inmunogenicidad
La vacunación induce la producción de anticuerpos anti-VHA en el 99% de los vacunados. La vacuna es eficaz en el control de brotes epidémicos que afectan a la comunidad, habiéndose demostrado, tras la vacunación, un importante descenso del número de casos de hepatitis A en poblaciones en las que el 70% de los individuos eran susceptibles40-42.
Para obtener una inmunidad a largo plazo es necesaria una dosis de recuerdo a los 6-12 meses de la primera dosis. El título medio de anticuerpos anti-VHA obtenidos tras la vacunación es al menos tres veces mayor que el obtenido tras la administración de inmunización pasiva con inmunoglobulina estándar.
Contraindicaciones y precauciones
Las contraindicaciones son las generales para las vacunas inactivas. Está contraindicada en pacientes con hipersensibilidad conocida a cualquiera de los componentes de la vacuna o en aquellos casos que han presentado una reacción alérgica grave tras la administración de una dosis de la misma. En caso de fiebre alta no debe vacunarse, no estando contraindicada en pacientes con infección leve sin fiebre.
Interacciones
Cuando sea necesaria la administración simultánea de HAVRIX 720® con otras vacunas se realizará con jeringas diferentes y en distintos lugares de inyección. Se ha demostrado en estudios clínicos que la administración concomitante de HAVRIX® con la vacuna recombinante de hepatitis B (ENGERIX-B®) es satisfactoria, obteniéndose la misma respuesta inmune que la inducida por ambos antígenos por separado. La administración concomitante de otras vacunas no interfiere con la respuesta inmune.
Se puede administrar la primera dosis simultáneamente con inmunoglobulinas, siempre que se inyecte en sitios anatómicos distintos. Las tasas de seroconversión en estos casos no se modifican, pero los títulos de anticuerpos podrían ser menores que los obtenidos tras la administración exclusiva de la vacuna43.
Advertencias
Es posible que en el momento de la vacunación el paciente se encuentre en período de incubación de una infección por el virus de la hepatitis A. En estos casos no está claro si la vacunación previene el desarrollo de la enfermedad.
La vacuna no debe administrarse en la región glútea, dado que puede inducir una menor respuesta inmunitaria. En ningún caso se inyectará por vía intravenosa.
Posología
Se administrará por vía intramuscular en niños mayores en la región deltoidea y en niños pequeños en la cara anterolateral del muslo. En pacientes hemofílicos o con trombocitopenia se debe vacunar por vía subcutánea.
La pauta de vacunación es de una dosis de 0,5 ml de HAVRIX 720®. La dosis de recuerdo se recomienda entre los 6-12 meses.
Reacciones adversas
La vacuna es bien tolerada. La mayoría de las reacciones adversas descritas son leves y transitorias, más frecuentes tras la primovacunación que tras la dosis de recuerdo. La reacción local más frecuente es el dolor en el lugar de la inyección y, más raramente, edema y enrojecimiento. Las reacciones sistémicas son infrecuentes, habiéndose descrito raramente, cefalea, malestar, vómitos, fiebre, náuseas y pérdida de apetito que cedieron espontáneamente.
Conservación
Se debe conservar en frigorífico entre +2o y +8 oC. No se puede congelar, y se debe desechar la vacuna si ha sufrido congelación. Tiene una duración de 2 años, no debiéndose utilizar tras la fecha de caducidad indicada en el envase.