Los antiagregantes plaquetarios son usados de forma rutinaria tanto en prevención primaria como secundaria de accidentes cardiovasculares. El desarrollo de nuevos agentes y el auge del intervencionismo coronario han hecho que el tratamiento antiagregante sea más prescrito y utilizado durante más tiempo. El efecto secundario más importante es el aumento de la incidencia de complicaciones hemorrágicas, siendo las gastrointestinales las más prevalentes. En este contexto es necesario optimizar el balance entre los beneficios cardiovasculares y los riesgos hemorrágicos de este tipo de terapias.
El artículo recomienda unas pautas de manejo específico y resalta aspectos prácticos relevantes, incluyendo la interacción entre clopidogrel y los inhibidores de la bomba de protones. La revisión describe los riesgos y beneficios en los diferentes escenarios clínicos con el objetivo de optimizar el equilibrio entre los beneficios cardiovasculares y el riesgo de hemorragia por el tratamiento antiagregante.
Antiplatelet agents are routinely used in both primary and secondary prevention of cardiovascular events. The development of new antiplatelet agents and the strong growth of interventional cardiology have led to this therapy being more widely prescribed and for longer periods. The most important secondary effect is the rise in the incidence of hemorrhagic complications, the most prevalent being gastrointestinal bleeding. In this context, the balance between the cardiovascular benefits and bleeding risk of these agents must be optimized.
This review provides specific management recommendations and highlights important practical aspects related to antiplatelet therapy, including the interaction between clopidogrel and proton pump inhibitors. The benefits and hazards in distinct clinical settings are outlined within the context of optimizing the balance between the cardiovascular benefits and bleeding risk of antiplatelet therapy.
El uso de terapias antiagregantes está cada vez más extendido en la práctica clínica, tanto en prevención primaria como secundaria de enfermedades cardiovasculares1–3. A pesar de su evidente beneficio, estas terapias tienen efectos secundarios, principalmente complicaciones hemorrágicas, tanto intracraneales (mayor gravedad) como extracraneales (más prevalentes). Las más graves dentro de las extracraneales son las hemorragias gastrointestinales.
En los últimos años el aumento del uso de doble antiagregación con ácido acetilsalicílico (AAS) y clopidogrel tras un episodio isquémico cardiovascular es importante, sobre todo tras el implante de stents coronarios. En este contexto es necesario primero conocer los beneficios y los riesgos potenciales asociados al uso de tratamiento antiagregante en prevención primaria y secundaria de enfermedad cardiovascular, y en segundo lugar evaluar el riesgo hermorrágico de cada paciente individualizadamente e iniciar tratamiento preventivo, si es necesario, con el fin de reducir las complicaciones gastrointestinales. El efecto potencial del AAS en la prevención del cáncer colorrectal, cuyo papel se ha visto reforzado por los últimos estudios publicados4, se debe tener en cuenta a la hora de valorar el riesgo beneficio del AAS.
Antiagregantes: mecanismo y dosis óptimaEl mecanismo de acción descrito del AAS viene dado por su capacidad de inactivar de forma permanente la actividad de la ciclooxigenasa (COX) de la prostaglandina H-sintasa-1 y 2 (también llamadas COX-1 y COX-2)5. Estas enzimas catalizan el primer paso de la síntesis de prostanoides (por ejemplo, la conversión de ácido araquidónico a PGH2). La PGH2 es el precursor inmediato de PGD2, PGE2, PGF2α, PGI2 y TXA26,7. El mecanismo molecular de la inactivación permanente de la actividad COX por AAS se debe a la inactivación del canal COX como consecuencia de la acetilación de residuo de serina (Ser529 en COX-1 y Ser516 en COX-2 humana), evitando el acceso del sustrato al sitio catalítico de la enzima y dando lugar a una supresión completa de la actividad COX-1 (≥ 95%) y a la capacidad plaquetaria para producir TXA28–10. La inhibición de la COX-1 se puede conseguir con bajas dosis de AAS administrado en una sola dosis al día. En cambio, la inhibición de la COX-2 (implicada en procesos de hiperalgesia e inflamación) requiere dosis más altas de AAS e intervalos de administración mucho más cortos (se ha sugerido que esta diferencia es debida al estado oxidativo intracelular)6,11. El perfil de riesgo/beneficio del AAS depende de la dosis y la indicación ya que la toxicidad gastrointestinal es dependiente de la dosis.
Las plaquetas humanas y el endotelio vascular procesan PGH2 para producir primeramente TXA2 y PGI2, respectivamente. El TXA2 induce agregación plaquetaria y vasoconstricción, mientras que la PGI2 inhibe la agregación plaquetaria e induce vasodilatación. Mientras que el TXA2 es un producto derivado de COX-1 (en su mayor parte de las plaquetas) y muy sensible a la inhibición plaquetaria; la PGI2 vascular puede derivar de COX-1 y, en condiciones fisiológicas adecuadas de COX-2. La produción de PGI2 dependiente de COX-1 tiene lugar de forma transitoria en respuesta al estímulo de diferentes agonistas (por ejemplo, bradicinina) y es sensible a la inhibición del AAS. La producción de PGI2 mediada por COX-2 tiene lugar en respuesta al estrés vascular y en general no es sensible a la inhibición que tiene lugar con dosis bajas de AAS.
Desde un punto de vista farmacocinético, el AAS es absorbido en el estómago y en el intestino superior. El pico plasmático ocurre de 30 a 40min tras la ingestión de aspirina y la vida media es de tan solo 15 a 20min. A pesar del rápido aclaramiento del AAS de la circulación, el efecto antiplaquetario dura toda la vida de la plaqueta, ya que el AAS inactiva de forma irreversible la COX-1 plaquetaria. Este fenómeno tiene lugar fundamentalmente en la circulación portal12.
La eficacia y la seguridad de AAS como antitrombótico ha sido estudiada en poblaciones diversas, desde sujetos sanos de alto riesgo (prevención primaria) a pacientes que sobrevivieron a un infarto agudo de miocardio o a un episodio de isquemia cerebral (prevención secundaria). Estos estudios han tenido periodos de seguimiento de semanas hasta 10 años de duración y se han utilizado dosis de entre 50 y 1.500mg/día. El AAS ha mostrado ser efectivo en múltiples escenarios: angina inestable en la que se redujo la incidencia de IAM o muerte en 4 estudios diferentes utilizando dosis diarias de 75, 325, 650 y 1.300mg/día, respectivamente2,3,5,13,14; angina estable en la que 75mg/día redujeron la incidencia de IAM o muerte súbita; cirugía de bypass aortocoronario en la cual la incidencia de reoclusión precoz fue significativamente menor con dosis diarias de 10015, 325, 975 y 1.200mg/día, respectivamente; IAM en el cual una dosis de 162,5mg/día dio lugar a una reducción de la mortalidad precoz (< 35 días), así como del reinfarto no mortal y AVC.
Los datos señalan que el AAS es un agente antitrombótico efectivo cuando es utilizado con dosis entre 50 y 1.500mg/día. Sin embargo, los datos de toxicidad indican dependencia de la dosis. Así, dosis de ≤ 300mg/día producen menos efectos gastrointestinales que dosis de 1.200mg/día. Los investigadores del estudio CURE revisaron retrospectivamente la relación entre la dosis de aspirina administrada (entre 75 y 325mg/día) y el riesgo de hemorragia mayor16. Los pacientes con síndrome coronario agudo que habían recibido aspirina en dosis ≤ 100mg/día presentaban la menor incidencia de hemorragias con riesgo vital en ambos grupos, en el grupo placebo (1,9%) y en el grupo de clopidogrel (3%) del citado estudio. El riesgo hemorrágico aumentaba con dosis crecientes de aspirina con o sin clopidogrel.
En el estudio recientemente publicado CURRENT-OASIS 7 se estudiaron 25.086 pacientes tras presentar un síndrome coronario agudo que fueron aleatorizados a recibir dosis bajas de AAS de 75-100mg o dosis altas de 300-325mg durante 30 días17. El estudio ha mostrado que no hubo diferencias significativas en lo que respecta al conjunto de episodios vasculares (muerte debido a causa cardiovascular, IAM o AVC a los 30 días) en función de la dosis de antiagregante que se utilice: un régimen de tratamiento durante 7 días de doble dosis de clopidogrel (150mg/día) no mostró diferencias significativas con respecto al tratamiento habitual (75mg/día). Tampoco se encontraron diferencias entre AAS a altas dosis (325mg/día) o bajas dosis (75mg/día).
En resumen, los datos sobre la saturabilidad del efecto antiplaquetario del AAS con dosis bajas, la ausencia de una relación dosis-respuesta en prevención cardiovascular y la dependencia de la dosis de los efectos secundarios apoyan el uso de AAS en bajas dosis para la prevención de episodios cardiovasculares. La utilización de la dosis mínima efectiva (50-100mg/día en tratamientos prolongados) es actualmente la estrategia más apropiada para maximizar su eficacia y minimizar su toxicidad.
Evidencia en prevención y resistencia al ácido acetilsalicílicoLa eficacia del AAS como agente antitrombótico se ha estudiado en diferentes poblaciones. Se han realizado 6 ensayos con personas sanas (prevención primaria) que incluyeron 95.000 sujetos de bajo riesgo cardiovascular, con una media de seguimiento de 6-9 años. Se evidenció que el uso del AAS disminuye en un 12% el riesgo relativo de episodios vasculares serios, p=0,0001 (IAM, AVC o muerte debido a causa vascular), efecto principalmente debido a la disminución de un 23% en IAM no mortal, pasando de un 0,23% a un 0,18% al año, p<0·00014,13. Sin embargo, no se evidenciaron descensos de la mortalidad por causa vascular (0,19% al año con o sin AAS). El porcentaje de hemorragias extracraneales aumentó la mitad, del 0,07 al 0,1% al año. En prevención secundaria, se han llevado a cabo 16 ensayos clínicos con 17.000 pacientes de alto riesgo con infarto o AVC previo con un seguimiento medio de 2,5 años. El tratamiento con AAS tuvo como resultado un 19% menos de accidentes vasculares serios (de 8,2 a 6,7% al año), con una reducción proporcional en eventos coronarios y de ictus isquémico (reducción relativa del 20 y 22%, respectivamente) y un aumento no significativo en hemorragia cerebral4.
La reducción proporcional en eventos coronarios mayores parece ser similar en prevención primaria y secundaria (RR 0,82 y 0,90, respectivamente), pero el beneficio absoluto difería significativamente (0,6 en prevención primaria frente a 10 por 1.000 pacientes/año en secundaria)3,13.
Tanto en prevención primaria como secundaria, los porcentajes de reducción de eventos eran similares en hombres y mujeres, también en jóvenes y mayores. Los predictores independientes de eventos vasculares serios y de hemorragias extracraneales mayores eran los mismos (edad, sexo masculino, diabetes mellitus, fumador activo, presión arterial e índice de masa corporal). Con todos estos datos se puede afirmar que los pacientes con alto riesgo de complicaciones vasculares también presentaban alto riesgo de hemorragias extracraneales mayores4.
A pesar de esta gran efectividad, los pacientes con frecuencia vuelven a presentar eventos vasculares isquémicos recurrentes debido a la naturaleza eminentemente multifactorial y progresiva de la aterosclerosis. Es importante precisar que en estos casos hay que calificar el evento isquémico vascular como fallo del tratamiento. La causa de este hecho es la progresión de la enfermedad, que ocurre a pesar de tomar AAS (y de su efecto antiagregante a través de la inhibición de COX-1).
Se ha sugerido que algunos pacientes podrían presentar resistencia al AAS en bajas dosis, impidiendo de esta manera la actividad antiagregante de este fármaco (medida con pruebas funcionales de agregabilidad con diferentes estimulantes de la agregación plaquetaria como colágeno, ADP, adrenalina). La estimación de la verdadera relevancia de este hecho es desconocida.
En diferentes estudios se ha definido a un paciente como resistente al AAS cuando presentaba agregación plaquetaria a pesar del tratamiento antiagregante tras realizar solo una única determinación. A este respecto hay que señalar que una única determinación de la función plaquetaria no refleja un fenotipo estable y se puede ver interferido con otros bloqueadores de la COX-1. En un estudio llevado a cabo en 48 sujetos sanos en tratamiento con aspirina analizando la agregación plaquetaria los tests funcionales de agregación plaquetaria18, se ha descrito que los análisis bioquímicos de agregación plaquetaria funcionales (Verifynow) no son reproducibles y no reflejan ni la actividad sérica del TXA2, ni la actividad plaquetaria COX-1, ni la agregación plaquetaria cuando se encuentra inhibida con bajas dosis de AAS. El estudio concluye que este tipo de pruebas presentan una significativa variabilidad intrasujeto e intersujeto. Se puede deducir entonces que los estudios que describen a pacientes con fenotipo no respondedor (resistente) al AAS con una determinación aislada, reflejan la inconsistencia de este concepto. Es más, en este contexto de pobre reproducibilidad intrasujeto, los umbrales arbitrarios utilizados en las pruebas funcionales para calificar a un paciente como resistente no se pueden sostener a la luz de la relación no lineal entre la inhibición de la actividad plaquetaria COX-1 y de agregación dependiente de TXA2. Las causas más frecuentes de inhibición incompleta de la actividad de COX-1 en pacientes tratados con AAS son la falta de cumplimiento terapéutico y la interacción con otros antiinflamatorios no esteroideos (AINE). Otras situaciones como diabetes mellitus y trombocitopenia esencial podrían dar lugar a regeneración acelerada de la enzima inactivada y modificar el intervalo óptimo de dosis. Con los datos disponibles hasta el momento, no está definido con claridad el mecanismo ni la relevancia clínica de la resistencia al AAS.
Clopidogrel: bloqueo de P2Y12 y resistencia a clopidogrelLa interacción de ADP con su receptor plaquetario P2Y12, puede ser bloqueada de forma irreversible por los metabolitos activos de las tienopiridinas (ticlopidina, clopidogrel y prasugrel) o antagonizado de forma reversible por las nuevas moléculas en etapa de precormecialización (cangrelor y ticagrelor); dando lugar a un potente efecto antiagregante plaquetario en ambos casos.
Clopidogrel requiere ser transformado en su metabolito activo por el citocromo P450 CYP2C19 para realizar su efecto antiagregante. Los genes que codifican la enzima CYP son polimórficos, y las variaciones en sus alelos pueden dar lugar a alteración en su función. Las variantes polimórficas del citocromo P450 CYP2C19 se han clasificado en 3 grupos diferentes según el metabolismo de clopidogrel19: rápido, intermedio y lento. En este ámbito, existen variaciones interraciales, con un 3-5% de los americanos de raza negra y hasta el 20% de los asiáticos considerados como metabolizadores lentos. Se ha descrito que presentar uno o 2 polimorfismos con deleción de la función de CYP2C19 se asocia con un descenso de la exposición del metabolito activo de clopidogrel y un menor efecto antiagregante del clopidogrel. Los pacientes que presentan la variante de 2 alelos sin función tienen un riesgo mayor de eventos cardiovasculares que los pacientes que no presentan esta alteración20. Estos pacientes presentaban bajos niveles plasmáticos del metabolito activo. En cambio, al añadir el metabolito in vitro, las plaquetas fueron inhibidas totalmente, demostrando que elemento fundamental es la formación del fármaco activo a través del profármaco (clopidogrel).
Es necesario recalcar que existe una gran variabilidad interindividual en la farmacocinética del clopidogrel, en lo que respecta a la cantidad del profármaco que llega a la ruta de activación metabólica y en la fracción del profármaco transformada finalmente en metabolito activo21–23. Las situaciones que disminuyen la biodisponibilidad del clopidogrel como en los pacientes con diabetes así como las interacciones farmacológicas con las enzimas que metabolizan el paso de clopidogrel a su principio activo (CYP2C19) podrían ser las causantes en algunos casos de esta variabilidad farmacocinética24.
Interacción entre clopidogrel y los inhibidores de la bomba de protonesHo et al25 publicaron un estudio retrospectivo de una cohorte de 8.205 pacientes con síndrome coronario agudo (SCA) tratada en 127 hospitales de veteranos americanos. Se analizaron todas las causas de mortalidad y la rehospitalización por SCA. Todos los pacientes estaban en tratamiento con clopidogrel y un 64% estaban en tratamiento con inhibidores de la bomba de protones (IBP). La muerte o rehospitalización por SCA tuvo lugar en el 30% de los pacientes con IBP y en el 21% de los pacientes que no estaban en tratamiento con IBP. La odds ratio (OR) ajustada para muerte o rehospitalización entre los pacientes con clopidogrel e IBP fue de 1,25 (IC 95%, 1,11-1,41). Sin embargo, los pacientes en tratamiento con IBP presentaban de forma significativa más probabilidad de tener: a) un IAM previamente que los pacientes con clopidogrel de forma aislada; b) diabetes (p<0,001); c) haber sufrido revascularización coronaria quirúrgica; d) insuficiencia cardiaca, y e) diversas comorbilidades en comparación con los pacientes que tomaban clopidogrel sin IBP. En resumen, los pacientes tratados con IBP eran mayores y presentaban más comorbilidades que los pacientes que tomaban clopidogrel sin un IBP. Es posible pues que se prescribiera IBP a los pacientes porque se percibió que presentaban un mayor riesgo potencial de hemorragia del tracto gastrointestinal superior. Por estos motivos, es arriesgado desde el punto de vista de la causalidad atribuir el aumento del riesgo de muerte y eventos cardiovasculares solamente al uso de IBP y no a las comorbilidades asociadas.
En el mismo estudio los riesgos (OR) para episodios cardiovasculares adversos en pacientes que tomaban rabeprazol y omeprazol fueron del 2,83 (IC 95%: 1,96-4,09) y 1,24 (IC 95%: 1,08-1,41), respectivamente. Rabeprazol es principalmente degradado de forma no enzimática con un mínimo metabolismo a través del citocromo P450 CYP2C19, utilizando otras enzimas P450 CYP para metabolizarse, mientras que omeprazol es metabolizado principalmente en el hígado por esta enzima. Basados en estos antecedentes, el hecho de que rabeprazol se haya asociado con un riesgo más de dos veces superior que omeprazol no tiene explicación evidente si se tiene en cuenta la teoría de interacción entre clopidogrel y el grupo de IBP que se metabolizan principalmente a través del citocromo P450 CYP2C19.
Con respecto a este aspecto en las últimas fechas han sido publicados diferentes estudios observacionales o revisiones post hoc de ensayos clínicos con resultados contradictorios. Merece especial atención el publicado por Braunwald et al26 en el que se analiza la asociación entre el uso de IBP, medidas de la función plaquetaria y evolución clínica de los pacientes tratados con clopidogrel y prasugrel en los ensayos PRINCIPLE-TIMI 44 (201 pacientes) y TRITON-TIMI 38 (13.608 pacientes). El uso de IBP fue por libre indicación de su médico. Se evidenció una inhibición de la agregación plaquetaria tras tratamiento con clopidogrel significativamente menor en los pacientes con IBP que en los que no estaban tratados con esta clase de fármacos. A pesar de ello, clínicamente no se evidenció ninguna asociación entre el uso de IBP y el riesgo de un evento como muerte cardiovascular, infarto agudo de miocardio o ictus.
El único ensayo clínico disponible que nos puede arrojar luz al respecto es el estudio COGENT recientemente publicado27. Se trata de un ensayo clínico aleatorizado, doble ciego, diseñado para valorar el efecto clínico de un compuesto que combina clopidogrel y omeprazol frente clopidogrel-placebo en pacientes con indicación de doble antiagregación con AAS y clopidogrel. El objetivo primario fue analizar eventos gastrointestinales, mientras que el objetivo secundario fue analizar eventos cardiovasculares; 3.863 pacientes fueron aleatorizados en grupos homogéneos. Los resultados mostraron que no había diferencia en los eventos cardiovasculares (muerte, infarto de miocardio no mortal, revascularización o ictus) entre el grupo tratado con omeprazol respecto al grupo tratado con placebo. Un total de 109 pacientes presentaron un evento cardiovascular, 4,9% con omeprazol y 5,7% con placebo (el riesgo [HR] para el compuesto clopidogrel-omeprazol fue de 0,99; IC 95%: 0,68-1,44; p=0,96 frente al compuesto clopidogrel-placebo, siendo la diferencia entre ambos tratamientos no significativa). El número de eventos gastrointestinales disminuyó significativamente en el grupo de omeprazol, siendo de un 1,1% frente al 2,9% con placebo con 180 días de seguimiento (el riesgo [HR] para el omeprazol fue de 0,34; IC 95% 0,18- 0,63; p<0,001; siendo la diferencia significativa con respecto al placebo). El estudio concluye que en pacientes con indicación para doble antiagreación con AAS y clopidogrel, añadir un inhibidor de la bomba de protones como omeprazol disminuye el riesgo de hemorragias gastrointestinales, sin evidenciar un exceso de eventos cardiovasculares que puedan ser atribuidos a la interacción entre clopidogrel y omeprazol.
Un artículo reciente en una prestigiosa revista médica28 ha investigado en las causas de la gran variabilidad en la respuesta clínica del tratamiento con clopidogrel. Los autores identifican a la enzima paraoxonasa-1 (PON1) como la enzima crucial en la bioactivación y en la actividad clínica del clopidogrel. Analizan en una cohorte de 7.719 pacientes con enfermedad coronaria y con un seguimiento medio de 18 meses los casos de trombosis de stent (n=41) frente a un grupo de sujetos elegido de forma aleatorizada (n=71). Los autores describen que en la población analizada, el alelo CYP2C19*2 explicaba el 12% de la variabilidad en la respuesta a la agregación plaquetaria tras estimulación con ADP, mientras que el polimorfismo PON1 Q192R de la paraoxonasa explicó el 72,5% de la variabilidad. Los autores indican que esta enzima podría ser el mayor determinante de la respuesta al clopidogrel.
En resumen, a pesar de todo lo publicado hasta el momento, quedan aún muchos interrogantes por responder con respecto al metabolismo, activación y efecto antiagregante del clopidogrel. Es necesario investigar más profundamente en la nueva línea de activación que corresponde a la PON1, ya que podría explicar gran parte de la variabilidad clínica tras el uso del clopidogrel.
Mecanismos de lesión gastrointestinal por ácido acetilsalicílicoEl AAS debido a sus características farmacodinámicas específicas tiene efectos secundarios sistémicos y locales en la mucosa gastrointestinal. Los estudios llevados a cabo para estudiar estos efectos se han realizado en modelos in vivo, in vitro y en voluntarios sanos29,30.
Una visión completa de la patogenia del daño gastrointestinal asociado al uso de AAS es algo que este artículo de revisión no intenta perseguir. Sin embargo, como ya se ha comentado previamente, el AAS presenta a nivel sistémico una mayor selectividad por la COX-1; esta mayor inhibición produce una reducción de los valores de PGE2 asociada de forma fisiológica a aumento del flujo sanguíneo, estímulo de síntesis de moco y bicarbonato, así como a la proliferación celular, esencial en la repación de lesiones31–33. Sin embargo, esta toxicidad indirecta debido al AAS a nivel sistémico no es la única causante del daño gastrointestinal. Se ha demostrado en modelos animales que el AAS induce lesiones gastrointestinales tanto en ratones con depleción de la enzima COX-1 como en aquellos con depleción COX-234, lo que sugiere que al igual que puede ocurrir con otros AINE es necesaria la inhibición de ambas enzimas para producir daño gastrointestinal. La cuestión clave aquí es si dosis bajas de AAS son suficientes para inducir efectos sistémicos, ya que desaparece rápidamente de la circulación sistémica. Los escasos estudios disponibles sugieren que la mucosa gastroduodenal es especialmente sensible a inhibición de prostaglandinas aún en dosis bajas de AAS. En sujetos sanos dosis de tan solo 10mg de AAS dieron lugar a una reducción de hasta un 40% en la producción de prostaglandinas en la mucosa gástrica34.
El AAS produce lesiones locales pocos minutos después de su ingestión a través de un mecanismo no mediado por prostaglandinas35. De esta manera, en estudios en voluntarios sanos, el daño macroscópico de la mucosa gástrica fue descrito solo una hora después de la administración de AAS36, así como una marcada alteración de la integridad de la barrera mucosa gástrica. El AAS es muy lipofílico (pudiendo penetrar con facilidad en el tejido gástrico), lo que facilita su acumulación dentro de las células gástricas. Esta acumulación intracelular se ha correlacionado con una mayor probabilidad de destrucción37 de la membrana celular gástrica.
De forma concordante con estos mecanismos mixtos, la experiencia clínica ha mostrado que los efectos secundarios gastrointestinales no solamente son debidos a sus efectos tópicos, ya que el uso de AAS con cubierta entérica ha fallado en el objetivo de prevenir el desarrollo de úlceras gastroduodenales. Igualmente se ha visto que dosis bajas de AAS tomada en forma de cubierta entérica induce lesiones erosivas y úlceras en el intestino delgado.
Por tanto, el uso de AAS por factores exógenos y endógenos da lugar a un medio gástrico más susceptible a la formación de úlceras y complicaciones gastrointestinales como las úlceras y las hemorragias.
Manifestaciones clínicas gastrointestinales producidas por ácido acetilsalicílicoEl AAS afecta al tracto gastrointestinal inferior y superior, aunque los efectos sobre el tracto gastrointestinal inferior38 están menos caracterizados que los del tracto superior. Los efectos adversos sobre el tracto gastrointestinal superior pueden ser caracterizados en diferentes tipos:
- –
Síntomas. Hasta el 20% de los pacientes en tratamiento con AAS experimentarán síntomas de dispepsia, y aproximadamente el 10% de dichos pacientes presentaran úlcera38. Todo ello puede tener un impacto significativo en el manejo del paciente.
El proceso de daño gastrointestinal, que ocurre predominantemente en el tracto superior, en respuesta a AAS en bajas dosis es un proceso secuencial, pero no necesariamente progresivo, que va desde la aparición de erosiones a úlceras pépticas que pueden o no ser sintomáticas y pueden o no complicarse poniedo en peligro la vida del paciente39. Un estudio de 187 pacientes que tomaban AAS (75-325mg) sin asociar gastroprotectores presentaban una prevalencia de úlceras detectadas en una endoscopia en un 11% (IC 95%: 6,3-15,1%)38. Este estudio también evidenció que el 20% de los pacientes con úlcera en la endoscopia habían presentado síntomas epigástricos. Una incidencia similar de síntomas epigástricos estaban presentes en los pacientes sin evidencia de úlcera en la endoscopia.
La dispepsia asociada al tratamiento con AAS puede ser causa de baja adherencia al tratamiento y la interrupción de bajas dosis de AAS puede dar lugar a un aumento significativo del riesgo de complicaciones cardiovasculares38,38.
- –
Lesiones gastrointestinales debidas a AAS sin clara significación clínica. Un 30-50% de los pacientes que toman AAS desarrollan hemorragias subepiteliales, erosiones y con menos frecuencia ulceraciones. Estas lesiones son en su mayor parte asintomáticas, y se reducen o desaparecen con un uso continuado, probablemente gracias a un proceso de adaptación de la mucosa40. El antro gástrico es la localización más frecuentemente afectada. Dado el carácter asintomático de las mismas, se ignora su significado clínico real. Es evidente que la mayoría desaparecen con el uso continuado o la interrupción del tratamiento, pero no es menos cierto que muchas complicaciones aparecen sin la presencia previa de dispepsia, lo que indica que estas pueden desarrollarse de úlceras asintomáticas.
- –
Úlceras sintomáticas y complicaciones gastrointestinales. La presencia de daño gastrointestinal ha sido descrita con dosis de AAS tan bajas como 10, 30 y 50mg34,41,42. El daño superficial en la mucosa gastrointestinal (erosión) ocurre en alrededor del 50% en los pacientes asintomáticos en tratamiento con bajas dosis de aspirina. En algún momento del tratamiento, un 10% de estos pacientes presentaran úlceras pépticas38 y una proporción < 1% presentará eventualmente una complicación. Un estudio de casos y controles evidenció que la odds ratio de ingreso hospitalario debido a hemorragia por úlcera aumentó de 2,3 (IC 95% 1,2-4,4) con 75mg/día de AAS a 3,9 (IC 95% 2,5,6,3) con 300mg/día de aspirina27. En la misma línea, un metaanálisis de 31 estudios controlados aleatorizados concluyó que el riesgo de hemorragia fue mayor en los pacientes con AAS ≥ 100mg/día que con dosis < 100mg/día43. Esta dependencia de la dosis del riesgo de complicación gastroduodenal asociado a aspirina a dosis bajas no siempre ha sido confimada44, pero no es menos cierto que la mayoría de los estudios sí la encuentran45.
- –
Mortalidad. Los datos de mortalidad asociados al uso de AAS son escasos y en muchos casos no concluyentes. En nuestro medio, en el año 2001 se registraron 50.114 complicaciones gastrointestinales, de las que un mínimo de 18.191 complicaciones y 1.022 muertes fueron atribuidas al uso de AAS u otro AINE. El riesgo de mortalidad en este estudio estimado fue de 15,3 muertes/100.000 consumidores de AAS u otro AINE. Más de un tercio de estos fallecimientos se atribuyeron al uso de AAS en bajas dosis46.
Diferentes estudios ampliamente difundidos han identificado cuáles son los factores de riesgo asociados a eventos cardiovasculares, asociados a tratamiento con AAS47–49. El más importante es la presencia de historia previa de úlcera (complicada y no complicada) y la edad avanzada. Se considera que aquellos pacientes mayores de 70 años presentan un riesgo similar a aquellos con historia de úlcera péptica. La edad avanzada aumenta el riesgo un 4% al año, probablemente debido a la presencia de factores de riesgo asociados48.
El papel de Helicobacter pylori (H. pylori) en los pacientes que toman AAS ha sido analizado con resultados diversos49. La mayor parte de ellos señalan que en pacientes en tratamiento con AAS, la presencia de infección por H. pylori es un factor de riesgo para el desarrollo de úlceras y complicaciones47,50. Una reciente revisión de la evidencia disponible señala que no existen datos concluyentes y que se precisan más datos para realizar recomendaciones firmes39.
La asociación de otro AINE o un coxib al AAS es otro factor que aumenta el riesgo de desarrollar complicación gastrointestinal (5,6-7,5% eventos gastrointestinales/año). Varios estudios epidemiológicos han demostrado que el uso de AAS y un coxib o un AINE no selectivo aumentan el riesgo de hemorragia gastrointestinal, por encima del riesgo que presentan estos compuestos por separado51. La adición de AAS al tratamiento con AINE tradicionales, no selectivos, parece asociarse a un mayor riesgo de complicaciones gastrointestinales que la combinación coxib+AAS52. Estos beneficios desde el punto de vista gastrointestinal han de ser equilibrados con los efectos cardiovasculares, especialmente los compuestos de vida media larga.
Finalmente, estudios recientes consideran que la toma de corticoides o anticoagulantes también se asocia a riesgo aumentado de complicación gastrointestinal en el paciente tratado con AAS53,54.
Manejo del riesgo gastrointestinal y cardiovascularEl principal objetivo del tratamiento con agentes antiagregantes en prevención primaria y secundaria es disminuir la incidencia de eventos cardiovasculares.
Las estrategias para proveer el máximo beneficio con la terapia antiagregante a nuestros pacientes se centran en identificar los factores de riesgo y establecer la mejor terapia disponible.
Estrategias de prevención de los factores de riesgo modificablesEl uso de antiagregantes en pacientes de riesgo cardiovascular a 10 años (≥10% en varones y ≥20% en mujeres, según escala de riesgo cardiovascular de Framingham)1 está indicado como prevención primaria por el momento. Dado que el riesgo de complicaciones aumenta con la dosis, se ha demostrado que dosis bajas de AAS de 75mg son suficientes para mantener el efecto cardiovascular protector. La toma concomitante de AAS en bajas dosis y otros AINE con efecto inhibidor reversible de la COX-1 como ibuprofeno y naproxeno2,5,55 no debe realizarse al mismo tiempo, ya que en este caso y debido a las características farmacodinámicas del AAS (corta vida media, inactivación presistémica), la inhibición de la agregación plaquetaria a través de la COX-1 podría no ser irreversible al producirse potencialmente una competición para bloquear el receptor plaquetario por ambos fármacos. El mecanismo es una inhibición incompleta de la acetilación irreversible de la COX-1 plaquetaria debido a que el residuo catalítico de serina al que el AAS se une puede encontrarse ocupado temporalmente por ibuprofeno o naproxeno durante el corto tiempo en el que AAS está circulando en plasma. Esta interacción no ocurre con coxibs u otros AINE tradicionales con actividad COX-2 como diclofenaco. Basándose en los análisis de los datos que tenemos en la actualidad, la Food and Drug Administration (FDA) ha publicado un consenso56, afirmando que ibuprofeno puede inferferir con el efecto antiagregante de la aspirina en bajas dosis, potencialmente haciendo que sea menos efectiva cuando se usa con el objetivo de prevención de episodios vasculares cardíacos y cerebrales2,5,57–59.
Estrategias de prevención de riesgo gastrointestinal mediante antiulcerososLos pacientes con al menos un factor de riesgo de hemorragia gastrointestinal deben de tomar un fármaco antiulceroso, comúnmente llamados gastroprotectores.
- –
Misoprostol. Los estudios disponibles con AAS y misoprostol son limitados y no hay datos en prevención de complicaciones. Misoprostol ha mostrado ser superior a placebo en el desarrollo de erosiones (en voluntarios sanos) y en la recurrencia de úlceras gástricas (en pacientes con historia ulcerosa previa), asociada a AAS en bajas dosis60,61. Sin embargo, misoprostol se asocia con un alto porcentaje de efectos secundarios que da lugar al abandono del tratamiento hasta en un 20%62.
- –
Antagonistas de los receptores H2. El uso de estos fármacos puede suprimir la producción ácida gástrica entre un 37 y un 68% durante 24h63–65, y las dosis utilizadas en la práctica clínica habitual tienen un efecto moderado en los pacientes en tratamiento con AAS. Un metaanálisis evidenció que el uso de antagonistas-H2 no reducían significativamente el riesgo de úlceras sintomáticas entre los pacientes que toman AINE (RR ajustado; 1,46 [0,06–35,3]). En pacientes sin antecedentes de úlcera gastrointestinal previa, famotidina asociada a AAS en bajas dosis es efectiva para prevenir úlceras gastroduodenales66.
Por otro lado, un estudio aleatorizado, controlado a doble ciego67 fue realizado en 404 pacientes en tratamiento previo con bajas dosis de AAS, con el objetivo de comparar el efecto de famotidina o placebo en lo referente a la prevención de úlceras gástricas, duodenales y esofagitis erosiva. El estudio concluyó que la famotidina era eficaz en la prevención de úlceras y esofagitis erosiva en este grupo de pacientes (OR 0,13; IC 95% 0,07-0,24; p < 0,0001). A pesar de estas conclusiones, el estudio ha sido criticado con diferentes argumentos; el tamaño muestral calculado inicial era de 700 pacientes, y solamente llegaron a aleatorizarse 404 pacientes (310 finalmente); el hecho de tener criterios de exclusión muy estrictos (no permitir la toma de AINE, corticoides o tratamiento erradicador frente a H. pylori) limita la validez externa. Finalmente solo se hizo la última endoscopia a un porcentaje bajo en ambos grupos, concretamente al 18% (37/204) de los pacientes en tratamiento con famotidina y al 26,5% (53/200) del grupo con placebo, asumiéndose que en aquellos pacientes en los que no se realizó endoscopia (72 y 63%, respectivamente), de haberse realizado hubiera sido normal. Todas estas críticas limitan la aplicación en la práctica clínica habitual de este estudio. A todos estos datos hay que añadir el hecho de que el cumplimiento terapéutico de los IBP parece ser mejor que el de los anti-H2.
Por otro lado, recientemente ha sido publicado un ensayo clínico aleatorizado68, controlado a doble ciego de 160 pacientes en tratamiento con 80mg de AAS (debido a causas cardiovasculares, vasculares cerebrales y diabetes mellitus) con antecedentes de úlceras/lesiones gastrointestinales comparando famotidina en alta dosis (80mg/día) frente a pantoprazol (20mg/día). El objetivo principal del estudio fue el estudio del desarrollo de nuevas úlceras en el estómago, en el duodeno o esofagitis 12 semanas tras la aleatorización (se realizó endoscopia antes de la aleatorización y al final del estudio). La hemorragia gastrointestinal fue más frecuente en el grupo de famotidina (7,7%) que en el de pantoprazol (0%, IC 95%: 0,02-1), así como los episodios de dispepsia causados por úlceras/erosiones, siendo mayor en el grupo de famotidina (12,3%) que en el de IBP (0%, IC 95%: 0,06-1). Datos observacionales indican que los IBP son más efectivos que los anti-H2 a la hora de prevenir episodios de hemorragia del tracto gastrointestinal superior. En una cohorte de 987 pacientes en tratamiento con AAS y clopidogrel, el uso de IBP dio lugar una mayor reducción de los episodios de sangrado del tracto gastrointestinal superior (OR: 0,04; IC 95%: 0,002 A 0,21) que el uso con anti-H2 (OR: 0,43; IC 95%: 0,18 a 0,91)69.
- –
Inhibidores de la bomba de protones. Los IBP reducen la secrección ácida gástrica de forma notable y prolongada70. Como se ha señalado anteriormente, los IBP son mucho más efectivos que los anti-H2 en el tratamiento y prevención de úlceras pépticas por AINE. La información es más limitada con AAS. En estudios de casos y controles el uso de IBP se asoció con una redución significativa (> 70%) del riesgo de complicaciones gastrointestinales entre AINE tradicionales o no, AAS a bajas dosis y clopidogrel71. En un estudio de cohortes72 retrospectivo realizado en pacientes en tratamiento con clopidogrel ingresados por IAM, o revascularización coronaria o angina inestable y cuyo objetivo primario era evaluar la asociación entre el uso de IBP, clopidogrel y el riesgo de ingresar debido a una hemorragia digestiva o a un evento mayor cardiovascular, el riesgo de hemorragia gastroduodenal con AAS fue de un 1,2% al año y se redujo un 50% en los pacientes a los que se había prescrito IBP. El uso de IBP se asoció a una reducción del riesgo absoluto de sangrado gastrointestinal de un 2,8% al año en pacientes con 3 o más factores de riesgo de hemorragia gastrointestinal. En otro estudio de casos y controles73 con 2.779 pacientes con hemorragia gastrointestinal superior confirmada con endoscopia y 5.532 controles, el uso concomitante de IBP y una tienopiridina se asoció a menor número de sangrados del tracto superior (RR: 0,19; IC 95%: 0,07 a 0,49) que el uso de una tienopiridina de forma aislada. Otros estudios de cohortes de menor tamaño parecen confirmar estos hallazgos74. En un reciente ensayo clínico27, los pacientes con enfermedad cardiovascular en tratamiento con AAS en baja dosis que fueron aleatorizados a recibir clopidogrel y omeprazol presentaron menos eventos gastrointestinales (objetivo compuesto de sangrado oculto, úlcera gastroduodenal sintomática o erosiones gastrointestinales) que los pacientes aleatorizados a tomar coterapia con clopidogrel solo (HR: 0,34; IC 95%: 0,18 a 0,63).
En definitiva, los datos anteriormente mencionados señalan que la coterapia con IBP es muy eficaz en la prevención de lesiones y complicaciones del tracto gastrointestinal superior asociadas al tratamiento con AAS y que el tratamiento con IBP en pacientes con AAS puede equilibrar el riesgo-beneficio en pacientes de alto riesgo cardiovascular y alto riesgo gastrointestinal, disminuyendo el riesgo de complicaciones hemorrágicas gastrointestinales y evitando así la interrupción de la antiagregación.
En la misma línea de lo comentado sobre la posible interacción entre los IBP y clopidogrel, una guía de práctica clínica recientemente publicada63 recomienda la utilización de IBP en pacientes de riesgo de hemorragia gastrointestinal dada la inconsistencia con los datos actuales de la teoría del posible aumento de episodios cardiovasculares debido a una interacción entre el clopidogrel y los IBP.
Sustitución del ácido acetilsalicílico por otro agente antiagreganteEl estudio CAPRIE (Clopidogrel versus Aspirin in Patients at Risk of Ischaemic Events) realizado en 19.185 pacientes, mostró que clopidogrel 75mg/día, en pacientes con enfermedad vascular, era más efectivo que AAS en reducir el riesgo combinado de ictus isquémico, IAM o muerte de origen vascular que 325mg/día de AAS (p=0,043) (RR 8,7%; IC 95%: 0,3-16,5) (aunque no el RR de IAM de forma aislada, p=0,66)75. Clopidogrel presentaba menor incidencia de dispepsia que 325mg/día de AAS (15,01 vs. 17,06%), sangrado en el tracto gastrointestinal sin identificar (1,99 vs. 2,66%) y hemorragia gastrointestinal grave (0,49 vs. 0,71%). Sin embargo, un estudio epidemiológico de casos y controles con bajas dosis de AAS y clopidogrel mostró que el RR de sangrado gastrointestinal era igual entre usuarios de clopidogrel y AAS (3,1 [IC 95%: 2,2- 4,4] y para 100mg/día de AAS vs. 3,6 [IC 95%: 2,9-4,3])45. Estos datos han sido confirmados en pacientes de riesgo en 2 ensayos de tamaño muestral reducido, donde clopidogrel solo se vio asociado a una alta incidencia de recurrencia de hemorragia digestiva por úlcera péptica. Así, en un ensayo clínico con 320 pacientes en tratamiento previo con AAS con historia de hemorragia gastrointestinal y H. pylori en el cribado realizado, fueron aleatorizados a tratamiento con clopidogrel y placebo frente a AAS en bajas dosis y esomeprazol76. Después de 12 meses, el porcentaje de recurrencia de hemorragia gastrointestinal superior (objetivo principal del estudio) fue del 8,6% para clopidogrel y de 0,7% para la combinación de baja dosis de AAS y esomeprazol.
Tras un síndrome coronario agudo el AAS se debe prescribir conjuntamente con clopidogrel y un anticoagulante. Para evaluar el efecto gastrointestinal de estas terapias en la práctica clínica habitual, un estudio77 retrospectivo con el objetivo de evaluar los episodios de hemorragia gastrointestinal superior, en pacientes tras un síndrome coronario agudo en tratamiento con AAS, clopidogrel y enoxaparina llevado a cabo en 666 pacientes (ingresados entre 2002 y 2006) evidenció que la incidencia de una hemorragia gastrointestinal era de un 2,7% y que la coprescripción de IBP podría reducir significativamente el riesgo de hemorragia (OR ajustado 0,77; IC 95%: 0,01-0,26; p < 0,001).
La combinación de AAS y esomeprazol se ha comparado con clopidogrel con respecto a la prevención de úlceras gastrointestinales. En un estudio prospectivo aleatorizado a doble ciego tras tratamiento erradicador de 170 pacientes que habían presentado úlcera gastrointestinal tras tratamiento con AAS78. El estudio con un seguimiento medio de un año, mostró que la incidencia de úlcera recurrente era de un 13,6% en el grupo de clopidogrel y de un 0% en el grupo con AAS y esomeprazol.
En otro estudio se comparó el efecto de clopidogrel y omeprazol frente a AAS y omeprazol en 129 pacientes que habían presentado úlcera péptica secundaria a tratamiento con AAS con un seguimiento medio de 8 semanas79. No se evidenciaron diferencias significativas con respecto a la incidencia de nuevas úlceras: 45% en el grupo de clopidogrel y omeprazol frente a 42% en el grupo de AAS y omeprazol (p=0,7).
Con estos datos, se puede concluir que en pacientes de riesgo gastrointestinal, clopidogrel aisladamente no es una alternativa segura en casos de alto riesgo de hemorragia digestiva.
Erradicación de Helicobacter pyloriDos estudios80,81 han abordado este aspecto. El primero llevado a cabo en 482 pacientes con historia de hemorragia digestiva del tracto superior infectados por H. pylori y en tratamiento concomitante con AAS en bajas dosis. En objetivo del estudio fue evaluar el impacto de la erradicación de H. pylori frente al tratamiento gastroprotector. En este grupo de pacientes, el tratamiento erradicador fue equivalente al tratamiento con omeprazol con respecto a prevenir sangrado recurrente. En el otro estudio81 con 123 pacientes que habían presentado una complicación ulcerosa tras tratamiento con AAS e infección por H. pylori y fueron tratados con tratamiento erradicador. Los pacientes, todos ellos en tratamiento con AAS durante los 12 meses del estudio, fueron aleatorizados a tratamiento con lansoprazol o placebo. El estudio puso de manifiesto que el tratamiento con lansoprazol redujo la recurrencia de complicaciones ulcerosas, siendo el riesgo de aquellos en tratamiento con placebo mayor, cociente de riesgo 9,6 e IC 95% de 1,2-76,1.
Con estos datos, hoy se considera que la mejor opción para reducir el riesgo de hemorragia gastrointestinal en pacientes de alto riesgo es el tratamiento erradicador en caso de infección de H. pylori en los pacientes con historia ulcerosa previa y añadir un gastroprotector, y con la evidencia actual, preferiblemente un inhibidor de la bomba de protones.
Interrupción de la terapia antiagregante en casos de hemorragiaEn los pacientes que toman dosis bajas de AAS y que presentan un episodio de hemorragia digestiva alta se aconseja habitualmente interrumpir la terapia antiagregante hasta la resolución del episodio62,63. En muchos casos la práctica habitual era interrumpir el tratamiento hasta que la úlcera hubiera cicatrizado, lo cual ocurre en 4-8 semanas, pero esto no se aconseja en el momento actual y parece razonable reintroducir la antiagregación lo antes posible (antes del alta)82.
En los casos de pacientes que incidentalmente presentan úlceras sangrantes activas y que han sufrido un síndrome coronario agudo durante el último año, o haber sido revascularizados percutáneamente con un stent en los meses previos se debe tener presente que la interrupción de AAS aumenta el riesgo de un episodio trombótico en pacientes con enfermedad cardiovascular reciente, mientras que persistir con antiagregantes puede provocar sangrado continuo y empeorar el pronóstico en este grupo. En este contexto se deben valorar los datos clínicos, la estabilidad hemodinámica y los cambios en los factores de la coagulación inducidos por el episodio hemorrágico, que en caso de persistir pueden incrementar el riesgo de complicaciones sistémicas graves con riesgo de poner en peligro la vida del paciente71.
Un estudio83 ha evaluado la reintroducción precoz de AAS en pacientes con enfermedad cardiovascular que habían presentado un episodio de úlcera hemorrágica aguda tan pronto como el paciente recibe terapia endoscópica de su ulcus sangrante. Se evidenció una tendencia a un mayor porcentaje de úlcera recurrente hemorrágica en el grupo con AAS (18,9%) frente a placebo, aunque las diferencias no fueron significativas. Sin embargo, la interrupción de AAS se asoció con un aumento significativo de la mortalidad global y la asociada a episodios cardiovasculares a los 30 días del episodio hemorrágico.
Es importante señalar que la colaboración entre cardiólogos y gastroenterólogos es fundamental a la hora de valorar los riesgos de hemorragia y trombosis con respecto a la suspensión o reintroducción precoz del tratamiento antiagregante en pacientes con riesgo cardiovascular alto.
Valoración de los beneficios y los riesgos en el paciente individual en tratamiento con bajas dosis de ácido acetilsalicílicoCon la evidencia actual y siguiendo las guías de práctica clínica, el tratamiento con AAS está indicado en la prevención primaria en hombres con riesgo de enfermedad coronaria moderada y alta en mujeres1. En el caso de los diabéticos, por el momento, se debe indicar si el riesgo a 10 años es ≥10%1,84. Estas guías asumen de forma implícita que el riesgo absoluto de complicaciones hemorrágicas es constante, bajo e independiente del riesgo vascular, o que depende principalmente de la edad. Sin embargo, un artículo publicado recientemente3 muestra que los factores de riesgo para un evento coronario lo son también para un episodio de sangrado.
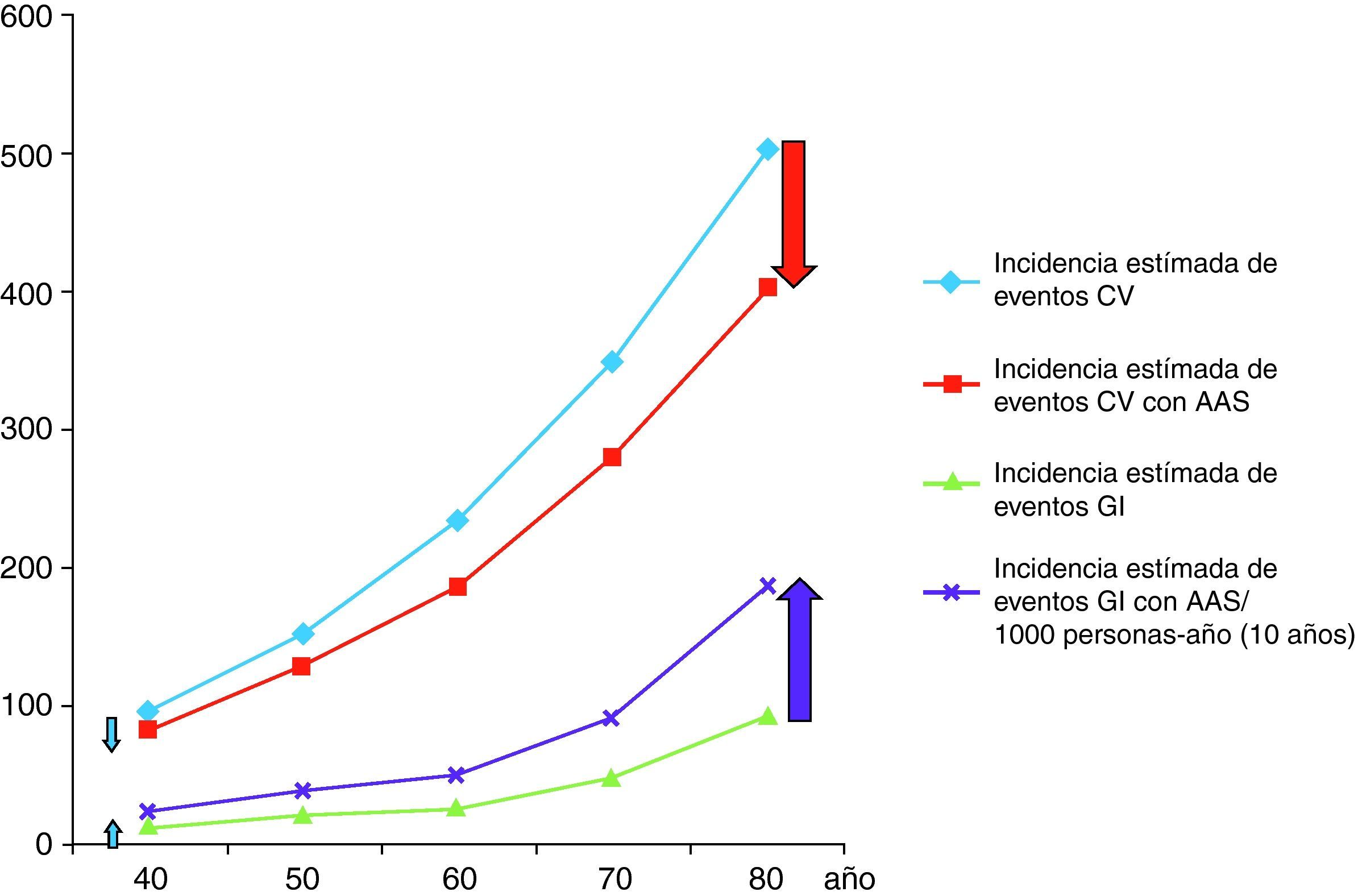
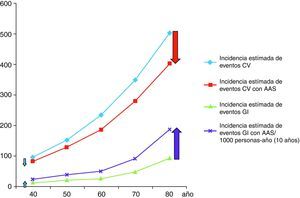
Nuestra aproximación es que el riesgo gastrointestinal es constante en el tiempo pero diferente en dependencia de los factores de riesgo del paciente. Para ilustrar esta aproximación describimos el contexto del riesgo y beneficio en pacientes tipo (fig. 1):
- 1.
Así, pacientes de 70 años, varones, con colesterol total de 220mg/dl, HDL 40mg/dl, fumadores, normotensos, no diabéticos y sin historia de hemorragia gastrointestinal presentan un riesgo de un 39,16% de tener un evento cardiovascular en 10 años85. Si toman AAS disminuirán el riesgo de tener un evento cardiovascular en 78 eventos cardiovasculares/1.000 pacientes en 10 años, pero a costa de presentar 90 episodios de hemorragia digestiva/1.000 pacientes/10 años (45 de ellos atribuidos a AAS). Al añadir un IBP, y con la evidencia disponible en la actualidad que indica que los IBP disminuyen el riesgo de hemorragia digestiva un 70%, el número de hemorragias gastrointestinales evitadas por un IBP será de 54/1.000 pacientes/10 años85.
- 2.
Si estos mismos pacientes presentan antecedentes de úlcera no complicada su riesgo cardiovascular en 10 años es similar (392/1.000 pacientes/10 años), y el tratamiento con AAS disminuirá su riesgo cardiovascular en igual magnitud, pero a costa de presentar 540 episodios de hemorragia digestiva/1.000 pacientes/10 años (270 de ellos atribuidos a AAS). Al añadir un IBP, el número de hemorragias gastrointestinales prevenidas por un IBP será de 324/1.000 pacientes/10 años. Dado que este paciente tiene historia ulcerosa previa la erradicación de H. pylori está recomendada, lo cual debiera reducir la probabilidad de recurrencia hemorrágica a valores próximos a los de la población normal.
- 3.
En el caso de mujeres diabéticas tipo 2, normotensas, con colesterol total de 180mg/dl, HDL 40mg/dl, no fumadoras y sin historia de hemorragia gastrointestinal el riesgo de tener un evento cardiovascular en 10 años es del 15,4% (154/1.000 pacientes/10 años). Si se prescribe AAS, su cardiovascular se reducirá en 23 eventos cardiovasculares/1.000 pacientes/10 años, pero a costa de presentar 72 episodios de hemorragias digestiva/1.000 pacientes/10 años (36 de ellos atribuidos a los AINE). Al añadir un IBP, si asumimos una reducción del riesgo del 70%, el número de hemorragias gastrointestinales prevenidas por un IBP será de 43/1.000 pacientes/10 años85.
- 4.
En el caso de mujeres de 60 años, no diabéticas, normotensas, con colesterol total de 180mg/dl, HDL 40mg/dl, pero fumadoras y sin historia de hemorragia gastrointestinal, el riesgo cardiovascular es del 17,27% (172 eventos/1.000 pacientes/10 años). Si toman AAS (a pesar de no estar indicada en este caso por tratarse de riesgo intermedio ≤ 20%) disminuirán su riesgo de tener un evento cardiovascular en 26 eventos cardiovasculares/1.000 pacientes/10 años, pero a costa de presentar 24 episodios de hemorragia digestiva/1.000 pacientes/10 años (12 de ellos atribuidos al AAS). El riesgo hemorrágico de tomar AAS en este grupo de pacientes no se ve contrarrestado con el posible beneficio cardiovascular de su utilización.
En la actualidad las guías clínicas, con la idea de maximizar el efecto cardioprotector del AAS, recomiendan utilizar AAS como prevención primaria de forma arbitraria cuando el riesgo de un evento coronario supere un umbral arbitrario del 0,6 al 2,0% al año. Estas guías clínicas asumen que el riesgo de complicación hemorrágica es constante y que depende solamente de la edad. Sabemos que esto no es cierto y que otros factores pueden incrementar el riesgo de foma notable. Además, los diferentes metanálisis publicados en las últimas fechas ya comentados previamente en esta revisión3,5 muestran que el uso de AAS en prevención primaria en el conjunto de eventos vasculares graves tiene un valor incierto con respecto a la reducción de eventos oclusivos y que es necesario valorar el riesgo de complicaciones hemorrágicas mayores (intracraneales, gastrointestinales).
En este sentido, es necesario tener en cuenta 3 aspectos fundamentales: a) la mayor parte de los ensayos clínicos en prevención primaria no han podido demostrar una significación estadística en el objetivo primario: prevención de enfermedad oclusiva vascular (el conjunto de IAM, AVC y muerte de origen vascular)3,5, y esto ha dado lugar a que no haya sido aprobada la indicación generalizada en la mayor parte de países; b) los 6 ensayos de prevención primaria de AAS se iniciaron hace 2 y 3 décadas, cuando los factores de riesgo cardiovascular se manejaban de forma menos agresiva (por ejemplo, tabaco, colesterol, hipertensión), esto puede dar lugar a que se sobrestime el beneficio del AAS; c) los pacientes con alto riesgo cardiovascular en muchos casos son pacientes de alto riesgo de hemorragia gastrointestinal. Este grupo de pacientes de alto riesgo fue excluido de los ensayos de AAS en prevención primaria, y de esta manera se ha infraestimado el riesgo de hemorragia en la población general. Los pobres resultados de estos ensayos pueden reflejar una selección inadecuada de los sujetos al excluir aquellos con más riesgo de hemorragia, así como también haber incluido un número insuficiente para llegar a conclusiones adecuadas. Los nuevos estudios en prevención primaria que se están llevando a cabo (ASCEND, ACCEPT-D, ASPREE, ARRIVE) arrojarán más datos sobre el verdadero efecto de la terapia antiagregante en prevención primaria en pacientes de alto riesgo.
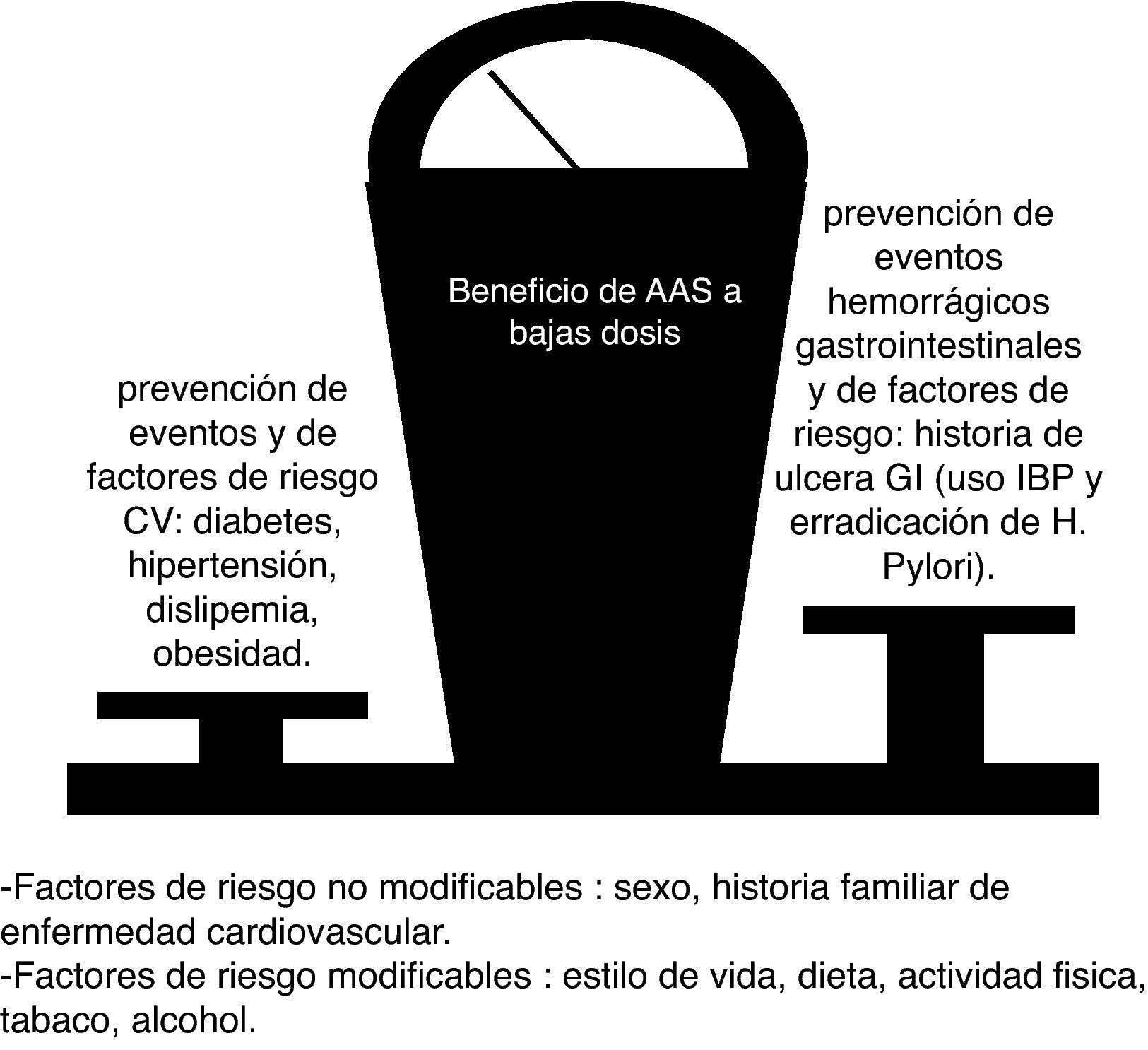
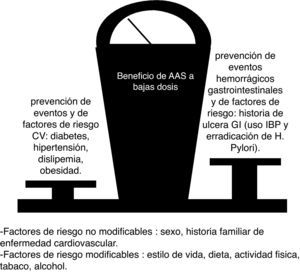
Tras sufrir un infarto agudo de miocardio y un síndrome coronario agudo la antiagregación con AAS sigue siendo fundamental en el manejo inicial. El tratamiento con AAS en dosis de 75-100mg al día con el objetivo de preveción secundaria representa tras un infarto la primera opción para prevenir las recurrencias. El efecto antiagregante complementario de clopidogrel y AAS ha sido probado en el síndrome coronario agudo en diferentes estudios, estando claramente indicado en el manejo actual. El beneficio de la terapia antigregante sola o combinada con clopidogrel en prevención secundaria ha sido puesto de manifiesto de forma inequívoca86. Es esencial que para que este beneficio sea óptimo se reduzcan al máximo los riesgos. La coterapia con IBP y/o erradicación de H. pylori, como se ha señalado anteriormente, son factores esenciales para conseguir esos objetivos (fig. 2).
FuturoActualmente diferentes empresas farmacéuticas trabajando con la FDA están iniciando el diseño para obtener mayor información que ayudará a entender y caracterizar los efectos de las variaciones genéticas y las interacciones farmacológicas relacionadas con CYP2C19 con respecto a la eficacia y seguridad de clopidogrel24. Aún quedan muchos interrogantes por responder con respecto al metabolismo, activación y efecto antiagregante del clopidogrel. Es necesario investigar más profundamente la nueva línea de activación descrita reciente, la paraoxoasa-1 (PON1) ya que podría explicar gran parte de la variabilidad clínica con el uso del clopidogrel.
Además, otros estudios de prevención primaria están en marcha seleccionando a pacientes con riesgo cardiovascular alto (≥2% al año), debido a diabetes mellitus (ASCEND y ACCEPT-D), edad avanzada (ASPREE) o varios factores de riesgo sin incluir diabetes (ARRIVE).
El beneficio adicional de la doble terapia de antiagregación con clopidogrel y AAS frente a AAS de forma aislada en pacientes con múltiples factores de riesgo cardiovascular hasta el momento ha sido modesta e inconsistente (CHARISMA). La adición de clopidogrel en este grupo mostró ser solamente una fracción del beneficio alcanzado con AAS en este grupo de riesgo. Estos resultados han dado lugar a pensar que el papel de los bloqueadores de ADP en aterotrombosis podría haber sido infraestimado en estos grupos, debido a un bloqueo incompleto y variable de la agregación plaquetaria inducida por ADP por el fármaco. De forma concordante con esta hipótesis, prasugrel da lugar a un mayor nivel de inhibición de la agregación por ADP y una menor variabilidad de la respuesta que el clopidogrel y puede ser una alternativa en pacientes con síndrome coronario agudo que van a ser intervenidos. Prasugrel reduce los eventos cardiovasculares en aproximadamente un 20% más que clopidogrel, aunque aumenta las hemorragias mayores en un tercio y de forma significativa los sangrados fatales con respecto a clopidogrel87. Al contrario que clopidogrel, prasugrel teóricamente no se vería afectado por los polimorfismos genéticos de las isoenzimas CYP. Sin embargo, en el análisis combinado de 2 ensayos de clopidogrel y prasugrel88, la ratio de muerte de origen cardiovascular, IAM o AVC fue similar para todos los IBP y no se evidenciaron diferencias en los pacientes que no los tomaban.
El ensayo clínico PLATO, recientemente publicado89, diseñado con el objetivo de evaluar la eficacia y seguridad de ticagrelor frente a clopidogrel en 13.408 pacientes tras síndrome coronario agudo ha mostrado que los pacientes en tratamiento con ticagrelor presentaban significativamente menor incidencia del conjunto de eventos: muerte, IAM o AVC a un año de seguimiento (HR 0,84; IC 95%: 0,75-0,94; p=0,0025). El estudio también mostró que no había diferencia con respecto al número de eventos hemorrágicos mayores (11,5 vs 11,6%), aunque sí había diferencias significativas con respecto al número de eventos hemorrágicos mayores y menores no debidos a cirugía de revascularización coronaria (8,9 vs 71%, HR 1,26; IC 95%: 1,1-1,26; p=0,004).
Por otro lado, teniendo en cuenta las características farmacocinéticas del clopidogrel y los IBP, se ha sugerido que el momento de la dosificación puede ser importante en caso de que exista interacción entre ambos. Esta teoría está basada en el hecho de que la vida media de ambos compuestos es menor de 2h, y las interacciones pueden ser minimizadas de esta forma, incluso en caso de metabolizadotes lentos de CYP2C19. En un estudio cruzado llevado a cabo en 72 voluntarios sanos90, a los que se administró dosis estándar de clopidogrel y dosis supraterapéuticas de omeprazol (80mg/día), mostró que la inhibición de la agregación plaquetaria fue mayor cuando las drogas se administraron con 12h de separación.
En el contexto actual donde es posible estimar el riesgo de un evento cardiovascular en función de unos factores de riesgo conocidos, es necesario disponer de otras herramientas para estimar el riesgo de un evento hemorrágico gastrointestinal al iniciar el tratamiento con AAS y/o clopidogrel.
En los próximos tiempos nos encontraremos con herramientas que nos ayudarán a analizar cuantitativamente el efecto beneficioso o pernicioso de iniciar diferentes terapias gastroprotectoras en pacientes en tratamiento antiagregante en función de los factores de riesgo vasculares y gastrointestinales.
Conclusiones- 1.
La antiagregación en los pacientes en prevención cardiovascular primaria o secundaria ha experimentado cambios muy significativos durante los últimos 20 años, pasando de uno a ocho antiagregantes plaquetarios en el arsenal farmacéutico con otros muchos fármacos en desarrollo.
- 2.
La evaluación cuantitativa del riesgo hemorrágico gastrointestinal (la edad ≥ 70 años, historia ulcerosa previa, infección por H. pylori, toma simultánea de anticoagulantes orales, AINE o corticoides) ha ido por detrás del desarrollo y la validación de herramientas terapéuticas para evitar complicaciones vasculares. Una gran parte de la información sobre los determinantes del riesgo hemorrágico está disponible en estudios observacionales, pero la información en los ensayos clínicos es limitada.
- 3.
A la luz de las limitaciones metodológicas importantes en lo que respecta a la interacción entre IBP y clopidogrel, la falta de evidencia de una hipótesis plausible metodológicamente tanto en este aspecto como en el caso de resistencia al AAS, la tendencia actual de retirar los IBP no está justificada y puede hacer más daño que beneficio en pacientes de alto riesgo de hemorragia gastrointestinal.
- 4.
Debe enfatizarse el hecho de que el tratamiento concomitante con múltiples fármacos puede modificar el balance riesgo/beneficio del tratamiento antiagregante, debido a las interacciones farmacocinéticas (clopidogrel) y farmacodinámicas (aspirina) con los diferentes tipos de antiagregantes utilizados, a modificar el riesgo de episodios vasculares con otras medicaciones que disminuyen el riesgo cardiovascular global (estatinas) o al uso de agentes que aumentan el riesgo de hemorragia digestiva (anticoagulantes y AINE).
- 5.
La elección individualizada de uno o más antiagregantes específicos y la dosificación para cada paciente de forma individualizada parece una opción realista en un futuro próximo. Es necesaria la utilización de herramientas para cuantificar la disminución del riesgo del tratamiento antiagregante tanto en prevención primaria como secundaria de episodios vasculares, así como la cuantificación del beneficio de añadir un fármaco gastroprotector en pacientes con riesgo de hemorragia gastrointestinal.
Los autores declaran no tener ningún conflicto de intereses.