La aparición de los análogos de nucleós(t)idos ha sido uno de los avances más importantes en el tratamiento de la hepatitis crónica por infección del virus de la hepatitis B. Los primeros antivirales empleados presentaban una eficacia limitada por la tasa de resistencias elevada pero en los últimos años han aparecido nuevas moléculas (tenofovir, entecavir) con mayor potencia antiviral y menor tasa de resistencias, y por ello las guías clínicas más actuales los consideran de primera elección. No obstante, el interferón todavía puede tener un papel relevante en el tratamiento de la hepatitis B en pacientes seleccionados. Además, en determinadas circunstancias como la insuficiencia renal, el embarazo o la inmunodepresión no se ha definido con exactitud el papel de los nuevos antivirales orales.
En esta revisión se analizan estos aspectos, así como algunas peculiaridades del manejo de los pacientes tratados con análogos de nucleós(t)idos.
One of the most important advances made in the treatment of chronic hepatitis B infection has been the development of nucleos(t)ide analogues. The first antiviral agents used had limited efficacy due to the high resistance rate. However, in the last few years, new agents (tenofovir, entecavir) have been developed with greater antiviral potency and a lower resistance rate. Consequently, these agents are considered to be the treatment of choice in the most recent clinical guidelines. Nevertheless, interferon may still play an important role in the treatment of hepatitis B in selected patients. Moreover, in some contexts, such as renal insufficiency, pregnancy or immunosuppression, the role of the new oral antiviral agents has not been precisely defined.
The present review analyzes these aspects, as well as some of the particular features of the management of patients treated with nucleos(t)ide analogues.
La aparición de los análogos de nucleósidos y nucleótidos ha sido uno de los avances más importantes en el tratamiento de la hepatitis crónica por infección del virus de la hepatitis B (VHB). El primer fármaco de administración oral que se aprobó fue la lamivudina en 1998, y posteriormente se han incluido otros 4 (adefovir, tenofovir, entecavir y telbivudina). También hay una combinación de emtricitabina y tenofovir (Trubada®), aprobada para el tratamiento de la infección por el virus de la inmunodeficiencia humana (VIH), y con eficacia demostrada frente al VHB.
El VHB es un virus ADN que se replica casi exclusivamente en los hepatocitos, aunque se han detectado bajos niveles de replicación en otros tejidos como páncreas, riñón y linfocitos. Una vez que el virus entra en la célula hepática, la cápside se transporta hasta el núcleo donde se libera el ADN viral que formará el ADNccc (ADN circular covalentemente cerrado) a partir del cual se sintetizan los ARNm que, una vez pasan al citoplasma, dirigen la síntesis de las diferentes proteínas que darán lugar a las nuevas partículas virales. El HBcAg polimeriza alrededor del complejo de ribonucleoproteínas que contiene el genoma en forma de ARN para constituir las cápsides inmaduras. En éstas, a partir del ARN y mediante la polimerasa viral, que tiene acción transcriptasa inversa similar a la del VIH, se sintetizan las nuevas cadenas de ADN, con la consiguiente maduración de las partículas virales que pueden seguir 2 caminos: volver al núcleo para replecionar el ADNccc o bien pueden unirse al HBsAg acumulado en el retículo endoplásmico adquiriendo la envoltura y pudiendo salir de la célula para infectar otras células.
En el caso de que la infección se resuelva, la acción de las citocinas y los linfocitos T consigue eliminar la mayor parte del ADNccc, si bien se ha visto que con técnicas sensibles se puede detectar ADN viral en pacientes con infección resuelta1,2, lo que justificaría la reactivación de la infección en determinadas circunstancias. En la infección crónica, el ADN también puede integrarse en el genoma del hepatocito, y este ADN que no tiene participación en los procesos replicativos parece desempeñar un papel importante en el desarrollo de hepatocarcinoma.
Evidentemente, esto tiene implicaciones a la hora de plantear el tratamiento de la hepatitis B crónica, puesto que el mecanismo de acción del interferón alfa y de los análogos de núcleos(t)idos es diferente.
Objetivos del tratamientoEl objetivo final del tratamiento de la hepatitis crónica B es evitar el desarrollo de cirrosis hepática, hepatocarcinoma y, en última instancia, la muerte relacionada con la infección por VHB. El fármaco ideal sería aquel que lograse la erradicación del virus, con la consiguiente desaparición del HBsAg y la seroconversión a anti-HBs, pero estos objetivos difícilmente se logran con los fármacos disponibles porque el ADN viral queda integrado en el genoma del hepatocito, el VHB no puede ser erradicado completamente y, por lo tanto, la curación es difícil de conseguir.
Desde un punto de vista práctico, el objetivo fundamental del tratamiento es la disminución de los niveles de ADN viral hasta que sea indetectable con técnicas sensibles (PCR en tiempo real), es decir, la respuesta viral completa. Ello va asociado a la denominada respuesta bioquímica con normalización de los valores de ALT y AST, así como a una mejoría histológica3. En los pacientes con HBeAg positivo un objetivo adicional es la seroconversión a antiHBe.
Fármacos disponiblesInterferón αEl interferón α (IFNα) es una citocina clave del sistema inmune innato, siendo el IFN estándar el primer fármaco empleado en el tratamiento de la hepatitis crónica B4. Posteriormente se desarrolló una nueva preparación en la que se añadió al IFN una molécula de polietilenglicol (IFN «pegilado»), lo que reduce la excreción renal, prolonga la vida media del fármaco y permite la administración semanal. El IFN actúa mediante la unión a receptores de la membrana celular y activa una cascada de segundos mensajeros que ponen en marcha mecanismos de defensa intracelular y estimulan el desarrollo de la respuesta inmune adaptativa: supresión de la síntesis de proteínas virales, degradación del ARNm viral, prevención de la infección viral, favorece la presentación de antígenos por las moléculas HLA I y HLA II, activación de otras células inmunes (natural killer, etc.) y aumento de la producción de citocinas5. Esta respuesta inmune puede lograr (con un tratamiento de duración finita) la eliminación del virus y una respuesta duradera, si bien solamente se consigue en una proporción pequeña de los pacientes tratados. Además, como el IFN es un inhibidor indirecto del VHB que actúa a través de efectores del huésped, no hay evidencia de que el VHB desarrolle resistencias frente a él. Las principales desventajas son la administración subcutánea y los efectos secundarios.
Análogos de núcleos(t)idosLa polimerasa del VHB desempeña un papel crucial en la replicación del virus, por lo que puede ser una diana excelente para el tratamiento de la infección crónica por VHB. Los análogos de núcleos(t)idos son fosforilados por las enzimas intracelulares para formar nucleósidos trifosfato que actúan como inhibidores selectivos competitivos de la polimerasa al competir con los nucleótidos en la unión al sitio activo de la enzima. Una vez son incorporados al ADN conllevan la finalización de la elongación de la cadena, bloqueándose la síntesis de ADN y formando viriones no infectivos. Pueden interferir tanto la síntesis de la hebra negativa de ADN como la positiva, y posiblemente también la del ADNccc de las células infectadas recientemente6.
Los análogos de los núcleos(t)idos son fármacos que se administran por vía oral y son muy bien tolerados, por lo que la adherencia puede ser superior a la del IFN. Por el contrario, aunque se logren reducciones rápidas de la viremia, no logran eliminar el VHB por lo que el tratamiento ha de ser indefinido.
Otro de los inconvenientes de estos fármacos es el desarrollo de mutaciones del VHB que confieren resistencia al tratamiento7. Estas mutaciones aparecen en la transcriptasa inversa y tienen como consecuencia una reducción de la afinidad por el fármaco frente al que aparecen. Las resistencias son más frecuentes cuando se mantiene un nivel de replicación viral bajo durante el tratamiento, lo que permite la selección de cepas mutantes resistentes. Por otra parte, hay que tener en cuenta la posibilidad de resistencias cruzadas a varios fármacos de la misma familia bioquímica.
Los análogos de núcleos(t)idos se dividen en varios grupos, de acuerdo con la estructura química:
- –
L-nucleósidos: lamivudina y telbivudina.
- –
Fosfonatos acíclicos: adefovir y tenofovir.
- –
Grupo ciclopentano: entecavir.
Aunque se aduce que estos fármacos presentan pocos efectos secundarios, hay algunos que pueden ser importantes y que hay que tener en cuenta. Aproximadamente en el 3% de los pacientes tratados con adefovir se ha observado algún grado de toxicidad renal, principalmente elevaciones de la cifra de creatinina8. El tratamiento con telbivudina se ha asociado a miopatía y neuropatía9,10 habiéndose detectado niveles de creatincinasa significativamente superiores en los pacientes tratados con telbivudina en comparación con los tratados con lamivudina. En relación con el tenofovir, se ha comunicado la aparición de síndrome de Fanconi, insuficiencia renal, osteomalacia y disminución de la densidad ósea11–13.
Cuándo tratarLa primera decisión que se debe tomar ante un paciente al que se ha diagnosticado hepatitis B crónica es la de si necesita o no tratamiento.
Están bastante claros los grupos de pacientes que, de entrada, no necesitan tratamiento:
- –
Pacientes en fase de inmunotolerancia, caracterizada por transaminasas normales, niveles elevados de ADN viral e histología normal (en principio no hay indicación de hacer biopsia hepática).
- –
Portadores inactivos de VHB caracterizados por niveles bajos de ADN viral (< 2.000 UI/ml) y transaminasas normales, que hay que distinguir de los sujetos con hepatitis HBeAg- en los que hay baja carga viral y periodos prolongados de transaminasas normales. El seguimiento a largo plazo permite caracterizar a unos y otros porque en los HBeAg- suelen elevarse el ADN y la ALT.
- –
Tampoco deben tratarse los casos de hepatitis B oculta o latente (HBsAg- con ADN detectable).
Las diferentes guías y conferencias de consenso están de acuerdo en que, en líneas generales, todo paciente con replicación viral activa e inflamación y fibrosis significativas es candidato a recibir tratamiento14. En los pacientes HBeAg+se considera un nivel de ADN de 20.000 UI/ml como el punto de corte para el inicio de tratamiento. Únicamente la guía europea establece un valor inferior (2000 UI/ml) como indicador de replicación viral activa3.
En el caso de pacientes HBeAg- el dintel de ADN establecido por la quía americana sigue siendo de 20.000 UI/ml, a diferencia de la europea3 y asiática15 que lo fijan en 2.000 UI/ml. En cuanto al nivel de ALT para considerar la indicación de tratamiento también hay diferencias entre las diversas recomendaciones. Tanto la guía americana como la asiática consideran indicado el tratamiento cuando la cifra de ALT está elevada al menos 2 veces el valor normal. En cambio, según la guía europea, cualquier paciente con VHB y elevación de ALT puede ser candidato a recibir tratamiento3.
Otro factor que se debe tener en cuenta en la evaluación de los pacientes con VHB crónica que pueden precisar tratamiento es la necesidad de realizar biopsia hepática. Un estudio retrospectivo demostró que hasta el 37% de los pacientes con hepatitis crónica B y niveles normales de ALT tenían fibrosis y/o inflamación significativas16. De ahí que las guías más recientes aconsejen hacer biopsia a los pacientes con valores de ALT poco elevados (entre 1 y 2 veces el valor normal), y tener en cuenta también otros factores como la edad (por debajo de los 40 años no suele haber lesión significativa y en el caso de HBeAg+ pueden presentar seroconversión) y el estatus HBeAg (los pacientes HBeAg- son enfermos de más larga evolución y por tanto es más probable que presenten lesión histológica).
Finalmente, hay situaciones en las que el tratamiento está claramente indicado y además debe iniciarse cuanto antes por el riesgo vital que conllevan:
- –
Cirrosis hepática descompensada (ascitis, hemorragia por hipertensión portal, encefalopatía).
- –
Insuficiencia hepática aguda o hepatitis fulminante; no es necesario en la hepatitis aguda sin criterios de gravedad definidos por encefalopatía, alteración de la coagulación o ictericia de más de 4 semanas de duración.
- –
Reactivaciones graves de la hepatitis B en las que haya ictericia y alargamiento del tiempo de protrombina17.
- –
En los pacientes con cirrosis hepática compensada hay indicación de tratamiento independientemente de los valores de ADN o transaminasas14.
Como ya se ha indicado, posiblemente la molécula clave en la hepatitis crónica B es el ADNccc que debería ser eliminado con el tratamiento para lograr la curación de la infección, ya que mientras persista una sola molécula de ADNccc en el núcleo, el hepatocito puede producir nuevos viriones infectivos18. Como el ADNccc se produce de modo exclusivo mediante la transcripción inversa, al menos teóricamente, podría ser eliminado mediante la inhibición de la síntesis de ADN viral. Sin embargo, el ADNccc tiene una vida media muy larga, estimada entre 33 y 50 días, y además una vez que se ha sintetizado puede seguir 2 vías. O bien formar nuevos viriones o bien rellenar el pool de ADNccc nuclear. Y el seguir uno u otro camino depende en gran medida de la concentración de HBsAg que haya en el retículo endoplásmico, que a su vez es proporcional a la cantidad de ADNccc del núcleo porque el ADNccc es el molde para la síntesis de los ARNm del HBsAg19,20. Por lo tanto, con la inhibición de la síntesis de ADN durante el tratamiento antiviral disminuye la concentración de ADNccc, y la pequeña cantidad de ADN que se sintetiza se dirige preferentemente hacia el núcleo para replecionar el pool de ADNccc. En consecuencia, la eliminación del VHB mediante la supresión de la síntesis viral va a requerir mucho tiempo y una supresión profunda de la replicación viral. Ninguna de las terapias actuales puede lograr este objetivo y esta es la razón por la que los fármacos disponibles rara vez logran la curación de la infección. El desarrollo de mejores terapias para la infección por VHB pasa por 2 opciones. La primera es la de optimizar la inhibición de la replicación viral con nuevos fármacos que actúen en otros pasos del ciclo reproductivo del virus y que podrían usarse en combinación con los fármacos ya disponibles, pudiendo alcanzar mayor supresión de la replicación, disminución de las resistencias e incluso lograr la curación. La segunda opción es la de poder degradar el ADNccc. Para ello es necesario conocer cómo elimina el sistema inmune el ADNccc en la resolución de la infección aguda por VHB y diseñar fármacos que induzcan estos mecanismos celulares. Probablemente la combinación de ambas sea lo más efectivo, pero ninguna de ellas es fácil de alcanzar21.
Asumiendo la premisa de que la curación de la infección crónica por VHB es un objetivo difícilmente alcanzable, la opción actual de tratamiento es la inhibición de la síntesis de ADN lo más intensa y duradera posible con el objetivo de detener la progresión de la enfermedad. Una vez que ya se ha indicado el tratamiento, la disyuntiva que se plantea es la de elección del tipo de fármaco más adecuado.
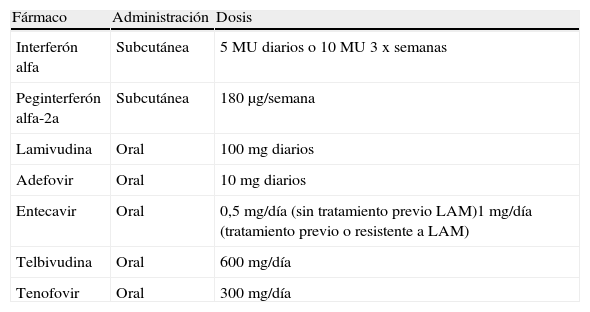
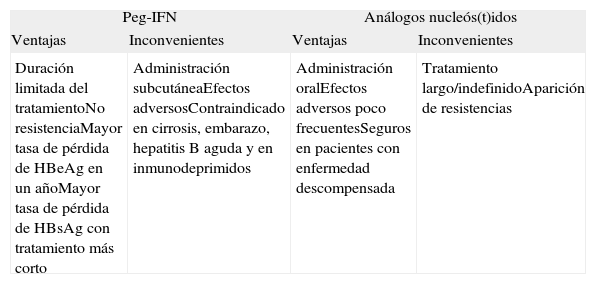
InterferónDe entre las opciones disponibles (tabla 1) hay circunstancias en las que ya de entrada se puede rechazar el tratamiento con IFN estándar o «pegilado». Así, en el embarazo, la hepatitis aguda, la cirrosis descompensada y como profilaxis en pacientes que van a recibir quimioterapia o inmunosupresión, está contraindicado; y tampoco es aconsejable en la cirrosis compensada22. En las restantes situaciones se planteará el dilema de elegir entre uno y otro fármaco, aunque algunos datos pueden orientarnos para la decisión más adecuada. En la tabla 2 se exponen las ventajas e inconvenientes de ambos tratamientos, pero hay otros factores adicionales que también deben tenerse en cuenta. En los pacientes HBeAg+ se observó que valores de transaminasas elevados, genotipo A y niveles bajos de ADN eran predictores de seroconversión a antiHBe en pacientes tratados con peginterferón alfa 2a23. Ahora bien, algunos de estos factores (niveles bajos de ADN y transaminasas elevadas) también son predictivos de respuesta en el tratamiento con los análogos de núcleos(t)idos. En relación con el genotipo, se ha observado que los genotipos A o B presentan una respuesta mejor al IFN que los genotipos C o D, e incluso no se recomienda este fármaco en los pacientes con genotipo D por la poca probabilidad de respuesta24. A modo de indicación práctica, el interferón es una buena opción en pacientes HBeAg+, con genotipo A o B, jóvenes, sin comorbilidad asociada, niveles bajos de ADN y ALT elevada 2 o 3 veces el valor normal; también ha de tenerse en cuenta en mujeres en edad fértil antes del embarazo25. En el caso de los pacientes con HBeAg-, la proporción de pacientes con ADN viral negativo a las 24 semanas de finalizar el tratamiento de 48 semanas es del 19% y no hay datos consistentes acerca de factores predictivos de respuesta mantenida26.
Fármacos disponibles para el tratamiento de la hepatitis crónica B
| Fármaco | Administración | Dosis |
| Interferón alfa | Subcutánea | 5 MU diarios o 10 MU 3 x semanas |
| Peginterferón alfa-2a | Subcutánea | 180μg/semana |
| Lamivudina | Oral | 100 mg diarios |
| Adefovir | Oral | 10 mg diarios |
| Entecavir | Oral | 0,5 mg/día (sin tratamiento previo LAM)1 mg/día (tratamiento previo o resistente a LAM) |
| Telbivudina | Oral | 600 mg/día |
| Tenofovir | Oral | 300 mg/día |
Vetajas e inconvenientes de Peg-IFN y análogos de nucleós(t)idos en el tratamiento de la hepatitis crónica B
| Peg-IFN | Análogos nucleós(t)idos | ||
| Ventajas | Inconvenientes | Ventajas | Inconvenientes |
| Duración limitada del tratamientoNo resistenciaMayor tasa de pérdida de HBeAg en un añoMayor tasa de pérdida de HBsAg con tratamiento más corto | Administración subcutáneaEfectos adversosContraindicado en cirrosis, embarazo, hepatitis B aguda y en inmunodeprimidos | Administración oralEfectos adversos poco frecuentesSeguros en pacientes con enfermedad descompensada | Tratamiento largo/indefinidoAparición de resistencias |
Con estos datos, ya tenemos una respuesta a la pregunta que encabeza esta revisión y es que, al menos, hay un subgrupo de pacientes en los que el IFN puede «encajar» mejor que los análogos de núcleos(t)idos.
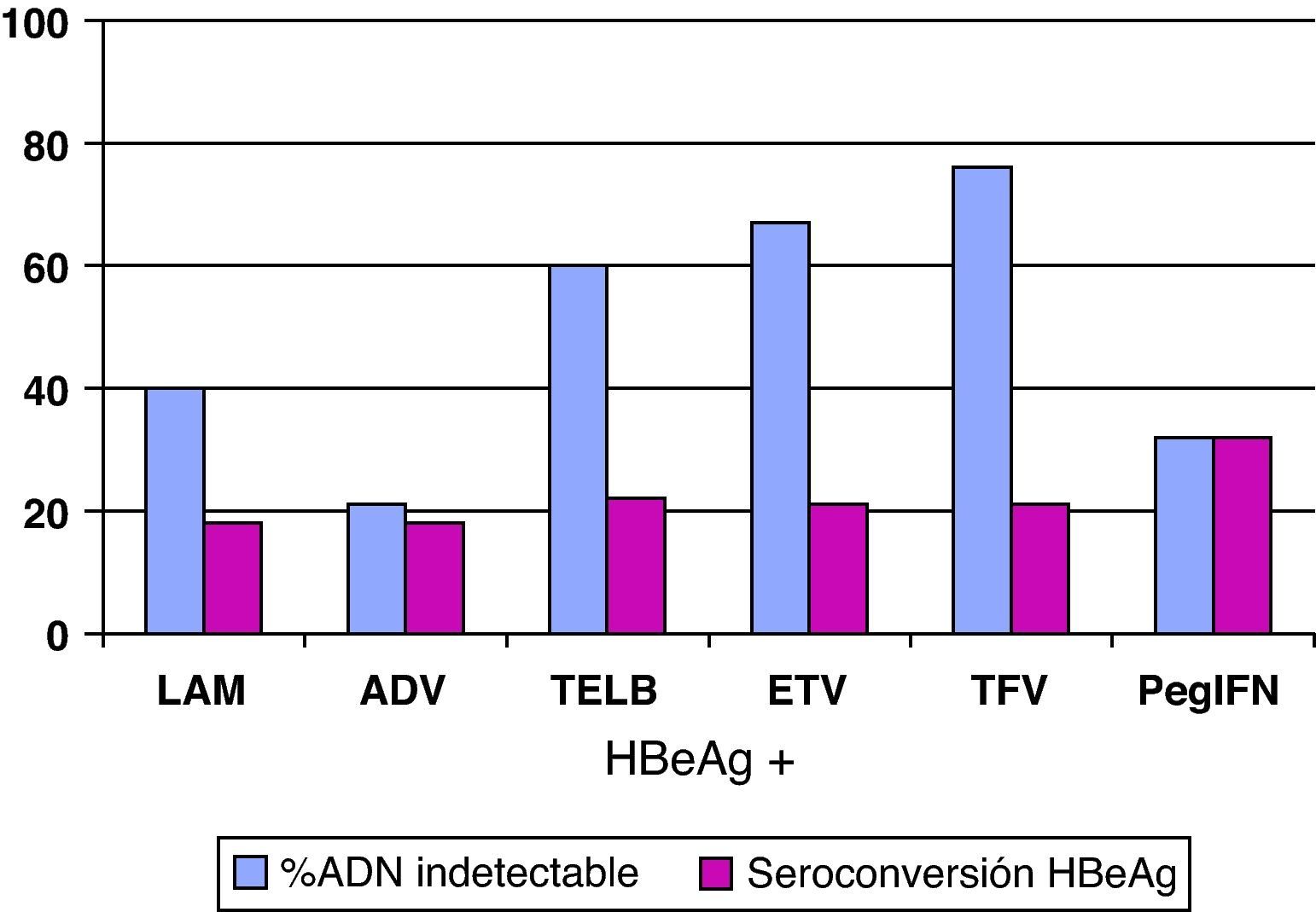
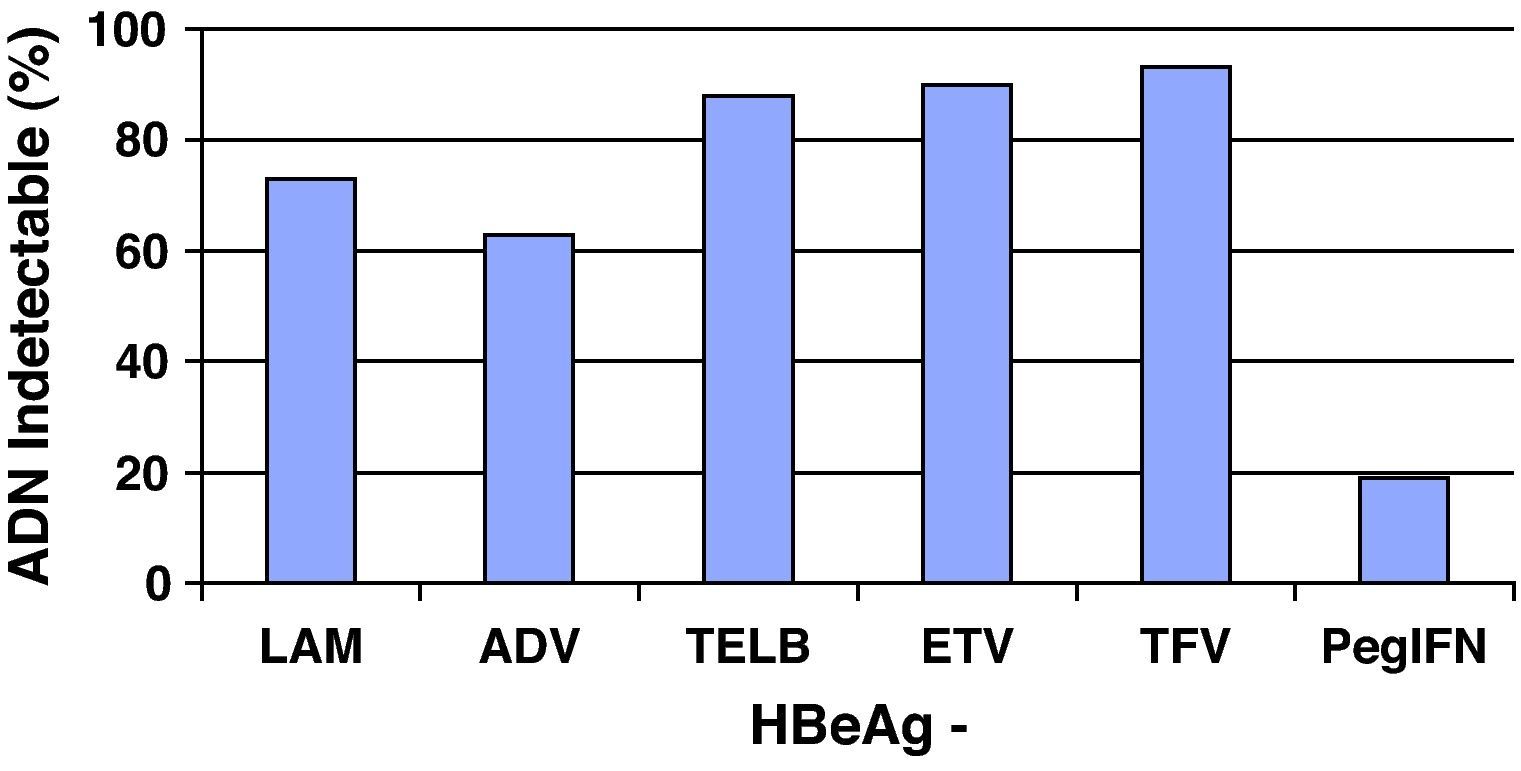
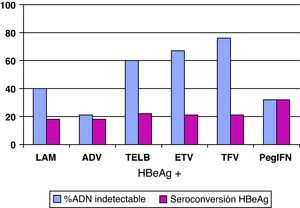
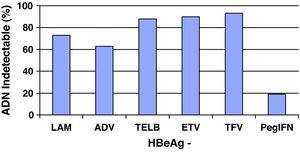
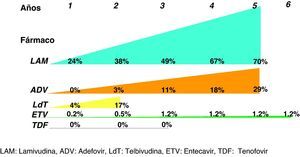
Análogos de núcleos(t)idosEn el resto de pacientes en los que esté indicado el tratamiento (y también en aquellos que el interferón sea una buena opción pero el paciente prefiera otros fármacos), éste se hará con los análogos de núcleos(t)idos. El resumen de los resultados obtenidos en los estudios pivotales, tanto en pacientes HBeAg+ como HBeAg-, con los tratamientos disponibles a las 48 semanas se presenta en las figuras 1 y 2, y cada vez hay más datos de estudios poscomercialización que los refrendan. Si bien es cierto que en el primer año de tratamiento de los pacientes HBeAg +, el IFN logra una tasa de seroconversión a antiHBe superior a la obtenida con los análogos de los núcleos(t)idos, conforme aumenta el tiempo de administración de éstos, las tasas de seroconversión también aumentan hasta alcanzar e incluso superar la conseguida con IFN, especialmente con telbivudina27. Aunque los datos disponibles con los nuevos análogos son limitados, estas tasas se mantienen una vez que se suspende el tratamiento por encima del 75%, por lo que, en este grupo de pacientes, los análogos son también una excelente opción pudiendo plantear tratamientos de duración finita una vez alcanzado el objetivo de la seroconversión27. Hay algunos factores basales que se asocian con una mayor probabilidad de lograr la seroconversión con el tratamiento con los análogos, como el genotipo A o B, la viremia basal baja o los valores de ALT elevados, pero el factor asociado con más fuerza es la negatividad del ADN del VHB en la semana 24 de tratamiento28.
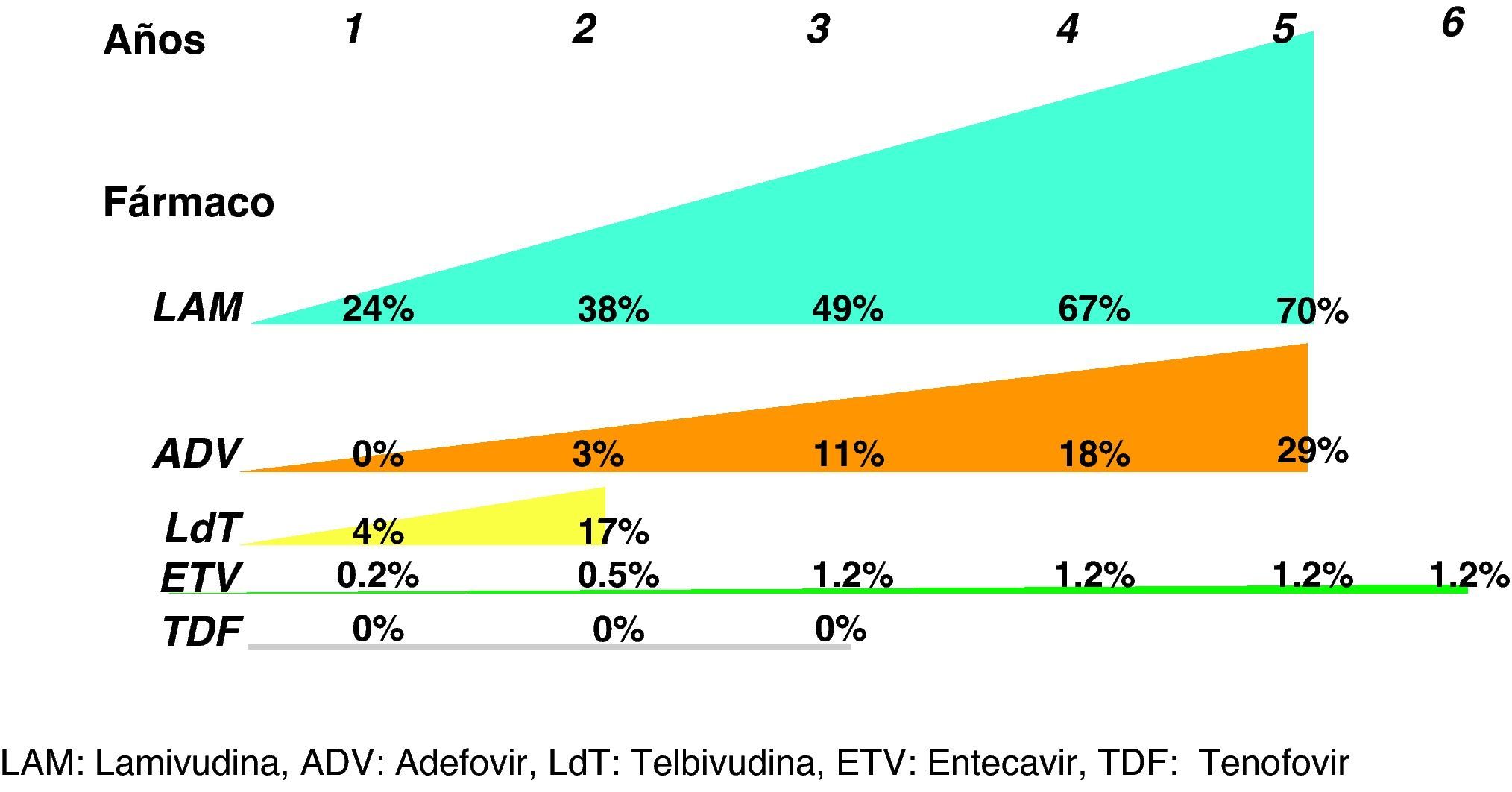
De entrada los análogos preferibles serán aquellos que logren una supresión viral intensa y tengan una elevada barrera genética para el desarrollo de resistencias, y estas características las cumplen especialmente tenofovir y entecavir. De hecho, las guías más recientes consideran ambos fármacos como los de primera elección tanto para pacientes HBeAg+ como HBeAg-3,22,25 y ello es debido, básicamente, a que no aparecen resistencias. Se dispone de resultados a largo plazo para todos ellos (fig. 3) y, por lo tanto, lamivudina, adefovir y telbivudina han pasado a un segundo plano como terapias de primera elección, excepto en alguna situación muy concreta que se comenta más adelante. En una revisión reciente sobre la eficacia de los antivirales disponibles para el tratamiento de la hepatitis B crónica en los primeros 12 meses29 se concluye que en los pacientes HBeAg+, tenofovir y entecavir consiguen excelentes resultados en negativización de ADN del VHB (88 y 61%), normalización de ALT (66 y 70%) y mejoría histológica (53 y 56%). En los pacientes HBeAg- también se mantiene esta tendencia con valores de ADN negativos al año de 94 y 88%, normalización de ALT de 76 y 73%, y mejoría histológica de 65 y 64%.
¿Combinación de fármacos?El sustento teórico para elegir una combinación de fármacos en el tratamiento de la hepatitis B crónica, sobre todo si no tienen un perfil de resistencias cruzadas, es la prevención de la aparición de variantes del VHB resistentes a los antivirales, así como el posible sinergismo que redundaría en una eficacia mayor de la combinación en relación con la monoterapia, de forma análoga a lo que sucede en el tratamiento de la infección por el VIH. Pero han de tenerse en cuenta algunos aspectos negativos: mayor coste; aumento de efectos adversos; posible disminución de la eficacia por mecanismos competitivos e interferencia entre los fármacos (todos los análogos de núcleos(t)idos bloquean de forma competitiva la actividad de ADN polimerasa); peor adherencia al tener que tomar más de un fármaco; si la combinación no es eficaz, hay un riesgo de aparición de resistencias frente a varios fármacos30. A diferencia de los análogos, no se han descrito resistencias al IFN, por lo que la asociación a un análogo podría ser una buena opción, y así se ha visto que la combinación de lamivudina + IFN logra una mayor tasa de negativización del ADN a las 48 semanas en comparación con lamivudina tanto en HBeAg+ como HBeAg-, pero no es superior al IFN en monoterapia30, aunque los resultados son claramente inferiores a los obtenidos con los nuevos antivirales, tenofovir y entecavir29. Los estudios que analizan la combinación de análogos en pacientes no tratados previamente son escasos y los que hay, han sido realizados con fármacos con baja barrera a las resistencias (lamivudina, telbivudina y adefovir) y, por otra parte, no obtienen resultados superiores a la monoterapia29. No obstante, la conclusión más importante que se puede sacar de ellos es que la tasa de resistencias genotípicas es claramente inferior a la de la monoterapia. Por ejemplo, en pacientes HBeAg+ se vio que a los 2 años de tratamiento, de los tratados con la combinación adefovir + lamivudina, desarrollaron resistencia genotípica el 17%, a diferencia del grupo que recibió lamivudina que presentó una tasa de resistencia del 43%31.
Las recomendaciones de tratamiento combinado de inicio se limitan a las siguientes circunstancias: cirrosis hepática, sobre todo si hay descompensaciones; coinfectados con VIH que precisan tratamiento antirretroviral; antes y después del trasplante hepático. Estas recomendaciones no están basadas en estudios controlados aleatorizados, sino en series de casos y en el riesgo de progresión rápida de la enfermedad y posibilidad de complicaciones graves en estos pacientes en ausencia de control de la infección por VHB30. La recomendación es emplear fármacos sin resistencias cruzadas: en caso de emplear lamivudina se combinará con adefovir o, preferiblemente, con tenofovir3. También se ha sugerido la posibilidad de combinar lamivudina (o telbivudina) + adefovir (o tenofovir)22 e, incluso, aunque no hay muchos datos, entecavir+tenofovir25.
Monitorización del tratamiento y resistenciasUna vez que se inicia el tratamiento es fundamental hacer el seguimiento del mismo para adoptar las decisiones más adecuadas en función de la respuesta virológica que, con algunas diferencias, viene recogida en las guías más actuales. En todas ellas se define el concepto de respuesta virológica temprana y, si ésta no se consigue con el tratamiento antiviral indicado, se hacen las recomendaciones subsiguientes para cambiar o añadir otro fármaco más potente y sin resistencia cruzada con el anterior, con el objetivo de reducir el riesgo de resistencia viral y aumentar la probabilidad de alcanzar la supresión viral completa. En los pacientes tratados con IFN, se recomienda determinar el ADN en las semanas 12 y 24, y si no hay respuesta primaria, se aconseja suspender el tratamiento y cambiar a un análogo de núcleos(t)ido3, siguiendo las mismas recomendaciones que para los pacientes no tratados previamente. También se puede hacer tratamiento con análogos en aquellos pacientes que no han respondido o recidivan tras un ciclo de tratamiento con interferón22.
En la tabla 3 se presentan las definiciones de respuesta viral durante el tratamiento con análogos de núcleos(t)idos. Evidentemente si hay respuesta viral completa lo recomendable es continuar con el mismo tratamiento y hacer el seguimiento habitual con determinación de ADN y serología. En cambio, en aquellos pacientes en los que no haya respuesta primaria o ésta sea parcial, y una vez que se haya descartado falta de adherencia al tratamiento, habrá que tomar las decisiones oportunas25. Las recomendaciones americanas aconsejan que los cambios en el tratamiento se realicen en la semana 24 pero, cuando se esté empleando un análogo con una alta barrera genética para el desarrollo de resistencias (tenofovir, entecavir) o potencia antiviral subóptima (adefovir) coinciden con las recomendaciones de la EASL3, en que la valoración de respuesta parcial o completa se haga en la semana 48.
Monitorización de la respuesta al tratamiento con análogos de núcleos(t)idos mediante la determinación de los niveles de ADN del VHB según las guías actuales
| Guía | Definiciones |
| Algoritmo USA25 | Respuesta viral: descenso de ADN del VHB>1 log10 UI/ml en la semana 12Fallo primario: descenso de ADN del VHB<1 log10 UI/ml en la semana 12Respuesta completa: ADN del VHB negativo (por PCR) en la semana 24Respuesta parcial: ADN del VHB<2.000 UI/ml en la semana 24Respuesta inadecuada: ADN del VHB>2.000 UI/ml en la semana 24 |
| EASL 20093 | No respuesta primaria: descenso de ADN del VHB<1 log10 UI/ml en la semana 12Respuesta completa: ADN del VHB negativo (por PCR) en la semana 48Respuesta parcial: descenso de ADN del VHB>1 log10 UI/ml, pero detectable por PCR en la semana 24 (lamivudina y telbivudina) o en la semana 48 (entecavir, tenofovir y adefovir) |
| AASL 200922 | Respuesta primaria: descenso de ADN del VHB>2 log10 UI/ml en la semana 24 |
Llegado el punto en el que el fármaco empleado no demuestra eficacia, ya sea por una ausencia de respuesta primaria o una respuesta parcial, existen 2 opciones que se pueden tomar, en principio, ambas correctas y con argumentos favorables tanto para una como para la otra: por una parte, está la posibilidad de añadir otro fármaco y, por otra, la de cambiar a otro distinto. En cualquier caso, y siempre que se tenga disponibilidad, será interesante hacer un estudio de las resistencias genotípicas, ya que ello puede ayudar en la selección de la estrategia y del fármaco. En la tabla 4 se presentan las mutaciones más frecuentes asociadas a resistencia a los antivirales y los perfiles de resistencia cruzada32, que nos van a guiar en la decisión del fármaco a elegir y serán los nuevos análogos los que tengan un papel fundamental a partir de este momento. En resumen, y teniendo en cuenta las recomendaciones de las distinta guías que ya se han comentado, la actitud a seguir en los casos en que no haya respuesta primaria, surjan resistencias o haya rebrote viral durante el tratamiento, puede ser:
- 1.
Fallo de lamivudina:
- –
Añadir tenofovir (adefovir si no se dispone de tenofovir)
- –
Cambiar a tenofovir/emtricitabina.
- –
- 2.
Fallo de adefovir:
- –
Añadir lamivudina.
- –
Cambiar a tenofovir y añadir un segundo fármaco sin resistencia cruzada.
- –
Cambiar a tenofovir/emtricitabina.
- –
Cambiar o añadir entecavir (si no hay resistencia a lamivudina).
- –
- 3.
Fallo de telbivudina:
- –
Añadir tenofovir o adefovir.
- –
Cambiar a Tenofovir/emtricitabina.
- –
- 4.
Fallo de entecavir:
- –
Cambiar o añadir tenofovir.
- –
Cambiar a tenofovir/emtricitabina.
- –
- 5.
Fallo de tenofovir:
- –
Podría añadirse entecavir, lamivudina, telvibudina o emtricitabina.
- –
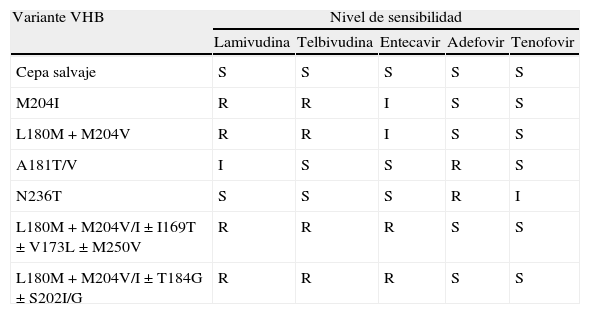
Datos de resistencia cruzada para las mutaciones más frecuentes del VHB
| Variante VHB | Nivel de sensibilidad | ||||
| Lamivudina | Telbivudina | Entecavir | Adefovir | Tenofovir | |
| Cepa salvaje | S | S | S | S | S |
| M204I | R | R | I | S | S |
| L180M+M204V | R | R | I | S | S |
| A181T/V | I | S | S | R | S |
| N236T | S | S | S | R | I |
| L180M+M204V/I±I169T±V173L±M250V | R | R | R | S | S |
| L180M+M204V/I±T184G±S202I/G | R | R | R | S | S |
S: sensible; I: intermedia; R: resistente.
No obstante, es posible que en los próximos años estas recomendaciones puedan modificarse ligeramente. Así, en los casos de respuesta incompleta a adefovir hay datos que avalan el paso directo a tenofovir o a emtricitabina/tenofovir si está disponible. En un estudio comunicado recientemente se incluyeron 105 pacientes que tras 6 meses de tratamiento con adefovir mantenían el ADN del VHB detectable. Se aleatorizaron a recibir tratamiento con tenofovir (53) o emtricitabina/tenofovir (52) y tras seguimiento de más de 3 años, el 88 y el 85%, respectivamente, mantenían niveles de ADN indetectables33.
Como cabe suponer, la información acerca del manejo de los pacientes que no responden a los nuevos antivirales es escasa, pero sí hay algunos datos observacionales. Concretamente en el caso de respuesta parcial a entecavir, se ha visto que añadir tenofovir consigue unos excelentes resultados34. En este estudio se incluyeron 41 pacientes con respuesta parcial a entecavir y se analizó la respuesta a tenofovir (6 pacientes), entecavir+adefovir (5 pacientes) o entecavir+tenofovir (31 pacientes). Se logró una negativización del ADN del VHB en el 67, 20 y 90%, respectivamente
Es importante destacar que los datos disponibles para alguna de las asociaciones reseñadas, concretamente la de tenofovir/emtricitabina, proceden de estudios en pacientes coinfectados por VIH, y que sobre la combinación tenofovir+entecavir hay pocos resultados, al menos en lo referente a seguridad. En un estudio abierto multicéntrico en el que se incluyeron 39 pacientes con fibrosis avanzada que ya habían llevado varias líneas de tratamiento con respuesta parcial o que habían desarrollado resistencias múltiples35 y a los que se administró la combinación entecavir/tenofovir, se observó que 31 casos negativizaron el ADN del VHB y en un caso se logró la seroconversión a anti-HBs. Tampoco presentaron efectos secundarios, en ningún paciente hubo que suspender el tratamiento y los pacientes con cirrosis no presentaron descompensación.
Poblaciones especialesAlgunos pacientes, ya sea por lo avanzado de la enfermedad hepática (cirrosis), condiciones especiales que concurren en el momento de plantear el tratamiento (embarazo) o por situaciones que pueden representar un elevado riesgo en caso de hepatitis activa o de reactivación (inmunodeprimidos), se incluyen en esta denominación de poblaciones especiales, y el tratamiento de la hepatitis B conlleva algunas particularidades que se exponen a continuación.
Cirrosis hepáticaCuando hay fibrosis avanzada o cirrosis hepática ya establecida, el tratamiento con IFN no es el más apropiado porque los efectos secundarios son más frecuentes y pueden ser más graves, especialmente si hay cirrosis descompensada. Por lo tanto, los antivirales orales que carecen de estos efectos secundarios son una excelente opción y así se recoge en las recomendaciones de las guías actuales36. Los estudios en los que se ha empleado lamivudina o adefovir, e incluso la combinación de ambos, en el tratamiento de pacientes con cirrosis descompensada han demostrado que el tratamiento tiene claros efectos beneficiosos reflejados en la mejoría de la función hepática y el descenso de la mortalidad37,38. Los nuevos antivirales tenofovir y entecavir, por su elevada potencia y eficacia, son excelentes opciones para estos pacientes, aunque hay que tener alguna precaución pues cabe la posibilidad de desarrollo de resistencias a entecavir en los pacientes que han llevado tratamiento con lamivudina. En un estudio en pacientes naïve, se administró entecavir (0,5mg) a 144 pacientes con cirrosis compensada y a 55 con cirrosis descompensada, logrando niveles de supresión del ADN viral al año similares y mejorando significativamente la función hepática en los pacientes descompensados, generalmente en los primeros 6 meses de tratamiento39. No obstante, en pacientes con deterioro importante de la función hepática (puntuación MELD mayor o igual a 20), el entecavir debe usarse con precaución porque se han descrito casos de acidosis láctica, que pueden ser fatales40. Recientemente se han publicado los resultados a las 48 semanas de un estudio41 en el que se aleatorizaron 112 pacientes con hepatitis B crónica y cirrosis descompensada a recibir tratamiento con tenofovir (45), tenofovir+emtricitabina (45) o entecavir (22). Se analizó la seguridad, tolerancia y alteraciones analíticas como elevación de la creatinina y descenso de fósforo plasmáticos. El tratamiento hubo de suspenderse en una pequeña proporción de pacientes (6,7% en tenofovir, 4,4% en tenofovir+Emtricitabina y 9.1% en Entecavir) sin diferencias significativas entre los diferentes grupos, como tampoco las hubo en las alteraciones de los parámetros de función renal. En cuanto a la negativización del ADN del VHB a las 48 semanas, ésta se alcanzó en el 70,5% de los pacientes tratados con tenofovir, 87,8% en tenofovir+emtricitabina, y 72,7% en entecavir, siendo las diferencias no significativas. Aunque se trata de un estudio a más largo plazo (168 semanas) estos resultados son muy prometedores en cuanto a seguridad y tolerancia de los nuevos antivirales en los pacientes con cirrosis descompensada, y en la línea de lo que se ha visto en otros trabajos, parece que la combinación tenofovir+emtricitabina parece que podría obtener los mejores resultados y prevenir el desarrollo de resistencias, tal y como se ha demostrado con la combinación de otros antivirales como adefovir y lamivudina35.
EmbarazoTeniendo en cuenta que el IFN tiene acción antiproliferativa y, por lo tanto, está contraindicado en el embarazo, los análogos de los núcleos(t)idos van tener un papel relevante en las mujeres embarazadas y con hepatitis B crónica, aunque estos fármacos no están adecuadamente evaluados en el embarazo y su seguridad no ha sido probada35. Lamivudina, adefovir y entecavir están considerados como categoría C, lo que indica que la seguridad no está demostrada plenamente en animales ni en seres humanos. En cambio, telvibudina y tenofovir están considerados categoría B, ya que se ha demostrado que son seguros en modelos animales y hay datos limitados en seres humanos. Además, y en relación con el empleo de lamivudina en el embarazo, no hay evidencia de la teratogenicidad ni efectos adversos (www.apregistry.com).
Podemos encontrarnos con varias situaciones en las que habrá que tomar alguna determinación y que no están recogidas en las guías de manejo de la hepatitis B. En el caso de una mujer joven sin tratamiento, y que desee tener un hijo, el tratamiento puede posponerse si el estado de la enfermedad hepática lo permite. Si la mujer ya está en tratamiento con análogos y desea quedarse embarazada, habrá que plantearse la retirada del fármaco en el caso de que sea uno de los considerados de categoría C. Pero si la hepatopatía está muy avanzada y existe un riesgo de descompensación al reactivarse el VHB la decisión habrá que tomarla una vez explicado a la paciente, teniendo en cuenta además que hay algunos datos que demuestran que los fármacos de categoría C son seguros en el embarazo.
Otra posible situación es la de prevención de la transmisión de la infección al niño. La estrategia actual es la de administrar al recién nacido inmunoglobulina e iniciar la vacunación inmediatamente tras el nacimiento42, pero aproximadamente un 5% de niños no quedan protegidos y desarrollan hepatitis B crónica, ya sea porque no reciben la vacunación completa, no forman anti-HBs o son hijos de madres con viremia elevada. Esto ha llevado a plantear otras estrategias como la de administrar tratamiento antiviral en el tercer trimestre a embarazadas con niveles elevados de ADN del VHB. Se han realizado diversos estudios con lamivudina pero ninguno demuestra reducir el riesgo a los niveles alcanzados con estrategia habitual35. En cambio, la administración de telbivudina sí que parece reducir el riesgo de transmisión perinatal en este subgrupo de pacientes. En un estudio comunicado recientemente43, se incluyó a 190 mujeres embarazadas con infección por VHB y HBeAg+, y se aleatorizaron para recibir tratamiento con telbivudina (600mg) o no, a partir de la semana 20-32 de gestación. A todos los recién nacidos se les administró al nacimiento inmunoglobulina y vacunación y para determinar la transmisión perinatal, se determinaron el HBsAg y el ADN del VHB en la semana 28. Antes del parto, los niveles de ADN eran significativamente más bajos en las mujeres tratadas y en el momento del nacimiento, el 6,32% de los hijos de madres tratadas tenían HBsAg frente al 30,43% de los de madre no tratada En el análisis de sensibilidad, ningún hijo de madre tratada con telbivudina tenía HBsAg frente al 8,7% del grupo control y el ADN sólo se detectó en los HBsAg+. El tratamiento fue bien tolerado sin efectos adversos ni necesidad de suspenderlo y tampoco se observaron malformaciones congénitas. Por lo tanto, a la vista de estos resultados, se concluye que la telbivudina administrada al final del embarazo en pacientes con viremia elevada puede reducir significativamente la transmisión perinatal.
Una cuestión que no está aclarada en este último grupo de pacientes es la necesidad de continuar el tratamiento tras el parto. En el embarazo se produce un estado de inmunotolerancia que desaparece con el parto y conlleva a una inmunorreactivación que podría tener como consecuencia una exacerbación de la enfermedad, por lo que se debería plantear la continuidad del tratamiento antiviral. En el estudio de telbivudina, de las 36 madres que suspendieron el tratamiento en la semana 4 tras el parto, ninguna presentó hepatitis grave, aunque sí hubo elevaciones de transaminasas (7,45 vs 18,48% en las no tratadas)42.
Insuficiencia renalLos pacientes con insuficiencia renal crónica son uno de los grupos de riesgo para la infección por VHB, habitualmente por contagio intrahospitalario, y además la probabilidad de desarrollar hepatitis crónica también es mayor. Por otra parte, la hepatitis crónica B se asocia con una reducción de la supervivencia después del trasplante renal, así como con mayor frecuencia de retrasplante44. Se ha utilizado lamivudina, adefovir y entecavir en el tratamiento de pacientes con hepatitis crónica B en diálisis o después del trasplante renal35, pero las resistencias son frecuentes y debido a la insuficiencia renal es necesario ajustar las dosis de los antivirales. Aunque parece que el tratamiento de la infección VHB es beneficioso, hasta el momento no se ha demostrado que modifique la evolución natural. En cualquier caso, el antiviral a elegir debe poseer una elevada barrera al desarrollo de resistencias.
El primer punto de controversia en los pacientes con VHB crónica y en diálisis es determinar si necesitan ser tratados. A diferencia de los pacientes sin alteración de la función renal los valores de transaminasas tienden a ser normales y los niveles de ADN del VHB también son inferiores45 y ello parece relacionado tanto con la respuesta inflamatoria alterada en la insuficiencia renal terminal como con el posible aclaramiento del ADN del VHB por la diálisis46. En líneas generales, todos aquellos pacientes en diálisis con niveles elevados de ADN y evidencia de inflamación activa en la biopsia son candidatos a tratamiento. Otra consideración que se debe tener en cuenta es que en la insuficiencia renal crónica en fase de diálisis no se recomienda el tratamiento con IFN por la escasa eficacia y los efectos secundarios47. En cuanto a los análogos de los núcleos(t)idos, el primero en utilizarse fue lamivudina con resultados aceptables que se alcanzaron tasas de negativización del ADN del 56%48, aunque, al igual que en pacientes sin alteración de la función renal, las resistencias eran bastante elevadas (hasta el 39%)44. También se ha utilizado adefovir en pacientes con insuficiencia renal y se han comunicado algunos casos de pacientes en hemodiálisis.
En cuanto a los nuevos antivirales, entecavir no ha sido estudiado en pacientes en hemodiálisis y en cuanto a tenofovir se han comunicado casos de toxicidad tubular renal y daño renal agudo, lo que ha hecho suponer que podría ser potencialmente tóxico en pacientes en hemodiálisis con función renal residual. No obstante, algunos datos recientes apoyan la seguridad de tenofovir a dosis de 300mg semanales en pacientes en diálisis49.
En el caso de pacientes ya trasplantados, el planteamiento a realizar en relación con la infección por VHB es el mismo que en los pacientes «normales», con la salvedad de que la infección oculta puede ser más frecuente y la viremia también puede ser más elevada50. Al igual que en la diálisis, el primer fármaco empleado fue la lamivudina con las mismas limitaciones en cuanto a eficacia, ajuste de dosis y aparición de rebrote virológico o resistencias. También se ha empleado adefovir tanto en pacientes naïve como en resistentes a lamivudina, obteniendo buenas reducciones de ADN viral sin toxicidad renal51.
En un estudio en el que se administró tenofovir a 10 pacientes trasplantados (8 renales) que habían desarrollado resistencia a lamivudina y adefovir, se observó que en todos descendió el ADN, siendo indetectable en el 50% a los 16 meses de tratamiento, sin empeoramiento de la función renal ni de los parámetros hematológicos52. En otro estudio reciente en el que se incluyeron 6 pacientes naïve y 10 con resistencia a lamivudina, se administró entecavir a dosis de entre 0,2 y 1mg diarios con un seguimiento medio de 18,2 meses53. El ADN del VHB era indetectable en el 69,2% a los 6 meses y en el 90% a los 12 meses de tratamiento y sólo un paciente mostró ausencia de respuesta primaria a entecavir. No hubo efectos secundarios.
Por lo tanto, aunque los datos disponibles son muy limitados, tanto tenofovir como entecavir parecen fármacos eficaces y seguros en estos pacientes.
Prevención de reactivaciones de virus de la hepatitis BLa última situación que vamos a analizar es la de pacientes que pueden sufrir una reactivación de la infección VHB porque van a recibir tratamiento inmunosupresor. La reactivación puede producirse en portadores inactivos, hepatitis B pasada y hepatitis B oculta, y se caracteriza por reaparición de HBsAg y HBeAg, reaparición o elevación del ADN del VHB>1 log UI/ml en relación con la viremia basal, y elevación de transaminasas54. Estas reactivaciones se han descrito con múltiples tratamientos (quimioterapia de tumores sólidos y hematológicos; tratamiento con inmunomoduladores o tratamientos biológicos; inmunodepresión por trasplante de órganos sólidos) y suele presentarse al inicio del tratamiento o después de finalizar el mismo por la reconstitución inmunológica. Tampoco se produce la reactivación en todos los pacientes a los que se va a someter a inmunosupresión del tipo que sea. Así, se han identificado algunos factores de riesgo dependientes del propio paciente y del virus como son el sexo masculino, edad joven, ser portador de linfoma o cáncer de mama, viremia basal superior a 20.000 UI/mL, HBeAg+. Y otros factores dependientes del tipo de tratamiento como la asociación de corticoides o la inclusión de rituximab en el régimen terapéutico53,55.
Las consecuencias de la reactivación son, por una parte, el riesgo de desarrollar una hepatitis aguda que puede ser grave y mortal, y, por otra, la necesidad de suspender o retrasar el inicio de la quimioterapia, con la repercusión que ello va a tener en la supervivencia del paciente. En el caso de trasplantados están aumentados tanto la mortalidad por cualquier causa como el riesgo de fallo del injerto53.
Lo ideal es determinar qué pacientes están en riesgo de reactivar la infección VHB y en ellos hacer tratamiento preventivo, por lo que ante todo paciente que vaya a recibir este tipo de tratamientos se recomienda hacer determinación de HBsAg y anti-HBc3. En relación con el fármaco que se debe utilizar como tratamiento profiláctico, casi todos los estudios hacen referencia a lamivudina y en el caso de pacientes que han sido tratados con quimioterapia ha demostrado su eficacia y seguridad tanto en tumores sólidos como hematológicos54 y ello ha sido avalado por 2 metaanálisis en los que se demuestra que el empleo de lamivudina de modo preventivo en estos pacientes reduce el riesgo de reactivación entre un 79 y 89%56,57. Adefovir también se ha utilizado tanto en las reactivaciones como en casos de aparición de resistencia a lamivudina estando en tratamiento preventivo58. Tanto entecavir como tenofovir son 2 buenos candidatos para esta situación dada su potencia antiviral y resistencias escasas, pero hasta el momento no se dispone de datos acerca de su utilidad. No obstante, las principales guías recomiendan que los portadores HBsAg con niveles de ADN indetectable y duración estimada del tratamiento menor de 12 meses sean tratados con lamivudina o telbivudina22; si el tratamiento va a ser más prolongado se aconseja entecavir o tenofovir, especialmente si el ADN basal es elevado (> 2.000)3. En cuanto a la duración del tratamiento tras la quimioterapia, se aconseja entre 6 y 12 meses una vez finalizada ésta.
En los pacientes con HBsAg– y anti-HBc+, si el ADN es indetectable, no se recomienda profilaxis. Pero si el ADN es detectable (hepatitis B oculta), el riesgo de serorreversión es elevado y se aconseja que sean tratados con lamivudina de forma preventiva o bien se haga un seguimiento estrecho, sin que se hayan evaluado adecuadamente ambas estrategias. No obstante, dada la seguridad de los antivirales orales y las consecuencias de la posible reactivación de VHB, parece adecuado recomendar la profilaxis en estos pacientes, especialmente en aquellos con alguno de los factores de riesgo de reactivación (trasplante de médula, inmunosupresión intensa como el tratamiento con anti-CD20)54.
Los datos disponibles de reactivación de VHB con el uso de las denominadas terapias biológicas son más limitados y la mayoría corresponden a series de casos relacionados con el uso de infliximab, aunque también se han comunicado reactivaciones con etarnecept y adalimumab. Sin embargo, se ha observado que el tratamiento profiláctico con lamivudina previene la reactivación en portadores de HBsAg. En una serie de 80 pacientes con enfermedad de Crohn tratados con infliximab, se detectaron 3 pacientes HBsAg+; de ellos, los 2 que no recibieron profilaxis tuvieron una reactivación de la infección, mientras que el que llevó profilaxis con lamivudina no tuvo reactivación59. Como conclusión, parece razonable la profilaxis en los portadores inactivos que van ser tratados con infliximab, aunque el fármaco que se debe emplear de elección no está definido. No obstante, dado que el tratamiento con anti-TNF se presupone prolongado y la lamivudina tiene una tasa alta de resistencias, es más lógico emplear fármacos con alta barrera al desarrollo de resistencia como tenofovir o entecavir53.
En los pacientes sometidos a trasplante de órganos diferentes al hígado también debe hacerse estudio serológico de VHB y las recomendaciones son similares a las realizadas en el caso de tratamiento quimioterápico. Si son HBsAg +, la posibilidad de reactivación es elevada por lo que se recomienda tratamiento antiviral y vigilancia estrecha una vez comenzado el tratamiento inmunosupresor y sobre todo en los posibles periodos de intensificación de la terapia inmunosupresora como son los episodios de rechazo o cambios de terapia60. Si bien la mayoría de estudios se han realizado con lamivudina, la elevada tasa de resistencias y el hecho de que la inmunosupresión sea a largo plazo ha llevado a que en las guías se recomienden antivirales más potentes como tenofovir y entecavir3,22. En el caso del trasplante renal, quizá sea entecavir el tratamiento preferido por la menor toxicidad renal, pero las guías específicas de prevención y tratamiento en pacientes trasplantados renales recomiendan tanto entecavir como tenofovir, asumiendo que este último tiene una toxicidad renal mucho menor que el adefovir61. En el caso de resistencia a lamivudina se recomienda emplear tenofovir.
En los pacientes con anti-HBs+ si el título es menor de 100 UI/ml debe considerarse una nueva inmunización53. En el caso de anti-HBc + y HBsAg- se ha visto que un porcentaje importante pueden presentar positividad de ADN tras el trasplante, pero sólo un 5% tuvieron HBsAg+ sin evidencia de hepatitis62, por lo que se recomienda vigilar y hacer profilaxis en los periodos de máxima inmunosupresión.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.