INTRODUCCION
Hay distintos nexos epidemiológicos entre la apendicitis aguda (AA) y la colitis ulcerosa (CU). Diversos estudios parecen indicar que la apendicectomía (especialmente en etapas tempranas de la vida) confiere cierta protección sobre un posterior desarrollo de CU. En este sentido, un metaanálisis reciente ha concluido que hay una relación inversa entre apendicectomía y riesgo de desarrollar CU1. Por otra parte, algunos estudios han relacionado el antecedente de apendicectomía con un curso menos grave de la CU, basándose en una menor frecuencia de brotes de actividad inflamatoria y una menor probabilidad de colectomía, cuando la CU se presenta años después de la apendicectomía2-5.
A pesar de que la incidencia de AA es elevada en nuestro medio (con una tasa esperada de apendicectomía del 18% en la población general a los 40 años de edad, según las estadísticas del Servicio Nacional de Salud)6, no hay datos en la literatura médica sobre las características de presentación y evolución clínicas de la AA en pacientes previamente diagnosticados de CU y la posterior evolución de la propia CU. Presentamos 2 casos de AA en pacientes previamente diagnosticados de CU extensa, se comparan los hallazgos histológicos apendiculares de estos casos con los observados en 2 pacientes colectomizados por una pancolitis ulcerosa refractaria y se revisa la bibliografía al respecto.
OBSERVACIONES CLINICAS
Caso 1
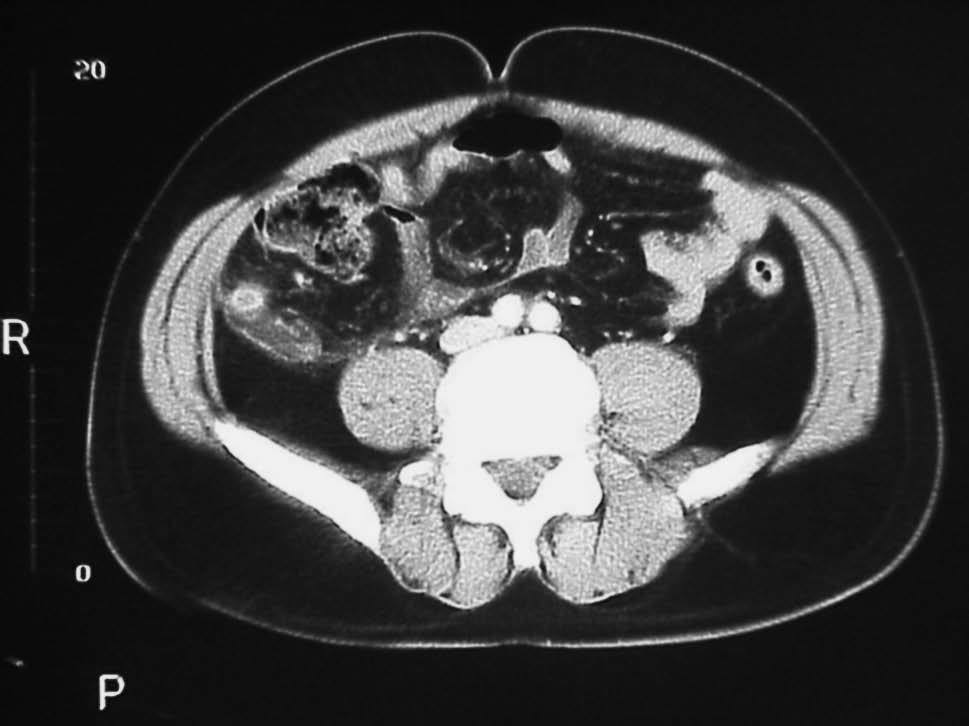
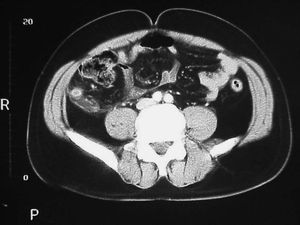
Varón de 32 años de edad, fumador de 3 cigarrillos/día, diagnosticado de pancolitis ulcerosa en 1998; respondió a un tratamiento con esteroides sistémicos, pero no mantuvo una pauta de mantenimiento posteriormente. Cinco años más tarde presentó un nuevo brote de actividad moderada, que respondió a mesalazina oral, con recidiva clínica antes de un año sin respuesta a esteroides intravenosos. Por este motivo, recibió ciclosporina i.v. con buena respuesta clínica, e inició tratamiento de mantenimiento con azatioprina. A los 4 meses del alta hospitalaria, el paciente consultó por un cuadro de dolor abdominal epigástrico, que posteriormente se localizó en la fosa ilíaca derecha (FID), con signos de irritación peritoneal y sin alteraciones del ritmo intestinal ni fiebre. Analíticamente, destacaba una leucocitosis con desviación a la izquierda. La tomografía computarizada (TC) abdominal reveló la presencia de un edema de colon, con una imagen lateral al ciego, compatible con apendicitis (fig. 1), por lo que se practicó una apendicectomía. La histología de la pieza quirúrgica fue compatible con una AA y una periapendicitis. El paciente siguió su tratamiento con azatioprina, sin haber presentado nuevos brotes de su CU tras 2 años de seguimiento.
Fig. 1. Tomografía computarizada abdominal (caso 1), donde se pone de manifiesto un engrosamiento mural concéntrico del apéndice cecal dilatado y que muestra un realce periférico de contraste intravenoso, con una pequeña colección de líquido adyacente.
Caso 2
Varón de 49 años de edad, no fumador, diagnosticado de pancolitis ulcerosa en 1993. En 1994 presentó un brote de actividad grave y corticorrefractario, que evolucionó favorablemente con ciclosporina i.v. Desde entonces, seguía en tratamiento de mantenimiento con azatioprina y se mantuvo en remisión durante 8 años; después de este período presentó un brote de actividad moderada, que se resolvió con esteroides orales, por lo que se decidió añadir mesalazina oral al tratamiento con azatioprina. En julio de 2004 tuvo un nuevo brote corticorrefractario, que respondió a ciclosporina i.v. Quince meses más tarde, el paciente presentó un cuadro de dolor continuo y progresivo en el flanco derecho y la FID, acompañado de náuseas y vómitos, sin alteración del ritmo deposicional ni fiebre. En la exploración física únicamente se observó una distensión abdominal con signos de irritación peritoneal en la FID. En la analítica destacaban 11.000 leucocitos con desviación a la izquierda, fibrinógeno de 645 mg/dl y proteína C reactiva de 130 mg/l. La TC abdominal fue sugestiva de AA, por lo que se realizó una apendicectomía. La histología confirmó el diagnóstico clínico. El paciente se ha mantenido en remisión clínica de la CU, bajo tratamiento con azatioprina y mesalazina, durante los 2 años siguientes.
CARACTERISTICAS HISTOLOGICAS DE LA APENDICITIS AGUDA EN LA COLITIS ULCEROSA
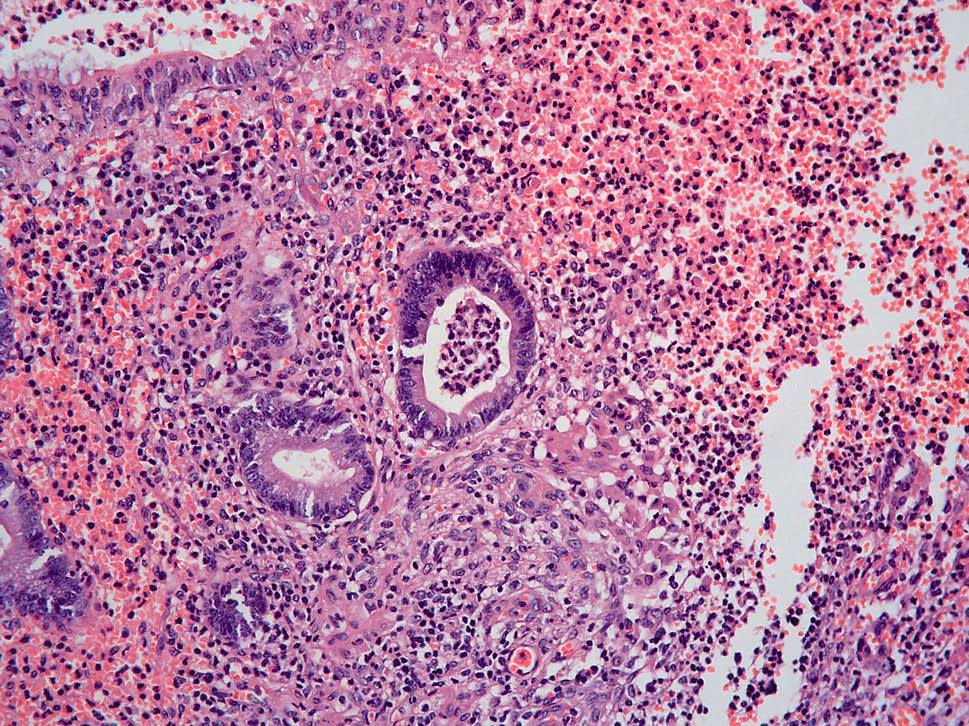
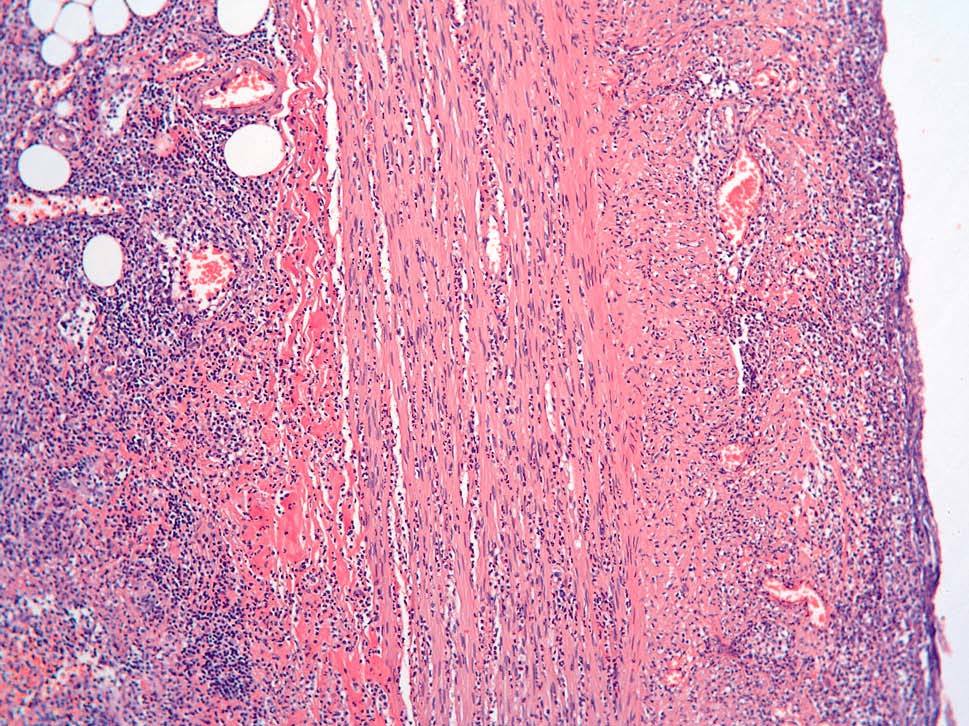
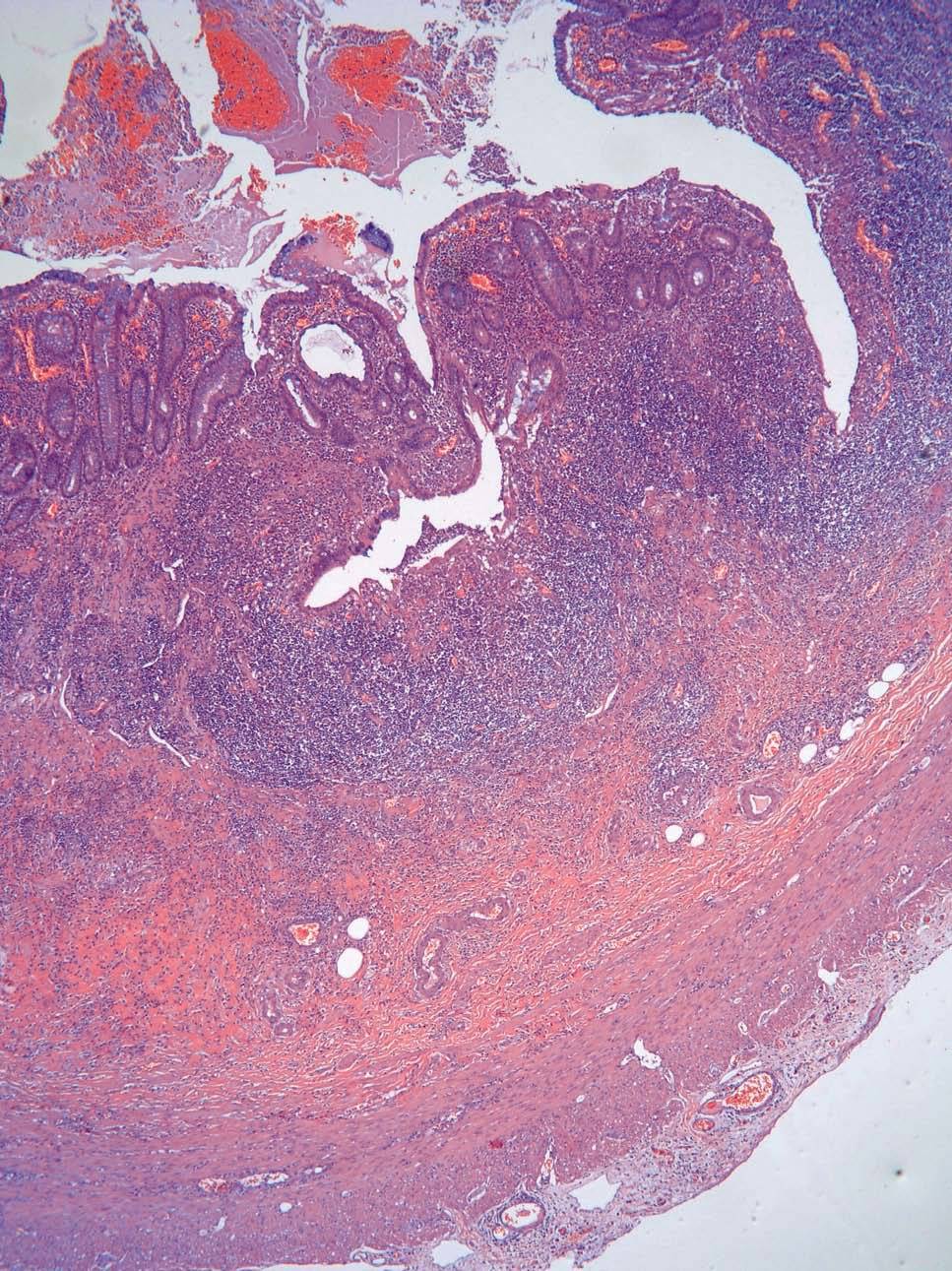
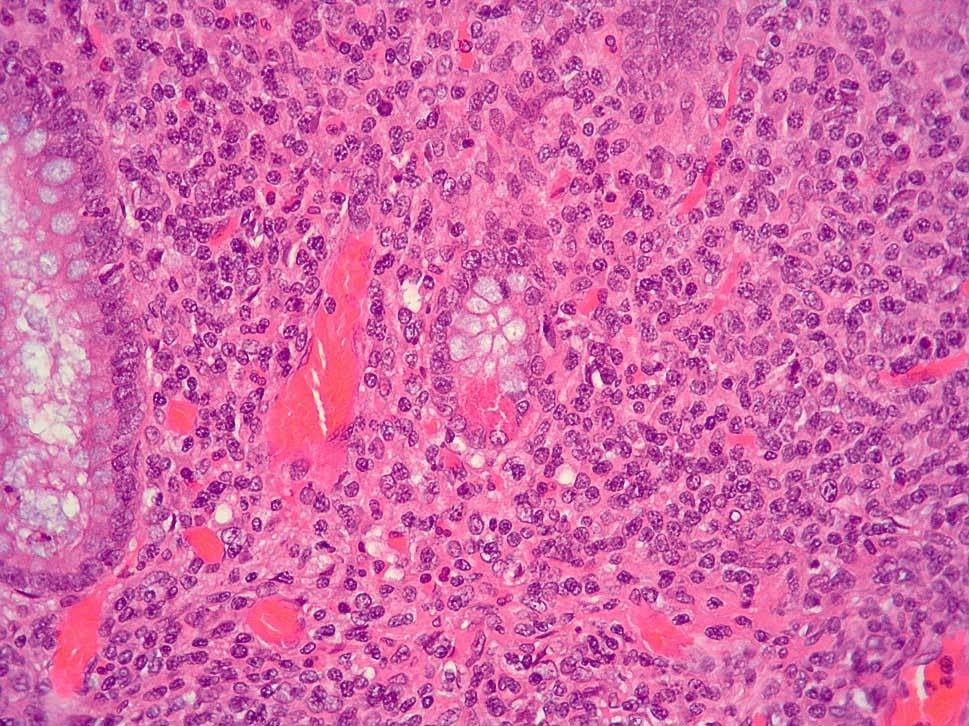
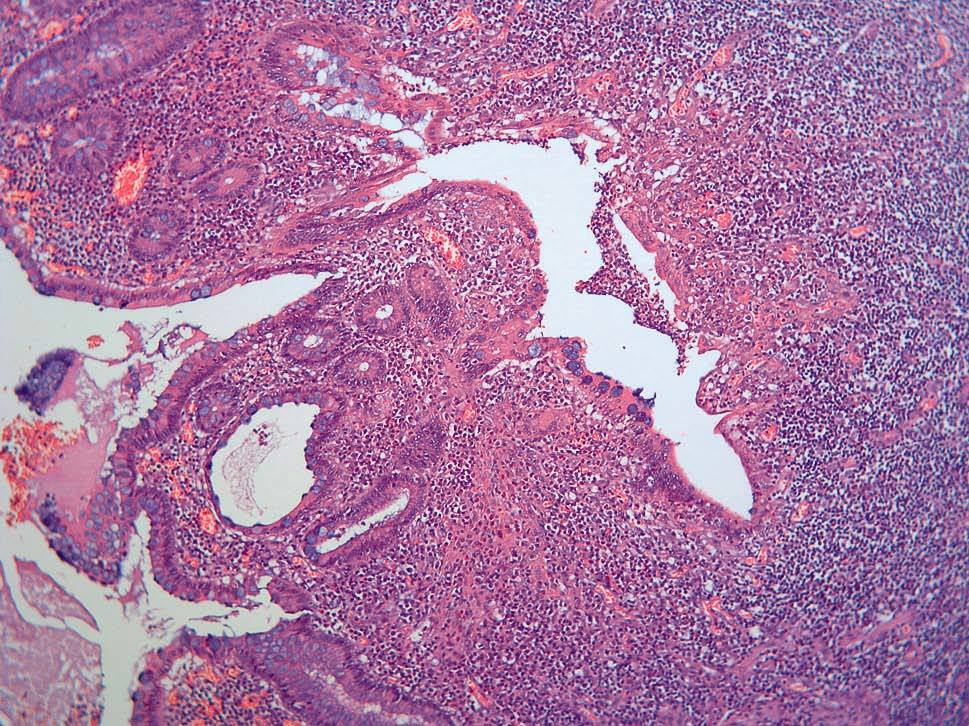
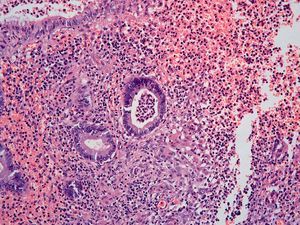
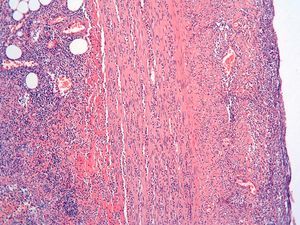
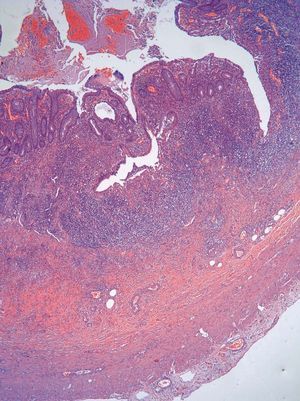
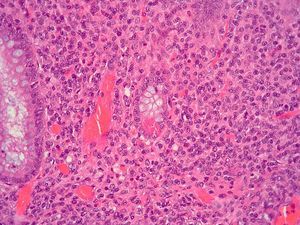
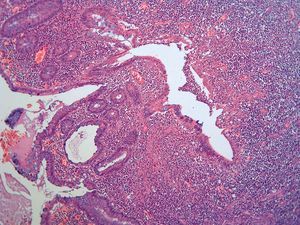
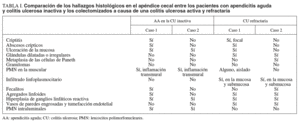
Dos patólogos (N.T. e I.O.) analizaron detalladamente los hallazgos histológicos de la pieza de apendicectomía de los 2 pacientes, que se compararon con los hallazgos en el apéndice de la pieza de colectomía de los 2 últimos pacientes que habían sido colectomizados en nuestro centro por una CU refractaria a tratamiento médico. Las características histológicas halladas en ambas situaciones clínicas se muestran en la tabla I. El predominio de infiltrado por polimorfonucleares, tanto transmural como intraluminal (en los casos de CU inactiva con AA) (fig. 2), y la presencia de glándulas dilatadas e irregulares, con infiltrado linfoplasmocitario y engrosamiento y tumefacción vascular (en el caso de CU universal activa refractaria) (fig. 3), fueron los hallazgos histológicos diferenciales. Sin embargo, no se hallaron diferencias respecto a la presencia de criptitis, abscesos crípticos, ulceración de la mucosa, fecalitos, agregados linfoides o hiperplasia reactiva de ganglios linfáticos.
Fig. 2A. Pieza de apendicitis aguda en la colitis ulcerosa inactiva. Absceso críptico con intenso infiltrado de leucocitos polimorfonucleares en la lámina propia (HE*40).
Fig. 2B. Pieza de apendicitis aguda en el contexto de una colitis ulcerosa inactiva. Infiltrado de polimorfonucleares transmurales (HE *4).
Fig. 3A. Pieza de afección apendicular en el contexto de una colitis ulcerosa refractaria. Presencia de abscesos con alteración arquitectural, dilatación glandular y afección transmural (HE*2).
Fig. 3B. Pieza de afección apendicular en la colitis ulcerosa refractaria. Intenso infiltrado linfoplasmocitario en la lámina propia, con metaplasia focal de la células de Paneth (HE *4).
Fig. 3C. Pieza de afección apendicular en el contexto de una colitis ulcerosa refractaria. Dilatación glandular, abscesos intracrípticos y criptitis (HE*4).
DISCUSION
El papel del apéndice en el desarrollo de la enfermedad inflamatoria intestinal (EII) ha sido un tema de interés recurrente. Diferentes estudios poblacionales han investigado esta relación, y la mayoría de ellos coincide en demostrar una asociación negativa entre la apendicectomía y la CU, con datos menos concluyentes acerca de la relación entre la apendicectomía y el desarrollo de enfermedad de Crohn1,2,7,8. Se ha sugerido que los pacientes con CU podrían presentar diferencias respecto a los individuos apendicectomizados, tanto en los factores genéticos como en los factores ambientales; por otra parte, y de forma no excluyente, la apendicectomía en edades tempranas podría modificar la respuesta inmunitaria intestinal, protegiendo del desarrollo de CU2. Aunque inicialmente se creía que sólo la apendicectomía realizada por causa inflamatoria (apendicitis o adenitis mesentérica) protegía del posible desarrollo de CU3,4,8, este extremo no se confirmó en un estudio prospectivo de cohortes5. Algunos datos indican que los pacientes con una apendicectomía realizada años antes del diagnóstico de EII suelen tener un curso menos agresivo de la enfermedad y, por tanto, puede que no requieran nunca un ingreso hospitalario2. Datos similares se han obtenido en animales de experimentación10; así, la realización de una apendicectomía temprana protege de la posterior aparición de la colitis que, de forma espontánea y constante, desarrollan los ratones TCR-*-/-. Por tanto, es razonable que el hecho de retirar el apéndice pueda derivar en un efecto beneficioso en los pacientes con CU5,9.
El apéndice es un órgano linfoide inmunológicamente activo, muy vascularizado y con alta densidad de vasos linfáticos. La mayoría de los linfocitos del apéndice son células B, con una pequeña población de células T de predominio CD4. En consonancia con el mayor protagonismo de los linfocitos B en la fisiopatología de la CU11,12, el apéndice podría constituir un órgano relevante en la presencia de células plasmáticas productoras de inmunoglobulina (Ig) A en la la pared intestinal. Estas Ig desempeñan un papel importante en la exclusión bacteriana y su producción inadecuada favorecería la producción patológica de IgG, lo que a su vez podría conllevar la activación de la respuesta inmunitaria celular2,15,16. Algunos autores han propuesto que, una vez desarrollada la CU, la ausencia de una fuente de activación de linfocitos B podría ser la causa de un curso menos agresivo de la enfermedad4,5. Por otra parte, la exclusión bacteriana inadecuada secundaria a la disminución de IgA también favorecería una afección más extensa de la CU16. Finalmente, se ha postulado que tras la apendicectomía se produciría un predominio de células T supresoras en el intestino, lo que induciría cambios en el balance Th1/Th2; estos cambios en las poblaciones linfocitarias podrían también justificar la protección frente a un posterior desarrollo de CU14,30 o incluso un cambio en la evolución clínica de una CU ya establecida17,18.
La afección apendicular en la CU puede darse en dos contextos distintos. En la CU universal, el apéndice suele estar afectado por continuidad, con características propias de la enfermedad de base, tal como se demostró en el análisis de nuestras piezas de colectomía. En el caso de la CU distal, o incluso de la proctitis, la afección apendicular también es posible18, y se presenta con más frecuencia como una lesión a distancia asociada a colitis distales19-23; esta localización no parece ser el resultado de la terapia médica23. La connotación clínica de este hallazgo ha sido interpretada como un marcador de gravedad21, aunque en trabajos más recientes se ha demostrado que la afección apendicular discontinua puede encontrarse en casi el 12% de las piezas de proctocolectomía, y que clínicamente estos pacientes se comportan como los que no presentan afectación apendicular19,22,26,27; se ha llegado incluso a sugerir que la afección apendicular a distancia podría ser un factor de mejor respuesta al tratamiento27, ya que se encuentra en mayor número en las colitis menos extensas23. A diferencia de los hallazgos histológicos descritos en nuestros pacientes, diversos autores han comunicado una mayor presencia de abscesos de criptas, ramificación y reducción glandular, y metaplasia de las células de Paneth, así como una menor infiltración de las mucosas musculares por neutrófilos en los pacientes con CU y una afección a distancia del apéndice24-26.
El papel terapéutico de la apendicectomía en la CU refractaria al tratamiento también se ha puesto en entredicho, partiendo de la premisa de que resecar el apéndice en los pacientes con una CU de mala evolución podría mejorar su curso clínico. Esta práctica se ha propuesto de forma teórica28 e incluso se ha comunicado algún caso aislado13. Sin embargo, la experiencia más amplia es la comunicada por Järnerot et al29, consistente en los resultados de un estudio piloto prospectivo, en el que se realizó una apendicectomía laparoscópica en 6 pacientes con CU refractaria, obteniéndose mejoría en sólo uno de ellos.
Según nuestros datos, no hay casos previos descritos en la literatura médica de AA en pacientes con CU diagnosticada previamente, lo que induce a pensar que su prevalencia es baja. Sin embargo, esta entidad debe tenerse en cuenta en el diagnóstico diferencial del dolor localizado en la FID, especialmente en pacientes sin síntomas de actividad de su CU. Los hallazgos histológicos son claramente diferenciables de los propios de la afección apendicular por CU, y la apendicectomía no parece tener efectos deletéreos sobre la posterior evolución clínica de la enfermedad de base, e incluso, desde un punto de vista meramente teórico, puede beneficiarla.