La aparición del síndrome de hipertensión portal (HTP) depende de la interacción de factores estructurales y funcionales que ocasionan finalmente un aumento de la resistencia vascular intrahepática y del flujo portal. La HTP se define como la existencia de un incremento patológico de la presión hidrostática en el territorio venoso esplácnico, que determina un aumento del gradiente porto-cava (GPC) por encima de su valor normal (1–5mm de Hg).
El GPC se estima en la clínica mediante el gradiente de presión venosa hepática (GPVH), calculado a partir de la diferencia entre la presión suprahepática enclavada (PSHE) y la presión suprahepática libre (PSHL), consideradas equivalentes a la presión de la porta y de la cava, respectivamente1, en ausencia de HTP presinusoidal. Si bien se ha propuesto recientemente que la presión auricular puede sustituir a la PSHL para la estimación del GPVH2. Recientemente un estudio ha confirmado que esta práctica disminuye el valor pronóstico del GPVH en situaciones de gran relevancia clínica3.
El GPVH cumple con las condiciones para ser considerado como un marcador subrogado en la cirrosis hepática: en primer lugar existe una estrecha relación entre el GPVH y la aparición de las complicaciones características de la HTP4–9; por otra parte se ha demostrado que los cambios del GPVH tienen un efecto modificador de la historia natural de la enfermedad10,11.
Así, en una cohorte de pacientes compensados sin varices (estadio de Baveno I), el GPVH fue el predictor más sólido de descompensación clínica; de hecho, aquellos sujetos con valores inferiores a 10mm de Hg tuvieron un 90% de probabilidades de no descompensarse en un periodo de 4 años12.
Además, en una revisión sobre factores pronósticos de mortalidad en la CH que incluyó 118 trabajos13, el GPVH fue un predictor independiente en dos tercios de los estudios donde fue evaluado. Dos metanálisis diseñados para estimar el efecto de la respuesta hemodinámica (reducción del GPVH de al menos un 20% o por debajo de un valor absoluto de 12mm de Hg) sobre el riesgo de hemorragia varicosa en pacientes en profilaxis primaria y secundaria observaron una disminución estadísticamente significativa de la mortalidad y del sangrado secundario a hipertensión portal en aquellos pacientes que la presentaban10,11. Por otra parte, cada vez está más extendido su uso en la planificación del tratamiento quirúrgico de pacientes con hepatocarcinoma14.
A pesar de que el GPVH ha demostrado su utilidad en diferentes escenarios clínicos, y que su abordaje ofrece la posibilidad de obtener muestras de tejido durante el mismo procedimiento, esta técnica no se ha extendido ampliamente, ni se encuentra suficientemente estandarizada en nuestro medio. El objetivo de esta revisión es describir los procedimientos para la correcta medición del GPVH y la realización de la biopsia hepática transyugular (BHTY).
Preparación del pacienteAntes del estudio se debe realizar una anamnesis detallada, que debe incluir una evaluación de alergias y comorbilidades, defectos anatómicos cervicales y torácicos, canalización previa de vías centrales y toma de fármacos que alteren la hemodinámica hepática o sistémica (p. ej., betabloqueantes, antihipertensivos, nitratos). El examen físico, y la revisión de pruebas de imagen recientes, encaminados a identificar factores que aumenten la dificultad o los riesgos del procedimiento, es de gran utilidad y disminuye el riesgo de complicaciones.
Así mismo, la necesidad o no de una BHTY debe ser parte de la evaluación previa, para la elección del acceso vascular y la preparación del material necesario.
Por último, disponer de un hemograma y un estudio reciente de coagulación es muy recomendable. En la cirrosis existe un desequilibrio entre los factores procoagulantes y anticoagulantes que dificulta la valoración del estado real de la hemostasia en estos sujetos15. Datos recientes señalan a las plaquetas como el factor limitante para una coagulación efectiva, de forma que cifras superiores a 60.000 aseguran una producción de trombina16 adecuada independientemente de los tiempos de protrombina (TP) y tromboplastina (TPT), los cuales no han demostrado ser buenos predictores de las complicaciones hemorrágicas en estos pacientes. Otro tipo de prueba como la tromboelastografía y la generación global de trombina parecen reflejar mejor el comportamiento in vivo de los factores de la coagulación pero su utilidad en la práctica clínica está aún por determinar16. A falta de mejores estimadores del riesgo de sangrado, se deben emplear con carácter orientativo las pruebas tradicionales de coagulación.
El consentimiento escrito del paciente, haciendo especial énfasis en el potencial riesgo de sangrado, hematomas y punción capsular hepática, es indispensable antes de iniciar cualquier procedimiento, así como también la verificación del correcto funcionamiento del equipamiento radiológico, de los sistemas de monitorización y de los instrumentos de medida (tabla 1).
Equipo recomendado para la medición adecuada del GPVH
| 1. Monitor que permita el registro continuo de frecuencia cardiaca, presión arterial, saturación de oxígeno y trazado electrocardiográfico. Disponibilidad de equipos para ofrecer soporte vital avanzado en caso necesario |
| 2. Equipo fluoroscópico adecuado |
| 3. Ecografía cervical para punción vascular guiada (preferible) |
| 4. Transductor adecuado para detectar cambios de presiones venosas, ubicado a nivel de la aurícula derecha |
| 5. Catéter balón para estimar la PSHL y PSHE (véase texto) |
GPVH: Gradiente de presión venosa hepática; PSHE: presión suprahepática enclavada; PSHL: presión suprahepática libre.
La monitorización electrocardiográfica, pulsioximétrica y de presión arterial debe realizarse durante todo el procedimiento. Al tratarse de una intervención completamente estéril deben seguirse las directrices universales de asepsia y antisepsia. Es recomendable un ayuno de al menos 6h.
Canalización de la vía centralHabitualmente el acceso vascular se alcanza a través de la vena yugular o femoral. La primera permite la realización de la biopsia transyugular y el cateterismo de las venas suprahepáticas es más sencillo; sin embargo, es incómoda porque restringe los movimientos del cuello del paciente durante el procedimiento. La vía femoral no permite la realización de biopsias y el paciente debe evitar la deambulación durante al menos 4-12h después de terminar la exploración. La elección del acceso vascular dependerá de la preferencia y experiencia del médico y de la finalidad del estudio.
La técnica para realizar una adecuada punción vascular guiada por ecografía ha sido revisada recientemente17; este procedimiento permite delinear la anatomía de las venas y su permeabilidad, así como la relación con las estructuras circundantes y su trayecto, minimizando el número de punciones y las complicaciones locales18–20. Es especialmente útil en aquellos casos en que se sospeche trombosis o que las referencias anatómicas externas estén distorsionadas por traumatismos, cirugía previa o quemaduras. Debe diferenciarse la vena yugular interna de la carótida; la primera es fácilmente identificable por ser de mayor tamaño, superficial y fácilmente colapsable con la presión.
Existen equipos de micropunción que disponen de agujas, guías e introductores de un diámetro inferior a los habituales en un intento de minimizar las complicaciones en circunstancias especiales, por ejemplo cuando el número de plaquetas es demasiado bajo o ante un INR claramente prolongado.
Si fuera necesaria la sedación, el midazolam, por su ausencia de efecto sobre la presión portal y su corta vida media, sería la benzodiacepina de elección21.
Medición del Gradiente de presión venosa hepatica (GPVH)El cateterismo de las venas suprahepáticas es un procedimiento seguro con una incidencia baja de complicaciones y un éxito técnico cercano al 95%.
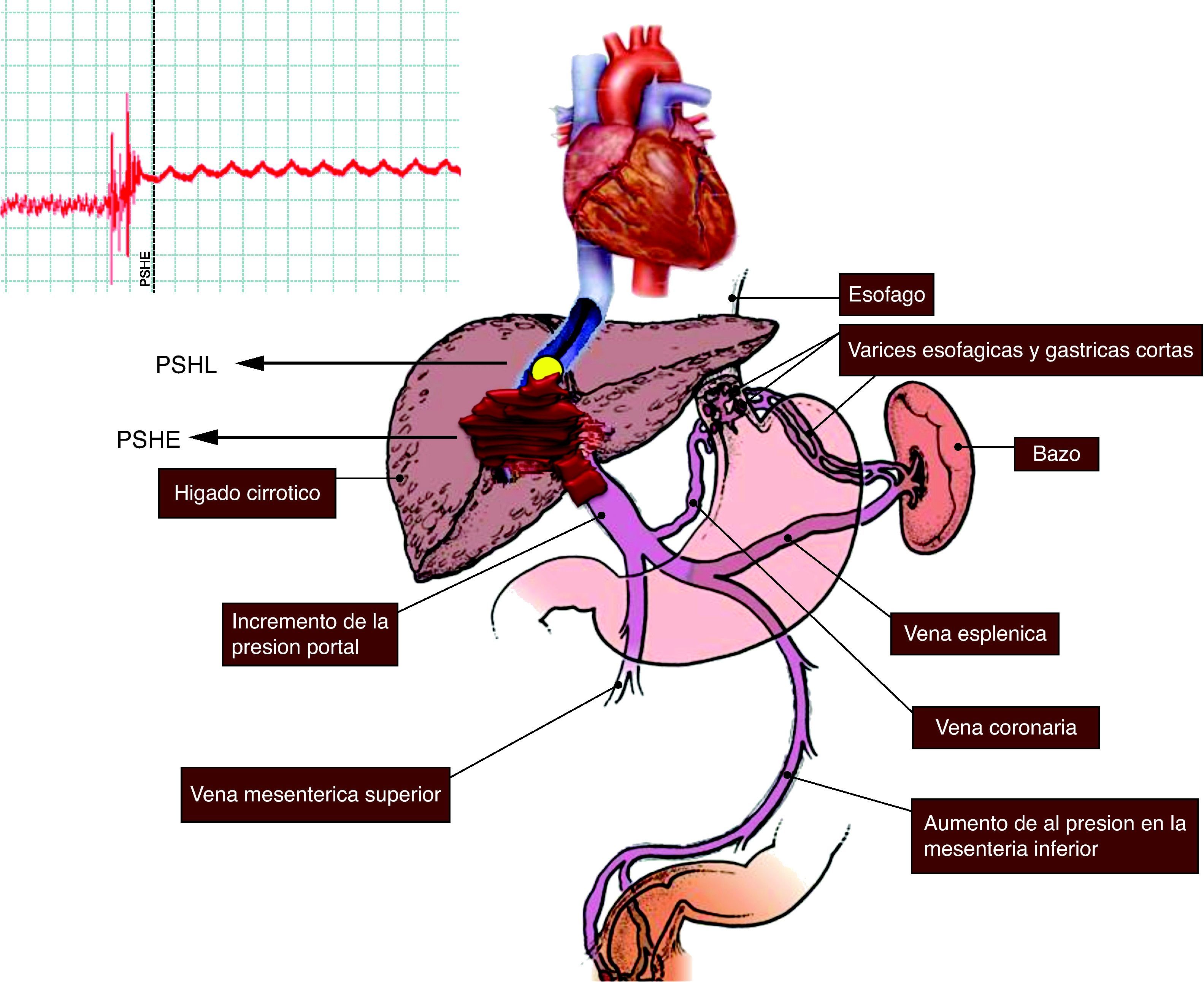
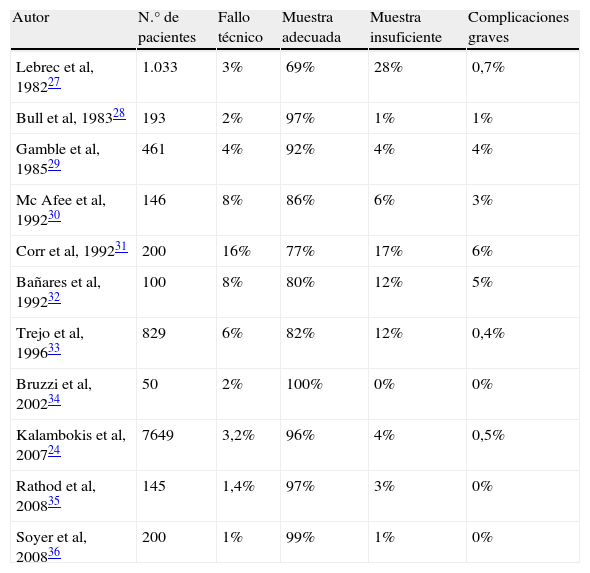
El fundamento físico de la medida del GPVH se basa en que al ocluir una vena suprahepática con un catéter, se crea una columna de sangre que transmite la presión del territorio vascular precedente, en este caso el territorio sinusoidal. En la CH, las conexiones intersinusoidales están distorsionadas por el depósito de colágeno, la presencia de nódulos regenerativos y de microtrombosis, evitando que la presión de la columna de sangre se disipe entre los sinusoides, manteniéndose constante desde la punta del catéter hasta la porta, por lo que la PSHE es virtualmente igual a la presión portal (fig. 1).
La introducción del catéter balón ha representado un gran avance técnico1, dado que permite realizar mediciones repetidas sin cambios de posición o intercambios, aumentando la reproducibilidad de las mediciones y la robustez de los resultados. Otra ventaja de este tipo de catéteres es la posibilidad de ocluir venas de mayor tamaño que recogen el drenaje de una cantidad más grande de parénquima hepático, reflejando de forma más precisa el valor real de la presión portal.
Recientemente se han revisado los procedimientos para una correcta medición del GPVH2,22,23. Se deben tener en cuenta las siguientes recomendaciones generales de forma sistemática (tabla 2):
- –
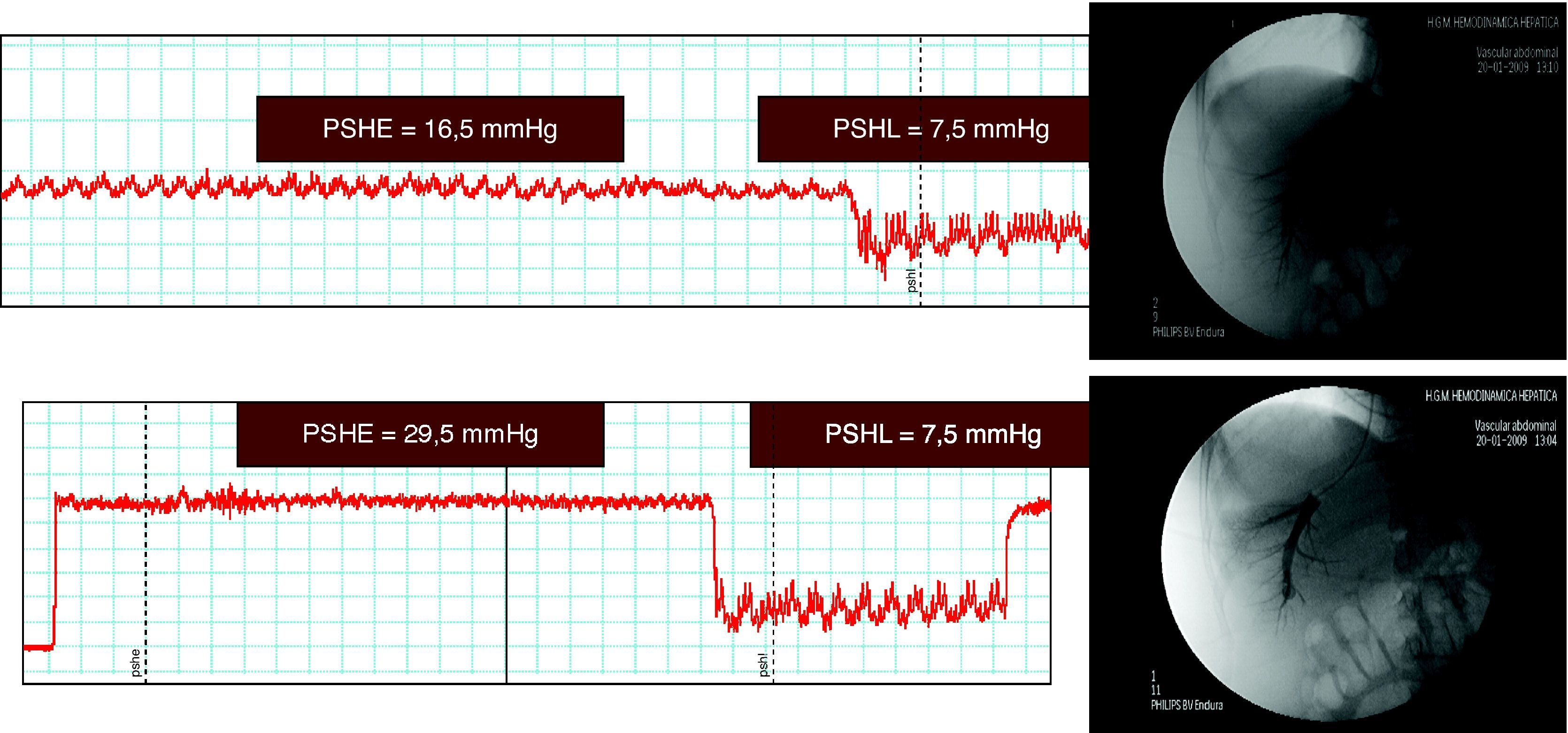
Localización. La vena escogida para la medición debe permitir una estimación fiable del GPVH. Habitualmente se prefiere la vena suprahepática derecha (VSHD) para que los resultados se basen en una cantidad representativa de parénquima hepático, aunque esto no es imprescindible. Una vez elegida la posición del catéter se debe hinchar el balón e inyectar contraste para comprobar el enclavamiento (fig. 2), descartar la presencia de estenosis, fístulas veno-venosas, y evitar las mediciones cerca de confluencias venosas hepáticas que impidan la correcta interpretación de los resultados. La diferencia entre la PSHL y la VCI no debe superar 1mm de Hg; en caso contrario, deberá tenerse en cuenta esta última para la realización de los cálculos.
- –
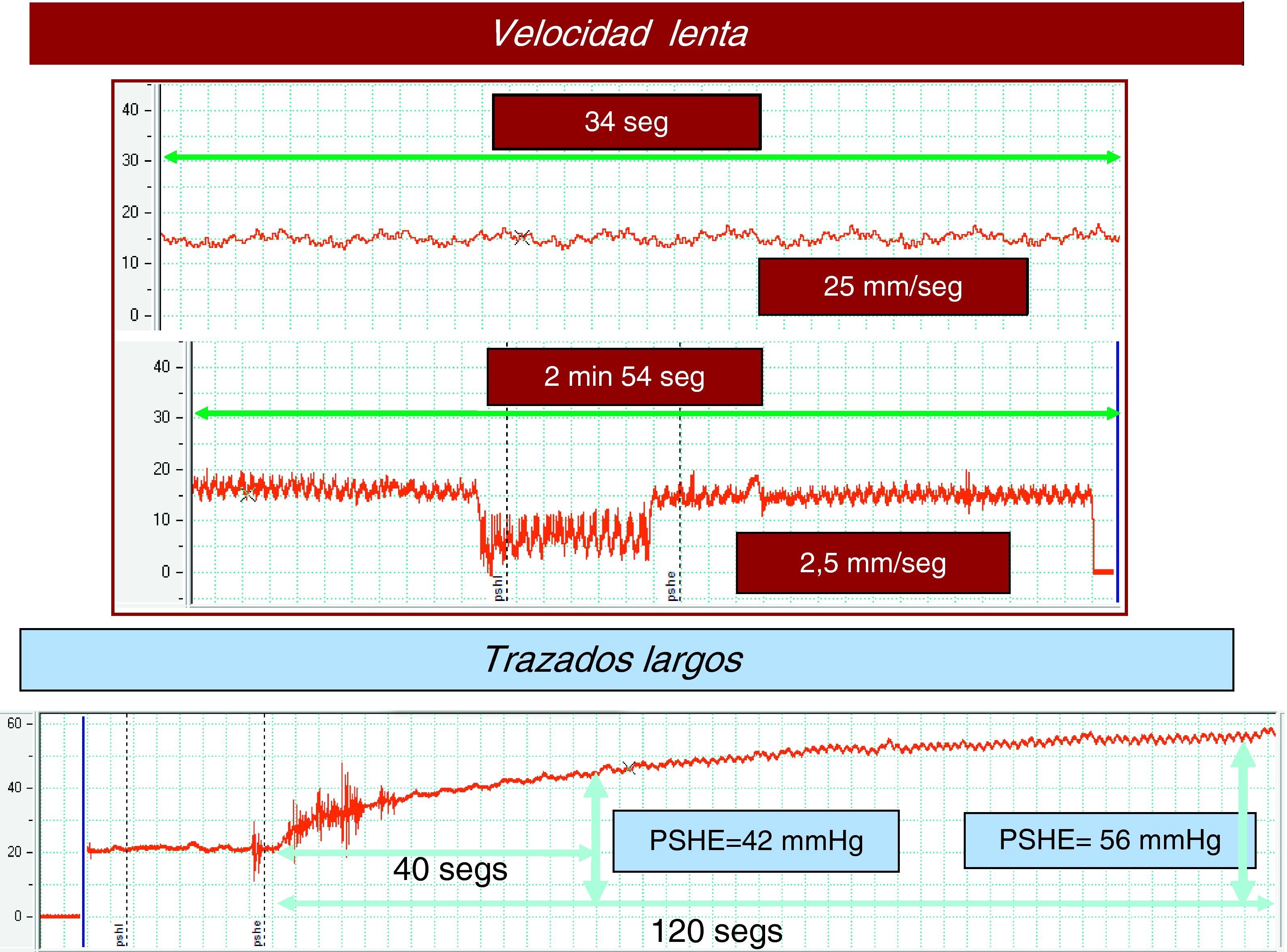
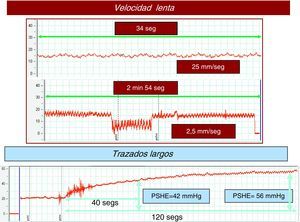
Tiempo. Con carácter orientativo una duración de las mediciones de al menos 15s para la PSHL y 60s para la PSHE suele ser suficiente. El objetivo es obtener un trazado estable y reproducible que permita realizar estimaciones precisas de la presión (fig. 3).
- –
Precisión y reproducibilidad. Se deben realizar mediciones repetidas para confirmar la reproducibilidad de los resultados y verificar el correcto enclavamiento del catéter. Pequeños cambios en los valores del GPVH pueden tener una gran relevancia pronóstica y no deben escatimarse esfuerzos ni tiempo para obtener estimaciones precisas. La presencia de contraste intravascular puede sobrestimar el valor real del GPVH y debe eliminarse siempre antes de realizar una nueva medición.
- –
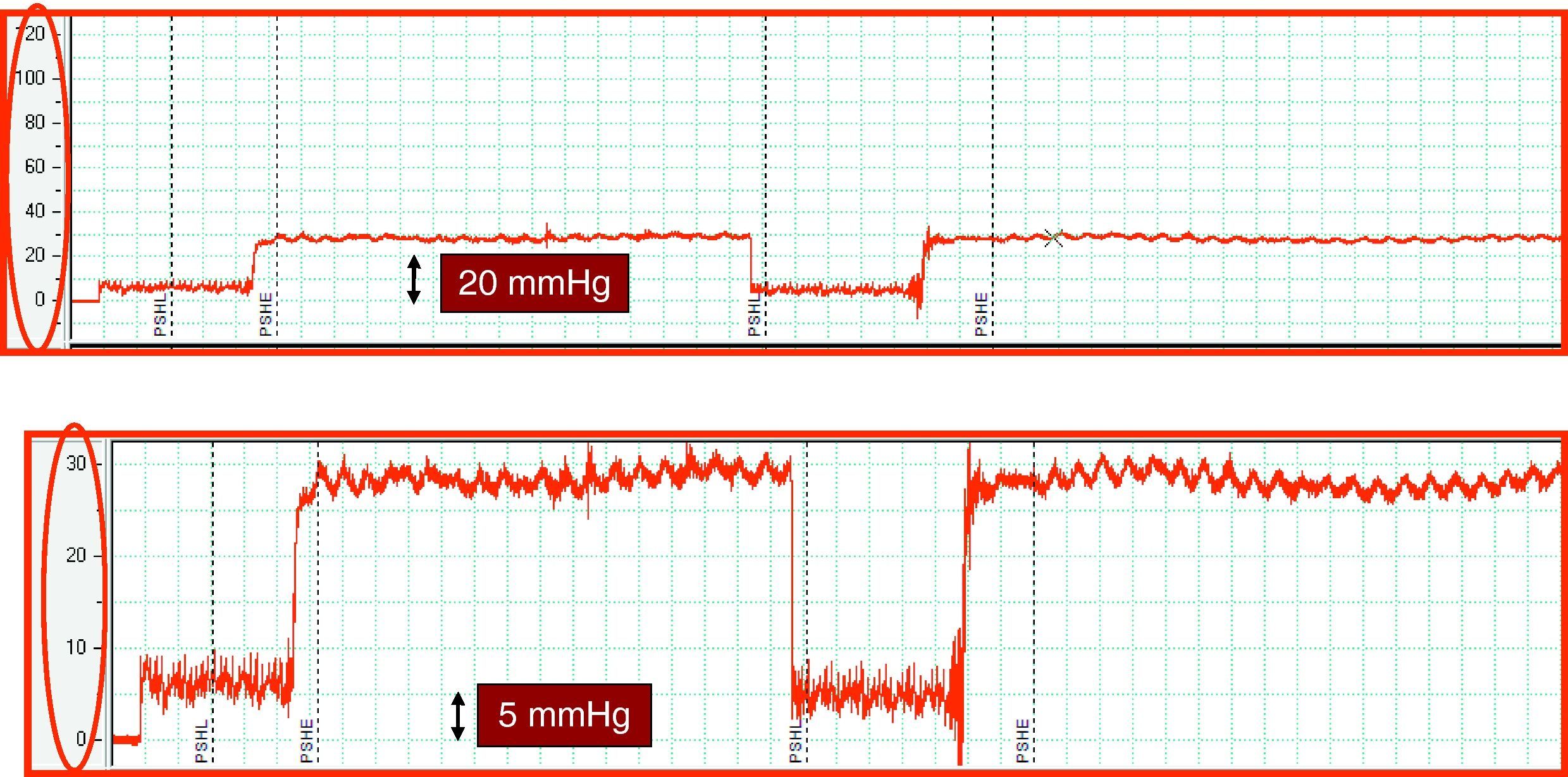
Calidad del trazado. La presión portal tiene un patrón manométrico de características venosas, de forma que sus valores oscilan entre 1-40mm de Hg. La utilización de una escala de medida adecuada (p. ej., 1mm de Hg=1mm) facilita la identificación de patrones hemodinámicos hepáticos; en este contexto las escalas utilizadas para la medición de la presión arterial son claramente inadecuadas (fig. 4). Así mismo, una velocidad lenta de registro (< 5mm/s, óptimo: 1-2mm/s) asegura una interpretación precisa del trazado. Por último, no deben realizarse estimaciones en función de los registros digitales de la pantalla, porque representa las presiones de un momento concreto del estudio. Los resultados expresados como la media de los valores registrados durante un intervalo de tiempo son un estimador más preciso de estas presiones.
- –
Cuidados posteriores. Al retirar el introductor debe comprimirse la zona de punción durante el tiempo necesario para evitar la formación de hematomas. Se recomienda que se mantenga la cabecera de la cama en ángulo de 45˚, un adecuado control de los signos vitales y la vigilancia del punto de entrada durante al menos 2h. El cuidado posterior al procedimiento debe realizarse por personal entrenado para la detección de las posibles complicaciones, especialmente si se ha realizado una biopsia hepática transyugular. Si existen las condiciones adecuadas, las exploraciones hemodinámicas hepáticas pueden hacerse en régimen de hospital de día.
Recomendaciones para la correcta medición y registro del GPVH
| 1. Transductor y escala adecuados para registrar cambios de presión venosa |
| 2. La medida en la VSHD refleja la presión del territorio sinusoidal correspondiente a una cantidad representativa de parénquima hepático. |
| 3. Es indispensable descartar la presencia de fístulas venosas, estenosis o confluencias de venas hepáticas distales a la punta del catéter, así como confirmar la buena oclusión al inflar el balón, previo al inicio de las mediciones |
| 4. Medida de la PSHL: la diferencia entre la PSHL y la VCI no debe superar 1mm de Hg, en este caso, el catéter debe ser reposicionado para repetir las mediciones |
| 5. Medida de la PSHE: el correcto enclavamiento del catéter es fundamental para obtener una medición fiable y debe verificarse siempre que existan variaciones importantes entre las estimaciones |
| 6. Las mediciones repetidas (se recomienda un mínimo de tres veces) de la PSHE y PSHL son importantes para confirmar la reproducibilidad de los resultados |
| 7. Los trazados deben ser largos, estables y registrados a una velocidad lenta (entre 1-5 mm/s) |
| 8. Los eventos que puedan alterar el trazado deben ser registrados (tos, movimientos del paciente) |
| 9. Las estimaciones no deben realizarse en función de los registros de la pantalla (véase texto) |
GPVH: Gradiente de presión venosa hepática; PSHE: presión suprahepática enclavada; PSHL: presión suprahepática libre; VCI: vena cava inferior; VSHD: vena suprahepática derecha.
La BHTY está indicada cuando la biopsia hepática percutánea (BHPC) no puede realizarse, habitualmente por la presencia de ascitis o una alteración significativa del estudio de coagulación; la vía intravascular permite una punción más segura en estas circunstancias porque evita el peritoneo y la cápsula hepática, disminuyendo el riesgo de complicaciones hemorrágicas graves. La realización de una BHTY ofrece además la posibilidad de obtener una medida del GPVH durante el mismo procedimiento y aportar información pronóstica complementaria al estudio histológico.
Las series más amplias y representativas de la literatura médica respaldan la BHTY como un procedimiento viable, seguro y de alto rendimiento diagnóstico (tabla 3).
Éxito técnico y seguridad de la BHTY: series más representativas de la literatura médica
| Autor | N.° de pacientes | Fallo técnico | Muestra adecuada | Muestra insuficiente | Complicaciones graves |
| Lebrec et al, 198227 | 1.033 | 3% | 69% | 28% | 0,7% |
| Bull et al, 198328 | 193 | 2% | 97% | 1% | 1% |
| Gamble et al, 198529 | 461 | 4% | 92% | 4% | 4% |
| Mc Afee et al, 199230 | 146 | 8% | 86% | 6% | 3% |
| Corr et al, 199231 | 200 | 16% | 77% | 17% | 6% |
| Bañares et al, 199232 | 100 | 8% | 80% | 12% | 5% |
| Trejo et al, 199633 | 829 | 6% | 82% | 12% | 0,4% |
| Bruzzi et al, 200234 | 50 | 2% | 100% | 0% | 0% |
| Kalambokis et al, 200724 | 7649 | 3,2% | 96% | 4% | 0,5% |
| Rathod et al, 200835 | 145 | 1,4% | 97% | 3% | 0% |
| Soyer et al, 200836 | 200 | 1% | 99% | 1% | 0% |
BHTY: Biopsia hepática transyugular.
Recientemente, se han revisado los procedimientos para una correcta realización de la BHTY24 (tabla 4). El acceso de elección es la vena yugular interna derecha. Si no es posible su canalización, puede intentarse la biopsia a través de la vena yugular izquierda, aunque pueden incrementarse notablemente las dificultades técnicas.
Recomendaciones para la realización de una BHTY.
| 1. Es importante la utilización de introductores de diámetro suficiente para permitir el paso de los sistemas de punción (al menos 9 Fr) |
| 2. Control radiológico permanente de la trayectoria de la aguja. Los movimientos de rotación para facilitar la progresión deben ser suaves y lentos |
| 3. Evitar las punciones periféricas; con carácter orientativo se recomienda el tercio medio de la VSHD |
| 4. Realizar la punción en pausa respiratoria disminuye el riesgo de lesión hepática |
| 5. En general 3 pases suelen ser suficientes para realizar un adecuado diagnóstico histológico |
BHTY: Biopsia hepática transyugular; VSHD: vena suprahepática derecha.
Al igual que para la medición del GPVH, se recomienda la utilización de un protocolo sistemático para su realización.
El punto idóneo de punción es la porción proximal de las venas suprahepáticas, en este punto la gran cantidad de parénquima circundante disminuye la probabilidad de punción capsular y de complicaciones hemorrágicas.
La BHTY se puede realizar con agujas de aspiración (Menghini) o de corte (Tru-Cut). La aguja de Menghini se avanza 1 o 2cm desde la punta de la funda, y con el paciente en pausa respiratoria, se avanza y retira en un movimiento único manteniendo la aspiración para no perder la muestra. La aguja automatizada tipo Tru-Cut se prepara tirando hacia atrás del dispositivo hasta escuchar un clic, se introduce a través de la funda, se avanza dentro del parénquima hepático y se acciona el mecanismo de disparo. Con cualquiera de los 2 sistemas es necesaria la inyección de material de material de contraste para descartar la presencia de perforación capsular tras cada pase de la aguja.
En una revisión reciente que incluyó 7.649 BHTY25, el porcentaje de procedimientos donde se obtuvo material suficiente para realizar un diagnóstico histológico adecuado fue del 96%. La calidad de los especímenes mejoraba con la utilización de agujas de corte y la realización de 3 o más pases, sin aumento del número de complicaciones.
A pesar de que inicialmente se cuestionaba la calidad de las muestras obtenidas con la BHTY, estudios posteriores han demostrado que su rentabilidad diagnóstica cuando se utilizan agujas de punción corte es equiparable a la BHPC26,27.
El fallo técnico del procedimiento ocurre en aproximadamente el 3% de los casos25,28–31. Las causas más frecuentes son la imposibilidad de canalizar la vena yugular (25,8%) y el fracaso para insertar la aguja dentro de las venas suprahepáticas (43%), casi siempre motivado por una excesiva horizontalización del ángulo entre ésta y la vena cava.
ComplicacionesLa incidencia de complicaciones de la BHTY es baja, de alrededor de un 7% en una revisión que incluyó más de 7.500 BHTY25.
Las más frecuentes son las derivadas de la punción cervical, fundamentalmente sangrado por el punto de entrada, hematomas (en ocasiones de gran tamaño con afectación de estructuras vecinas), dolor local, disfonía, parestesias del miembro superior y ocasionalmente síndrome de Horner por lesión del simpático cervical; sin embargo, suelen resolverse espontáneamente y son menos frecuentes con la punción guiada por ecografía18–20.
El paso de los distintos dispositivos puede motivar arritmias auriculares (fibrilación auricular y taquicardias paroxísticas) que habitualmente son autolimitadas, si bien en raras ocasiones es necesaria la aplicación de cardioversión.
Las complicaciones más graves se relacionan con la realización de la punción hepática. Entre ellas destaca la perforación capsular por el riesgo de hemorragia intraperitoneal; en estos casos puede intentarse embolizar el trayecto de la aguja. La hemobilia, el desgarro de la vena cava y la aparición de hematomas intraparenquimatosos de gran tamaño son complicaciones infrecuentes. En cualquier caso, la aparición de complicaciones graves (0,5%) y de la mortalidad asociada al procedimiento (0,09%) es aceptablemente baja.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al personal de enfermería del Laboratorio de Hemodinámica Hepática del Hospital General Universitario Gregorio Marañón, por su colaboración y profesionalidad durante todos estos años.