Presentamos el caso de una mujer de 22 años, sin antecedentes personales o familiares de interés, que acude a nuestro centro para completar el estudio de un trastorno del comportamiento de reciente aparición. El desarrollo psicomotor y la integración socio-laboral de la paciente había sido normal hasta que comenzó un cuadro de 6 meses de evolución consistente en cambio en la conducta alimentaria, comportamiento desinhibido, trastornos en el habla y la deambulación, que se agravaron de manera progresiva. Tres meses después, presentaba amenorrea y lesiones cutáneas ampollosas en cara y extremidades, diagnosticadas como dermatitis atópica tras biopsia. Nunca había presentado diarrea, náuseas, vómitos, dolor abdominal u otra clínica digestiva. La paciente negó la ingesta de cualquier tóxico o droga, así como viajes al extranjero, picadura de insectos, convivencia con animales o ingesta de alimentos no elaborados industrialmente.
La exploración física general no evidenció hallazgos destacables, y en la exploración neurológica estaba bien orientada en espacio, tiempo y persona, presentaba un nistagmo inagotable hacia la izquierda, temblor cefálico discreto y piramidalismo bilateral de predominio izquierdo con clonus aquíleo izquierdo y signo de Babinski bilateral. Igualmente, presentaba disdiadococinesia, temblor intencional y marcha con aumento marcado en la base de sustentación sin lateralizaciones ni pulsiones.
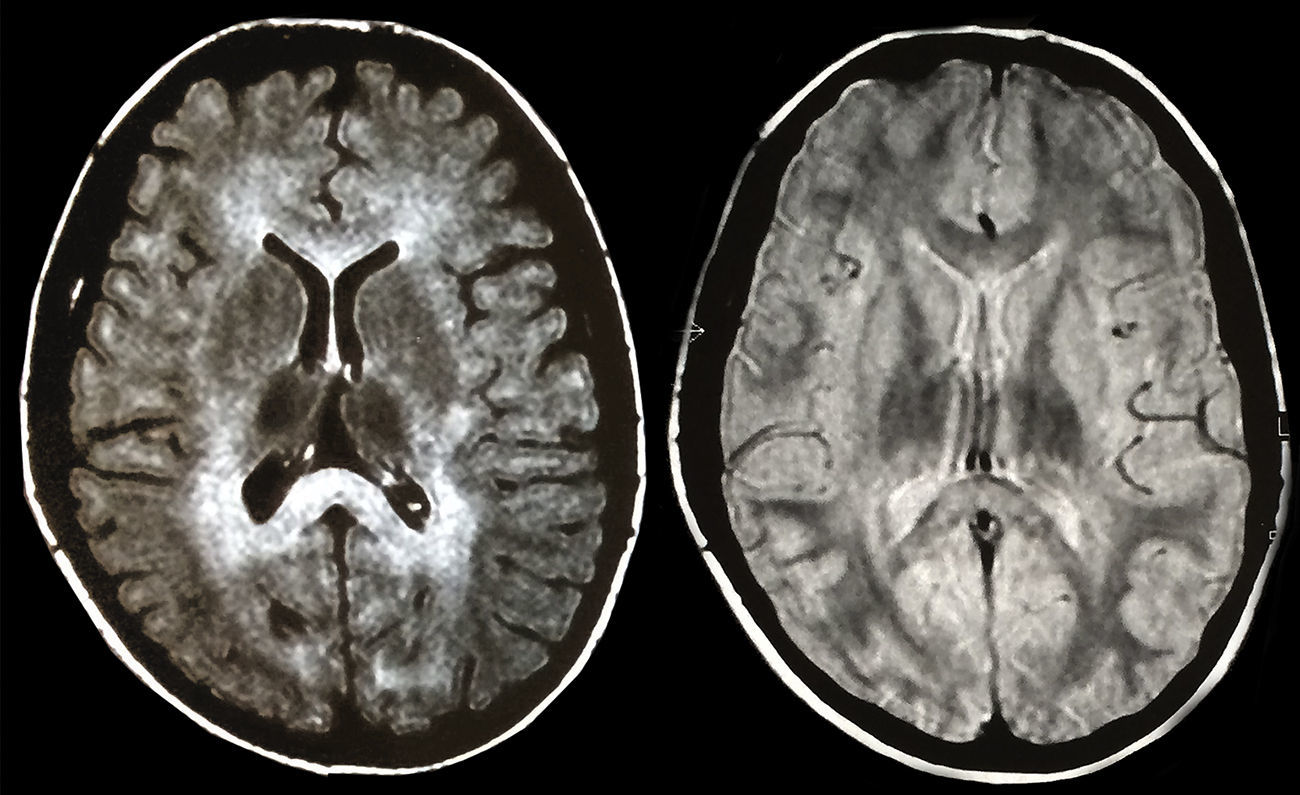
Se realizó una Resonancia Magnética Nuclear (RMN) craneal, informada como leucoencefalopatía metacromática, que puso de manifiesto una extensa afectación de la sustancia blanca cerebelosa y cerebral subcortical, de los centros semiovales, cápsulas internas, externas y ambos branchium pontis (fig. 1). En un estudio de potenciales evocados auditivos y visuales, se halló una alteración de la conducción entre oliva bulbar y protuberancia, y una importante alteración de las vías visuales a nivel retroquiasmático, respectivamente. El EEG fue informado como normal y no existía enfermedad a nivel de los nervios periféricos. La valoración psiquiátrica descartó psicopatología primaria y emitió el diagnóstico de síndrome frontal en el contexto de trastorno orgánico.
Se descartaron enfermedades infecciosas, defectos congénitos del metabolismo, esclerosis múltiple, así como tóxicos. Se objetivaron bajas cifras de ácido fólico, hierro y ferritina, niveles de IgA en suero disminuidos (59mg/dl), anticuerpos antigliadina IgA e IgG, antiendomisio y antitransglutaminasa IgA positivos.
En la endoscopia oral se observaron unos pliegues de segunda porción duodenal discretamente aplanados. El examen histológico reveló atrofia vellositaria parcial con un marcado incremento de los linfocitos intraepiteliales (Marsh IIIa), todo ello compatible con enfermedad celíaca (EC). El estudio inmunofenotípico de las biopsias duodenales evidenció un aumento en los linfocitos T intraepiteliales gamma-delta (γδ) del 24% y una disminución de los linfocitos CD3−CD103+(i-NK) respecto al total de linfocitos intraepiteliales del 0,1%. En el estudio de histocompatibilidad se objetivó la presencia del haplotipo DR3-DQ2.
Con el diagnóstico de leucoencefalopatía, ataxia por gluten (AG), EC y déficit de IgA, se inició tratamiento con suplementos de hierro y ácido fólico asociados a dieta sin gluten, con buena adherencia por parte de la paciente, corrigiéndose las alteraciones conductuales y desapareciendo el temblor y la ataxia al cabo de un año. La RMN craneal de control a los 2 años del diagnóstico demostró remisión de las lesiones descritas. Igualmente, se ha comprobado normalización histológica, serológica e inmunofenotípica de los marcadores de EC.
La EC es una enteropatía por sensibilidad al gluten de origen autoinmune que se desarrolla en individuos genéticamente predispuestos. Diferentes estudios epidemiológicos han estimado una prevalencia de un caso por cada 130-400 individuos de la población general1–3. Los metabolitos del gluten son capaces de activar una cascada inmunológica que produce inflamación intestinal como resultado final. Sin embargo, son frecuentes las manifestaciones extraintestinales, entre los que destacan una cantidad no despreciable de síndromes neurológicos (tabla 1). Se estima que hasta el 10% de los pacientes diagnosticados de EC presentan como manifestación inicial clínica de tipo neurológico4–6. De forma global, la clínica neurológica aparece en una proporción variable de pacientes celíacos, estimada entre el 8-26%7.
Trastornos neurológicos y psiquiátricos asociados a EC. Adaptado de Pengiran et al.7
| Epilepsia |
| Síndromes ansioso-depresivos |
| Migraña, cefalea tensional |
| Síndrome del túnel carpiano |
| Ictus |
| Miopatía |
| Trastornos del aprendizaje |
| Meningitis, encefalitis |
| Enfermedad de Parkinson |
| Esclerosis múltiple |
| Neuropatía periférica |
| Patología cerebelosa |
| Mielopatía |
| Leucoencefalopatía progresiva crónica |
Asimismo, una reacción cruzada con proteínas del gluten, mediada por anticuerpos dirigidos contra células de Purkinje es la causante de la AG8, que se suele presentar en pacientes de mediana edad de manera insidiosa. Su manifestación universal es la ataxia de la marcha, aunque puede presentar una clínica neurológica más florida, con disartria (66%), ataxia de miembros (90%) y clínica ocular (84%)9. El despistaje de anticuerpos anti-transglutaminasa y anti-gliadina forma parte del estudio inicial de la ataxia, independientemente de que exista o no clínica gastrointestinal. Cuando son positivos, está indicada una dieta sin gluten de manera indefinida, así como uno la realización de biopsia duodenal, que muestra atrofia de vellosidades en aproximadamente un tercio de los pacientes. La respuesta a la DSG refuerza el diagnóstico de AG, y se aprecia a los 6-12 meses de su inicio. Dicha respuesta es variable y, ya que la pérdida de células de Purkinje es irreversible, depende fundamentalmente de la duración de la ataxia, que suele ser de unos 10 años previo al diagnóstico9.