INTRODUCCIÓN
Ante la evidencia de una lesión pancreática, clásicamente se planteaba la duda diagnóstica entre una enfermedad benigna o maligna, para posteriormente valorar la resecabilidad de la lesión y la operabilidad del paciente para remitirlo a una resección quirúrgica. Este algoritmo de manejo, en el que se excluía la opción de la biopsia de la lesión pancreática, se basaba en que el resultado negativo de una punción no excluía la posibilidad de que realmente se tratase de una lesión maligna, en que la realización de la biopsia pancreática podría impedir una cirugía curativa, sobre todo por el riesgo de recidiva tumoral en el trayecto de la biopsia con el acceso clásico percutáneo (guiado por ecografía abdominal, tomografía computarizada o resonancia magnética abdominal), los datos disponibles de una baja morbimortalidad quirúrgica y, finalmente, por la alta sensibilidad diagnóstica de los diferentes métodos de imagen. Ante todos estos hechos, la biopsia de las lesiones pancreáticas se limitaba a los tumores irresecables, previo al tratamiento oncológico paliativo, y a casos aislados en los que el diagnóstico diferencial incluía la tuberculosis, el linfoma, la sospecha de un tumor neuroendocrino o tumores quísticos de naturaleza incierta. Sin embargo, este algoritmo plantea ciertos problemas relacionados, por ejemplo, con la imposibi lidad de aplicar protocolos en el manejo del cáncer de páncreas, la imposibilidad de conocer mejor las características histológicas de procesos benignos (pancreatitis crónica) e, igualmente, no poder derivar a estos pacientes a centros especializados, tanto desde el punto de vista quirúrgico especialmente relevante, ya que estudios recientes han mostrado la importancia de realizar la cirugía pancreática en centros especializados, con un elevado volumen de intervenciones quirúrgicas, en los que las cifras de morbimortalidad son significativamente inferiores1 como oncológico, con lo que se puede ofrecer a nuestros pacientes consejos sobre diferentes opciones terapéuticas o incluso aplicar tratamientos neoadyuvantes2. Con ello, probablemente las indicaciones que se deberían plantear en la actualidad para la obtención de biopsias de masas pancreáticas deberían incluir, aparte de los tumores irresecables, los casos en que se precise realizar un diagnóstico diferencial entre una pancreatitis crónica y un cáncer de páncreas, el diagnóstico preoperatorio de los tumores pancreáticos, la sospecha de tumores neuroendocrinos, ante la presencia de una lesión quística de páncreas y en la evolución de los pacientes con una pancreatitis crónica, entre otras. En este contexto clínico surge la necesidad creciente de obtener muestras de biopsia de las diferentes lesiones pancreáticas. A continuación revisaremos el gran avance que supone la ecografía endoscópica y la biopsia dirigida mediante esta técnica para el estudio de las enfermedades pancreáticas.
ECOGRAFÍA ENDOSCÓPICA Y PUNCIÓN GUIADA POR ECOGRAFÍA ENDOSCÓPICA
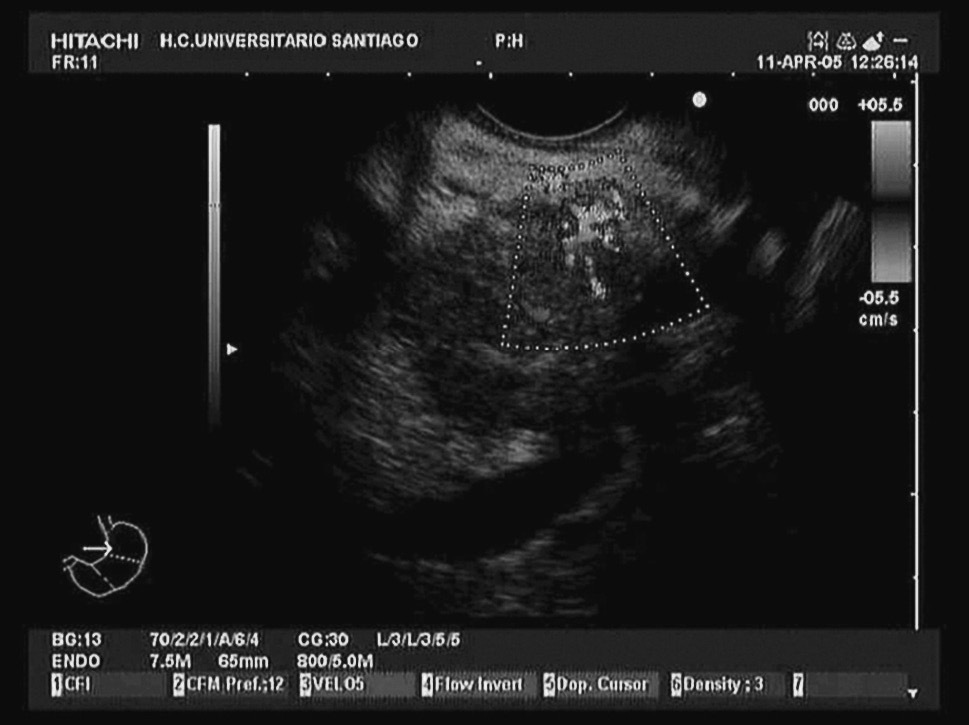
La ecografía endoscópica, técnica que combina una imagen endoscópica con una imagen ecográfica, se encuentra en continuo desarrollo desde su implantación en los años ochenta. De hecho, con los equipos electrónicos disponibles en la actualidad es posible realizar estudios vasculares mediante las distintas opciones Doppler (Doppler-color, angio-Doppler y pulsados)3. La realización de la ecografía endoscópica mediante equipos sectoriales ha supuesto un gran avance, al permitir acceder a la realización de biopsias dirigidas de territorios difícilmente accesible por otros medios, como el mediastino, la región pararrectal y, por supuesto, el páncreas, entre otros, así como realizar estas biopsias con un gran margen de seguridad, aportado por el estudio vascular previo a la biopsia, con el fin de evitar complicaciones hemorrágicas (fig. 1).
Fig. 1. Imagen de tumoración en la cabeza del páncreas mediante ecografía endoscópica con eco-Doppler color.
Para la realización de la punción-aspiración con aguja fina se dispone de diferentes agujas para la toma de muestras en un estudio citológico, con calibres entre 19 y 25 G, y en la actualidad se dispone de agujas de 19 G tipo trucut, que permiten obtener muestras para realizar no sólo estudios citológicos, sino también estudios histológicos4,5.
TUMORES PANCREÁTICOS SÓLIDOS
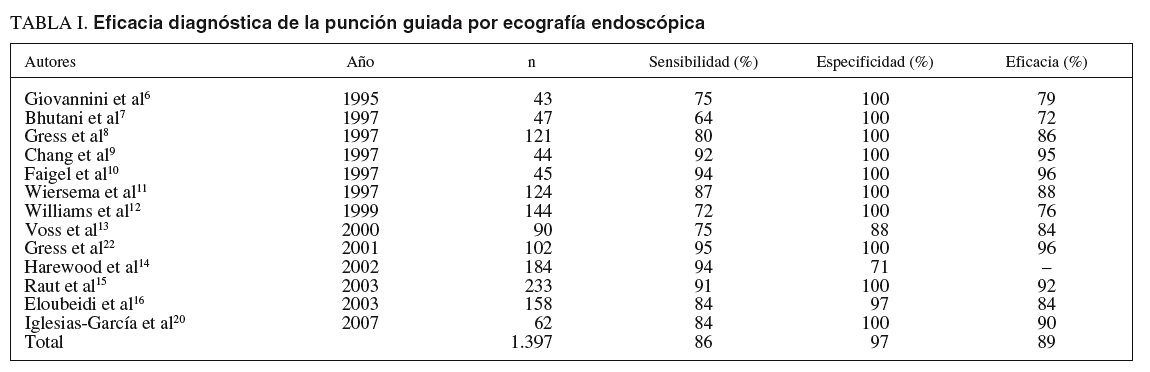
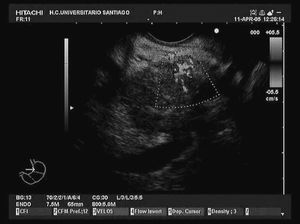
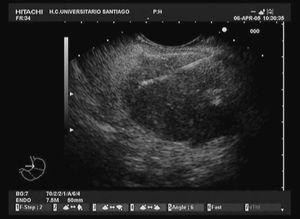
En la actualidad, la punción guiada por ecografía endoscópica es la vía ideal para la obtención de muestras de los tumores pancreáticos (fig. 2). Los primeros resultados obtenidos de rentabilidad diagnóstica publicados en relación con la punción guiada por ecografía endoscópica datan del año 1995, Giovaninni et al6 obtuvieron una eficacia diagnóstica en su serie del 79%. En los años posteriores, estos resultados han mejorado, fundamentalmente por la optimización de la técnica y del material disponible para su realización, alcanzado unas elevadas cifras de eficacia diagnóstica para la detección de malignidad, que oscilan entre el 72 y el 96% (tabla I)6-16. En estas publicaciones los resultados se obtienen mediante un estudio citológico, en la mayor parte de los casos mediante agujas de 22 G. En la actualidad, mediante las agujas tipo trucut es posible obtener material para el estudio histológico; sin embargo, aun hay limitaciones con dicha técnica, ya que esta aguja sólo puede emplearse a través del estómago, por lo que su utilización transduodenal es difícil y presenta mayor riesgo de complicaciones. Con esta técnica se mantiene una eficacia diagnóstica similar a la referida previamente para la citología (alrededor del 80%)17-19, con la opción de poder realizar estudios especiales con las muestras (inmunohistoquímica, marcadores moleculares, obtención de ADN y ARN), que pueden ayudar en la valoración de tumores pancreáticos diferentes al adenocarcinoma, como es el caso de los linfomas o tumores metastáticos. Sin embargo, mediante modificaciones en la técnica de punción con aguja fina de 22 G es posible obtener muestras válidas para realizar estudios histológicos. En nuestro centro, en un estudio realizado sobre 62 pacientes con masas pancreáticas, mediante la combinación del estudio de muestras citológicas clásicas y muestras histológicas, obtenidas mediante una modificación de la técnica, hemos logrado una eficacia global en la evolución de las masas pancreáticas sólidas de un 90,32%, con la ventaja de haber podido detectar con el estudio histológico una metástasis pancreática por un microcítico de pulmón o un linfoma pancreático20. En este contexto, otro de los puntos clave en el estudio de los tumores pancreáticos es el diagnóstico diferencial con lesiones inflamatorias focales, fundamentalmente con la pancreatitis crónica focal, donde la ecografía endoscópica también ha demostrado su eficacia. En un trabajo publicado por Takahashi et al21, se evaluó la utilidad de la técnica en el diagnóstico diferencial entre el cáncer de páncreas y la pancreatitis crónica focal, con una eficacia global del 86% y un valor predictivo negativo del 58%.
Fig. 2. Punción-aspiración con aguja fina de 22 G de un tumor en la cabeza del páncreas.
Pero las ventajas de la punción guiada por ecografía endoscópica se observan también en los casos en que la técnica se emplea tras el fracaso en la obtención de muestra por otras vías; por ejemplo, en un estudio de Gress et al22, tras el fracaso del acceso percutáneo y de la colangiopancreatografía retrógrada endoscópica, la punción por ecografía endoscópica permitió acceder al diagnóstico anatomopatológico en aproximadamente el 85% de los casos.
Finalmente, se ha observado que en el estudio de los tumores pancreáticos, la punción guiada por ecografía endoscópica también tiene implicaciones clínicas importantes, que llegan a contraindicar la cirugía hasta en el 41% de los pacientes, y evitar la realización de otras pruebas diagnósticas en el 57%, para modificar la actitud terapéutica en el 68% de los casos23.
LESIONES PANCREÁTICAS BENIGNAS
Una indicación que cobra una mayor trascendencia con el desarrollo de la técnica es el estudio de las lesiones benignas, entre las que destacan la pancreatitis crónica y la pancreatitis autoinmunitaria, sin descartar otras como la tuberculosis. De hecho, en la actualidad hay un número creciente de estudios encaminados a la evaluación de estas lesiones.
Para la evaluación diagnóstica de la pancreatitis autoimunitaria, Levy et al24 destacan, en un estudio inicial, la elevada eficacia diagnóstica de la biopsia guiada por ecografía endoscópica mediante agujas tipo trucut, que permite optimizar el tratamiento de este tipo de pacientes. Deshpande et al25 evaluaron igualmente la utilidad de la punción guiada por ecografía endoscópica en el estudio de esta entidad, describiendo algunas de las características citohistológicas que ayudan a establecer el diagnóstico.
La posibilidad de obtener muestras de pacientes con el diagnóstico de pancreatitis crónica puede ser de gran utilidad para un alcanzar un mejor conocimiento de la enfermedad. En un estudio realizado en nuestro centro, fue posible evaluar, mediante punción guiada por ecografía endoscópica, las características histológicas de 14 pacientes con pancreatitis crónica, observando diferentes características histológicas en función de la gravedad de la enfermedad26.
Quizá una de las grandes ventajas con el estudio citohistológico es no sólo evaluar las características anatomopatológicas de las distintas enfermedades, sino la posibilidad de realizar estudios inmunohistoquímicos específicos, moleculares y de mutaciones genéticas, que ayuden a definir y conocer mejor este grupo de enfermedades.
TUMORES QUÍSTICOS DE PÁNCREAS
La ecografía endoscópica es muy útil para la detección de lesiones quísticas pancreáticas, incluso las de pequeño tamaño, no observables o no accesibles por otras técnicas (seudoquistes, cistoadenoma seroso, cistoadenoma y cistoadenocarcinoma mucinoso, tumor mucinoso papilar intraductal [TMPI], etc.). La punción guiada permite la obtención, mediante aspiración, de material de estas lesiones, que puede emplearse no sólo para su estudio citohistológico (ya sea del contenido de la lesión o de áreas sólidas presentes en las lesiones), sino también para el análisis bioquímico del líquido27,28. Se han empleado distintos marcadores en la valoración de estas lesiones (tabla II). La obtención de un material viscoso del aspirado de la lesión suele ser característico de los tumores mucinosos, pero no de los de los cistoadenomas serosos o de las lesiones inflamatorias29. Los valores de amilasa se encuentran elevados en las lesiones quísticas comunicadas con el conducto pancreático, como los seudoquistes o en casos concretos de TPMI29. Diversos estudios han demostrado una elevación del CEA y el CA 72-4 en el aspirado de tumores mucinosos, con una sensibilidad diagnóstica alrededor del 80%); de hecho, en la actualidad, la determinación de los valores de CEA en el contenido de las lesiones quísticas se considera fundamental para un estudio correcto de estas lesiones: los tumores mucinosos se caracterizan por presentar unos valores por encima de 192 ng/ml30,31. En actualidad también se está evaluando la utilidad de evaluar las mutaciones, como la del k-ras, presente en cases de cistoadenocarcinomas32. De forma global, la eficacia diagnóstica, en las diferentes series publicadas en la literatura médica se encuentra próxima al 90%.
Con todo ello, la punción guiada por ecografía endoscópica se considera en la actualidad como la técnica de elección en el diagnóstico diferencial de las lesiones quísticas de páncreas.
PUNCIÓN GUIADA POR ECOGRAFÍA ENDOSCÓPICA Y SUS COMPLICACIONES
Una vez que hemos evaluado la alta rentabilidad diagnóstica de la punción guiada por ecografía endoscópica en el estudio de las lesiones pancreáticas, cabe destacar la baja tasa de complicaciones relacionadas con esta técnica. En este sentido, el riesgo de bacteriemia es muy bajo, el riesgo de pancreatitis aguda oscila entre el 1 y el 2% de los casos, y la probabilidad de sangrado o peritonitis es raro; el grupo más delicado es el de las lesiones quísticas, sobre todo por riesgo de complicaciones infecciosas, por lo que es recomendable la utilización de profilaxis antibiótica33. En el estudio más amplio, que incluye un total de 355 pacientes sometidos a punción de lesiones pancreáticas sólidas, se describe únicamente una tasa de complicaciones del 2,5% (3 casos de dolor abdominal, 2 casos de síndrome febril autolimitado, 2 episodios de pancreatitis aguda), sin evidencia de perforaciones, hemorragia significativa y, sobre todo, sin ninguna muerte asociada34. En nuestra experiencia, en el total de las 105 punciones pancreáticas realizadas por ecografía endoscópica, tanto de lesiones sólidas como quísticas, únicamente se han producido dos complicaciones, un caso de pancreatitis aguda y otro de hemorragia en el punto de punción (por lo que no se ha incrementado la estancia hospitalaria de los pacientes), y no se ha presentado ningún caso de muerte relacionada con la técnica.
Por otra parte, la tasa de diseminación tumoral con esta técnica se ha mostrado significativamente más baja que la obtenida mediante la punción percutánea. En el trabajo de Micames et al35, en los paciente sometidos a punción guiada por ecografía endoscópica el porcentaje con carcinomatosis peritoneal fue del 2,2%, significativamente inferior al obtenido mediante la punción percutánea (16,3%).
CONCLUSIONES
La realización de una biopsia pancreática se está convirtiendo en la actualidad en un punto fundamental para el correcto manejo de los pacientes con lesiones pancreáticas de cualquier etiología, que es útil no sólo para la evaluación de la malignidad sino para el mejor estudio y conocimiento de cualquier tipo de enfermedad, con lo que ayudará a un mejor manejo terapéutico de estos pacientes. La punción guiada por ecografía endoscópica es una técnica segura, con un bajo índice de complicaciones y una precisión diagnóstica no alcanzable por otros procedimientos; probablemente, es la técnica de elección para el estudio de lesiones pancreáticas.