INTRODUCCIÓN
Las neoplasias epiteliales malignas del aparato digestivo, al igual que las de otras localizaciones, están precedidas o acompañadas durante el proceso carcinogénico de alteraciones celulares que se han llamado de forma genérica «lesiones premalignas». La identificación y la detección de estas lesiones precursoras, es fundamental para el diagnóstico precoz y la prevención del cáncer invasivo1.
CONCEPTO Y DEFINICIÓN DE DISPLASIA
El término displasia significa etimológicamente desviación del desarrollo, y fue utilizado originalmente para describir anomalías en el desarrollo embriológico. Por extensión se utiliza el término, desde hace varias décadas, para referirse a las alteraciones del desarrollo celular que preceden o acompañan a las neoplasias invasivas, especialmente las de origen epitelial2.
En las neoplasias epiteliales digestivas se considera que conceptualmente las lesiones displásicas forman parte del proceso neoplásico, y se ha definido la displasia epitelial como «una proliferación celular inequívocamente neoplásica, no invasiva». Esta definición, que fue introducida en 19833 en el contexto de la enfermedad inflamatoria intestinal, en la actualidad está universalmente admitida y se aplica a todos los segmentos del tubo digestivo, en cualquier contexto clínico patológico1-5. La cualidad de «no invasiva» significa que la proliferación celular está limitada por la membrana basal del epitelio y, por tanto, cumple los criterios de «neoplasia intraepitelial» (igual que los establecidos en otros órganos no digestivos y en cualquier tipo de epitelio). En todas las clasificaciones actuales el término displasia es sinónimo al de neoplasia intraepitelial.
CRITERIOS DIAGNÓSTICOS
La introducción del término «inequívocamente neoplásico» en la definición destaca la dificultad que conlleva la identificación de la displasia, que se ha de distinguir claramente no sólo del carcinoma invasivo sino también de los cambios de tipo reactivo o reparativo.
El diagnóstico de displasia se basa fundamentalmente en criterios histológicos. La mayor parte de las lesiones displásicas se descubren en una mucosa indistinguible macroscópicamente de la mucosa normal circundante, aunque en algunos casos pueden ponerse de manifiesto mediante técnicas auxiliares, como la cromoendoscopia o la endoscopia de fluorescencia6,7. En algunas ocasiones dan lugar a lesiones, planas o sobreelevadas que se pueden reconocer en un examen endoscópico convencional. Las formas de displasia «elevada» pueden constituir masas mal delimitadas de la mucosa no neoplásica o adoptar un crecimiento polipoide sésil o pediculado bien delimitado, mostrando las características morfológicas de los adenomas colorrectales. De hecho, a todos los efectos, los adenomas intestinales son focos bien delimitados de displasia y los criterios de diagnóstico y gradación de los adenomas son los mismos que los de la displasia plana. Por tanto, en la actualidad los términos displasia polipoide y adenoma son sinónimos, con algunas excepciones, en cualquier órgano del aparato digestivo1,2,8.
La displasia epitelial se caracteriza por la presencia de alteraciones tanto celulares como estructurales (arquitectura de la mucosa). Los dos tipos de alteraciones suelen coexistir y en su identificación e interpretación en el estudio microscópico se basa el diagnóstico y la clasificación de la displasia. Las alteraciones celulares consisten en atipia y pleomorfismo celular de grado variable, hipercromatismo nuclear, incremento de la relación núcleo-citoplasma, pérdida de la polaridad celular dentro del epitelio, actividad mitótica aumentada y, uno de los datos fundamentales, disminución o ausencia de la maduración celular. Las alteraciones estructurales son más manifiestas en los epitelios glandulares, con pérdida de grado variable de la arquitectura glandular normal, que da lugar a un aumento desordenado del número de glándulas, las cuales pueden presentar ramificaciones complejas, patrones de aspecto cribiforme y adosamientos glandulares sin estroma interpuesto1-5.
En la valoración histológica de la displasia en el epitelio glandular, además de las alteraciones citológicas y estructurales imprescindibles para el diagnóstico, hay que considerar otros aspectos fundamentales, como la maduración del epitelio superficial, la coexistencia de inflamación activa y la presencia de ulceraciones o erosiones epiteliales. La displasia afecta siempre al epitelio de superficie y se extiende en profundidad, por lo que puede afectar a todo el espesor de la mucosa. Por tanto, no se debe diagnosticar una displasia cuando las alteraciones se limitan a la porción profunda de las glándulas y se constata una buena maduración en la superficie. Este hecho, que es prácticamente un axioma en la valoración histológica de la displasia1,3,9,10, se ha visto cuestionado recientemente por un grupo de investigadores que afirman que puede haber una auténtica displasia que afecte sólo a las criptas, con maduración del epitelio de superficie11.
Los cambios reactivos de tipo inflamatorio y la reparación del epitelio en zonas de erosión o ulceración pueden dar lugar a alteraciones celulares y estructurales que podrían confundirse con la displasia. El epitelio regenerativo puede mostrar características similares a las del epitelio displásico, fundamentalmente un aumento de la actividad proliferativa, una pérdida de maduración y una moderada alteración estructural, por lo que en el estudio histológico puede llegar a ser muy difícil distinguir los cambios regenerativos de una lesión displásica5,12. Esto obliga a extremar la prudencia en la evaluación de una posible displasia en estas circunstancias; la norma general es evitar hacer el diagnóstico histológico de displasia epitelial en presencia de una notable actividad inflamatoria o en áreas de reparación de ulceraciones epiteliales.
A partir de los avances obtenidos en el conocimiento de la biología y la evolución de los procesos neoplásicos, en los últimos años se han incorporado nuevas técnicas para el diagnóstico y la tipificación de la displasia epitelial. Entre ellas han sido de utilidad el estudio de la ploidía mediante citometría de flujo y, especialmente, las técnicas inmunohistoquímicas para valorar la proliferación celular (Ki 67) y la expresión de p53 mutado. Estas técnicas de inmunohistoquímica son en la actualidad sencillas y reproducibles y pueden ayudar en la gradación de las displasias y, sobre todo, en la distinción con cambios epiteliales reactivos1,9,12-14. En una publicación reciente se concluye que la determinación inmunohistoquímica de a-metilacil-CoA racemasa (AMACR), enzima que se sobreexpresa en diversas neoplasias, es útil como marcador de epitelio displásico en esófago de Barrett y enfermedad inflamatoria intestinal, con una gran sensibilidad y especificidad15. Hasta el momento no se ha demostrado de forma fehaciente la existencia de marcadores moleculares que puedan predecir la progresión neoplásica, y ninguna de estas técnicas auxiliares ha resultado ser superior a la valoración histológica en el diagnóstico y la clasificación de las displasias.
GRADACIÓN DE LA DISPLASIA
Inicialmente, se siguió para la clasificación de la displasia el sistema clásico de 3 grados (leve, moderado y grave). En la actualidad se ha impuesto el sistema de 2 grados, es decir, displasia de bajo y alto grado. Se ha comprobado que el sistema de 2 grados mejora el acuerdo entre distintos observadores y, por tanto, la reproducibilidad diagnóstica. Además, proporciona una información clínica más útil, ya que la mayor parte de los algoritmos terapéuticos, y en particular la decisión entre control o cirugía, están basadas en el sistema de alto y bajo grado1,2. Lo mismo ha sucedido en la gradación histológica de los cánceres invasivos, donde también se ha impuesto a todos los efectos el sistema de 2 grados. En el epitelio glandular la displasia de bajo grado incluye las categorías leve y moderada de la gradación clásica, y la de alto grado se corresponde con la displasia grave. Por el contrario, en el epitelio escamoso la displasia de bajo grado queda restringida a la forma leve del sistema clásico y los grados moderado y grave se han fusionado en el grupo de displasia de alto grado.
El concepto de carcinoma in situ (que no rompe la membrana basal del epitelio) sigue vigente, pero no tiene mucha utilidad práctica como término diagnóstico. El consenso actual es no separar la displasia de alto grado del carcinoma in situ, ya que su comportamiento y, por tanto, la actitud terapéutica, no difieren1-5.
La valoración de las alteraciones celulares y estructurales de la displasia es la base para la gradación histológica. En el epitelio escamoso (esófago y ano en el aparato digestivo), la displasia de bajo grado se limita al tercio inferior (basal) del epitelio poliestratificado. Cuando la lesión afecta a capas más altas, se cataloga como displasia de alto grado. La displasia que afecta todo el espesor del epitelio sin evidencia de maduración en la superficie se puede definir como displasia de alto grado o carcinoma in situ.
En el epitelio glandular los criterios de gradación combinan alteraciones celulares y estructurales (arquitectura de la mucosa). Estos criterios son los mismos en cualquier localización, en el epitelio nativo o metaplásico, y en presencia o ausencia de una enfermedad inflamatoria crónica1-5.
Displasia glandular de bajo grado
Alteraciones celulares
Seudoestratificación del epitelio glandular, con núcleos elongados, hipercromáticos, localizados predominantemente en la porción basal, y una escasa actividad mitótica. Ésta es la forma más frecuente de displasia, que se ha denominado genéricamente «adenomatoide» porque es la forma que manifiestan los adenomas colorrectales. Menos frecuentemente se observan lesiones de displasia sin seudoestratificación y con núcleos globosos no hipercromáticos. Aunque el patólogo debe reconocer las diferentes formas de displasia, en la práctica diagnóstica no se distingue entre ellas, ya que no tiene repercusión en el manejo clínico de los pacientes.
Arquitectura
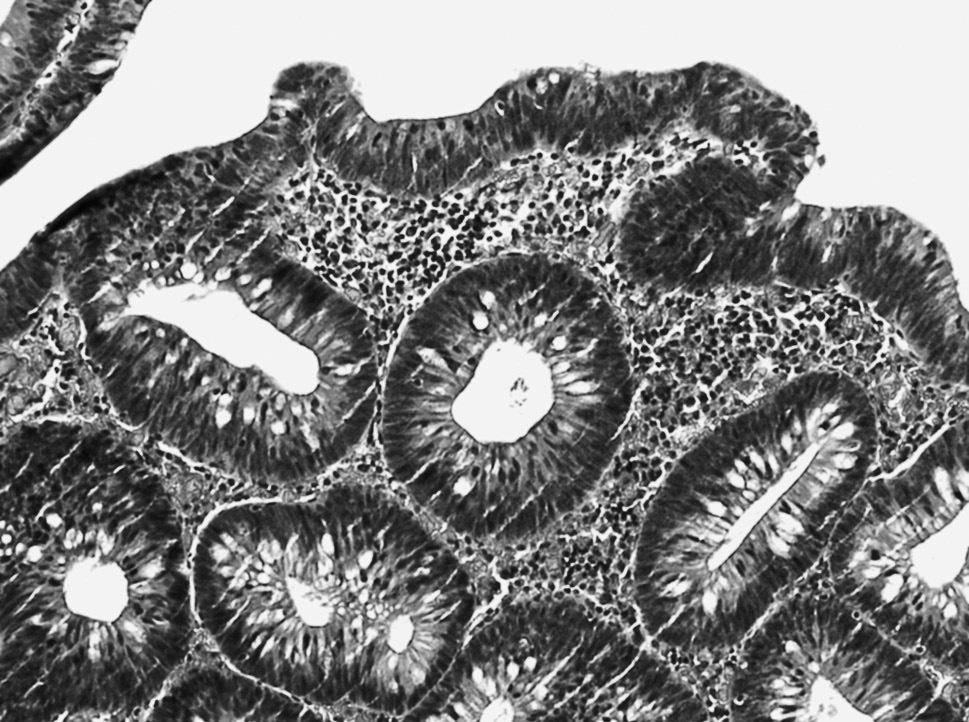
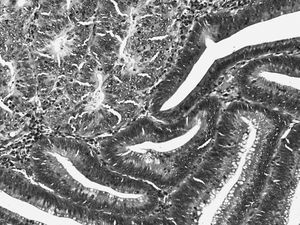
La lesión puede afectar la porción superficial de las glándulas o a toda su longitud. Las glándulas están individualizadas, raramente ramificadas (fig. 1).
Fig. 1. Displasia de bajo grado en la mucosa glandular. Glándulas individualizadas, con epitelio poliestratificado, de núcleos elongados e hipercromáticos, que conservan aceptablemente su polaridad basal.
Displasia glandular de alto grado
Alteraciones celulares
Células con un notable aumento de la relación núcleo/citoplasma, con núcleos grandes, vesiculares, y presencia de nucléolos prominentes. Pérdida completa de la polaridad nuclear. Actividad mitótica alta con posible presencia de mitosis atípicas.
Arquitectura
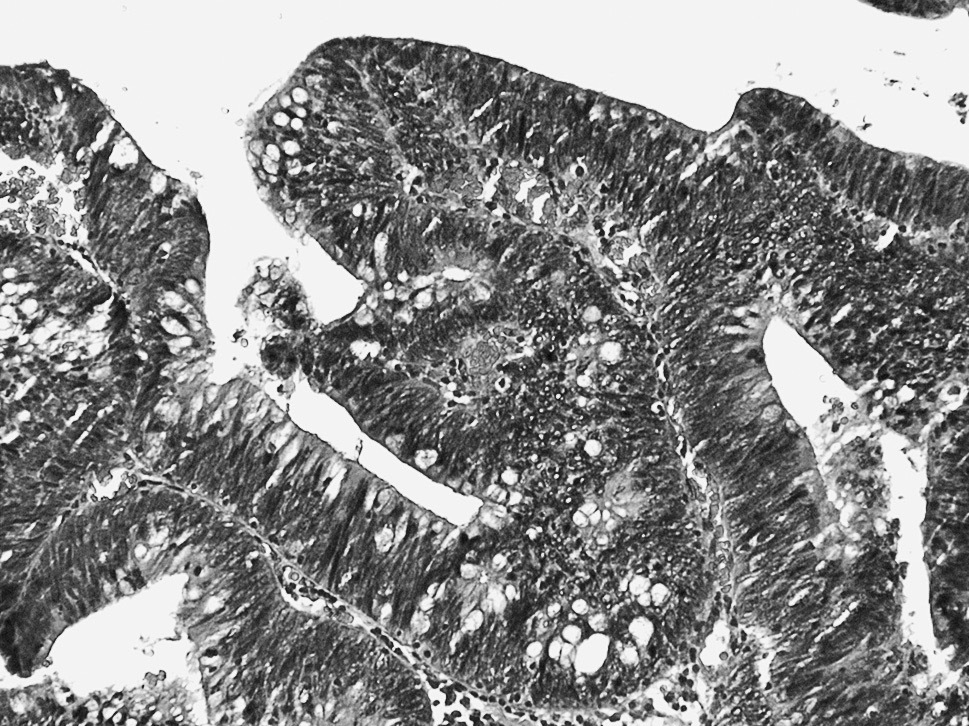
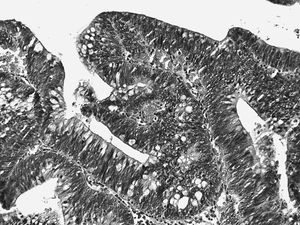
La lesión suele afectar a todo el grosor de la mucosa. Las glándulas displásicas muestran una clara desestructuración, con adosamientos glandulares, gemaciones, ramificaciones y zonas de patrón cribiforme (fig. 2).
Fig. 2. Displasia de alto grado. Glándulas adosadas y ramificadas. Pérdida completa de la polaridad de los núcleos que se distribuyen en todo el espesor del epitelio.
Aunque el diagnóstico y la gradación de la displasia se lleva a cabo mediante criterios aparentemente objetivos, en la práctica la aplicación de estos criterios no es sencilla y puede haber casos en los que no sea posible decidir si los cambios observados son «inequívocamente» neoplásicos. Esta dificultad se hace especialmente manifiesta a la hora de diferenciar entre los cambios epiteliales reactivos y una autentica displasia o neoplasia intraepitelial. Teniendo en cuenta estas circunstancias, en la clasificación original de Ridell de 19833 se incluyó la categoría «indefinido para displasia», que obliga a un seguimiento a corto plazo para intentar concretar un diagnóstico. A efectos prácticos, algunos autores abogan por unir esta categoría a la displasia de bajo grado, aplicándole las mismas pautas clínicas de control y seguimiento4,16.
Por otra parte, dado el indudable componente de subjetividad que toda clasificación histológica implica, la variabilidad intra/interobservador en el diagnóstico de la displasia puede ser significativa3,17,18. En ello influye, evidentemente, la dificultad de establecer límites de grados en un proceso continuo. En algunos estudios publicados19,20 se han obtenido índices de concordancia bajos entre los expertos en patología gastrointestinal, especialmente en las categorías intermedias, con un mejor acuerdo en los extremos del espectro o cuando se agrupan categorías10,20,21. Esta variabilidad interobservador ha llevado a la recomendación de que el diagnóstico de displasia, en particular el de alto grado que puede conllevar decisiones terapéuticas importantes, se confirme con una segunda opinión de otro patólogo, a ser posible con experiencia en enfermedades digestivas3,22. En la práctica diaria, en la mayor parte de los servicios de anatomía patológica, los diagnósticos de displasia se suelen consensuar en una interconsulta entre los patólogos del servicio.
DIFERENCIAS ESTE-OESTE. CLASIFICACIÓN DE CONSENSO DE VIENA
Las diferencias en el diagnóstico de la displasia son mucho más manifiestas cuando se comparan los diagnósticos hechos por patólogos japoneses, con gran experiencia en el campo de las neoplasias gástricas, con los de los patólogos «occidentales». Las diferencias comienzan en que la terminología empleada, e incluso el enfoque conceptual de las diversas lesiones son distintos, de tal forma que muchos estudios publicados por patólogos japoneses no son comparables a los publicados por los occidentales. Esta disparidad ha creado durante muchos años una gran confusión en la interpretación y la valoración de la displasia gastrointestinal, que se hace evidente al revisar la literatura médica relacionada con el tema18,22,23. Varios intentos de acercamiento cristalizaron en dos reuniones de consenso entre expertos japoneses y occidentales, celebradas en Padua (Italia) en abril de 1998, centrada exclusivamente en la displasia gástrica24,25, y en Viena (Austria) en septiembre de 1998, en la que se consideró globalmente la displasia gastrointestinal26. De la reunión de Viena surgió la clasificación de consenso que se muestra en la tabla I.
En esta clasificación, que aúna los criterios diagnósticos este-oeste, destacan de entrada tres hechos. El primero es que se ordena los diagnósticos en grupos o categorías numeradas (1 a 5), tal como lo vienen haciendo tradicionalmente los patólogos japoneses, el segundo es que en la definición de las lesiones se ha impuesto la terminología occidental, y el tercero es que el término «neoplasia» tiende a sustituir al de «displasia», que ha desaparecido en el enunciado de la tabla. Vemos también que en esta clasificación de consenso sigue estando la categoría de «indefinido» y que, siguiendo la opinión mayoritaria, tampoco se separan a efectos prácticos la displasia de alto grado del carcinoma in situ, ya que el abordaje clínico y terapéutico es el mismo. El diagnóstico de carcinoma invasivo (grupo 5) requiere la constatación de que se ha roto el límite basal de las glándulas y el tumor ha invadido, como mínimo, la lámina propia de la mucosa; esta invasión se puede poner de manifiesto por la reacción desmoplásica (fibrosis) que la neoplasia estimula habitualmente en los tejidos que invade. Posteriormente, uno de los participantes en la reunión de consenso ha revisado la clasificación27, proponiendo una pequeña modificación que consiste en incluir dentro del grupo 4 también el carcinoma intramucoso, que podría ser susceptible de resección endoscópica, igual que las lesiones de alto grado no invasivas. La clasificación de Viena parece práctica, y sobre todo resuelve las controversias este-oeste, aunque de momento no parece haber sustituido en la práctica diaria las clasificaciones en uso. Tendrán que pasar más años para comprobar si esta clasificación de consenso de la displasia gastrointestinal acaba imponiéndose.
SIGNIFICACIÓN CLÍNICA DEL DIAGNÓSTICO DE DISPLASIA
La relevancia clínica del di agnóstico de displasia radica en que las lesiones displásicas son el marcador de que un cáncer invasivo puede desarrollarse en un futuro próximo o, aún más importante, que ya está presente. El hallazgo de displasia de alto grado obliga a descartar la coexistencia de un carcinoma invasivo y adoptar las medidas necesarias para erradicar o prevenir la neoplasia4,5. Lo que se persigue en el esfuerzo de diagnosticar, tipificar y gradar las lesiones displásicas es llegar a encontrar algún cambio claramente identificable que nos informe de manera objetiva de que el riesgo de un carcinoma actual o futuro es lo suficientemente importante como para adoptar decisiones clínicas que pueden tener gran trascendencia para el paciente5.
Conceptualmente, se ha considerado que las alteraciones celulares producidas durante el proceso neoplásico dan lugar a cambios fenotípicos progresivos que se pueden identificar en el estudio histológico como lesiones displásicas, que evolucionan de bajo a alto grado, hasta terminar en el carcinoma invasivo. Aunque este modelo «evolutivo» es atractivo y es el que se ha adoptado como hipótesis de trabajo, también podría ser que tanto la displasia como el cáncer invasivo fueran alteraciones celulares finales y que su coexistencia reflejara simplemente la predisposición individual a desarrollar neoplasias epiteliales debido a una combinación de factores genéticos y ambientales22. De hecho, no se dispone de datos concluyentes de la evolución en el tiempo de un foco concreto de displasia de alto o bajo grado. Por tanto, la displasia es un claro indicador de riesgo de carcinoma, pero no hay pruebas definitivas de que sea la lesión precursora5. Cuando se afianzó el concepto de carcinoma in situ se asumió que todos los cánceres evolucionaban a través de grados progresivos de displasia hasta hacerse invasivos. Aunque en muchos casos esto puede ser cierto, no es un proceso obligado. En algunos carcinomas invasivos sólo se encuentran lesiones de displasia de bajo grado asociadas, por lo que la secuencia del espectro completo de lesiones displásicas no es un prerrequisito para la invasión4.
Aunque las lesiones displásicas pueden desarrollarse en cualquier tipo de epitelio, en el aparato digestivo tiene especial relevancia la displasi a en el epitelio glandular, nativo o metaplásico, en distintas localizaciones. Como ya se ha comentado, los criterios básicos de diagnóstico y clasificación son los mismos en todos los órganos digestivos y en todos los contextos clínicos. Las principales diferencias radican en el comportamiento clínico y en el abordaje terapéutico, que pueden variar en función de la localización y la posible enfermedad de base. A continuación se contemplan las 4 situaciones clinicopatológicas en las que el diagnóstico y la gradación de la displasia en el epitelio glandular tienen mayor relevancia.
DISPLASIA EN ESÓFAGO DE BARRETT
La displasia glandular en el esófago se observa exclusivamente en el contexto de esófago de Barrett. El diagnóstico de esófago de Barrett exige la comprobación histológica de la metaplasia columnar «especializada», con características morfológicas de metaplasia intestinal, habitualmente incompleta o de tipo III, similar a la que se puede originar en el estómago en el contexto de una gastritis crónica. En esta mucosa metaplásica tienen lugar las alteraciones celulares que originarán los adenocarcinomas. Los pacientes con esófago de Barrett tienen un riesgo incrementado de neoplasias en la zona metaplásica, con una prevalencia de adenocarcinomas aproximadamente del 10%12. Aunque las neoplasias pueden aparecer en pacientes con esófago de Barrett de segmento corto, es lógico pensar que el riesgo se incrementa con la extensión del área metaplásica28. Teniendo en cuenta que la unión esofagogástrica es difícil de delimitar endoscópicamente, puede ser importante determinar la localización exacta de la mucosa metaplásica, a efectos de control y valoración de riesgo. Un grupo de investigadores definió un patrón de expresión de citoqueratinas 7 y 20, que consideraron específico de la metaplasia de Barrett, distinto del expresado por la metaplasia intestinal gástrica de la zona cardial29. Algunas publicaciones posteriores han confirmado este hecho e incluso han comprobado que este patrón de expresión de citoqueratinas se mantiene en los adenocarcinomas originados en esta zona, lo que podría ser de utilidad para clasificar correctamente el origen de los cánceres de la unión esofagogástrica30. Por el contrario, otros autores han encontrado que el patrón de citoqueratinas de la metaplasia intestinal de la mucosa cardial en la unión esofagogástrica es igual al del esófago de Barrett, aunque distinto del que expresa la metaplasia intestinal en el resto del estómago31. Por tanto, la utilidad del estudio de la expresión de citoqueratinas en el diagnóstico de esófago de Barrett es un tema controversial en la actualidad9,32.
La prevalencia de displasia en esófago de Barrett oscila entre el 5 y el 20%21 y puede observarse en la mucosa plana, indistinguible endoscópicamente de la mucosa metaplásica no displásica, o dar lugar a crecimientos polipoides identificables macroscópicamente33. Aunque la displasia polipoide es similar macro y microscópicamente a un adenoma originado en otros segmentos del tubo digestivo, el término «adenoma» no se utiliza en esófago de Barrett.
Manejo clínico de los pacientes con displasia en esófago de Barrett
Para descartar una displasia es imprescindible realizar un muestreo biópsico sistemático de la mucosa metaplásica, aunque endoscópicamente no tenga alteraciones relevantes. Se recomienda tomar biopsias de los 4 cuadrantes cada 2 cm y, por supuesto, de todas las lesiones detectadas endoscópicamente28,34. La periodicidad de los controles puede variar, aunque una de las pautas habituales es un control anual. Cuando en el examen histológico se encuentra una displasia de bajo grado, la periodicidad se acorta a 3 o 6 meses, hasta que en dos controles sucesivos el resultado es negativo para la displasia. Ante la confirmación diagnóstica de displasia de alto grado, es obligado descartar inmediatamente por endoscopia y biopsias múltiples la coexistencia de un adenocarcinoma. En estos casos el muestreo debe ser más extenso y algunos autores recomiendan acortar a 1 cm la distancia entre las tomas biópsicas, aunque no se observen lesiones endoscópicas sospechosas21. Es evidente que la displasia de alto grado en esófago de Barrett se asocia con un riesgo muy elevado de padecer, simultánea o posteriormente, un adenocarcinoma, aunque el riesgo no está relacionado con la extensión de la displasia y su distribución focal o difusa35. El adenocarcinoma puede coexistir con la displasia de alto grado en un número elevado de casos, incluso en ausencia de una masa tumoral reconocible endoscópicamente33. En algunas series publicadas se ha encontrado que el 50-60% de los pacientes con displasia de alto grado desarrolla un cáncer en un período de 5 años36. De ahí que el abordaje terapéutico clásico ante el hallazgo de displasia de alto grado en esófago de Barrett sea la cirugía inmediata. Sin embargo, el tratamiento óptimo de estos pacientes es objeto de controversia y algunos autores abogan por un control endoscópico estricto y reservar la esofagectomía para los pacientes con adenocarcinoma demostrado37, o aplicar, cuando sea posible, terapias alternativas menos agresivas, como la ablación endoscópica mediante diversas técnicas (resección endoscópica, terapia fotodinámica, electrocoagulación multipolar, sonda térmica, coagulación con láser de argón). Puede resultar difícil distinguir entre displasia de alto grado y carcinoma intramucoso, pero es muy importante a efectos de planificación terapéutica cuando se decide realizar un seguimiento endoscópico de la displasia de alto grado.
En la actualidad hay dos grandes cohortes de pacientes con esófago de Barrett que se han seguido mediante controles estrictos de endoscopia y biopsias múltiples durante un largo período. En uno de los grupos37, 1.099 pacientes fueron seguidos durante 20 años. En 79 pacientes se diagnosticó histológicamente una displasia de alto grado, en 34 de ellos en la primera endoscopia y en 45 durante los controles periódicos. Cuatro de estos pacientes desarrollaron un adenocarcinoma en el primer año. De los 75 restantes sólo 12 desarrollaron un adenocarcinoma en un período medio de 7,3 años, 11 de ellos en estadio poco avanzado, que se consideraron curados con cirugía o terapia ablativa. Ello sugiere que la displasia de alto grado no evoluciona inexorablemente a cáncer, como se pensaba previamente. La segunda cohorte21 corresponde a un estudio prospectivo, longitudinal, comenzado en 1983. En los resultados publicados tras 15 años de estudio se incluyeron 327 pacientes con un seguimiento muy estricto (endoscopias y biopsias múltiples cada 2 años en casos negativos para displasia, 18 meses en indefinidos, 16 meses en displasia de bajo grado y 5 meses en alto grado). Un total de 42 pacientes desarrollaron adenocarcinoma, 35 de ellos en los 5 primeros años. Ninguno de los adenocarcinomas apareció en pacientes con biopsias negativas para displasia, indefinidas o con displasia de bajo grado, lo que indica que los períodos de control se podrían espaciar en estos grupos de pacientes.
Las terapias antirreflujo, en particular el tratamiento a largo plazo con inhibidores de la bomba de protones, reducen los cambios reactivos y pueden dar lugar a una regresión parcial de la metaplasia de Barrett, con reepitelización de epitelio escamoso por encima del epitelio glandular metaplásico, pero raras veces se produce una regresión completa. Lo mismo sucede con algunas terapias ablativas en las que tiene lugar una reepitelización. Este sobrecrecimiento de epitelio escamoso puede llevar a infravalorar endoscópica e histológicamente la extensión de la metaplasia y, lo que es más importante, introduce una dificultad añadida en la valoración y la gradación de una posible displasia en las glándulas metaplásicas que persisten en profundidad38,39. La repercusión de estos cambios es un aspecto que cabe valorar en el futuro, pero los endoscopistas y los patólogos deben conocer y tener en cuenta estas circunstancias para valorar adecuadamente a estos pacientes.
DISPLASIA GÁSTRICA
La prevalencia de la displasia gástrica es elevada en los países considerados de alto riesgo de cáncer gástrico, como Colombia o China, alcanzando unas cifras entre el 9 y el 20% de la población. En la mayor parte de los países occidentales, de bajo riesgo de cáncer gástrico, las cifras son más bajas, entre un 0,5 y un 3,75%22,40. Es mucho más frecuente en procesos inflamatorios crónicos, con una prevalencia del 4-30% en pacientes con gastritis crónica atrófica o estatus postgastrectomía, y alcanza el 40% en pacientes con anemia perniciosa22.
En los países de bajo riesgo, la displasia gástrica es más frecuente en varones40. En cambio, en los países de alto riesgo, como Colombia, se observa la misma prevalencia en ambos sexos41. Aunque puede aparecer en cualquier edad, es más frecuente a partir de la quinta década y su prevalencia se incrementa con la edad.
Desde hace años se admite la secuencia gastritis crónica atrófica-metaplasia intestinal-displasia-carcinoma, en la génesis del adenocarcinoma gástrico de tipo intestinal. Por tanto, es lógico que las lesiones displásicas se encuentren con mayor frecuencia en el antro y la zona de incisura angularis, que son las áreas más afectadas en los procesos de gastritis crónica multifocal, relacionados o no con la infección por Helicobacter pylori. La displasia se asocia característicamente con la metaplasia intestinal incompleta o de tipo cólico, de ahí la utilidad de tipificar la metaplasia intestinal en las biopsias gástricas. Se considera que la metaplasia intestinal incompleta es un factor de riesgo y que su hallazgo obliga a un control más estricto del paciente. No obstante, con mucha frecuencia coexisten la metaplasia completa y la incompleta, y su distribución es irregular, por lo que es posible que no pueda detectarse la existencia de una metaplasia intestinal incompleta en una biopsia endoscópica.
El aspecto endoscópico de la displasia gástrica es variable. En muchos casos puede aparecer en la mucosa sin cambios macroscópicos objetivables, habitualmente en el contexto de una mucosa atrófica, o puede encontrarse en zonas de aspecto cicatricial o en relación con erosiones o úlceras. Algunas técnicas auxiliares, como la cromoendoscopia, pueden ayudar en la identificación endoscópica de estas lesiones22. En algunas ocasiones la displasia gástrica da lugar a lesiones bien delimitadas, reconocibles endoscópicamente, formando placas o lesiones sobreelevadas polipoides. Los pólipos displásicos gástricos reciben el nombre de adenoma, igual que las mismas lesiones en el intestino delgado y el intestino grueso. Los adenomas gástricos son más frecuentes en el antro, suelen ser únicos y, como sus homólogos intestinales, cuanto mayor es su tamaño, mayor es la posibilidad de contener carcinoma.
Aunque la reunión de consenso de Padua25 se centró exclusivamente en la displasia gástrica y en ella se elaboró una clasificación, en la actualidad se recomienda utilizar la clasificación de Viena26, anteriormente comentada, que es común para todos los órganos digestivos. La única diferencia práctica es que el diagnóstico de carcinoma intramucoso gástrico se basa exclusivamente en criterios estructurales y no es imprescindible encontrar reacción desmoplásica estromal, como se precisa en otras localizaciones. Por ello, en algunos casos puede ser difícil establecer el límite entre displasia de alto grado y carcinoma intramucoso.
Como ya se ha comentado, la displasia gástrica se asocia tradicionalmente al adenocarcinoma gástrico de tipo intestinal. Hace unos años se describió una forma de displasia, asociada al carcinoma de tipo difuso, originada en la zona del cuello de las glándulas gástricas, llamada por esta razón «displasia del cuello de los túbulos». Su morfología es similar a la del componente invasivo, aunque limitada por la membrana basal de las glándulas, y también ha recibido el nombre de «displasia globoide»42. Este tipo de displasia puede ser precursora del carcinoma de tipo difuso, pero es una lesión muy rara y de difícil identificación; en la actualidad no se encuentran publicaciones en las que se describa su frecuencia y su utilidad en el diagnóstico precoz del cáncer gástrico.
Relevancia clínica del diagnóstico de displasia gástrica
Más del 50% de los carcinomas descubiertos durante controles de seguimiento de displasia son precoces y potencialmente curables40,43,44, lo que subraya la importancia del seguimiento estricto de los pacientes de riesgo. Tras el diagnóstico de displasia de bajo grado se recomienda realizar un control endoscópico de los pacientes cada 3 meses durante el primer año44. En el seguimiento de estos pacientes se puede observar una regresión hasta en el 40-50% de los casos. Esta cifra tan elevada puede deberse, sin negar la posibilidad de regresión de una auténtica lesión displásica, a que en algunos casos se trate de cambios reactivos sobrediagnosticados inicialmente o que, debido a la focalidad de las lesiones, la biopsia no contenga mucosa displásica. En aproximadamente el 20-30% de los casos persiste la displasia de bajo grado y se observa una progresión a alto grado en el 15%43. En seguimientos efectuados a pacientes con displasia de alto grado se observó una regresión en aproximadamente el 5%, una persistencia de la lesión en el 15% y una progresión a carcinoma en el 80-85%. El tiempo transcurrido entre el diagnóstico de displasia de alto grado y el carcinoma osciló entre algunas semanas y 39 meses43,44. Por tanto, el diagnóstico confirmado de displasia de alto grado es, para la mayoría de los autores, una indicación clara de resección quirúrgica. No obstante, gracias al avance de las técnicas de localización y estadificación, como la cromoendoscopia y la ecoendoscopia, se pueden seleccionar casos susceptibles de resección endoscópica45.
DISPLASIA EN LA ENFERMEDAD INFLAMATORIA INTESTINAL
El riesgo de neoplasia es similar en la enfermedad de Crohn y en la colitis ulcerosa y guarda fundamentalmente relación con el tiempo de evolución y la extensión de la enfermedad46. En un estudio reciente se concluye que el riesgo relativo de cáncer en la enfermedad de Crohn y en la colitis ulcerosa es, respectivamente, del 2,6 y el 2,7%47. En la enfermedad de Crohn también hay un riesgo incrementado de adenocarcinoma en el intestino delgado y en los segmentos excluidos del intestino48. Las neoplasias siempre van precedidas o acompañadas de lesiones displásicas, cuyas características patológicas son similares en las dos entidades, por lo que vamos a considerarlas conjuntamente. Como ya se ha mencionado, los principales factores de riesgo para el desarrollo de displasia y carcinoma son la extensión y la duración de la enfermedad. Otros posibles factores de riesgo controvertidos son la edad temprana de inicio y los antecedentes familiares de cáncer de colon46.
Las estrategias de vigilancia son similares en la enfermedad de Crohn y en la colitis ulcerosa, aunque los principales estudios sobre la incidencia y la morfología de la displasia en la enfermedad inflamatoria intestinal se han realizado en colitis ulcerosa, por su mayor accesibilidad a la exploración endoscópica. La incidencia de la displasia en la colitis ulcerosa es difícil de estimar. En algunos estudios se ha sugerido que a partir de los 10 años el 5% de los pacientes presenta lesiones de displasia, y se alcanza la cifra del 25% a los 20 años de evolución. Se considera que el riesgo de carcinoma se incrementa un 1-2% cada año a partir de 10 años de evolución de la enfermedad46,49. No hay acuerdo unánime con respecto a la mejor estrategia de control en los pacientes con enfermedad inflamatoria intestinal. Con respecto a la colitis ulcerosa, la Asociación Americana de Gastroenterología (AGA) recomienda iniciar el control a partir de los 8 años de comienzo de la enfermedad en la pancolitis, y a los 15 años si sólo está afectado el colon izquierdo. No se recomienda realizar un control en los pacientes que únicamente presentan proctitis ulcerosa. Los controles consisten en una colonoscopia cada 1-2 años, con biopsias de los 4 cuadrantes cada 10 cm desde ciego hasta el sigma, y cada 5 cm desde el sigma hasta el recto. Por supuesto, se han de biopsiar todas las lesiones macroscópicas.
La displasia puede encontrarse en cualquier zona del intestino afectada por la enfermedad y puede aparecer como un foco aislado, aunque lo más frecuente es que sea multifocal y muy raramente difusa. En los pacientes con adenocarcinoma se encuentra una displasia adyacente al tumor en la mayor parte de los casos, pero también puede observarse en zonas distantes46,48. Se reconocen dos patrones morfológicos de displasia en la enfermedad inflamatoria intestinal, la forma plana y la elevada. La displasia plana no se puede detectar endoscópicamente, salvo con técnicas auxiliares, como la endoscopia de fluorescencia tras la administración de ácido 5-aminolevulínico7. La displasia elevada se conoce genéricamente como «lesión o masa asociada a displasia» (DALM), y puede ser tipo adenoma, polipoide y bien delimitada, similar al adenoma esporádico, o formar una masa mal delimitada, habitualmente más grande, con amplia base sésil, a veces causando estenosis y con mayor riesgo de contener ya un adenocarcinoma. La displasia elevada de tipo adenoma se ha de distinguir de un auténtico adenoma esporádico que puede aparecer en un paciente con enfermedad inflamatoria intestinal, en una zona afectada o no por la enfermedad. En la displasia tipo adenoma hay un mayor componente inflamatorio y, a diferencia de los adenomas, suelen estar mezcladas criptas displásicas con otras normales. Por técnicas inmunohistoquímicas se comprueba que se sobreexpresa p53 en la displasia tipo adenoma y no en los adenomas esporádicos46.
Repercusión clínica del diagnóstico de displasia en la enfermedad inflamatoria intestinal
Depende del grado, pero fundamentalmente del tipo de displasia46:
Displasia plana
En las lesiones de bajo grado, se recomienda realizar un control endoscópico y biópsico. Si es multifocal o se encuentra en el examen inicial, actualmente se recomienda realizar una colectomía46. La confirmación de displasia de alto grado es indicación de colectomía.
Displasia elevada
El hallazgo de una masa de tipo no adenoma, generalmente asociada a una displasia plana, obliga a realizar una colectomía, independientemente de que la displasia sea de bajo o alto grado. Cuando la displasia elevada es de tipo adenoma, su distinción de un adenoma esporádico, aunque de indudable interés patológico, en la actualidad no es necesaria desde el punto de vista clínico, ya que en las DALM tipo adenoma se recomienda realizar una polipectomía y un control si la lesión está completamente extirpada, igual que en los adenomas esporádicos, a no ser que coexista con la displasia plana, en cuyo caso se recomienda llevar a cabo una colectomía46,50. En los pacientes con indicación de colectomía en los que no se pueda practicar la cirugía por cualquier circunstancia, un control cada 3-6 meses se considera una alternativa aceptable.
DISPLASIA EN ADENOMAS COLORRECTALES
Desde hace muchos años se admite la secuencia evolutiva adenoma-adenocarcinoma en la génesis de la mayor parte de los cánceres colorrectales. Los adenomas se definen como proliferaciones displásicas clonales del epitelio del colon. Habitualmente son lesiones polipoides, sésiles o pediculadas, bien delimitadas de la mucosa circundante no neoplásica, pero en raras ocasiones se pueden observar adenomas planos, en general de pequeño tamaño. Histológicamente, los adenomas están constituidos por estructuras tubulares o vellosas que pueden coexistir. La terminología diagnóstica se basa en la proporción de ambas estructuras en el examen histológico. Los adenomas tubulares no tienen componente velloso o, si está presente, no supera el 25% de la masa del pólipo, los tubulovellosos tienen entre el 25 y el 75% de componente velloso, y es necesario que este componente supere el 75% para recibir la denominación de adenoma velloso.
En los últimos años se ha prestado especial interés a un subtipo morfológico, denominado adenoma serrado, que muestra una morfología similar al pólipo hiperplásico, pero con displasia similar a la del resto de adenomas. En los adenomas serrados la secuencia carcinogénica sigue una vía distinta a la de los adenomas convencionales y suelen dar lugar a adenocarcinomas con inestabilidad de microsatélites, con una morfología y un comportamiento clínico característicos.
Se han identificado diversos factores de riesgo de transformación maligna de los adenomas, que son útiles en el control y el manejo clínico de los pacientes. Entre ellos, los más destacados son el número de adenomas, el tamaño, el tipo histológico y el grado de displasia. La valoración conjunta de estos 4 factores, a partir de la primera colonoscopia, ha llevado a estratificar a los pacientes portadores de adenomas en grupos de bajo y alto riesgo de desarrollar nuevos adenomas o adenocarcinomas, y se han establecido pautas de control y seguimiento en función del riesgo51,52. Se consideran pacientes de alto riesgo los que tienen 3 o más adenomas, y al menos uno de ellos de tamaño igual o mayor de 1 cm de diámetro, de tipo velloso y con displasia de alto grado. El grupo de bajo riesgo lo constituyen los pacientes con 1-2 adenomas, de pequeño tamaño, tipo tubular y con displasia de bajo grado.
Repercusión clínica del diagnóstico anatomopatológico
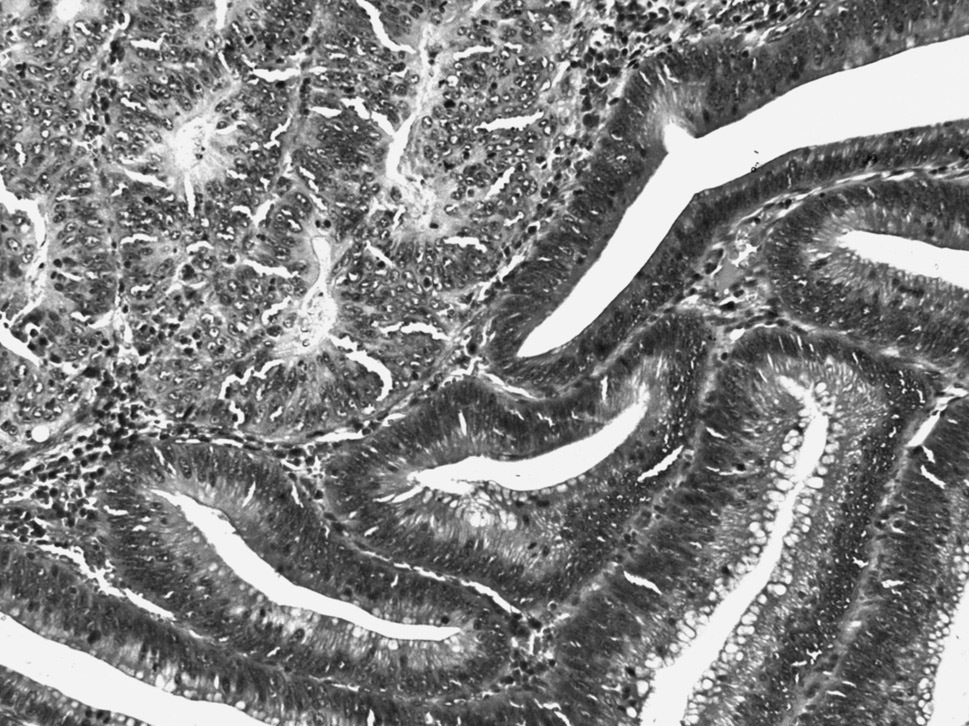
Habitualmente, el tratamiento adecuado de los adenomas colorrectales, con independencia del tamaño, el tipo histológico y el grado de displasia, es la polipectomía endoscópica, evitando la fragmentación siempre que sea posible. El dato más importante en el informe anatomopatológico, además del tipo y el grado de displasia, es la constatación de si los márgenes están libres o no. Cuando el margen de resección está afectado o no puede evaluarse, es necesario realizar un control endoscópico y biópsico estricto, hasta asegurar la eliminación completa de todos los restos neoplásicos. En los adenomas en que no sea posible la resección endoscópica, habitualmente lesiones sésiles de gran tamaño, se ha de plantear la exéresis quirúrgica. Es importante tener en cuenta que en el colon, a diferencia del estómago, el carcinoma intramucoso no tiene capacidad metastásica y, a efectos prácticos, se ha de considerar en el mismo grupo que la displasia de alto grado/carcinoma in situ (fig. 3). El hallazgo en el estudio histológico de un adenocarcinoma invasivo (que afecta como mínimo la submucosa), no siempre conlleva una indicación quirúrgica. En los adenomas pediculados con adenocarcinoma focal de bajo grado, sin evidencia de invasión vascular y con el margen de resección libre a una distancia de 2 mm, se considera que la polipectomía endoscópica es suficiente.
Fig. 3. Adenocarcinoma intramucoso (izquierda y arriba) en un adenoma tubulovelloso de colon. En esta zona, las glándulas displásicas en contacto con el adenocarcinoma muestran sólo una displasia de bajo grado.
Las guías y las recomendaciones de control de los paci-entes con adenomas de colon son dinámicas y sujetas a cambios motivados por la aparición de nuevas evi dencias52. En la actualidad hay múltiples líneas de investigación clínica, morfológica, molecular y genética que, indudablemente, en un futuro próximo contribuirán positivamente al manejo de estos pacientes y a la prevención del cáncer colorrectal.