La reservoritis es la principal complicación, tras la proctocolectomía total con anastomosis ileoanal y reservorio, en la colitis ulcerosa. En un 15% de los casos sigue un curso crónico y, a veces, refractario al tratamiento antibiótico, y puede terminar en exéresis del reservorio. Por ello, son necesarias otras opciones terapéuticas. Budesonida es un corticoide de acción tópica que, en cápsulas orales de liberación en el íleon terminal (CIR), puede ser una posible alternativa terapéutica.
Material y métodoEstudio prospectivo, abierto, realizado en 5 pacientes con reservoritis crónica refractaria. Descartadas otras causas de refractariedad, se trata a los pacientes con budesonida oral 9mg/día. Se realiza una evaluación clínica, endoscópica e histológica basal y tras 8 semanas de tratamiento. La eficacia se evalúa mediante la comparación del índice de actividad de reservoritis (PDAI) y sus subíndices clínico, endoscópico e histológico, antes y después del tratamiento. Se establece como remisión un índice < 7. Se valora, asimismo, la modificación de diversos parámetros analíticos y la tolerancia.
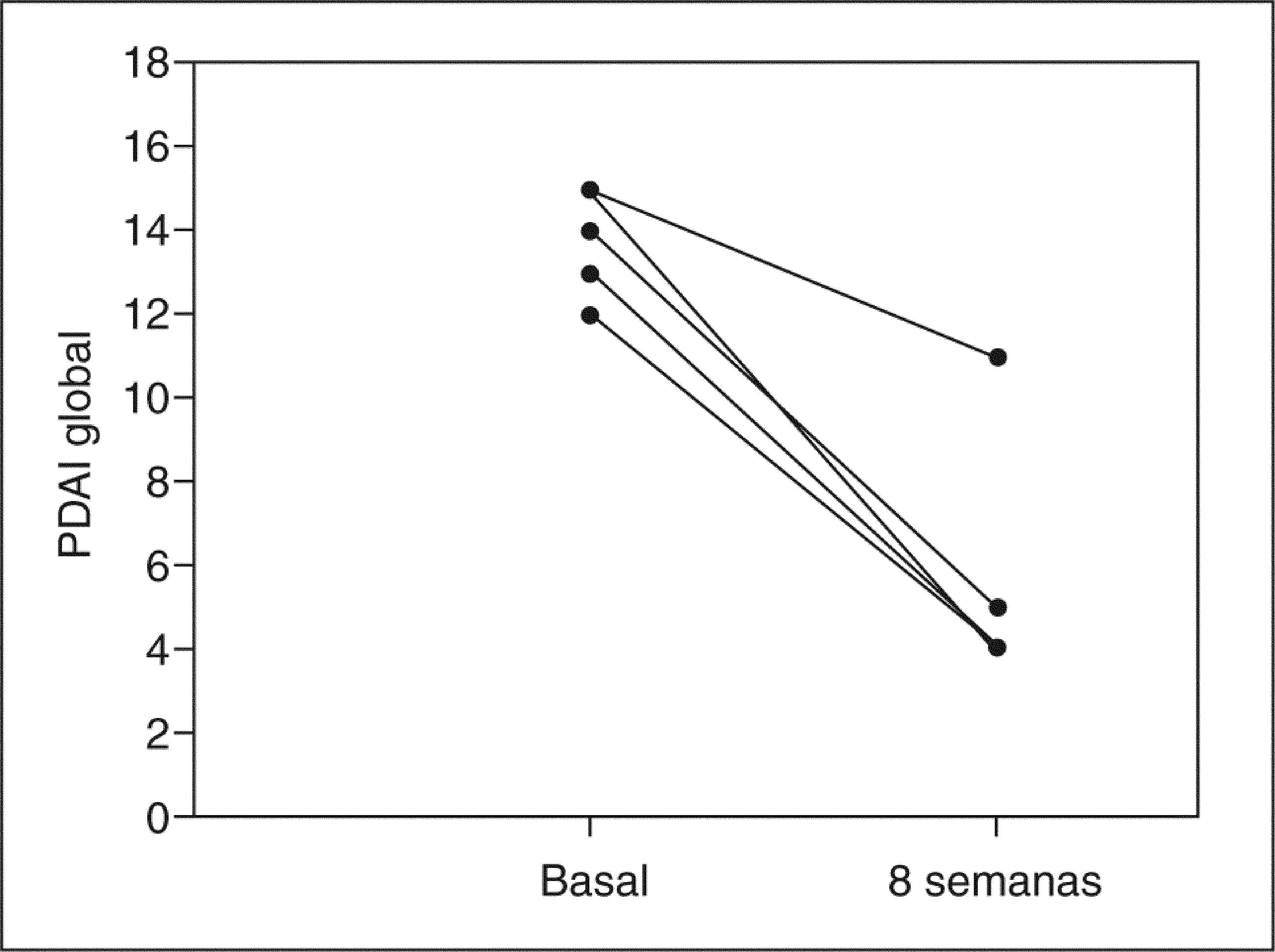
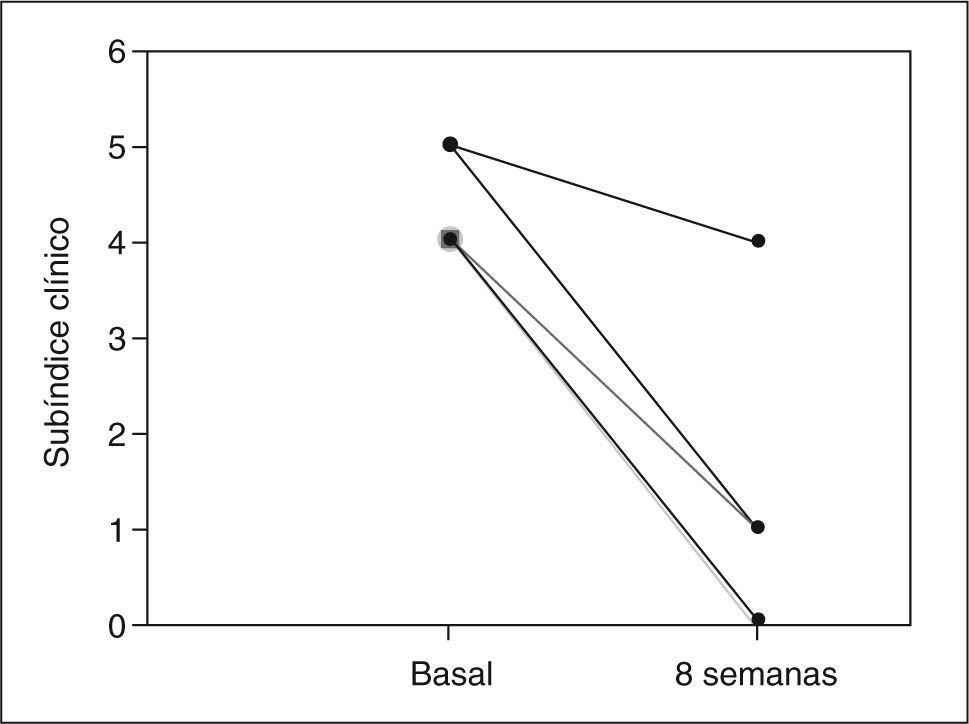
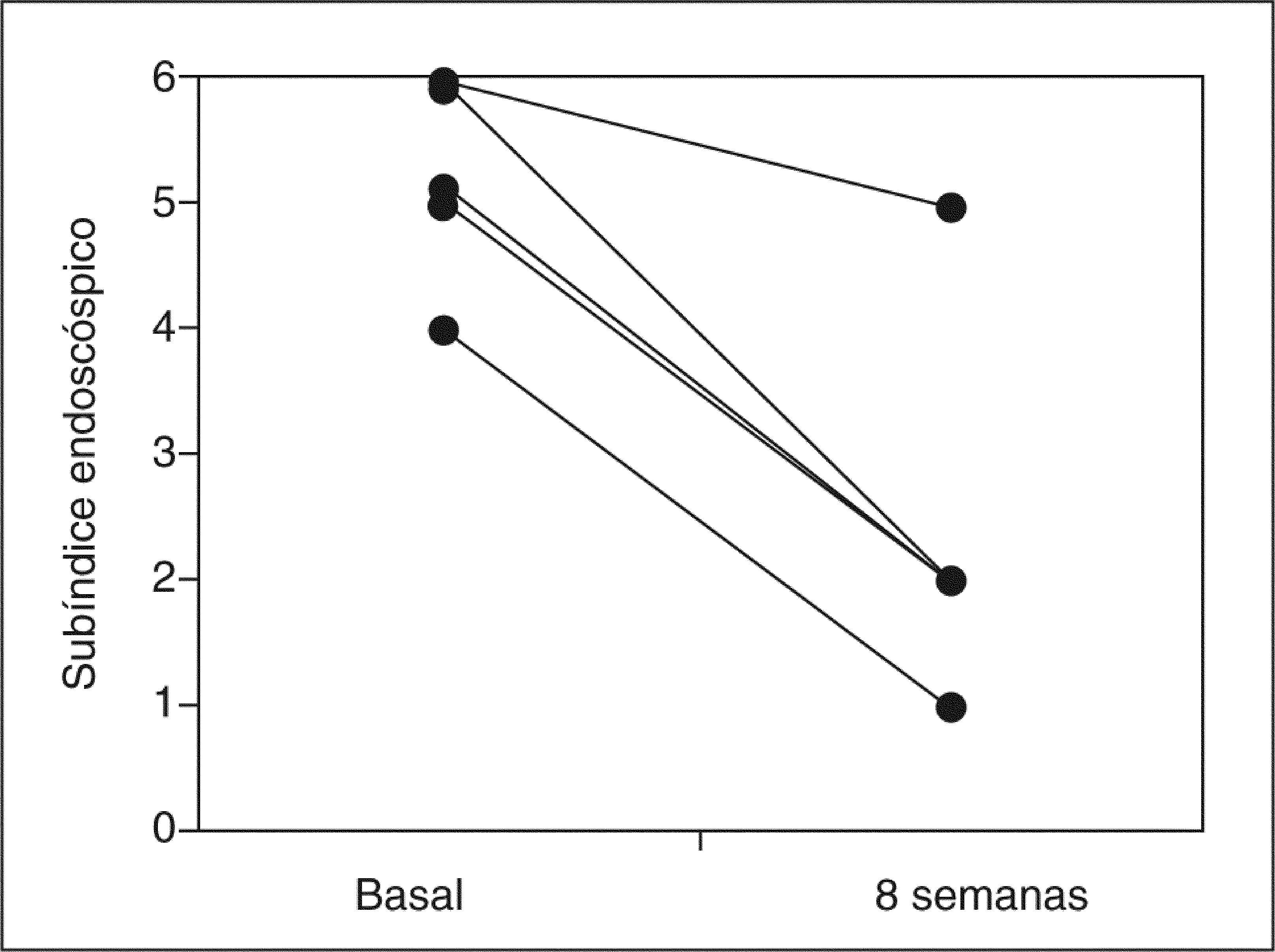
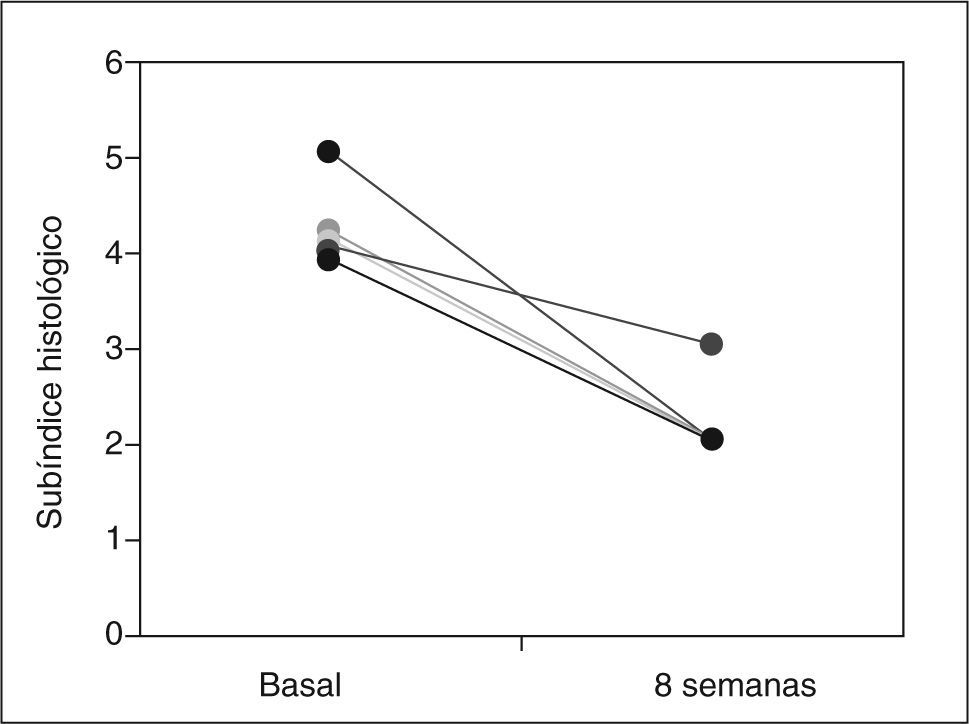
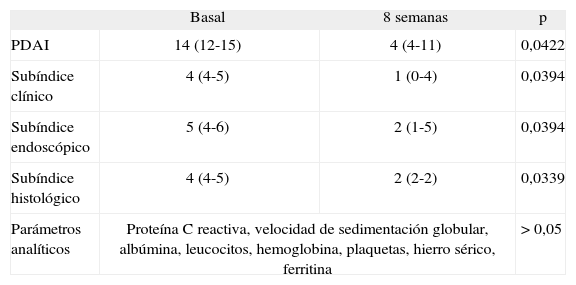
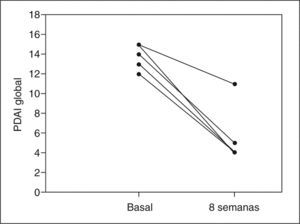
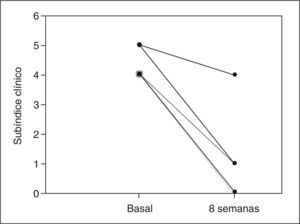
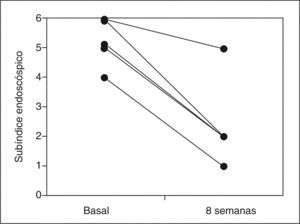
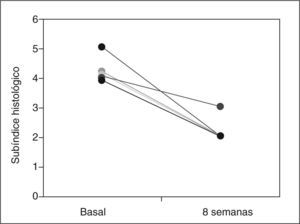
ResultadosCuatro de 5 pacientes logran la remisión tras 8 semanas de tratamiento y se constata un descenso significativo en la mediana del PDAI global de 14 (rango, 12-15) a 4 (rango, 4-11) (p=0,0422), así como en sus 3 subíndices: clínico de 4 (rango, 4-5) a 1 (rango, 0-4) (p=0,0394), endoscópico de 5 (rango, 4-6) a 2 (rango, 1-5) (p=0,0394) e histológico de 4 (rango, 4-5) a 2 (rango, 2-2) (p=0,0339). No se registraron efectos secundarios.
ConclusionesBudesonida oral en cápsulas de liberación ileal controlada puede ser una opción terapéutica para inducir la remisión en la reservoritis activa, crónica y refractaria. La tolerancia es buena y se puede evitar su aplicación en forma de enemas.
Pouchitis is the most frequent complication following total proctocolectomy with ileal pouch-anal anastomosis for ulcerative colitis. Up to 15% of patients with pouchitis experience a chronic course, which can be resistant to antibiotic therapy and may lead to surgical excision of the pouch. Further therapeutic options are therefore needed. Oral budesonide, a corticosteroid with topical activity in the terminal ileum (controlled ileal release [CIR] capsules), may be an alternative.
Material and methodWe performed a prospective, open study of five patients with chronic refractory pouchitis. Patients were treated with 9 mg of budesonide capsules after other causes of the lack of treatment response were excluded. Assessments included clinical, endoscopic and histological evaluation at baseline and after 8 weeks of treatment. Efficacy was evaluated using the pouchitis disease activity index (PDAI) global scores as well as the clinical, endoscopic and histological subscores at baseline and 8 weeks. Remission was defined as a global score < 7. Variations in laboratory parameters and tolerance were also assessed.
ResultsFour out of five patients went into remission at 8 weeks and a significant decrease was observed in the median total PDAI score from 14 (range, 12-15) to 4 (range, 4-11) (p=0.0422) and in the three subscores: clinical from 4 (range, 4-5) to 1 (range, 0-4) (p=0.0394), endoscopic from 5 (range, 4-6) to 2 (range, 1-5) (p=0.0394), and histologic from 4 (range, 4-5) to 2 (range, 2-2) (p=0.0339). No significant adverse effects were reported.
ConclusionsOral budesonide CIR capsules may be an option to induce remission in active chronic refractory pouchitis. Because tolerance is good, the use of enemas may be avoided.
La técnica quirúrgica de elección en pacientes con colitis ulcerosa (CU) que requieren colectomía es la proctocolectomía restauradora con anastomosis ileoanal y creación de reservorio. La inflamación inespecífica de la mucosa del reservorio, llamada reservoritis (o pouchitis) es la principal complicación a largo plazo, con una frecuencia variable en los distintos estudios, que se cifra entre el 10 y el 59% y depende, fundamentalmente, del tiempo de seguimiento desde la cirugía, los diferentes criterios diagnósticos empleados o la amplitud de la serie estudiada1. El riesgo acumulativo de desarrollar reservoritis se cifra en un 15, un 36 y un 45%, al cabo de 1, 5 y 10 años tras la cirugía, respectivamente2. Su etiología es desconocida y multifactorial, y se considera como una CU del reservorio, especialmente en casos crónicos3. La mucosa ileal del reservorio sufre cambios adaptativos con el tiempo, adquiriendo características de mucosa cólica (metaplasia cólica no completa) que, en casos genéticamente susceptibles, puede presentar una respuesta inflamatoria. Se han señalado diversas anomalías genéticas asociadas al desarrollo de reservoritis, como polimorfismos en el gen del antagonista del receptor de IL-1 (IL-1ra) y en genes de otras citocinas, así como varios factores de riesgo clínicos, biológicos y ambientales4,5.
Su diagnóstico se basa en la presencia de síntomas de disfunción del reservorio (incremento de la frecuencia defecatoria, sangrado rectal, urgencia fecal, dolor abdominal, fiebre, en general leve) y la confirmación de actividad inflamatoria de la mucosa del reservorio por endoscopia e histología1,3, aunque este último dato no parece imprescindible, al menos una vez conocido el diagnóstico6.
Para evaluar el diagnóstico y definir la presencia de actividad, el índice más empleado, objetivo y reproducible es el Pouchitis Disease Activity Index (PDAI)7. Es un índice de 18 puntos que evalúa síntomas clínicos y signos endoscópicos, así como datos histológicos de inflamación aguda, estableciéndose como reservoritis activa un índice $ 7 y la remisión como un índice < 7.
Aunque no hay uniformidad de criterios ni una clasificación prospectivamente validada de reservoritis, ésta suele dividirse en reservoritis aguda (episodio de inflamación del reservorio que responde al tratamiento antibiótico en menos de 4 semanas), que se presenta en alrededor de la mitad de los casos de anastomosis ileoanal con reservorio en algún momento de su evolución8. Si la inflamación no se resuelve en el período de 4 semanas, precisa tratamiento más del 50% del tiempo, o se presentan más de 3 episodios al año, se cataloga como reservoritis crónica5,9. La refractariedad, en general, se establece en función de la falta de respuesta al tratamiento antibiótico durante 4-6 semanas. Los casos refractarios son de difícil manejo, y pueden terminar en exéresis del reservorio, por lo que es necesario disponer de otras alternativas terapéuticas en esta situación.
En este estudio abierto se recoge la eficacia de budesonida oral en cápsulas de liberación ileal controlada (CIR) en el tratamiento de pacientes con reservoritis activa crónica y refractaria.
MATERIAL Y MÉTODOSPacientesEstudio prospectivo en 5 pacientes, afectados de reservoritis crónica recidivante de larga evolución tratados con budesonida oral. El curso de la enfermedad era prolongado (mediana de 51 meses; rango, 26-204) y en todos los casos habían recibido diversos ciclos de antibióticos, solos o en combinación, principalmente metronidazol y ciprofloxacino. Las características de los pacientes se recogen en la tabla I.
Características clínicas y demográficas de los pacientes
| Sexo (V/M) | 3/2 |
| Edad (rango) | 29-54 años |
| Hábito tabáquico | |
| Fumadores | 0 |
| Ex fumadores | 1 |
| No fumadores | 4 |
| Ingesta de AINE | 0 |
| Extensión de la CU | |
| Pancolitis | 4 |
| Distal | 1 |
| Motivo de la colectomía | |
| Brote grave refractario | 2 |
| Corticodependencia | 3 |
| Tiempo desde la cirugía al primer episodio de reservoritis (mediana) | 18 meses (rango, 4-100) |
| Tiempo de evolución de la reservoritis (mediana) | 51 meses (rango, 26-204) |
| la reservoritis (mediana) | |
| Manifestaciones extraintestinales | |
| Espondiloartropatía axial | 1 |
| CEP | 0 |
AINE: antiinflamatorios no esteroideos; CEP: colangitis esclerosante primaria; CU: colitis ulcerosa.
En el momento del episodio objeto de estudio, 2 pacientes habían sido tratados con metronidazol 20 mg/kg/día durante un período mínimo de 4 semanas sin respuesta; en 3 no se empleó por haber presentado previamente neuropatía periférica. Los 5 fueron tratados también con ciprofloxacino 1 g/día, un mínimo de 6 semanas, en un caso asociado a rifaximina, sin respuesta. En todos los casos se descartaron otras causas de refractariedad mediante la realización de un estudio endoscópico y biopsia del íleon preservorio, inmunohistoquímica para citomegalovirus (CMV) en la biopsia de la mucosa del reservorio, estudio coproparasitario y de Clostridium difficile en heces, así como revisión de la pieza de colectomía para confirmar el diagnóstico de CU.
IntervenciónSe empleó budesonida oral, en cápsulas entéricas CIR, en dosis de 9 mg/día durante 8 semanas, con posterior reducción de la dosis a razón de 3 mg/15 días. Se realizó una evaluación clínica, analítica, endoscópica e histológica basal y a las 8 semanas de tratamiento.
Medidas de resultadosComo medida de eficacia se valoró la comparación del PDAI global y por separado de cada uno de sus subíndices: clínico, endoscópico e histológico pre/postratamiento. La evaluación histológica se realizó sin tener conocimiento de los datos clínicos y endoscópicos de los pacientes.
Se considera remisión un índice < 7 con un descenso de, al menos, 3 puntos sobre el basal. Se analizó la modificación pre/postratamiento de diversos parámetros analíticos: proteína C reactiva, velocidad de sedimentación globular, albúmina, leucocitos, hemoglobina, plaquetas, hierro sérico y ferritina. Se recogieron los posibles efectos secundarios y la tolerancia al tratamiento.
Estudio estadísticoLa descripción de los datos se ha realizado mediante el cálculo de frecuencias, medianas y rangos. Los índices y las variables analíticas pre/postratamiento se han comparado mediante el test de Wilcoxon de signos para muestras apareadas. Se ha empleado el paquete estadístico SAS (SAS Institute para Windows versión 9.1) para el análisis estadístico.
RESULTADOSA las 8 semanas de tratamiento, 4 de los 5 pacientes estaban en remisión (80%). La mediana del PDAI global se redujo significativamente tras el tratamiento de 14 (rango, 12-15) a 4 (rango, 4-11) (p = 0,0422), acompañada de una reducción significativa en la mediana de cada uno de los 3 subíndices: clínico de 4 (rango, 4-5) a 1 (rango, 0-4) (p = 0,0394), endoscópico de 5 (rango, 4-6) a 2 (rango, 1- 5) (p = 0,0394) e histológico de 4 (rango, 4-5) a 2 (rango, 2-2) (p = 0,0339) (tabla II). En la figura 1 se muestran los cambios en el PDAI global en los 5 pacientes antes y después del tratamiento, y en las figuras 2–4 los cambios en cada uno de sus subíndices.
Modificación de la mediana del PDAI global y sus subíndices antes y después del tratamiento con budesonida oral
| Basal | 8 semanas | p | |
| PDAI | 14 (12-15) | 4 (4-11) | 0,0422 |
| Subíndice clínico | 4 (4-5) | 1 (0-4) | 0,0394 |
| Subíndice endoscópico | 5 (4-6) | 2 (1-5) | 0,0394 |
| Subíndice histológico | 4 (4-5) | 2 (2-2) | 0,0339 |
| Parámetros analíticos | Proteína C reactiva, velocidad de sedimentación globular, albúmina, leucocitos, hemoglobina, plaquetas, hierro sérico, ferritina | > 0,05 | |
No se detectaron diferencias estadísticamente significativas en ninguno de los parámetros analíticos evaluados (p > 0,05).
No se presentaron efectos adversos significativos en los pacientes tratados y la tolerancia fue excelente en todos los casos.
De los 4 pacientes en remisión a las 8 semanas, 2 la mantuvieron a los 6 meses. Posteriormente, uno de ellos ha presentado 3 episodios de reservoritis controlados de nuevo con budesonida oral. En ambos casos, tras la instauración de tratamiento de mantenimiento con VSL#3, no se han presentado recidivas durante el posterior seguimiento, que en la actualidad es de 11 meses.
DISCUSIÓNAlrededor de un 15% de pacientes con reservoritis desarrolla una forma crónica1,4. Se ha descrito la ileítis por reflujo y la colangitis esclerosante primaria asociada como factores predictivos de su desarrollo10. La reservoritis crónica se puede subdividir en dependiente de antibiótico, si responde al tratamiento antibiótico pero recidiva inmediatamente al suspenderlo, y refractaria al antibiótico, si no responde1,3. En ambas situaciones es necesario disponer de otras alternativas terapéuticas.
Aunque son escasos los ensayos clínicos controlados que evalúan las diferentes opciones de tratamiento en la reservoritis, en función del posible desequilibrio de la flora fecal en su origen, los antibióticos son el tratamiento inicial, al ser capaces de corregir el sobrecrecimiento de diversas cepas bacterianas11. En un ensayo controlado frente a placebo, metronidazol fue eficaz en el tratamiento de la reservoritis crónica activa con un odds ratio (OR) para la respuesta (valorada exclusivamente como descenso de la frecuencia defecatoria) de 26,67 (intervalo de confianza [IC] del 95%, 2,31-308,01) y un número de pacientes que era necesario tratar de 212. Ciprofloxacino presenta una eficacia similar, incluso con menor incidencia de efectos secundarios, por lo que algunos autores lo consideran el fármaco de elección13.
La no respuesta al tratamiento con uno de estos antibióticos en un período adecuado de unas 4 semanas se considera como refractariedad, y en esta situación es preciso descartar que ello obedezca a otras causas, como una enfermedad de Crohn del reservorio, una causa infecciosa (C. difficile o sobreinfección por CMV), cuffitis, síndrome del reservorio irritable, estenosis de la anastomosis, ingesta de antiinflamatorios no esteroideos o enfermedad celíaca1,3,5.
El tratamiento de la reservoritis crónica refractaria es particularmente difícil. No hay ninguna opción de primera línea, por lo que se ha descrito el empleo de diversos fármacos. La asociación de metronidazol y ciprofloxacino14 o de rifaximina, un antibiótico de amplio espectro y acción local, y ciprofloxacino9,15 se ha mostrado efectiva en estudios abiertos. Algunos estudios controlados y aleatorizados sobre otras alternativas, como los supositorios de glutamina y butirato, la inulina o enemas de bismuto, no han mostrado resultados concluyentes16,17. La experiencia con alicaforsen en enemas es prometedora pero aún escasa18. En estudios abiertos se han empleado tratamientos propios de la enfermedad inflamatoria intestinal de forma empírica, como mesalazina oral y tópica, inmunosupresores e incluso infliximab, antes de plantear la exéresis quirúrgica del reservorio1,4,5.
Si se considera la reservoritis una colitis ulcerosa del reservorio, con mecanismos patogénicos y patrones de expresión de citocinas similares19,20, los corticoides, tratamiento establecido en la CU, podrían ser una alternativa terapéutica, aunque la evidencia al respecto es limitada4. Budesonida es un corticoide sintético con elevada actividad tópica, baja biodisponibilidad sistémica y menos efectos adversos que los corticoides clásicos. En forma de enema de 2 g ha mostrado menos efectos adversos y una eficacia similar a metronidazol 1 g/día (el 58 frente al 50%) para controlar el episodio de reservoritis, en un ensayo controlado, doble ciego, de doble simulación de 6 semanas de duración (OR = 1,4; IC del 95%, 0,23-8,86)21. Este ensayo incluye a pacientes con una enfermedad menos evolucionada que los de nuestra serie, con formas tanto agudas como crónicas, y la respuesta es inferior en estas últimas.
Budesonida también está disponible en cápsulas CIR, diseñadas para que el principio activo se libere en el íleon terminal y el colon proximal, que ha mostrado su eficacia en la enfermedad de Crohn de dicha localización22,23. Esta formulación podría tener un teórico efecto sobre la mucosa inflamada del reservorio ileoanal y sustituir a la aplicación por vía rectal en forma de enema, modalidad rechazada a veces por los pacientes y que podría limitar el cumplimiento terapéutico24.
Las referencias al respecto son escasas. Un reciente estudio, abierto, realizado en 20 pacientes con reservoritis crónica refractaria, muy similar al nuestro, muestra una tasa de remisión del 75% a las 8 semanas y una reducción significativa de la mediana del PDAI total, como resultado de un descenso significativo en los subíndices clínico, endoscópico e histológico del PDAI. Asimismo, pone de manifiesto una significativa mejoría en el índice de calidad de vida que los autores tuvieron la oportunidad de evaluar25. También se apunta su eficacia en un estudio retrospectivo que incluye 13 casos, aunque en él no se especifica si son reservoritis agudas o crónicas26.
En nuestra experiencia, aunque el número de casos es limitado, budesonida oral se muestra como una alternativa eficaz en la reservoritis crónica, que cabe considerar en casos refractarios de difícil manejo; ello puede permitir el control del episodio para posteriormente utilizar medidas que se han mostrado eficaces en el mantenimiento de la remisión, como los probióticos. VSL#3 es una preparación que contiene una alta concentración de 8 cepas de bacterias liofilizadas. En 2 ensayos controlados, doble ciego27,28, mantuvo la remisión a los 9 y 12 meses en el 85% de los pacientes con reservoritis crónica recurrente o refractaria, frente al 0-6% de los pacientes del grupo placebo.
Son necesarios estudios controlados que evalúen el papel de budesonida oral a corto y largo plazo y su repercusión sobre la calidad de vida en estas formas de reservoritis crónicas y refractarias, especialmente difíciles de tratar.