Las manifestaciones extraintestinales (MEI) son frecuentes en pacientes con enfermedad inflamatoria intestinal (EII). Nuestro objetivo es caracterizar y determinar la prevalencia de MEI en nuestra cohorte de pacientes con EII.
Pacientes y métodosSe realizó un estudio retrospectivo en pacientes adultos con EII del Hospital Pablo Tobón Uribe en Medellín (Colombia). Se consideraron MEI articulares, colangitis esclerosante primaria (CEP), oftalmológicas y dermatológicas. Se emplearon frecuencias absolutas y relativas. Para comparar 2proporciones se utilizó la prueba χ2 de independencia y se estimó el odds ratio (OR).
ResultadosNuestro registro cuenta con 759 pacientes con EII, 544 presentaban CU (71,6%), 200 EC (26,3%) y 15 EII no clasificable (1,9%). Del total, 177 pacientes con EII (23,3%) presentaron MEI, 123 de 544 (22,6%) con CU y 53 de 200 (26,5%) con EC (OR: 0,81; IC 95%: 0,55-1,17; p=0,31). En cuanto al tipo de MEI, las articulares fueron las más frecuentes (13,5%), más en EC que en CU (20,0 vs. 11,3%; OR 1,94; IC 95%: 1,25-3,00; p=0,0037). Los pacientes con EII y MEI utilizaron más anticuerpos contra el factor de necrosis tumoral (anti-TNF) que aquellos sin MEI (43,5 vs. 18,5%; OR 3,38; IC 95%: 2,31-4,90; p=0,0001).
ConclusionesLa prevalencia de MEI en nuestra cohorte es alta (23,3%) y el tipo más frecuente es la articular. Los anti-TNF son más utilizados cuando coexisten EII y MEI. Nuestro estudio aporta información valiosa sobre la asociación de MEI y EII en Latinoamérica.
Extraintestinal manifestations (EIMs) are frequent in patients with inflammatory bowel disease (IBD). Our objective is to characterize and determine the prevalence of MEIs in our cohort of patients with IBD.
Patients and methodsA retrospective study was carried out in adult patients with IBD at the Pablo Tobón Uribe Hospital in Medellín. Colombia. Articular MEIs, primary sclerosing cholangitis (PSC), both ophthalmological and dermatological, were considered. Absolute and relative frequencies were used. The Chi square test of independence was used to compare 2proportions and the odds ratio (OR) was estimated.
ResultsOur registry has 759 patients with IBD, 544 present UC (71.6%), 200 CD (26.3%) and 15 unclassifiable IBD (1.9%); 177 patients with IBD (23.3%) presented EIMs, 123 of 544 (22.6%) with UC and 53 of 200 (26.5%) with CD (OR: 0.81, 95% CI: 0.55-1.17, P=0.31). Regarding the type of EIMs, the articular ones were the most frequent (13.5%), more in CD than in UC (20.0 vs. 11.3%, OR 1.94, 95% CI: 1.25-3.00, P=0.0037). Patients with IBD and EIMs used more antibodies against tumor necrosis factor (anti-TNFs), compared to those without EIMs (43.5 vs. 18.5%, OR 3.38, 95% CI: 2.31-4.90, P=0.0001).
ConclusionsThe prevalence of EIMs in our cohort is high (23.3%) and the most frequent type is joint. Anti-TNFs are most used when IBD and EIMs coexist. Our study provides valuable information on the association of EIMs and IBD in Latin America.
La enfermedad inflamatoria intestinal (EII) comprende 2entidades: la colitis ulcerativa (CU) y la enfermedad de Crohn (EC), que son enfermedades inflamatorias crónicas del tracto gastrointestinal poco comunes, que afectan primordialmente al colon y al intestino delgado, y cuya etiología es multifactorial1,2. Su curso clínico se caracteriza por presentar múltiples recaídas, y durante los últimos años se ha detectado un aumento en la frecuencia de aparición tanto a nivel mundial como en Latinoamérica3,4. Los pacientes con EII, tanto EC como CU, pueden desarrollar manifestaciones extraintestinales (MEI), las cuales se definieron recientemente en un consenso de la European Crohn's and Colitis Organisation (ECCO) como «una enfermedad inflamatoria en un paciente con EII, localizada fuera del intestino y cuya patogénesis es dependiente de la respuesta inmune del intestino, o es un evento inflamatorio independiente perpetuado por la EII, o comparte una predisposición genética o ambiental con la EII»5. Las MEI más frecuentes descritas son las articulares (artropatías periféricas y axiales), dermatológicas (eritema nudoso, pioderma gangrenoso, estomatitis aftosa), colangitis esclerosante primaria (CEP) y las oculares (epiescleritis, uveítis)6. Los reportes de prevalencia de MEI en EII han sido variables y oscilan entre el 6 y el 47%7-10. El estudio español AQUILES encontró en 341 pacientes con EII una incidencia del 6,5% de enfermedades inflamatorias mediadas por inmunidad (espondiloartritis, uveítis y psoriasis) en 2 años de seguimiento11. Se ha descrito que MEI, como la artritis periférica pauciarticular, úlceras orales, eritema nudoso y epiescleritis, dependen de la actividad de la EII; la espondilitis anquilosante y la uveítis tienen un curso independiente, y otras como la CEP y el pioderma gangrenoso pueden, o no, estar relacionadas con la actividad de la EII12. La presencia de MEI en EII se asocia con colitis extensa tanto en CU como en EC, EC perianal, tabaquismo y antecedente familiar de EII e incrementan la susceptibilidad a desarrollar otras MEI5,8,13. Adicionalmente, se ha visto que en ocasiones las MEI pueden preceder a la aparición de la EII14. A pesar de que las MEI se observan frecuentemente en pacientes con EII, datos de su prevalencia en Latinoamérica son escasos. El objetivo de este estudio es determinar la prevalencia de MEI en nuestra cohorte de pacientes con EII y describir sus características clínicas.
Pacientes y métodosSe analizaron en forma retrospectiva datos de pacientes adultos con EII que llegaron por urgencias, fueron hospitalizados o fueron atendido por la consulta externa del Hospital Pablo Tobón Uribe en Medellín (Colombia) hasta febrero de 2019, para determinar la presencia de MEI. Se tomaron los diagnósticos de CU y EC de las historias clínicas, teniendo en cuenta los siguientes códigos: K500 EC de intestino delgado, K501 EC del intestino grueso, K508 otros tipos de enfermedad de Crohn, K509 EC no especificada, K519 CU sin otra especificación y K518 otras colitis ulcerativas.
Criterios diagnósticosLas recientes guías de ECCO para el diagnóstico de CU y EC reconocen que no hay un «patrón de oro» para el diagnóstico de CU y EC, y que debe ser establecido por hallazgos clínicos, de laboratorio, de imágenes, endoscópicos e histopatológicos. No recomiendan el uso de pruebas genéticas ni serológicas para el diagnóstico15,16. La actividad de la CU se definió por la clasificación de Truelove y Witts17, y la extensión se definió según la Clasificación de Montreal18. La localización y el comportamiento de EC se determinaron según la Clasificación de Montreal18. Los pacientes que, a pesar de hallazgos clínicos, radiológicos, endoscópicos, histológicos y serológicos, no cumplían los criterios establecidos previamente para CU y EC, se denominaron sujetos con EII no clasificable18,19. En caso de duda o de no cumplir criterios diagnósticos de EII, fueron excluidos del estudio.
Definiciones de manifestaciones extraintestinalesA pesar de que múltiples enfermedades extraintestinales están asociadas a EII, para este estudio se incluyeron solo las consideradas verdaderas MEI, según definición y consensos de la ECCO5,6, las cuales son: articulares, orales, dermatológicas, oftalmológicas y CEP. No se incluyeron las complicaciones asociadas a EII.
Las manifestaciones articulares las dividimos en axiales y periféricas. Las primeras incluyen sacroilitis axial y espondilitis anquilosante, según la clasificación Assessment of SpondyloArthritis International Society (ASAS)20. Para las artropatías periféricas se utilizó la clasificación propuesta por Orchard en 1998, que incluye 2tipos21, la clasificación de ASAS para espondiloartritis periférica se validó en muy pocos pacientes con EII22, por lo cual preferimos usar la clasificación de Orchard, diseñada solo para pacientes con EII. El tipo 1 está definido como dolor articular (artralgia) con evidencia de inflamación o derrame (artritis) que afecta a menos de 5articulaciones, principalmente las grandes articulaciones que soportan peso de la extremidad inferior, con síntomas que suelen ser agudos y autolimitados (menos de 10 semanas), sin daño articular permanente y que generalmente se correlacionan con brotes de EII. El tipo 2 afecta a más de 5articulaciones, tiene una distribución simétrica y afecta de forma predominante a las extremidades superiores y los síntomas persisten durante meses o años, con independencia de la actividad de la EII21. Se excluyó a pacientes que solo presentaban artralgias, sin artritis.
Las otras MEI que tuvimos en cuenta fueron la presencia de eritema nudoso, úlceras orales, pioderma gangrenoso, psoriasis, uveítis, epiescleritis y CEP. Todos los pacientes con MEI habían sido valorados por el respectivo servicio de Reumatología, Dermatología, Oftalmología y Hepatología.
Recolección de datosSe construyó una base de datos con formato Excel y se recolectaron los siguientes datos de cada paciente para el análisis: 1) Tipo de EII (CU, EC y EII no clasificable). 2) Sexo del paciente. 3) Tratamiento médico acumulado (5-ASA, esteroides, inmunosupresores, terapia biológica). 4) Presencia de MEI. 5) Número de MEI. 6) Tipo de MEI (articular, dermatológica, CEP, oftalmológica). 7) Tiempo de aparición de MEI con respecto a EII y 8) indicación de anti-TNF (EII o MEI).
Análisis estadísticoSe emplearon frecuencias absolutas y relativas para las variables cualitativas y para las variables cuantitativas se utilizaron media y desviación estándar o mediana y rango intercuartílico (P25-75) previa verificación del supuesto de normalidad con las pruebas Kolmogorov-Smirnov. Para comparar 2proporciones se utilizó la prueba χ2 de independencia y se estimó el odds ratio (OR) con su respectivo intervalo de confianza del 95%.
Consideraciones éticasLos investigadores del proyecto se adhirieron a los principios internacionales de la Declaración de Helsinki versión de 2013 en Fortaleza (Brasil) y a la resolución 008430 de 1993 del Ministerio de Salud Nacional de Colombia. Según esta última resolución es una investigación sin riesgo, ya que se revisaron las historias clínicas de los pacientes y se garantizó la confidencialidad y privacidad de la información recogida.
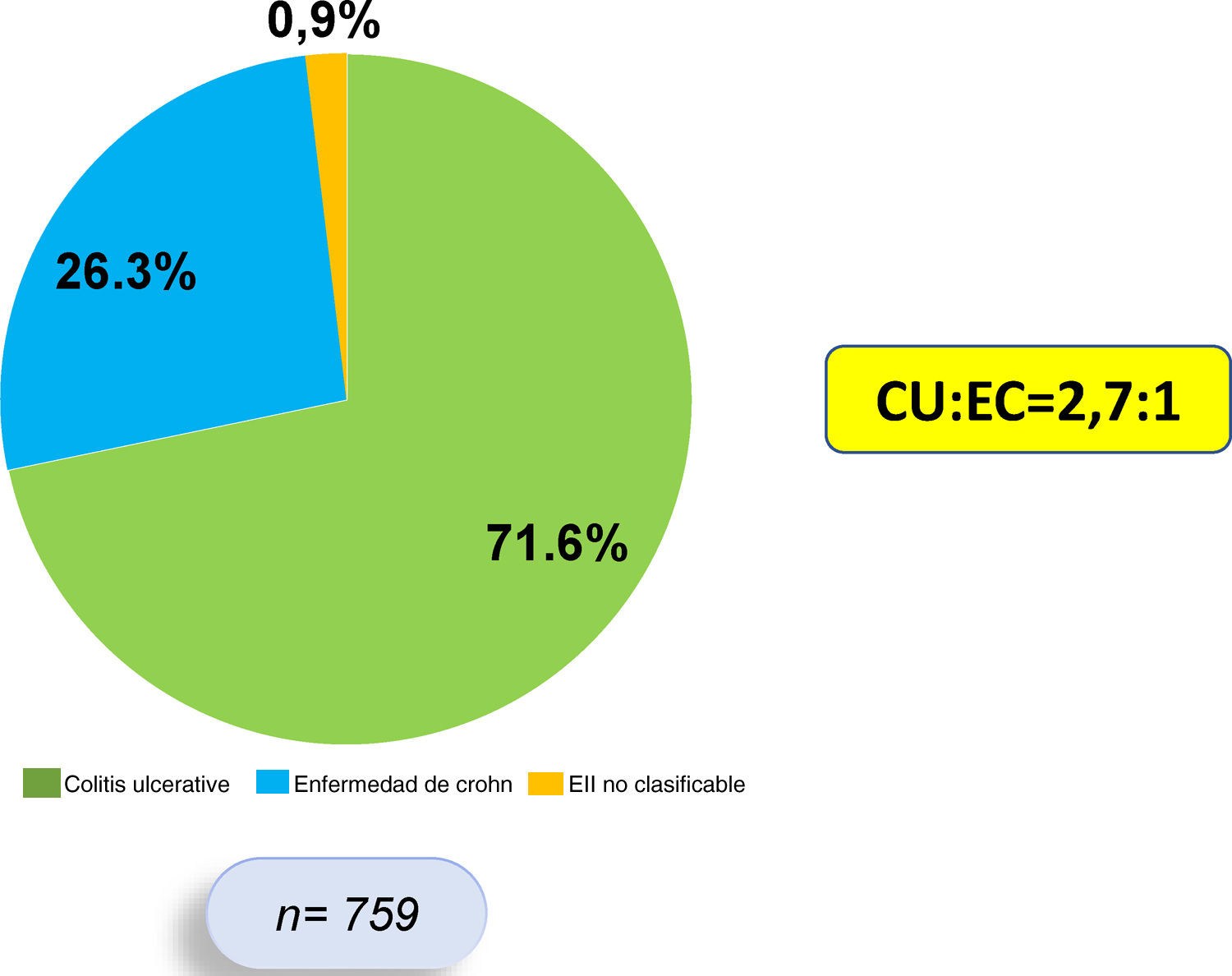
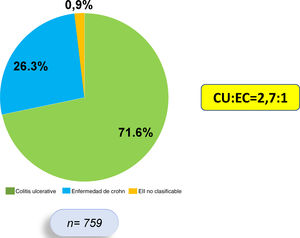
ResultadosEste es un estudio retrospectivo, descriptivo y analítico, en el que se incluyó sistemáticamente a 759 pacientes que cumplían criterios diagnósticos de EII, de los cuales 544 (71,6%) presentan diagnóstico de CU, 200 (26,3%) de EC y 15 (1,9%) de EII no clasificable. La razón CU:EC fue de 2,7:1 (fig. 1). Se encontró un predominio de sexo femenino en CU (53,4%), mientras que en EC hubo un predominio del sexo masculino (57,5%).
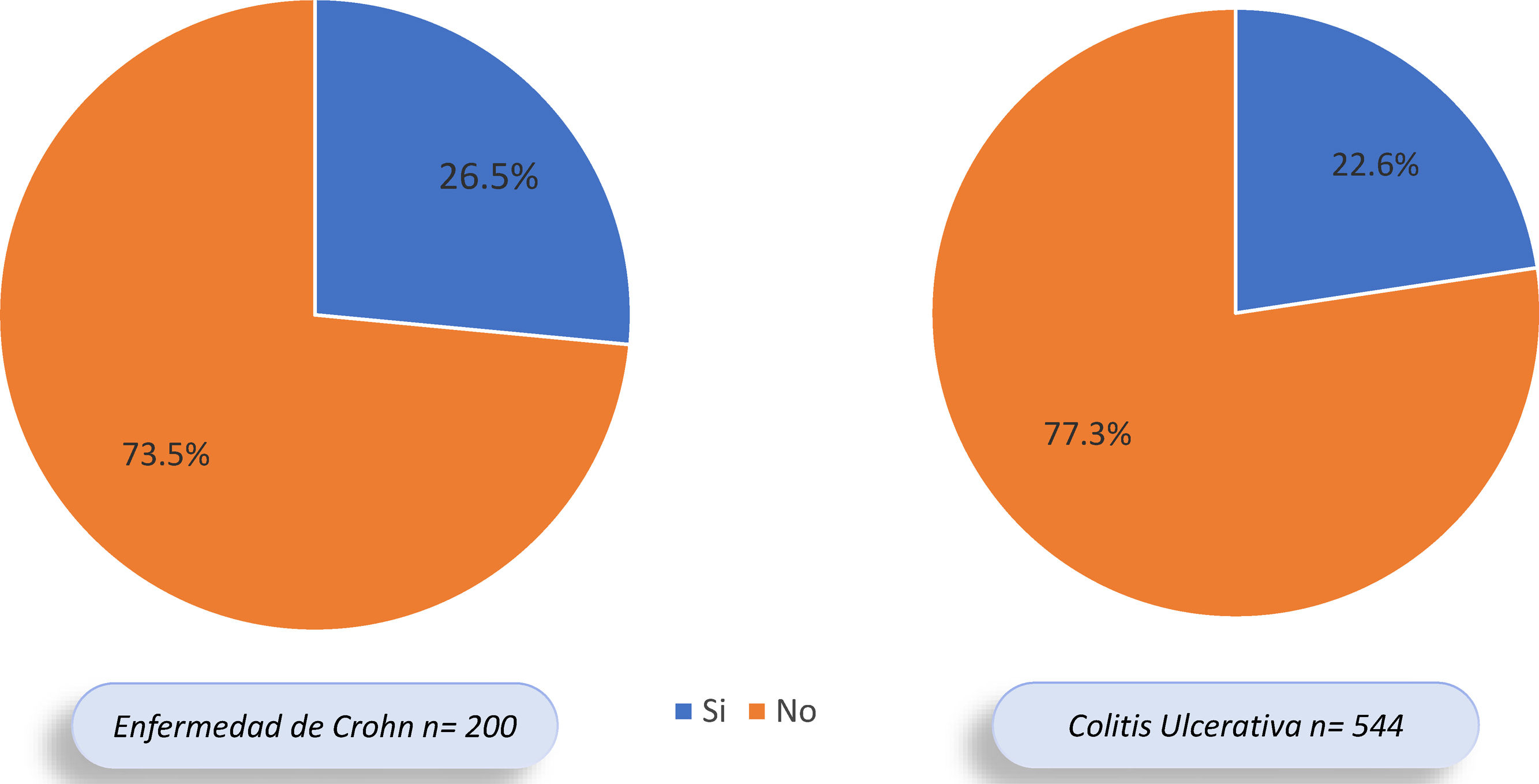
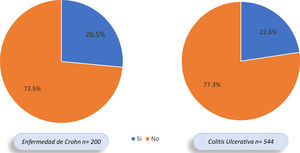
Del total de pacientes con EII, 177 (23,3%) presentaron MEI, 53,1% mujeres y 46,9% hombres. En 123 de los 544 (22,6%) pacientes con CU se documentaron MEI y en 53 de 200 (26,5%) con EC; sin embargo, esta diferencia no fue significativa (OR: 0,81; IC 95%: 0,55-1,17; p=0,31) (fig. 2). De los 177 pacientes con MEI, 145 (81,9%) presentaron una MEI y 32 (18,1%) individuos presentaron 2o más MEI. En el 62,5% de los pacientes se presentó la EII antes que las MEI, en el 16,7% la MEI antecedió la EII y en el 20,8% se diagnosticaron al tiempo.
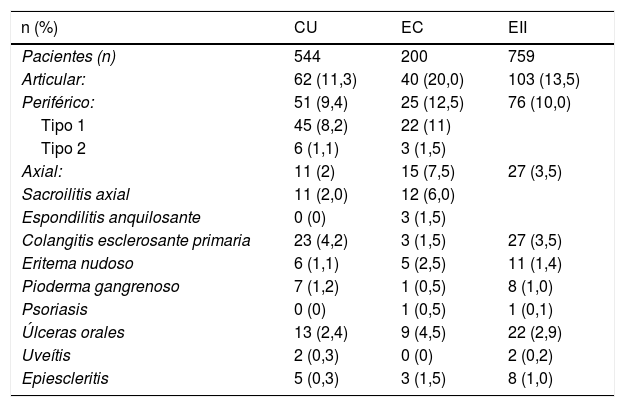
En cuanto al tipo de MEI, las articulares fueron las más frecuentes: se documentaron en un 13,5% de los individuos con EII, en un 10,0% con artropatías periféricas y en un 3,5% con compromiso axial. Las manifestaciones articulares fueron más frecuentes en EC (20,0%) que en CU (11,3%); esta diferencia fue significativa (OR 1,94; IC 95%: 1,25-3,00; p=0,0037). El 3,0% de los pacientes con EII presentaron sacroilitis y solo el 0,4% espondilitis anquilosante (1,5% en EC). Llama la atención que ningún paciente con CU presentó espondilitis anquilosante. En cuanto a las artropatías periféricas, la más frecuente fue la tipo 1, que se distribuyó en forma similar entre CU y EC (8,2% y 11,0%), lo mismo la tipo 2 (1,1% y 1,5%), respectivamente.
Se presentó CEP en el 3,5% de los sujetos con EII; fue más frecuente en CU (4,2%) que en EC (1,5%), sin embargo, esta diferencia no fue significativa (OR 2,89; IC 95%: 0,86-9,76; p=0,11). Otras MEI fueron poco frecuentes en nuestros pacientes con EII: eritema nudoso (1,4%), pioderma gangrenoso (1,0%), psoriasis (0,1%), úlceras orales (2,9%), uveítis (0,2%) y epiescleritis (1,0%). En la tabla 1 se presentan los porcentajes de MEI según tipo de EII.
Tipo de enfermedad inflamatoria intestinal y frecuencia de manifestaciones extraintestinales
| n (%) | CU | EC | EII |
|---|---|---|---|
| Pacientes (n) | 544 | 200 | 759 |
| Articular: | 62 (11,3) | 40 (20,0) | 103 (13,5) |
| Periférico: | 51 (9,4) | 25 (12,5) | 76 (10,0) |
| Tipo 1 | 45 (8,2) | 22 (11) | |
| Tipo 2 | 6 (1,1) | 3 (1,5) | |
| Axial: | 11 (2) | 15 (7,5) | 27 (3,5) |
| Sacroilitis axial | 11 (2,0) | 12 (6,0) | |
| Espondilitis anquilosante | 0 (0) | 3 (1,5) | |
| Colangitis esclerosante primaria | 23 (4,2) | 3 (1,5) | 27 (3,5) |
| Eritema nudoso | 6 (1,1) | 5 (2,5) | 11 (1,4) |
| Pioderma gangrenoso | 7 (1,2) | 1 (0,5) | 8 (1,0) |
| Psoriasis | 0 (0) | 1 (0,5) | 1 (0,1) |
| Úlceras orales | 13 (2,4) | 9 (4,5) | 22 (2,9) |
| Uveítis | 2 (0,3) | 0 (0) | 2 (0,2) |
| Epiescleritis | 5 (0,3) | 3 (1,5) | 8 (1,0) |
No se encontraron diferencias significativas entre la extensión de CU, la localización y el comportamiento de la EC, con respecto a la presencia o no de MEI.
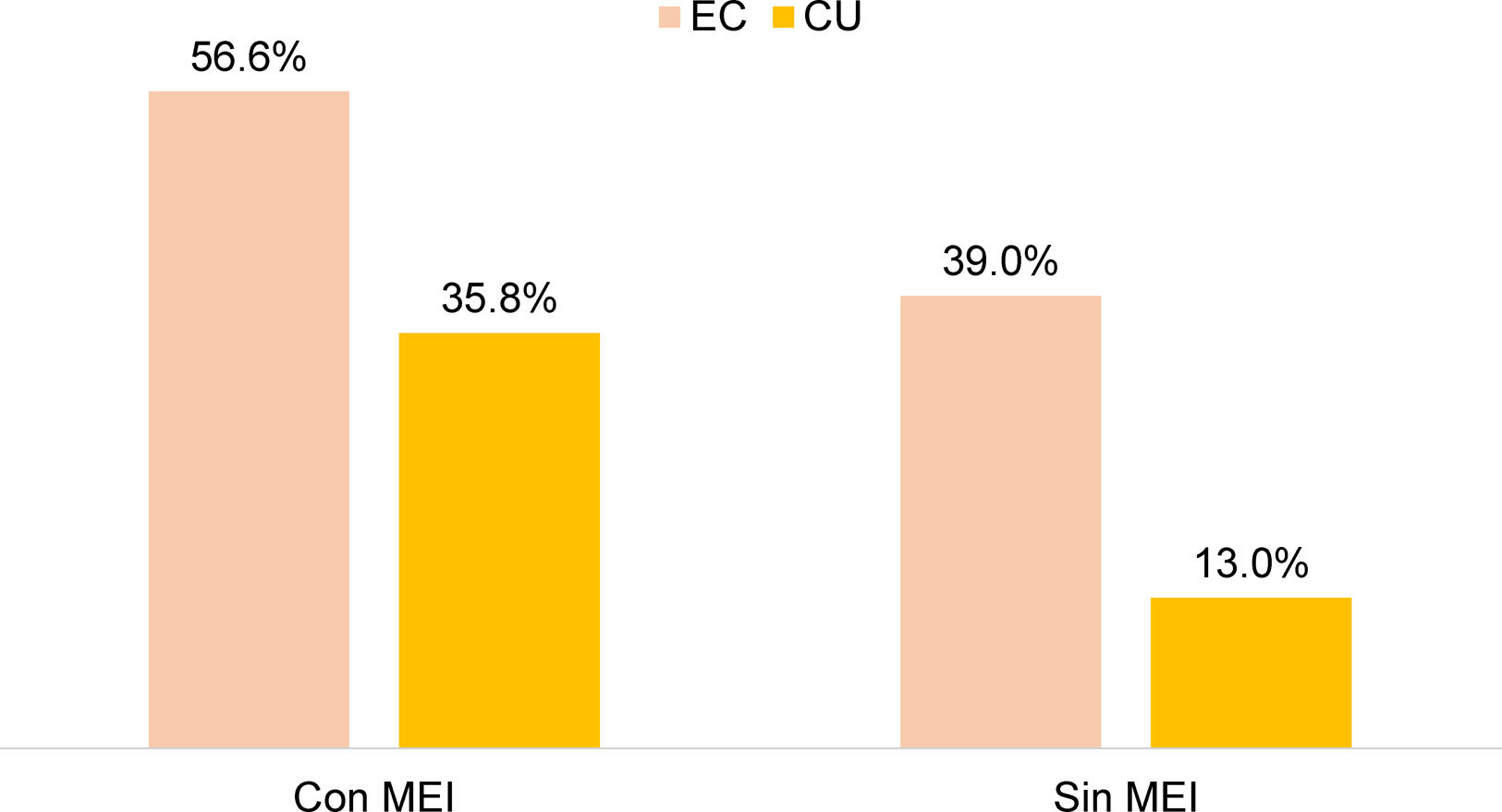
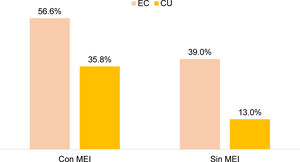
No hubo diferencia significativa entre el uso de esteroides en EII y la presencia de MEI, pero sí se encontró un mayor uso de anti-TNF en pacientes con EII y MEI, comparado con aquellos sin MEI (43,5 vs. 18,5%; OR: 3,38; IC 95%: 2,31-4,90; p=0,0001). Lo anterior se demostró por separado en CU (35,8 vs. 13,0%; OR 3,89; IC 95%: 2,38-6,36; p=0,0001) y en EC (56,6 vs. 39,9%; OR 3,35; IC 95%: 1,74-6,46; p=0,0001) (fig. 3). En el 17,1% de los sujetos con terapia biológica, la indicación del uso de anti-TNF fue la presencia de MEI.
DiscusiónNuestro estudio demostró una prevalencia de MEI en nuestra cohorte de pacientes con EII del 23,3%; fue más frecuente en EC (26,5%) que en CU (22,6%), y en el 18,1% de los individuos se documentó más de una MEI. Adicionalmente, encontramos que las manifestaciones articulares fueron las más frecuentes: se presentaron más en EC que en CU (20 vs. 11,3%; p=0,0037). En un estudio poblacional canadiense en la provincia de Manitoba, se encontró un 6,2% de MEI en pacientes con EII, un 5,5% en EC y un 7% en CU, y solo el 0,3% de los pacientes presentaron múltiples MEI; sin embargo, se excluyó a pacientes con artropatía periférica7. En un estudio húngaro de 873 pacientes con EII, el 21,3% tenían MEI, más frecuente en EC (36,6%) que en CU (15,0%), y encontraron más manifestaciones articulares en EC que en CU (22,4 vs. 10,2%; p<0,01), cifra similar a los resultados nuestros8. Un estudio de la Clínica Mayo en Minnesota encontró un 40% de MEI en 243 pacientes consecutivos con EII, el 36% en CU y el 43% en EC9. De forma más reciente: en una cohorte suiza10 de 950 pacientes con EII, se encontró un 38,1% de MEI, un 43% en EC y un 31% en CU, las más frecuentes de las cuales fueron articulares (28,6% en EC y 21,3% en CU); además, el 12,3% de los pacientes con EII presentaban más de una MEI. Este hallazgo es similar a lo reportado en nuestra cohorte. En un estudio español, en 173 pacientes solo con EC se encontró un 35,5% de MEI y el 9,8% presentaban 2o más MEI, con predominio de manifestaciones articulares y con mayor riesgo en sexo femenino, compromiso colónico y mayor dependencia a esteroides, lo cual no se demostró en nuestro estudio23.
En una revisión sistemática y metaanálisis de manifestaciones articulares en EII se encontró, en 71 estudios, una prevalencia de artritis periférica del 13%, de sacroilitis del 10% y de espondilitis anquilosante del 3%24. En un estudio más reciente del grupo IBSEN en Noruega, encontraron en 470 pacientes con EII, espondiloartritis axial (7,7%) y espondilitis anquilosante (4,5%), en 20 años de seguimiento25. Estos porcentajes son superiores a lo encontrado en nuestro estudio, lo que probablemente esté asociado a un mayor tiempo de seguimiento de los pacientes.
En cuanto a CEP, se presentaron más casos en sujetos con CU que con EC (4,2% vs. 1,5%). Los estudios de Hungría8 y Suiza10, mencionados previamente, reportaron resultados similares, con más casos de CEP en CU que con EC (1,6 vs. 0,8% y 4 vs. 1%, respectivamente).
Otro hallazgo interesante de este estudio es que en el 16,7% de los individuos, la MEI se diagnosticó de forma previa a la EII. En la cohorte suiza, en el 25,8% de los pacientes, la MEI precedió al diagnóstico de la EII14. En un estudio más reciente encontraron que el 7% de los pacientes con EII presentaban MEI articulares antes del diagnóstico de EII26.
Para explicar esta asociación de MEI y EII encontrada en este y otros estudios previos, los expertos proponen 2teorías. La primera considera que las MEI surgen como una extensión de respuestas inmunes específicas de antígenos del intestino a sitios no intestinales, y la segunda sostiene que las MEI son eventos inflamatorios independientes iniciados o perpetuados por la presencia de EII o por factores de riesgo genéticos o ambientales compartidos en el huésped5. Además, se han propuesto varios mecanismos potenciales por los cuales la microbiota intestinal también podría participar en la patogénesis de MEI en pacientes con EII: similitud entre epítopes de microbiota intestinal y epítopes no microbianos presentes en el sitio extraintestinal; translocación bacteriana del intestino al sitio extraintestinal; lipopolisacáridos bacterianos liberados a la circulación, en la que promueven inflamación en sitios extraintestinales y disrupción de la barrera intestinal y producción de metabolitos por parte de la microbiota, que puede alterar la respuesta inmunológica5.
Por último, encontramos que los pacientes con EII y MEI requieren, en forma significativa, más terapia anti-TNF que aquellos sin MEI (43,5 vs. 18,5%). Esto se demostró tanto para EC como en CU. Adicionalmente, en el 17,1% de los pacientes, la indicación del uso de anti-TNF fue la presencia de MEI. Una reciente revisión sistemática y un metaanálisis demostraron efectividad de anti-TNF en MEI, sobre todo en las articulares, dermatológicas y articulares27. Lo anterior se explica por mecanismos dependientes de TNF-? comunes en la fisiopatología de la EII y algunas MEI5. En un estudio suizo se encontró que pacientes con EII y MEI recibieron más tratamiento con anti-TNF que aquellos sin MEI (58,2 vs. 21,0%), porcentajes similares a los encontrados en nuestro estudio. Además, en el 43,2% de los pacientes, los anti-TNF fueron iniciados para tratar las MEI28.
Dentro de las limitaciones de este estudio podemos decir que, al ser retrospectivo y basado en datos recolectados de historias clínicas, puede tener sesgos de selección. Por otro lado, nuestro hospital es de alta complejidad, centro de referencia de pacientes con EII de todo el país, por lo que probablemente incluimos a pacientes más graves y complicados que los de otros centros del país, y sabemos que este tipo de pacientes se asocian más con la presencia de MEI. De otro lado, al ser un estudio retrospectivo, basado en datos tomados en revisión de historias clínicas, no pudimos determinar de manera confiable la actividad tanto de EC como de CU en el momento de presentarse las MEI para establecer alguna asociación. En cuanto al menor porcentaje de compromiso articular axial en nuestro estudio, puede deberse a un subdiagnóstico y nosotros, como gastroenterólogos, debemos tener más conciencia de la coexistencia de la EII con este tipo de manifestaciones, tener en cuenta los criterios diagnósticos y realizar un interrogatorio minucioso de síntomas articulares.
ConclusionesEn resumen, las MEI en pacientes con EII son frecuentes en nuestro medio, más en EC que en CU; las manifestaciones articulares son las más frecuentes y la asociación de EII y MEI requiere mayor uso de terapia biológica. Todos estos hallazgos son similares a lo reportado previamente en otras series. Por lo anterior, es importante integrar grupos multidisciplinarios en las instituciones que incluyan gastroenterólogos, reumatólogos, dermatólogos, oftalmólogos, hepatólogos, entre otros muchos profesionales, para favorecer un mejor diagnóstico tanto de EII como de MEI, disminuir el retraso en el diagnóstico de estas enfermedades y ofrecer un tratamiento adecuado y oportuno a estos complejos pacientes, como se ha intentado en consensos internacionales29. Nuestro estudio aporta información valiosa sobre la asociación de MEI y EII en nuestro medio, ante la escasa información existente de esta asociación en Latinoamérica.
FinanciaciónPara la realización de este estudio no se recibió financiación de ninguna entidad.
Autoría/colaboracionesF. Juliao-Baños: Diseño del estudio, reclutamiento de pacientes y redacción del documento.
M. Arrubla: Recolección de datos.
L. Osorio: Recolección de datos.
J. Camargo: Recolección de datos.
J. Londoño: Recolección de datos.
C. Cáceres: Recolección de datos.
J. Carvajal: Reclutamiento de pacientes.
G. Mosquera: Reclutamiento pacientes.
J. Donado: Análisis estadístico.
FinanciaciónPara la realización de este estudio no se recibió financiación de ninguna entidad.
Conflicto de interesesNinguno de los autores del estudio reportó conflictos de interés.