El cáncer gástrico precoz (CGP) es aquel que está limitado a la mucosa o submucosa, independientemente de la afección ganglionar y de la extensión en superficie. Sin embargo, dado el conocido valor pronóstico de la afección ganglionar, es posible que se esté incluyendo en un mismo concepto tumores con un pronóstico muy diferente, lo que podría conducir a resultados confusos cuando se analizan las diferentes terapéuticas en estos pacientes. De hecho, se ha propuesto la revisión del concepto de early gastric cancer debido al peor pronóstico que conlleva la afección ganglionar1,2.
En cuanto al tratamiento, aunque se han descrito resecciones endoscópicas, la gastrectomía continúa siendo el tratamiento de elección en la mayoría de los servicios quirúrgicos. Sin embargo, existe discusión sobre el tipo de gastrectomía, pues no está claro que la gastrectomía total proporcione mayor supervivencia a largo plazo que la gastrectomía parcial3,4.
Realizamos un análisis de nuestra experiencia en el tratamiento del CGP con el objetivo fundamental de determinar la posible influencia sobre la supervivencia de: a) la profundidad de la invasión parietal (mucosa o submucosa); b) la presencia o no de metástasis ganglionares, y c) el tipo de gastrectomía (subtotal o total).
Como objetivo secundario hemos evaluado los resultados quirúrgicos y supervivencia global a los 5 y 10 años de la intervención quirúrgica.
MATERIAL Y MÉTODOS
Realizamos un estudio longitudinal de 101 pacientes (57 varones y 44 mujeres) intervenidos en el Hospital Universitario Marqués de Valdecilla (Santander) en un período de tiempo comprendido entre los años 1974 y 1999, por CGP, mediante revisión de los datos clínicos y patológicos.
La edad media fue de 59,8 años (límites, 21-84). Ningún paciente se diagnosticó en fase asintomática. El tiempo medio de diagnóstico desde el inicio de los síntomas fue de 16,6 meses.
La manifestación clínica más fecuente fue el cuadro ulceroso en 69 pacientes (68,3%), seguido del síndrome constitucional en 19 (18,8%), hemorragia digestiva en 12 (11,9%) y anemia crónica en uno (1%).
Los métodos diagnósticos empleados fueron el tránsito baritado gastroduodenal (TGD) (73; 72,3%), la gastroscopia (94; 93,1%), la gastroscopia con biopsia (90; 89,5%) y la gastroscopia con citología (79; 87,2%).
El TGD fue positivo para el diagnóstico en el 41,8% de los pacientes; la gastroscopia lo fue en el 40%; la gastroscopia con biopsia en el 85,2%, y la gastroscopia más citología en 78,6% de los pacientes. El índice final de diagnósticos combinando gastroscopia más biopsia más citología fue del 95,7%.
En 6 pacientes la localización fue en el tercio proximal; en el tercio medio en 44 pacientes, y en el tercio distal en 50; en un caso se localizó sobre un muñón gástrico.
En relación con el tipo de intervención, se practicó gastrectomía total en 16 pacientes (15,8%), gastrectomía parcial en 84 (83,2%) y en un caso se realizó resección local (tabla I). La indicación de gastrectomía total o parcial fue según el criterio personal de cada cirujano, excepto en los casos en los que la proximidad del tumor al cardias hizo necesaria la gastrectomía total.
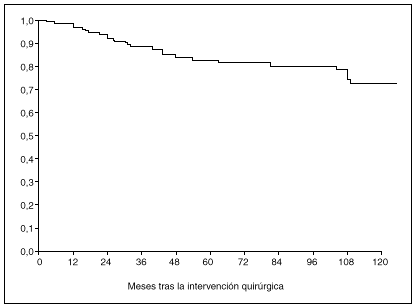
Fig. 1. Probabilidad global de supervivencia a los 5 y a los 10 años después de la intervención quirúrgica.
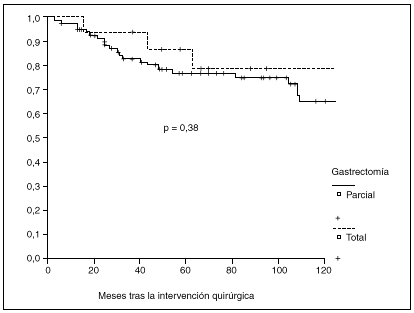
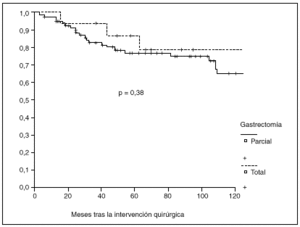
Fig. 2. Probabilidad de supervivencia postoperatoria en pacientes con gastrectomía parcial o total.
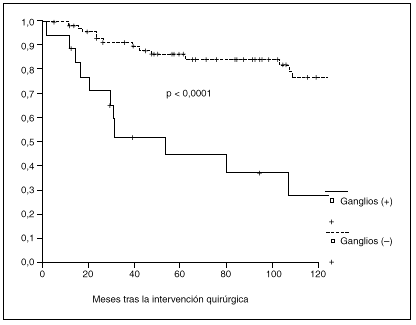
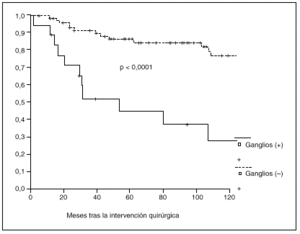
Fig. 3. Probabilidad de supervivencia postoperatoria en pacientes con y sin metástasis ganglionares.
En los pacientes operados en el período 1974-1985, se practicó una linfadenectomía D1 que comprende los ganglios linfáticos perigástricos de la curvatura mayor y menor con omentectomía. Desde 1985, se realizó de forma sistemática una linfadenectomía D2 que comprende, además de los ganglios mencionados, los ganglios supra e infrapilóricos, así como los ganglios de la arteria hepática hasta el tronco celíaco. En las gastrectomías totales se incluyeron, además, los ganglios paracardiales y del hilio esplénico.
Análisis estadístico
La frecuencia de metástasis ganglionares en relación con la invasión parietal se analizó mediante la prueba de la *2 con prueba exacta de Fisher cuando existían menos de 5 casos por celda, al igual que la relación entre metástasis ganglionares o invasión parietal con el tipo de gastrectomía.
Para el estudio de supervivencia se consideró fallecidos sólo a los pacientes que lo hicieron debido al tumor. Los fallecidos por causas no relacionadas o los pacientes perdidos se consideraron perdidos a partir de la fecha de su fallecimiento o la última visita a la consulta.
El análisis univariante de la probabilidad de supervivencia se realizó mediante la prueba de Kaplan-Meier y la significación de la diferencia entre las curvas se estimó mediante la prueba de rangos logarítmicos. Las variables que evidenciaron valor pronóstico en el análisis univariable se compararon mediante el modelo de riesgos proporcionales de Cox. Se consideraron como significativos los valores de p < 0,05.
RESULTADOS
Mortalidad y complicaciones
No se obtuvo ningún caso de mortalidad postoperatoria. Se produjeron complicaciones postoperatorias en 8 pacientes (9,5%), en 6 casos en relación con gastrectomía parcial (tres abscesos abdominales y tres dehiscencias anastomóticas que motivaron cuatro reintervenciones consistentes en drenaje del absceso y sutura) y en 2 casos (12,5%) en relación con gastrectomía total (dos abscesos abdominales que precisaron reintervención). En 2 pacientes tratados mediante gastrectomía parcial, en el informe anatomopatológico se apreció infiltración neoplásica del borde de resección, por lo que fueron reintervenidos.
Hallazgos histológicos
La clasificación según el aspecto macroscópico predominante se expone en la tabla II. En 4 casos los datos anatomopatológicos fueron insuficientes para ser valorados. El grado de diferenciación fue pobre en 28 (27,7%), mediano en 25 (24,7%) y bien diferenciado en 48 (47,5%). El tipo histológico fue difuso en 55 (54,4%) e intestinal en 46 (45,5%). Se hallaron múltiples focos neoplásicos en un solo caso.
El tumor afectaba a la mucosa en 46 casos (45,5%) y a la submucosa en 55 (54,5%). Existían metástasis ganglionares en 18 pacientes (17,8%) y no pudo determinarse en uno. La presencia de metástasis ganglionares fue mayor en los tumores que afectaron a la submucosa (14; 25,5%) que en los que afectaron a la mucosa (4; 8,7%).
Estudio de supervivencia
El seguimiento medio ± desviación estándar (DE) postoperatorio ha sido de 84,04 ± 55,89 meses (límites, 2-264 meses). Se registraron 29 fallecimientos durante el período de seguimiento. En relación con el tumor, ocurrieron 13 fallecimientos, con una media de supervivencia de 24 meses. Fallecieron 12 pacientes (66,7%) de los 18 que tenían afección ganglionar por diseminación metastásica entre los 7 y los 81 meses. Fallecieron 16 pacientes (19,3%) de los 83 pacientes que no tenían afección ganglionar, sin que la muerte estuviera relacionada con el tumor. Falleció un paciente por recidiva local a los 36 meses de la intervención quirúrgica.
No se ha podido realizar el seguimiento completo en 39 pacientes, en 23 casos por perderse el contacto con ellos y en 16 porque la muerte no estaba relacionada con el tumor. En los 23 pacientes perdidos se realizó un seguimiento con una mediana de 85 meses. Al final del estudio han sobrevivido 53 pacientes, con una mediana de seguimiento de 108 meses.
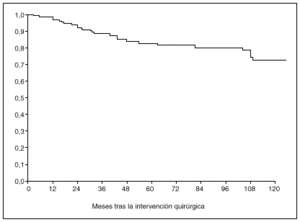
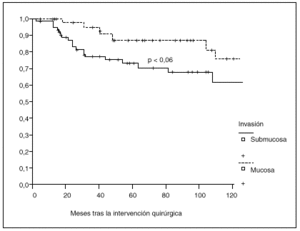
La probabilidad de supervivencia (PS) global a los 5 años fue del 79,24%, y a los 10 años, del 68,14%. La PS fue superior en los pacientes tratados con gastrectomía total (el 87% a los 5 años y el 79% a los 10 años) en relación con la gastrectomía parcial (el 77% a los 5 años y el 65% a los 10 años); p = 0,38 (NS). La PS fue superior en los pacientes sin afección ganglionar (el 86% a los 5 años y el 77% a los 10 años) en relación con los pacientes con afección ganglionar (el 44% a los 5 años y el 27% a los 10 años); p < 0,0001. La PS en los pacientes según la afección mucosa o submucosa ha sido: afección mucosa, el 86% a los 5 años y el 76% a los 10 años, y afección submucosa, el 73% a los 5 años y el 61% a los 10 años; p < 0,06.
DISCUSION
El CGP presenta una supervivencia claramente superior que la del cáncer avanzado. Sin embargo, existen diferencias evidentes entre la supervivencia de distintos pacientes con CGP, motivo por el cual hemos realizado este estudio, a fin de analizar la posible influencia de la invasión submucosa, la frecuencia de metástasis ganglionares y el tipo de gastrectomía. La presente serie tiene el valor de un elevado número de casos para un país occidental, así como un adecuado seguimiento.
Fig. 4. Probabilidad de supervivencia postoperatoria en pacientes con tumor limitado a la mucosa o a la submucosa.
Observamos invasión de la submucosa en el 54,5% de los pacientes, lo que nos sitúa en valores elevados entre los descritos, que oscilan entre el 315 y el 68,5%6. En comparación con otras series españolas, sorprende que nuestras cifras son considerablemente más elevadas que las de zonas geográficamente próximas (el 331 y el 37%7), aunque similares a otras con un 57% de invasión submucosa8.
Como se aprecia en la presente serie, el pronóstico empeora claramente con la afección de la submucosa en relación con tumores limitados a la mucosa, observación anteriormente descrita5,6,9 aunque no confirmada en todos los trabajos10-12.
Otro factor que puede influir sobre el pronóstico son las metástasis ganglionares. La frecuencia de nuestra serie (17,8%) se encuentra en el límite superior del habitualmente publicado, entre el 7,5 y el 22%2,6,13,14, en comparación con otras series españolas se encuentra igualmente en el rango alto, estimado entre el 10,9 y el 20,6%1,7,8.
Al igual que en otras series15,16, hemos observado metástasis ganglionares incluso cuando el tumor se encuentra localizado en la mucosa. Nuestro estudio, al igual que la mayoría1,2,5,9,13-15, demuestra que los pacientes con metástasis ganglionares presentan una supervivencia postoperatoria significativamente menor que los que presentan ganglios libres de tumor, aunque algunos autores no observan correlación entre supervivencia y afección ganglionar6,10.
Por tanto, parece que la categoría de CGP incluye tumores de pronóstico muy diferente. Por un lado, los casos de tumor limitados a mucosa con ganglios negativos tienen un pronóstico mucho mejor que los tumores con afección submucosa y ganglios positivos. La existencia de metástasis ganglionares es probablemente la variable más importante, ya que tiene mayor significación pronóstica en la mayoría de los estudios13.
De hecho, según la clasificación TNM14, si un CGP presenta metástasis ganglionares se trata de un estadio IB, por lo que no parece lógico considerarlo como un cáncer «precoz». Por ello podrían ser necesarios una revisión del concepto de CGP y definirlo como carcinoma limitado a mucosa o submucosa sin evidencia de afección ganglionar, como ya se ha propuesto anteriormente1,2.
La mayoría de los grupos coincide en la suficiencia de una gastrectomía parcial subtotal, a menos que el tumor se localice en el tercio proximal. No obstante, pocos trabajos se han centrado en este aspecto y, además, los resultados han sido contradictorios, ya que no se han observado diferencias entre ambos tipos de gastrectomías4 y en otros se ha apreciado mejor supervivencia en casos de gastrectomía parcial3. Aunque según nuestros datos la probabilidad de supervivencia a largo plazo es algo superior tras gastrectomía total que tras gastrectomía parcial, la diferencia no es estadísticamente significativa. Este resultado es especialmente valorable, teniendo en cuenta la homogeneidad de ambos grupos, ya que no existen diferencias significativas en cuanto a distribución de casos con invasión submucosa o ganglionar.
El principal argumento válido para defender la gastrectomía total, aparte de la localización del tumor, es la posibilidad de multifocalidad, pues ésta se da en un porcentaje variable, entre el 8,4 y el 23,6%6,8,17,18. En la presente serie tan sólo hemos encontrado un caso, aunque probablemente los 2 casos con infiltración de bordes en el estudio anatomopatológico lo fueran. No obstante, en el 71% de los casos con más de un foco, éstos pueden detectarse de forma preoperatoria mediante combinación de examen radiológico y endoscópico19. Si a ello se une la baja probabilidad de que un foco no detectado quede en el remanente gástrico, si la gastrectomía parcial es subtotal, parece recomendable no exponer al paciente a los mayores riesgos postoperatorios de una gastrectomía total.
Muchos grupos realizan una linfadenectomía D22,9,20,21, aunque existen partidarios de una linfadenectomía limitada a los ganglios perigástricos, linfadenectomía D122,23. Creemos que debe realizarse de forma sistemática una linfadenectomía D2, ya que existen metástasis ganglionares hasta en un 22% de los casos13,24-26, siendo en el segundo nivel ganglionar (N2) hasta en un 4,4%8. Si sólo se extirpara el primer nivel ganglionar (N1), la resección no sería absolutamente curativa en muchos casos, de acuerdo con las recomendaciones para la cirugía del cáncer gástrico27. Además, Roukos et al28 comprobaron que en algunos casos no se aprecian diferencias significativas en la supervivencia alcanzada tras linfadenectomías D1 y D2, pero en los casos N1 la supervivencia alcanzada tras una linfadenectomía D2 era significativamente mayor que tras una D1; por ello somos partidarios de la linfadenectomía D2 en el CGP.
Es posible que para casos muy seleccionados pueda emplearse la resección endoscópica29; sin embargo, es muy difícil tener la certeza de que el tumor se limita a la mucosa y que no existen metástasis ganglionares, incluso empleando la ecografía endoscópica. De hecho, con frecuencia es necesaria la gastrectomía tras comprobar invasión submucosa o afección de los bordes de la pieza resecada endoscópicamente30.
En cuanto al diagnóstico, cabe destacar, puesto que la radiología es negativa en un considerable número de pacientes, que creemos conveniente la realización de una endoscopia con biopsia y citología cuando se sugiere epigastralgia persistente o recurrente, ya que de forma combinada se alcanza el diagnóstico en la mayoría de los casos9,11,19,31.
En conclusión, en el presente estudio se observa que el pronóstico del CGP empeora con la afección submucosa y ganglionar, pero de forma especial con esta última, por lo que habría que considerar la posibilidad de revisar el propio concepto de CGP en el sentido de excluir aquellos casos con metástasis ganglionares o bien de utilizar la clasificación TNM, considerando sólo como realmente precoces los tumores T1N0M0.
No se han apreciado diferencias significativas en la supervivencia a largo plazo en cuanto al tipo de gastrectomía realizada, por lo que parece recomendable la gastrectomía parcial, a menos que el tumor se encuentre en el tercio proximal.