Sr. Director: El tacrolimus es un macrólido aislado del Streptomices tsukubaensis. Su mecanismo de acción es similar a la ciclosporina con una potencia inmunosupresora de 10-100 veces superior, una absorción intestinal rápida no dependiente de la integridad de la mucosa intestinal y con gran variabilidad individual que obliga a un estrecho seguimiento de los valores plasmáticos del fármaco1.
En la actualidad se dispone de una amplia experiencia sobre el uso de tacrolimus como fármaco inmunosupresor en el trasplante de órganos, fundamentalmente del riñón y el hígado. La evidencia científica disponible para su uso en la enfermedad inflamatoria intestinal (EII) es escasa debido al tamaño y la heterogeneidad de los estudios publicados2. Recientemente, se ha publicado el primer estudio con tacrolimus oral, controlado con placebo, en el tratamiento de la colitis ulcerosa refractaria en población japonesa3.
Presentamos un caso de colitis ulcerosa (CU) tratado con tacrolimus, en el que se pone de manifiesto el posible papel de este fármaco en la curación mucosa y el mantenimiento de la remisión clínica. Paciente de 37 años de edad, sin antecedentes personales de interés ni hábitos tóxicos en la actualidad (ex fumador). El cribado de tuberculosis fue negativo. En la serología del virus de la hepatitis B VHB se obtuvo AgHBs(—), anti-HBc(+) y anti-HBs(+). Fue diagnosticado de pancolitis ulcerosa en el año 2006, con brote moderado, y presentó una buena evolución clínica con corticoides orales. Ingresó en el hospital, 3 meses más tarde, por un brote agudo que precisó tratamiento con ciclosporina, ini- cialmente intravenosa y posteriormente oral, junto con el inicio de tratamiento con azatioprina (2,5 mg/kg/día).
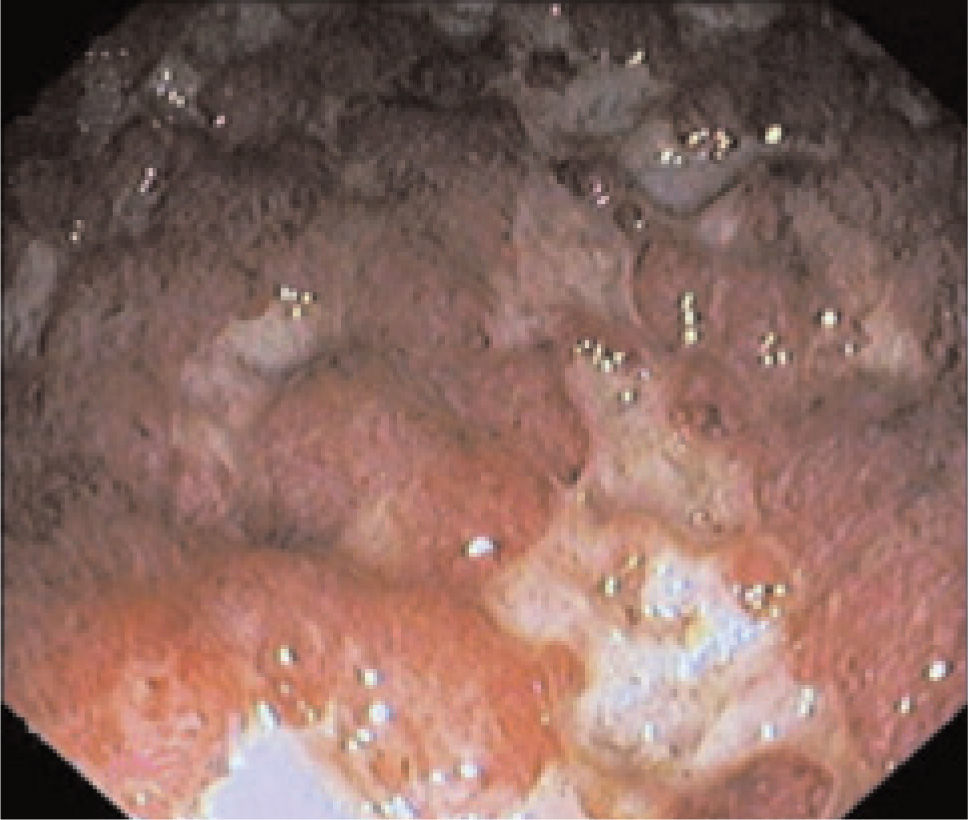
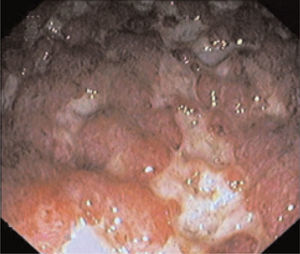
A los 7 meses, presentó un nuevo brote agudo con más de 8 deposiciones/ día con restos hemáticos en la totalidad de las deposiciones, febrícula y dolor abdominal. En la analítica destacaban una proteína C reactiva de 69,6 mg/l, junto con leucocitosis con desviación izquierda, anemia (hemoglobina de 11,6 g/dl) microcítica hipocrómica e hipoalbuminemia (2,61 g/dl). Las funciones renal y hepática eran normales. Se inició tratamiento con dosis plenas de corticoides sin respuesta clínica y se detectó en la rectoscopia una afectación mucosa continua con úlceras profundas y sangrado espontáneo (fig. 1) sin evidencia en el análisis inmunohistiquímico de sobreinfección por citomegalovirus. Nuevamente se pauta tratamiento con ciclosporina i.v. (2 mg/kg/día), con buena evolución clínica, lo que permitió el cambio a tacrolimus oral al sexto día de tratamiento, por lo que el paciente fue dado de alta en remisión clínica y en tratamiento con corticoides en pauta descendente, junto con tacrolimus oral como único tratamiento de mantenimiento (asociado a profilaxis para Pneumocystis carinii).
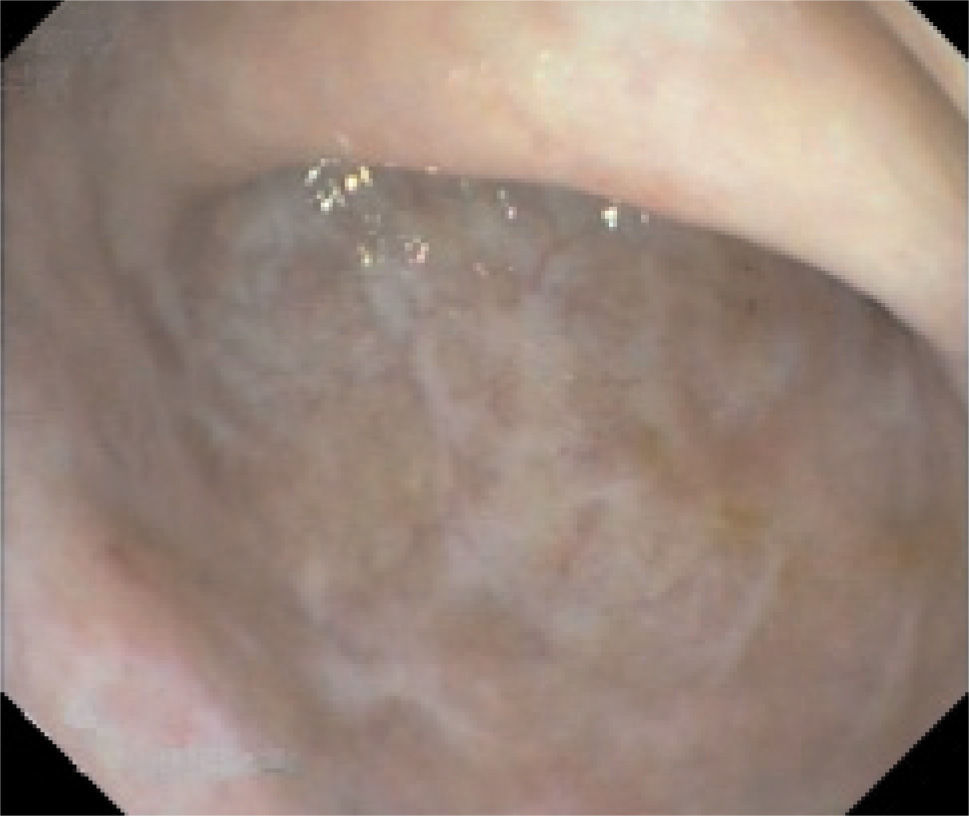
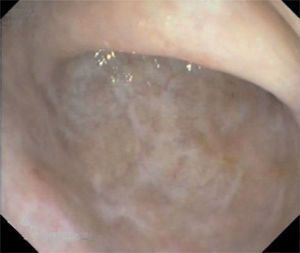
En la actualidad, 12 meses después, el paciente permanece asintomático, sin evidencia de efectos secundarios en relación con el tratamiento inmunosupresor y con valores de tacrolimus en sangre estables entre 6 y 10 ng/ml. Se realiza una sigmoidoscopia de control, mediante la que se constata la curación mucosa completa (fig. 2).
La actividad endoscópica y la gravedad de la inflamación histológica durante el seguimiento son los factores predictivos más importantes para el desarrollo de cáncer colorrectal en los pacientes con CU4,5. La normalidad macroscópica de la mucosa en la colonoscopia implica una reducción del riesgo, al menos a 5 años, igual al de la población general. Por otra parte, la presencia de signos inflamatorios agudos o cambios crónicos (seudopólipos inflamatorios y/o estenosis) representan un aumento del riesgo de desarrollar una neoplasia colorrectal4.
El tacrolimus, en el único estudio controlado con placebo publicado hasta la fecha3, consigue la curación mucosa en el 73% (40/55) de los casos a la décima semana, porcentaje superior al logrado con infliximab en los estudios ACT1 (62%) y ACT2 (60,3%) a la octava semana con 5 mg/kg/día6. Ambos estudios utilizan la misma definición de curación mucosa (subpuntuación 0 y 1 del índice de la Clínica Mayo), y es en esta definición de curación endoscópica donde podemos encontrar la explicación de la discrepancia entre los porcentajes de curación mucosa y remisión clínica en ambos trabajos.
El papel del tacrolimus en el mantenimiento a largo plazo de la remisión es desconocido. En la serie retrospectiva de Baumgart et al7, más del 65% de los pacientes con CU se mantuvieron en remisión durante el seguimiento. En los pacientes con EII que respondieron a tacrolimus pero no pudieron mantener la remisión con inmunomoduladores, la duración de la respuesta con tratamiento combinado osciló entre 10 meses y más de 4 años. Un caso de CU permaneció en remisión más de 3,5 años únicamente con tacrolimus7. En niños con CU el tratamiento de mantenimiento con tacrolimus fue útil en casos de corticodependencia, aunque no en casos de corticorrefractariedad8.
El beneficio de asociar inmunomodulador en el mantenimiento con tacrolimus no está claramente establecido en la EII, y hay constancia en series retrospectivas de la eficacia de la monoterapia con tacrolimus8,9. No cabe duda de que se necesitan estudios controlados para valorar el papel del tacrolimus en la CU, fundamentalmente su utilidad en el mantenimiento de la remisión, y el diseño de esos estudios debería incluir la endoscopia con el objetivo primario de lograr la normalidad macroscópica de la mucosa, así como probablemente la histología, ambos factores predictivos del riesgo de desarrollar cáncer colorrectal en estos pacientes.