Actualmente, la colonoscopia es la técnica de elección para el diagnóstico del cáncer colorrectal (CCR), así como para la identificación y resección de las lesiones precursoras. Sin embargo, su eficacia ha sido cuestionada ante la evidencia de pacientes con diagnóstico de CCR tras una colonoscopia reciente “negativa”. Estos cánceres poscolonoscopia son también conocidos como cánceres de intervalo y la identificación de sus posibles causas ha comenzado a despertar interés en los últimos años. Los estudios presentados este año en el Congreso de la American Gastroenterological Association (AGA) que se describen a continuación, aportan información relevante para identificar las potenciales causas de las neoplasias detectadas tras una colonoscopia reciente y proponen alternativas para disminuir este riesgo. Entre estos estudios destacan los enfocados a la prevalencia de CCR de intervalo, estudios que pretender mejorar la calidad de la colonoscopia con el fin último de lograr una mayor detección de lesiones neoplásicas, como es la valoración de la limpieza intestinal, la tasa de detección de adenomas, estudios que proponen nuevas alternativas en la técnica endoscópica, así como en la visualización del colon, como la cápsula colónica.
Colonoscopy is currently the technique of choice for the diagnosis of colorectal cancer (CRC), as well as for the identification and resection of precursor lesions. However, its efficacy has been questioned due to evidence that some patients receive a diagnosis of CRC after a recent “negative” colonoscopy. These post-colonoscopy cancers are also known as interval cancers and, in the last few years, there has been interest in identifying their possible causes. The studies presented this year in the congress of the American Gastroenterological Association (AGA), described in the present article, provide important information for identification of the potential causes of neoplasms detected after a recent colonoscopy and propose methods to reduce this risk. Notable among such studies are those on the prevalence of interval colorectal cancer, those aiming to improve the quality of colonoscopy with a view to increasing the detection of neoplastic lesions, such as assessments of bowel cleansing and of the adenoma detection rate, and studies that propose new alternatives in endoscopy and in colon visualization, such as the colon capsule.
El cáncer colorrectal (CCR) es una de las neoplasias más frecuentes en nuestro medio, de modo que ocupa el segundo lugar en incidencia y mortalidad por cáncer en la mayoría de los países desarrollados1.
En España constituye la neoplasia más frecuente cuando se consideran ambos sexos conjuntamente, siendo el tercer cáncer en los varones (tras el de próstata y pulmón) y el segundo en mujeres (después del de mama), por lo que constituye un importante problema de salud pública. Según datos del Instituto Nacional de Estadística, en el año 2007 fallecieron en España 13.495 personas debido al CCR, lo que representa la segunda causa de muerte por cáncer2.
La colonoscopia es el “patrón oro” para el diagnóstico del CCR, así como para la identificación y resección de las lesiones precursoras. Algunos estudios observacionales recientes sugieren que la realización de la colonoscopia comporta una reducción del 60% en la incidencia y mortalidad por CCR3.
A pesar de la efectividad comprobada de dicho procedimiento, no se puede obviar que hay pacientes con diagnóstico de CCR tras una colonoscopia reciente. Estos cánceres poscolonoscopia son también conocidos como cánceres de intervalo y se definen como el CCR que se diagnostica entre colonoscopias de vigilancia.
Con el objetivo de profundizar en el concepto de neoplasia colónica de intervalo y minimizar su riesgo, a continuación se describen algunos de los principales aspectos relacionados con dicha neoplasia, enfatizando en las novedades aportadas este año en el Congreso Americano de Gastroenterología (AGA 2013).
Cáncer de intervalo. Incidencia y potenciales causasEl cáncer de intervalo representa entre el 3,5 y el 9% de todos los CCR diagnosticados. Es uno de los aspectos que más inquietan en los programas de vigilancia colonoscópica, sin embargo hay pocos estudios que hayan explorado las posibles explicaciones de la aparición de estas neoplasias4. Entender su etiología es de gran relevancia clínica, ya que puede permitir la identificación y corrección de errores potencialmente prevenibles.
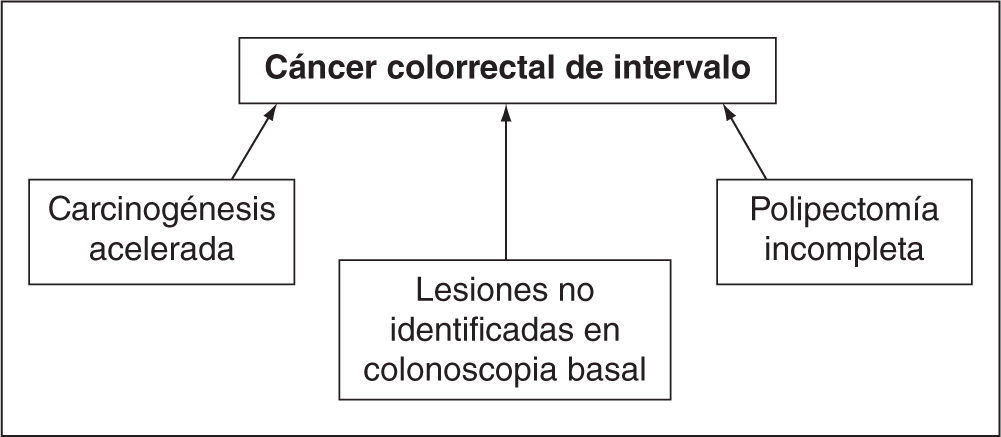
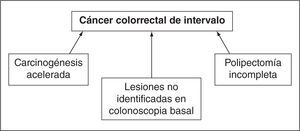
Entre las causas que se han implicado en el cáncer de intervalo, los estudios más recientes4,5 apuntan principalmente a factores inherentes al procedimiento endoscópico, en especial a lesiones no identificadas en la colonoscopia basal y la resección incompleta de lesiones, es decir, a factores que definen la calidad de la endoscopia. Por ejemplo, estudios recientes han sugerido que la polipectomía incompleta (principalmente en el caso de adenomas sésiles de gran tamaño) es responsable del 27–31% de los CCR de intervalo6; por otro lado, la evidencia apoya que hasta el 50% de los CCR de intervalo se deben a lesiones no identificadas en la colonoscopia inicial7, ya sea por problemas de la calidad del endoscopio, colonoscopias incompletas o mala preparación intestinal. Sin embargo, también se han descrito otros aspectos, como la biología tumoral, la carcinogénesis acelerada o la implicación de la vía serrada de la carcinogénesis, que pueden explicar hasta el 30% de los CCR de intervalo (fig. 1).
Con la finalidad de establecer la tasa, características y factores predictivos del CCR no diagnosticado o de intervalo tras una colonoscopia basal, Sammadder et al8 realizaron un estudio retrospectivo de base poblacional en el Estado de Utah (Estados Unidos), que incluía a pacientes de entre 50 y 80 años de edad que se habían realizado una colonoscopia entre 1995 y 2009 y a los que se les había diagnosticado un CCR entre los 6 y 60 meses tras dicho procedimiento. Se incluyó un total de 126.936 pacientes, identificándose una tasa de CCR de intervalo del 3,5% (n=91) en el período comprendido entre 6 y 36 meses, y del 6% (n=159) cuando el periodo incluía entre 6 y 60 meses tras la colonoscopia basal. Se realizó un análisis de regresión logística para identificar factores de riesgo. La edad y el sexo no estaban relacionados. El 85% de los cánceres tenía antecedente de polipectomía en la colonoscopia basal y estadio tumoral más precoz —estadio avanzado— (odds ratio [OR]: 0,70; intervalo de confianza [IC] del 95%, 0,50–0,96; p=0,03) y localización proximal (OR: 2,24; IC del 95%, 1,46–3,42; p<0,001), así como una mejor supervivencia en general (hazard ratio: 0,63; IC del 95%, 0,49–0,71; p<0,001) y por estadio. Los autores concluyen que el hecho de que estas neoplasias sean de predominio derecho y con mejor pronóstico orienta a que la biología tumoral de estos CCR sea diferente al CCR convencional.
Calidad de la endoscopiaUno de los puntos cardinales de la calidad de la endoscopia es la limpieza intestinal. La eficacia diagnóstica de la colonoscopia depende principalmente de la capacidad para visualizar las lesiones mucosas. La preparación intestinal inadecuada es una de las explicaciones más plausibles para la falta de detección de neoplasias durante la colonoscopia. Una limpieza intestinal inadecuada puede llevar a no identificar lesiones, procedimientos incompletos, mayor molestia del paciente, pruebas más largas y, potencialmente, complicaciones. Aunque existen diferentes esquemas de preparación de limpieza para la colonoscopia, no hay un corte de superioridad de alguna de las estrategias sobre las otras. Con el objetivo de evaluar las diferencias entre los regímenes de dosis partida y en una toma, considerando diferentes tipos y dosis de laxantes, Bucci et al9 realizaron un metaanálisis presentado este año en el Congreso de Orlando (Estados Unidos). La calidad de la limpieza se graduó en excelente o buena y pobre o inadecuada. Del total de 1.385 artículos potencialmente relevantes se incluyeron 26, comparando 46 ramas de tratamiento, y 6.808 pacientes. Independientemente del tipo de laxante utilizado, la frecuencia de limpieza “excelente o buena” fue en todos los casos significativamente mayor en el grupo de dosis partida, con una diferencia media del 20,9% (IC del 95%, 16,3–25,5; p<0,0001) y esta tendencia se mantenía cuando se comparaban los diferentes laxantes (variando del 11,6 al 30%; p<0,001). Esta superioridad se iba perdiendo progresivamente a medida que aumentaba el tiempo entre la última dosis de laxante y el inicio de la colonoscopia. Estos resultados apoyan la implementación de la dosis partida independientemente del tipo de laxante utilizado en la preparación.
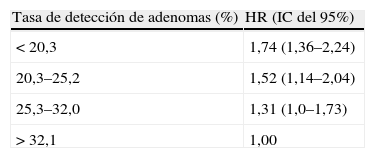
Otro de los principales criterios de calidad de la endoscopia que se han establecido es la tasa de detección de adenomas (TDA), que se define como la proporción de pacientes sometidos a una colonoscopia en los que se ha detectado como mínimo 1 adenoma. En esta línea, este año en el AGA se presentó un estudio10 que evaluó la asociación entre la TDA y el riesgo de CCR de intervalo en una cohorte de base poblacional entre los años 1998 y 2010. Las colonoscopias se realizaron por endoscopistas experimentados. La TDA se definió como el porcentaje de exploraciones en las que, al menos, se encontró 1 adenoma o CCR. Los pacientes fueron seguidos hasta 2011, o hasta el diagnóstico de CCR o la realización de una colonoscopia (lo que pasara primero). Se excluyeron los CCR detectados los primeros 6 meses tras la colonoscopia basal. En el análisis se incluyeron las variables TDA, tiempo de la exploración, sexo, edad, etnia, historia familiar de CCR y score de Charlson de comorbilidad. Se incluyeron 316.334 colonoscopias y 716 casos de CCR poscolonoscopia. La TDA fue el único factor independiente asociado al riesgo de CCR tras una colonoscopia negativa, el riesgo aumenta a medida que la TDA baja, y no se identificó ningún punto de corte por debajo del cual ya no hubiera beneficio añadido (tabla 1).
Lesiones de difícil identificaciónOtra de las posibles explicaciones es que parte de los cánceres de intervalo sean producto de pólipos planos, principalmente en colon derecho, cuya identificación endoscópica es más difícil11.
Diversos estudios han demostrado que el adenoma colónico constituye una lesión premaligna; asimismo, en los últimos años se ha establecido el papel de los pólipos hiperplásicos o serrados en la carcinogénesis colorrectal, atribuyéndose hasta un 30% de los cánceres por la vía alternativa o serrada12.
Los pólipos serrados, en particular los adenomas serrados (AS) sésiles (ASS), frecuentemente son planos, suelen estar localizados en el colon proximal, muchas veces cubiertos de moco, características que dificultan su identificación, por lo que son los pólipos que en los últimos años se han relacionado de forma más estrecha al cáncer de intervalo.
Los pólipos serrados comprenden un grupo heterogéneo de lesiones con una característica común: la presencia de una arquitectura en “dientes de sierra” en el epitelio de la cripta, con o sin la presencia de displasia citológica; actualmente la Organización Mundial de la Salud los divide en 3 categorías: pólipos hiperplásicos, ASS —con o sin displasia— y AS tradicional (AST). El ASS se considera la lesión precursora de CCR a través de la llamada vía serrada de carcinogénesis13.
El riesgo de malignización está condicionado por las características histológicas, el número de pólipos, el tamaño > 1cm y la localización proximal, siendo estas últimas 2 variables las de mayor importancia14,15.
A pesar de que hay información que asocia a los pólipos serrados, especialmente a los ASS, con el CCR, la historia natural de estas lesiones sigue siendo desconocida, especialmente en cuanto a su tasa de crecimiento, así como la incidencia de progresión a cáncer.
Estrategia de vigilancia pospolipectomía adecuadaOtra de las posibles causas del CCR de intervalo es establecer una estrategia de vigilancia inadecuada, de ahí la importancia de estar familiarizados con estas pautas.
Los pacientes que han desarrollado un adenoma colónico tienen una mayor probabilidad de presentar otros pólipos durante el seguimiento, siendo más frecuente cuando la lesión inicial es múltiple, > 1cm o con componente velloso16. Por ello, una vez comprobada la extirpación de todas las lesiones, los pacientes deben ser incluidos en programas de vigilancia endoscópica. La periodicidad de las exploraciones dependerá de las características y número de pólipos, la edad de presentación y la existencia de antecedentes familiares de adenoma o CCR17.
En los pacientes con más de 10 adenomas se debería realizar una colonoscopia en menos de 3 años y valorar la posibilidad de un síndrome polipósico. En los pacientes que presentan adenomas múltiples (3–10) o un adenoma avanzado (≥ 10mm, con componente velloso o displasia de alto grado), el intervalo desde la exploración basal hasta la primera colonoscopia de seguimiento debería ser de 3 años. En los pacientes con 1 o 2 adenomas tubulares de pequeño tamaño (< 10mm) y displasia de bajo grado, este intervalo puede ser de 5 o 10 años. En pacientes con pólipos hiperplásicos rectales de pequeño tamaño se recomienda la siguiente colonoscopia a los 10 años. La frecuencia de sucesivas exploraciones dependerá de los hallazgos de la colonoscopia previa18.
Los pólipos hiperplásicos (PH) en el recto no se han asociado con un aumento del riesgo de adenomas proximales ni de CCR y su resección completa no está formalmente recomendada19. Sin embargo, los pólipos serrados (PH, ASS, AST), fuera de esta localización deben ser resecados completamente y si hay dudas de su resección completa debe realizarse una colonoscopia a los 2–6 meses para comprobarla. Con la información actual es difícil establecer la estrategia de vigilancia en pacientes con pólipos serrados. Se ha sugerido que la estrategia debe basarse en el tamaño, número y localización siguiendo las guías de los adenomas convencionales20. Así, en los pacientes con pólipos serrados que presenten displasia citológica o tamaño > 1cm o localización proximal se recomienda la realización de una colonoscopia a los 3 años21. Sin embargo se necesitan más estudios para evaluar la estrategia apropiada de vigilancia de acuerdo a los diferentes subtipos de pólipos serrados, y las recomendaciones actuales más que basadas en la evidencia están establecidas por consenso.
Como se ha mencionado, actualmente se considera que las lesiones serradas son las precursoras de la tercera parte de los CCR. Sin embargo, el intervalo de seguimiento adecuado en estas lesiones no está bien establecido. Con este objetivo se presentó un estudio22 para determinar la prevalencia y el tiempo de presentación de lesiones metacrónicas basándose en el tipo de lesiones serradas. Se incluyó un total de 105 pacientes que habían presentado una lesión serrada entre 2008 y 2011 y se les realizó una colonoscopia de vigilancia, dividiéndose la cohorte en 4 grupos de acuerdo con los hallazgos de la colonoscopia basal: a) AS solo (AS, n=15); b) PH grande, > 10mm (PHG, n=9); c) PH medio, entre 5 y 9mm (PHM, n=43), y d) lesiones serradas y adenomas concomitantes (SAC, n=38). El tiempo medio de vigilancia fue de 33,7 meses. La proporción de pacientes con pólipos metacrónicos (serrados o adenomas) fue del 46,7% (AS), 55,6% (PHG), 30,2% (PHM) y 60,5% (SAC), respectivamente (p=0,049). Se observó una diferencia significativa en el tiempo de recurrencia de los pólipos entre los 4 grupos, con la menor tasa en el grupo de PHM (log rank; p=0,006). Sin embargo, la proporción de pacientes con adenomas en el seguimiento fue del 20% en el grupo AS, 33,3% en el grupo PHG, 25,6% en el grupo PHM y 52,6% en el grupo SAC, siendo las diferencias estadísticamente significativas (p=0,04). Con estos resultados, los autores concluyen que los pacientes con pólipos serrados y PHG tienen una alta tasa de recurrencia de pólipos en la colonoscopia de seguimiento; sin embargo, la tasa de detección de adenomas en estos pacientes es más baja que en la de los que tenían adenomas sincrónicos en la colonoscopia basal.
Biología tumoralHay evidencia creciente de que algunos de los CCR de intervalo son resultado de vías de carcinogénesis alternativas. En este sentido, los CCR de intervalo presentan más frecuentemente inestabilidad de microsatélites, fenotipo metilador y menos mutación de KRAS23–25. Según esta línea de carcinogénesis se ha implicado a los pólipos serrados como una de las lesiones precursoras más relevantes en el CCR de intervalo. Se ha establecido una relación clínica y molecular entre los pólipos serrados y el CCR esporádico, especialmente con los tumores con inestabilidad de microsatélites (IMS). Los pólipos serrados, en particular los ASS, están localizados habitualmente en el colon proximal y comparten características moleculares con el cáncer esporádico con IMS, que está causado por la metilación somática del gen MLH1. Estas características incluyen una alta frecuencia de metilación somática de diversos genes supresores de tumores (conocido como fenotipo metilador o CIMP por sus siglas en inglés, CpG island methylator phenotype) y la presencia de mutaciones en el gen BRAF. Estas 2 características somáticas constituyen la base molecular de la “vía serrada” de la carcinogénesis12.
Nuevas técnicas endoscópicasA pesar de que la colonoscopia es la mejor técnica disponible, hasta un 15% de las lesiones de tamaño < 1cm pueden pasar desapercibidas, de ahí la importancia de mantener unos criterios de calidad26.
Con el objetivo de mejorar la tasa de detección de pólipos, se han desarrollado diferentes técnicas complementarias, entre las cuales se encuentran la cromoendoscopia o el narrow band imaging. Este año se presentó un estudio multicéntrico27 que comparaba la eficiencia del colonoscopio convencional (CC, es decir con un ángulo de visión de 140–170°) con el colonoscopio FUSE, que tiene un ángulo de visión de 330°, siendo el objetivo principal la comparativa entre tasas de adenomas no detectados entre ambas técnicas. Se incluyeron 185 pacientes entre enero de 2012 y marzo de 2013, a los que se les realizaron el mismo día ambos procedimientos (por el mismo endoscopista). A 88 pacientes se les realizó primero CC, detectándose 28 adenomas, y 20 adenomas adicionales al realizar posteriormente el procedimiento Fuse, lo cual representó una tasa de adenomas no detectados del 41,7% para la primera prueba. Por otro lado se detectaron un total de 61 adenomas en los 97 pacientes sometidos inicialmente al procedimiento Fuse, con 5 adenomas adicionales al realizarse la CC posterior; por tanto, la tasa de adenomas no detectados para el procedimiento Fuse fue de 7,6% (p<0,0001). No hubo diferencias significativas en cuanto al tiempo de intubación cecal (CC: 5,1min, Fuse: 4,8min), pero sí en cuanto al tiempo de retirada (CC: 5,6min, Fuse: 6,2min; p<0,0001). Estos resultados abren la puerta a una alternativa endoscópica para mejorar la calidad y rentabilidad del procedimiento.
Alternativas a la colonoscopiaSi bien la colonoscopia se considera el “patrón oro” para visualizar el colon, hay otras exploraciones, como la colonografía o la cápsula colonoscópica, con el objetivo de visualizar el colon de una forma menos invasiva, sin el riesgo de sangrado, perforación o de la sedación, además, en el caso de la cápsula, libre de radiación. De cara a evaluar la eficacia de la nueva generación de cápsula colonoscópica, pillcam COLON2, el grupo de Rex28 realizó un estudio prospectivo que evaluó la seguridad y precisión de la CCE en comparación con la colonoscopia estándar en la detección de pacientes con lesiones > 6mm. Participaron 16 centros con un total de 884 pacientes, a quienes tras 4–6 semanas de ser sometidos a la cápsula se les realizaba una CC. La correlación de los hallazgos se basó en la localización de la lesión y el tamaño, clasificándose en categorías de > 6 o > 10mm. La media de edad fue de 57,3 años, el 55% eran mujeres. Se reportó un solo episodio adverso tras la colonoscopia (dolor abdominal, que se resolvió al siguiente día). De los 884 pacientes, 689 fueron incluidos en el análisis de pacientes con adenomas y 695 con pólipos (adenomas y pólipos serrados). La sensibilidad de la cápsula para detectar adenomas > 6 y > 10mm fue del 88 (IC del 95%, 82–93) y el 92% (IC del 95%, 82–97), respectivamente; la especificidad fue del 82 (IC del 95%, 80–83) y el 95% (IC del 95%, 94–95). En cuanto a la detección de cualquier pólipo > 6 y > 10mm, la sensibilidad de la cápsula fue del 81 (IC del 95%, 77–84) y el 80% (IC del 95%, 74–86), respectivamente, y la especificidad fue del 93 (IC del 95%, 91–95) y el 97% (IC del 95%, 96–98).
Con estos hallazgos, los autores sugieren que la pillcam COLON2 tiene una capacidad de detección de adenomas comparable a la de la colonografía, siendo una opción adecuada para pacientes que no sean candidatos a una colonoscopia.
Como alternativa en la detección de neoplasias colorrectales de intervalo entre colonoscopias se ha propuesto la realización del test inmunológico de sangre oculta en heces (SOHi), y con la intención de evaluar su eficacia se presentó un estudio29 que incluyó 1.260 pacientes que se realizaron una colonoscopia tras un test positivo de SOHi, y que se dividieron en 3 grupos: a) grupo A (n=103), contaban con una colonoscopia basal y todavía no cumplían el tiempo establecido para la colonoscopia de seguimiento; b) grupo B (n=48), contaban con una colonoscopia basal y la fecha de la colonoscopia de seguimiento ya se había cumplido, y c) grupo C (n=1.109), sin colonoscopia previa. Los esquemas de vigilancia se establecieron basándose en la guía americana (US multi-society task force) de 2012. El tiempo promedio de la colonoscopia previa era de 3,73 y 9,21 años en los grupos A y B, respectivamente. La incidencia de lesiones neoplásicas fue significativamente menor en el grupo A en comparación con los otros 2 grupos (el 33, 56,3 y 51,6%, respectivamente), así como de adenomas avanzados (el 8,7, 16,7 y 19,1%, respectivamente). Sin embargo, la incidencia de cáncer invasivo en el grupo A, si bien fue más bajo, no lo fue de forma significativa (el 2,9, 4,2 y 5%, respectivamente). Con estos resultados, los autores proponen que el test SOHi puede ser una herramienta complementaria para la detección de cáncer de intervalo.
ConclusionesSi bien la colonoscopia es la técnica de elección para el diagnóstico del CCR, la evidencia obliga a ser conscientes de los CCR de intervalo y, sobre todo, de la identificación de las posibles causas de estas neoplasias. Los resultados expuestos anteriormente sugieren que la mayoría de los CCR de intervalo son secundarios a problemas en la identificación de lesiones en la colonoscopia basal y, por tanto, causas potencialmente prevenibles haciendo hincapié en la calidad de la endoscopia, con la finalidad de aumentar la detección y correcta resección de todas las lesiones precursoras, con una especial atención a lesiones planas y proximales.
Conflicto de interesesLa autora declara no tener ningún conflicto de intereses.