Se ha propuesto que métodos no invasivos pueden remplazar la biopsia hepática en el diagnóstico del daño tisular en pacientes con hepatopatía autoinmune (EHA). Este estudio evalúa el rendimiento diagnóstico y grado de concordancia entre el índice Ast to Platelet Ratio Index (APRI) y la biopsia hepática en el diagnóstico de cirrosis en estos pacientes.
Material y métodosEn una cohorte de pacientes con EHA se determinó el valor del índice APRI y los resultados de la biopsia hepática según la escala METAVIR. Se evaluó el área bajo la curva (AUC) y la concordancia entre un valor de APRI > 2 y un puntaje METAVIR F4 como marcadores de la presencia de cirrosis hepática mediante un estadístico de kappa.
ResultadosSe incluyeron 70 pacientes (51 ± 13 años). Las hepatopatías autoinmunes más frecuentes fueron la cirrosis biliar primaria (CBP) (40%), Hepatitis autoinmune (HAI) (24,3%) y el síndrome de sobreposición HAI–CBP (32,9%). Se confirmó cirrosis por biopsia en 16 pacientes (22,9%); 15 pacientes (21,4%) presentaron índice APRI > 2 (cirrosis) y solo seis cumplieron ambos criterios. El AUC del APRI fue de 0,77 (IC 95% 0,65-0,88). La concordancia entre las pruebas fue baja para un punto de corte APRI > 2 (kappa 0,213; IC 95% 0,094 - 0,332), o para puntos de corte > 1,5, > 1 o > 0,5 (kappa 0,213, 0,255, 0,257, respectivamente).
ConclusionesNuestros resultados sugieren que existe un pobre acuerdo entre el resultado del APRI y la biopsia hepática en el diagnóstico de cirrosis en pacientes con EHA, por lo tanto, no se debe utilizar como método diagnóstico único para determinar la presencia de cirrosis.
It has been proposed that non-invasive methods may replace liver biopsy for the diagnosis of tissue damage in patients with autoimmune liver disease (ALD). The aim of this study was to determine diagnostic performance and degree of concordance between the APRI index and liver biopsy for diagnosing cirrhosis in these patients.
Material and methodsIn a cohort of patients with ALD, the value of the APRI index and liver biopsy results were determined according to the METAVIR score. The AUC and the degree of concordance between an APRI value >2 and a METAVIR score of F4 were evaluated as markers of liver cirrhosis, through a kappa statistic.
ResultsIn total, 70 patients (age 51 ± 13 years) were included. The most common autoimmune liver diseases were primary biliary cirrhosis (PBC) (40%), autoimmune hepatitis (AIH) (24.3%) and AIH-PBC overlap syndrome (32.9%). Cirrhosis was confirmed by biopsy in 16 patients (22.9%). 15 patients (21.4%) had an APRI index >2 (Cirrhosis) and only six met both criteria. The AUC of the APRI was 0.77 (95% CI 0.65-0.88). The degree of concordance between the tests was low for an APRI cut-off point >2 (kappa 0.213; 95% CI 0.094-0.332), as well as for cut-off points >1.5, >1 and >0.5 (kappa 0.213, 0.255, 0.257, respectively)
ConclusionOur results suggest that there is little concordance between APRI and liver biopsy for the diagnosis of cirrhosis in patients with ALD. It should therefore not be used as a single diagnostic method to determine cirrhosis.
Las enfermedades hepáticas autoinmunes (EHA), incluyendo la hepatitis autoinmune (HAI), la colangitis biliar primaria (CBP), la colangitis esclerosante primaria (CEP) y los síndromes de sobreposición, son enfermedades crónicas, que pueden potencialmente progresar a cirrosis, falla hepática e incluso a la muerte1–6.
El grado de fibrosis hepática es un factor pronóstico cuantificable en el desarrollo de cirrosis y otras complicaciones hepáticas7–9 por lo que las guías internacionales consideran esencial su evaluación para guiar las estrategias terapéuticas1,4,5.
Si bien la biopsia hepática ha sido considerada como el «estándar de oro» para la evaluación del daño tisular en pacientes con hepatopatías crónicas (HC)7–10, es un procedimiento costoso, invasivo y con riesgo de presentar complicaciones10,11. Por otra parte, ésta proporciona una muestra pequeña y potencialmente no representativa del grado de fibrosis hepática7,12, y existe una alta variabilidad interobservador entre los patólogos de hasta un 10-20%8,12. Estas limitaciones han propiciado el desarrollo de diversos métodos no invasivos con miras a lograr una evaluación temprana de la fibrosis hepática7,11.
Entre los más frecuentemente empleados se encuentra el índice APRI, propuesto por Wai et al., que ha ganado aceptación por ser un método no invasivo y sencillo, basado en la medición de las transaminasas y el conteo de plaquetas12. El índice APRI mostró ser un buen predictor de fibrosis significativa y cirrosis en pacientes con esteatohepatitis no alcohólica y hepatitis C, con un área bajo la curva ROC (AUROC) del APRI en predicción de fibrosis significativa y cirrosis del 80 y 89%, respectivamente12,13. Sin embargo este rendimiento diagnóstico es menor a la hora de predecir la fibrosis en pacientes con infección por el virus B14.
Hasta el momento la información con respecto al rendimiento del índice APRI como predictor de cirrosis hepática en pacientes con EHA es limitada, por lo que las guías europeas para el manejo de la HAI1 refieren que aún no es posible emitir una recomendación para su uso, y las guías Americanas para el manejo de la CEP no la contemplan dentro de sus recomendaciones para el seguimiento o manejo6. El objetivo del presente estudio es evaluar el rendimiento diagnóstico del índice APRI para el diagnóstico de cirrosis en pacientes con EHA y evaluar concordancia del APRI y la biopsia hepática como prueba diagnóstica de cirrosis en estos pacientes.
Pacientes y métodosSe realizó un análisis retrospectivo, tomando como universo poblacional los pacientes con EHA crónica atendidos en consulta externa del servicio de Hepatología del Hospital Universitario San Ignacio, un centro de referencia situado en Bogotá D.C (Colombia), durante el periodo comprendido entre el 1 de enero de 2016 y el 25 de junio de 2019. Se incluyeron pacientes mayores de 18 años, con diagnóstico EHA utilizando los criterios establecidos por los consensos internacionales para el diagnóstico de HAI1, CBP4, CEP6 o síndromes de sobreposición autoinmune15. Los pacientes incluidos debían contar con química sanguínea, incluyendo transaminasas y plaquetas realizadas lo más próximo a la fecha de realización de la biopsia hepática, siendo el tiempo máximo de un año. Se excluyeron los pacientes a quienes no se realizó biopsia hepática y aquellos con cirrosis con etiología distinta a HAI, CBP o CEP.
Se recolectó información con respecto al tipo de hepatopatía autoinmune de cada paciente (diagnóstico de HA, CBP, CEP), las variables serológicas para el cálculo del índice APRI (AST y conteo plaquetario), el perfil hepático (ALT, fosfatasa alcalina, GGT, bilirrubinas, albumina, y tiempos de coagulación), los niveles de anticuerpos medidos (ANAs, antimitocondriales, anti musculo liso, ANCAS), los niveles de IgG, la presencia o ausencia de estenosis de la vía biliar por colangioresonancia, así como de otras comorbilidades autoinmunes (síndrome de Sjögren, esclerosis sistémica, lupus eritematoso) y enfermedades sistémicas de importancia (hipotiroidismo y diabetes mellitus).
Para el cálculo del APRI se utilizó la fórmula propuesta por Wai et al. (APRI = (nivel AST paciente/AST límite superior normal) x 100 /conteo plaquetario 109/L). El AST y conteo plaquetario fueron tomados después de la biopsia, pero antes del inicio de manejo específico. Se utilizó para el análisis primario un punto de corte > 2 como indicador del diagnóstico de cirrosis12.
En las biopsias hepáticas la fibrosis se estadificó según la escala METAVIR: FH = 0 (no fibrosis), FH = 1 (fibrosis periportal), FH = 2 (fibrosis incompleta de septos), FH = 3 (fibrosis completa de septos), FH = 4 (cirrosis histológica)16.
Se calculó el tamaño de muestra de acuerdo al nomograma de Hong15 (asumiendo una prevalencia marginal 50% de cirrosis en la población estudiada) con un grado de acuerdo entre las dos pruebas bajo la hipótesis nula de 0,9 (90%) y aceptando una diferencia entre la proporción de acuerdo aceptable de 0,1 (10%), para un tamaño muestral de 70 pacientes.
La diferencia entre medianas del puntaje de la escala APRI de acuerdo con el grado de fibrosis se comparó mediante el estadístico de Kruskall-Wallis, tomando en cuenta que los datos no cumplieron con el supuesto de normalidad. Las diferencias significativas se determinaron mediante una prueba U-Mann-Whitney como un análisis post hoc, realizando un ajuste de Bonferroni, considerando que se realizaron comparaciones múltiples. Se determinó el área bajo la curva ROC para determinar la capacidad predictiva del APRI con respecto a la biopsia hepática, prueba considerada como estándar de referencia para el diagnóstico de cirrosis. La concordancia entre las dos pruebas se evaluó mediante un estadístico de kappa simple. Los resultados se interpretan de acuerdo con los criterios de Landis y Koch de la siguiente manera: por encima de 0,8 grado excelente, entre 0,61 y 0,8 bueno, entre 0,41 y 0,6 moderado, entre 0,2 y 0,4 bajo y menor de 0,2 mínimo. Todos los análisis estadísticos fueron realizados utilizando el paquete estadístico Stata 15.
Al ser un estudio retrospectivo se consideró que no requería diligenciamiento de consentimiento informado. El estudio fue aprobado por el comité de ética de nuestra institución.
ResultadosDe un total de 474 pacientes manejados por el servicio ambulatorio de hepatología con diagnóstico de EHA, 70 pacientes cumplieron los criterios de inclusión y fueron tenidos en cuenta para el análisis. La media de edad fue de 51 años (DE ± 13), siendo la mayoría mujeres (88,6%). La colangitis biliar primaria (CBP) fue la hepatopatía autoinmune más frecuente con un total de 28 pacientes (40%); 24 pacientes (34,3%) tenían enfermedades autoinmunes diferentes a la hepatopatía. Para la CBP, las comorbilidades autoinmunes más frecuentes fueron las enfermedades esclerosantes (14,3%) y la artritis reumatoide (7,2%), a diferencia de la sobreposición (HAI+CBP) donde la comorbilidad más frecuente fue el síndrome de Sjögren (17,4%). Las características clínicas y demográficas se presentan en la tabla 1.
Descripción de la muestra
| Características | n = 70 |
|---|---|
| Sexo (femenino), n (%) | 62 (88,6) |
| Edad (años), media (DE) | 51 (13) |
| Hepatopatía crónica autoinmune, n (%) | |
| Colangitis biliar primaria | 28 (40) |
| Sobreposición (HAI+CBP) | 23 (32,9) |
| Hepatitis autoinmune | 17 (24,3) |
| Colangitis esclerosante primaria | 1 (1,4) |
| Sobreposición (HAI+CBP+CEP) | 1 (1,4) |
| Comorbilidades, n (%) | 38 (54,3) |
| Enfermedad autoinmune | 24 (34,3) |
| Tipo de enfermedad autoinmune** | |
| Más de una condición autoinmune | 7 (29,1) |
| Síndrome de Sjögren | 6 (25) |
| Esclerosis sistémica | 3 (12,5) |
| Artritis reumatoide | 2 (8,3) |
| Colitis ulcerativa*** | 2 (8,3) |
| Lupus eritematoso sistémico | 1 (4,2) |
| Trombocitopenia Inmune | 1 (4,2) |
| Síndrome antifosfolípido | 1 (4,2) |
| Enfermedad de tejido conectivo no diferenciado | 1 (4,2) |
| Otras | 15 (21,4) |
| Hipotiroidismo | 8 (11,4) |
| Hipertensión arterial | 5 (7,1) |
| Diabetes mellitus tipo 2 | 2 (2,9) |
| Enfermedad tromboembólica venosa | 2 (2,9) |
| Tabaquismo | 1 (1,4) |
| Virus de inmunodeficiencia humana | 32 (45,7) |
| Sin comorbilidades, n (%) | |
DE: Desviación estándar, CBP: Colangitis biliar primaria, HAI: Hepatitis autoinmune, CEP: Colangitis esclerosante primaria; n = Tamaño muestra; % = porcentaje.
* Los dos pacientes con estenosis de la vía biliar correspondían a aquellos que tenían CEP
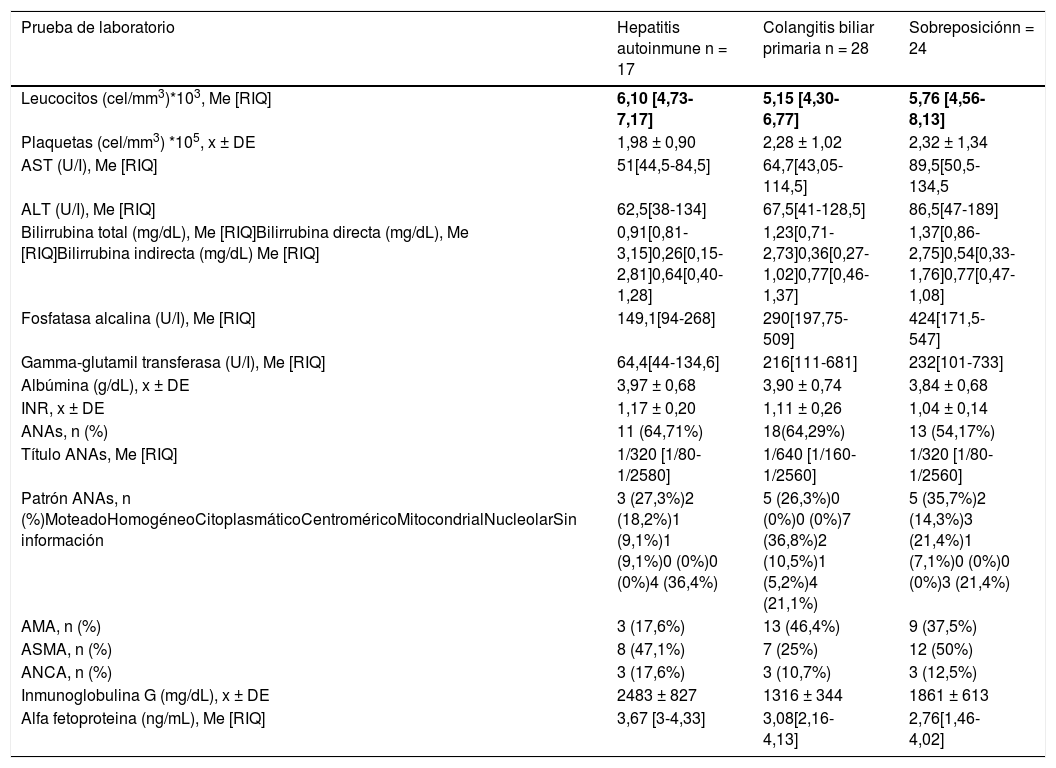
Los conteos leucocitarios y plaquetarios fueron similares entre los distintos tipos de hepatopatías crónicas autoinmunes. Los niveles de transaminasas, fosfatasa alcalina y gamma-glutamil transferasa se encontraban más elevados en el grupo de sobreposición autoinmune, así como los niveles de bilirrubinas, los cuales también están elevados en el grupo de colangitis biliar primaria. Los ANAs y antimitocondriales fueron positivos en más pacientes del grupo de colangitis biliar primaria (ANAs = 67,9%, AMA = 46,4%), mientras que los ASMA fueron positivos en más pacientes del grupo de sobreposición y HAI (50% y 47,1%, respectivamente). En cuanto al patrón de ANAs, el patrón moteado fue el más frecuente en HAI y los síndromes de superposición, mientras que en CBP fue el patrón centromérico (tabla 2).
Características de laboratorio por tipo de hepatopatía crónica autoinmune
| Prueba de laboratorio | Hepatitis autoinmune n = 17 | Colangitis biliar primaria n = 28 | Sobreposiciónn = 24 |
|---|---|---|---|
| Leucocitos (cel/mm3)*103, Me [RIQ] | 6,10 [4,73-7,17] | 5,15 [4,30-6,77] | 5,76 [4,56-8,13] |
| Plaquetas (cel/mm3) *105, x ± DE | 1,98 ± 0,90 | 2,28 ± 1,02 | 2,32 ± 1,34 |
| AST (U/I), Me [RIQ] | 51[44,5-84,5] | 64,7[43,05-114,5] | 89,5[50,5-134,5 |
| ALT (U/I), Me [RIQ] | 62,5[38-134] | 67,5[41-128,5] | 86,5[47-189] |
| Bilirrubina total (mg/dL), Me [RIQ]Bilirrubina directa (mg/dL), Me [RIQ]Bilirrubina indirecta (mg/dL) Me [RIQ] | 0,91[0,81-3,15]0,26[0,15-2,81]0,64[0,40-1,28] | 1,23[0,71-2,73]0,36[0,27-1,02]0,77[0,46-1,37] | 1,37[0,86-2,75]0,54[0,33-1,76]0,77[0,47-1,08] |
| Fosfatasa alcalina (U/I), Me [RIQ] | 149,1[94-268] | 290[197,75-509] | 424[171,5-547] |
| Gamma-glutamil transferasa (U/I), Me [RIQ] | 64,4[44-134,6] | 216[111-681] | 232[101-733] |
| Albúmina (g/dL), x ± DE | 3,97 ± 0,68 | 3,90 ± 0,74 | 3,84 ± 0,68 |
| INR, x ± DE | 1,17 ± 0,20 | 1,11 ± 0,26 | 1,04 ± 0,14 |
| ANAs, n (%) | 11 (64,71%) | 18(64,29%) | 13 (54,17%) |
| Título ANAs, Me [RIQ] | 1/320 [1/80-1/2580] | 1/640 [1/160-1/2560] | 1/320 [1/80-1/2560] |
| Patrón ANAs, n (%)MoteadoHomogéneoCitoplasmáticoCentroméricoMitocondrialNucleolarSin información | 3 (27,3%)2 (18,2%)1 (9,1%)1 (9,1%)0 (0%)0 (0%)4 (36,4%) | 5 (26,3%)0 (0%)0 (0%)7 (36,8%)2 (10,5%)1 (5,2%)4 (21,1%) | 5 (35,7%)2 (14,3%)3 (21,4%)1 (7,1%)0 (0%)0 (0%)3 (21,4%) |
| AMA, n (%) | 3 (17,6%) | 13 (46,4%) | 9 (37,5%) |
| ASMA, n (%) | 8 (47,1%) | 7 (25%) | 12 (50%) |
| ANCA, n (%) | 3 (17,6%) | 3 (10,7%) | 3 (12,5%) |
| Inmunoglobulina G (mg/dL), x ± DE | 2483 ± 827 | 1316 ± 344 | 1861 ± 613 |
| Alfa fetoproteina (ng/mL), Me [RIQ] | 3,67 [3-4,33] | 3,08[2,16-4,13] | 2,76[1,46-4,02] |
AST: aspartato aminotransferasa, ALT: alanino aminotransferasa, INR: International normalized ration, ANAs: anticuerpos antinucleares, AMA: anticuerpos antimitocondriales, ANCA: anticuerpos anticitoplasma de neutrófilo, ASMA: anticuerpos antimúsculo liso.
Me = Mediana; RIQ = Rango Intercuartílico; x = Media; DE = Desviación estándar; n = Tamaño muestra; % = porcentaje.
El grupo de pacientes con colangitis esclerosante primaria tenía un paciente y no permitió establecer cálculos para datos agupados.
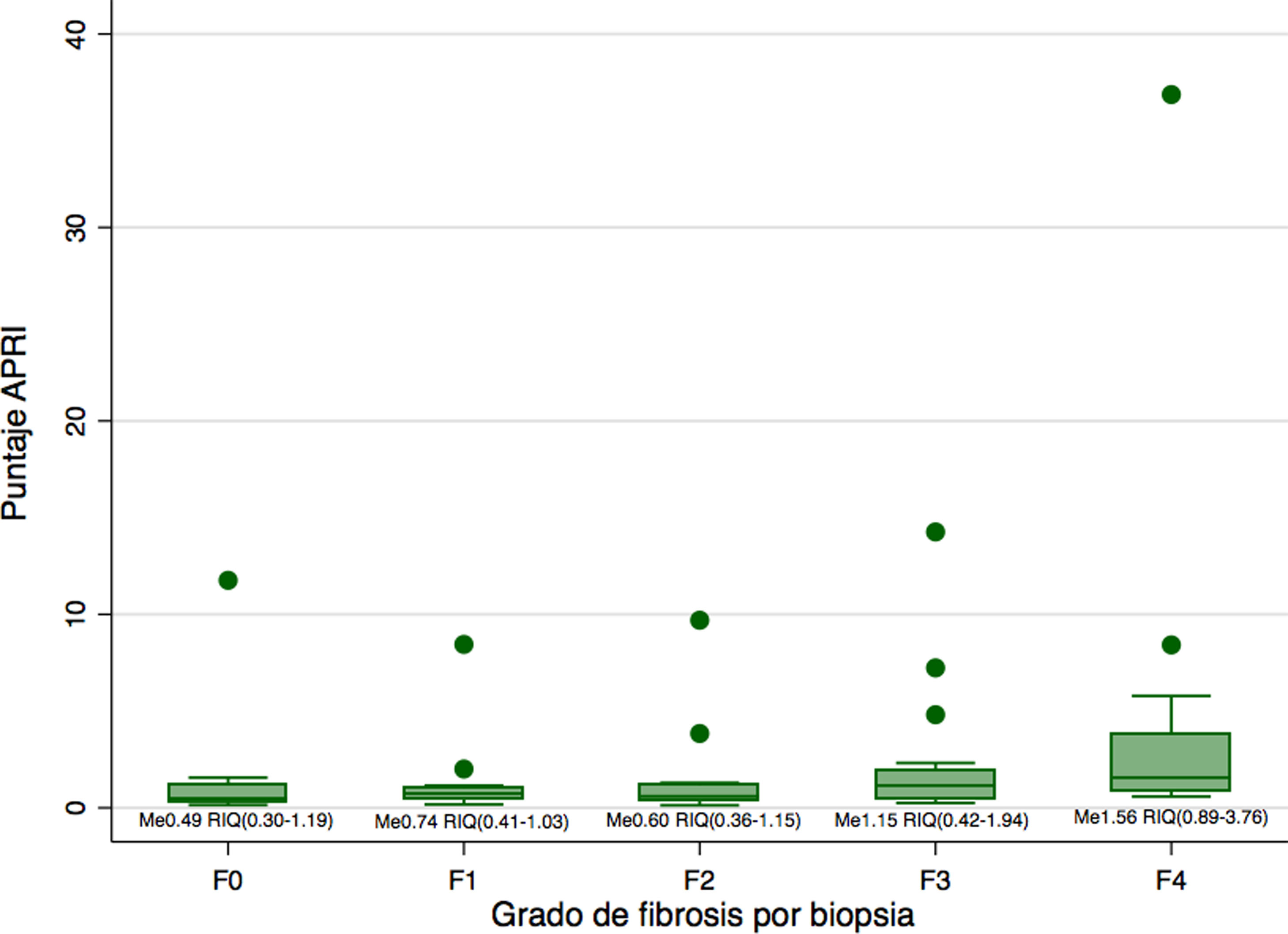
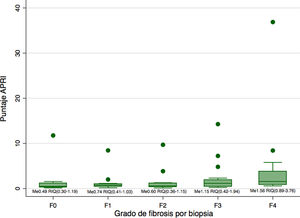
Se confirmó cirrosis por biopsia (escala METAVIR F4) en 16 pacientes (22,9%), fibrosis completa de septos (F3) en 16 pacientes (22,9%), fibrosis incompleta de septos (F2) en 14 pacientes (20%), y fibrosis periportal (F1) en 16 pacientes (22,9%), mientras que en ocho pacientes (11,4%) se observó ausencia de fibrosis por el resultado de la biopsia (escala METAVIR F0). La distribución del puntaje de APRI según grado de fibrosis en biopsia se encuentra en la figura 1. Solo seis pacientes tuvieron simultáneamente escala METAVIR F4 y puntaje de APRI mayor de 2 simultáneamente.
Al comparar la mediana de los puntajes de APRI entre las diferentes categorías de fibrosis, se observó que existía una diferencia en la mediana de al menos una pareja de resultados (Kruskall-Wallis 0,0148). Dicha diferencia solo fue significativa entre la categoría F4 y F0 (p = 0,02), F4 y F1 (p< 0,01) y F4 y F2 (p< 0,01). Sin embargo, las diferencias no fueron significativas tras aplicar el ajuste de Bonferroni.
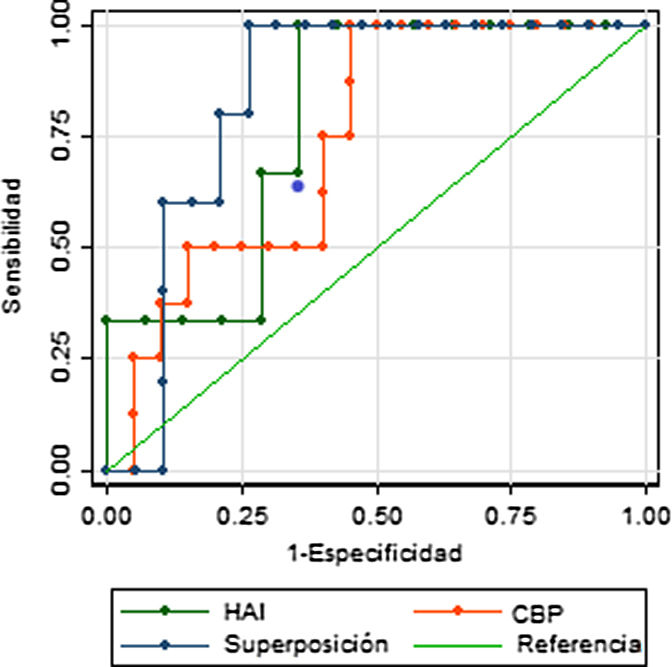
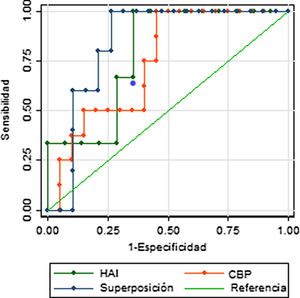
La evaluación de la capacidad predictiva del APRI como herramienta para la detección de cirrosis en EHA, mostró un valor del área bajo la curva (AUC) de 0,77 (IC 95% 0,65-0,88), con valores similares al analizar individuamente los subgrupos según la patología específica: para hepatitis autoinmune el AUC fue de 0,79 (IC 95% 0,52-1), para colangitis biliar primaria de 0,74 (IC 95% 0,55-0,93) y para sobreposición fue de 0,84 (IC 95% 0,68-1). La sensibilidad del APRI, utilizando como punto de corte un valor de 2 fue del 37,5% (IC 95% 15,2%-64,6%) y la especificidad del 83,3% (IC 95% 70,7%-92,1%) (Figura suplementaria 1). Al seleccionar el punto de corte con simultáneamente mayor sensibilidad y especificidad determinamos un valor de 0,835, el cual tiene una sensibilidad de 87,5% (IC 95% 61,7%-98,4%) y especificidad de 61,1% (IC 95% 46,9%-74,1%).
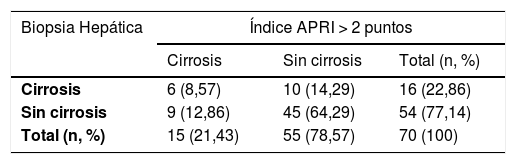
El grado de concordancia entre el índice APRI (> 2) y la biopsia hepática (METAVIR F4), para la población total, fue bajo (kappa 0,213; IC 95% 0,094-0,332 p = 0,07) (tabla 3). Al cambiar el punto de corte del índice APRI a un puntaje > 1,5 (kappa 0,255; IC 95% 0,137-0,373 p = 0,03), o > 1 (kappa 0,257; IC95% 0,149-0,365 p = 0,02), o > 0,5 (kappa 0,253; IC 95% 0,174-0,333 p = 0,001) la concordancia fue igualmente baja. El grado de concordancia entre el índice APRI (> 2) y la biopsia hepática (METAVIR F4), al interior de cada patología individual, mostró valores de kappa consistentemente por debajo de 0,4.
Coeficiente kappa para concordancia entre índice APRI y biopsia hepática
| Biopsia Hepática | Índice APRI > 2 puntos | ||
|---|---|---|---|
| Cirrosis | Sin cirrosis | Total (n, %) | |
| Cirrosis | 6 (8,57) | 10 (14,29) | 16 (22,86) |
| Sin cirrosis | 9 (12,86) | 45 (64,29) | 54 (77,14) |
| Total (n, %) | 15 (21,43) | 55 (78,57) | 70 (100) |
Kappa 0,213 (IC 95% 0,094-0,332)
El presente estudio evalúa el rendimiento diagnóstico del índice APRI para el diagnóstico de cirrosis en pacientes con EHA incluyendo pacientes con HAI, CBP y síndromes de sobreposición, demostrando que tiene una capacidad predictiva y especificidad moderadas, con baja sensibilidad. Adicionalmente demostramos un bajo nivel de acuerdo entre un valor de APRI > 2 y la biopsia hepática para el diagnóstico de cirrosis (METAVIR F4), datos que sugieren que estos resultados no pueden considerarse como clínicamente equivalentes en este grupo de pacientes.
La mayoría de los pacientes fueron mujeres, lo que es compatible con lo reportado en otros estudios, donde predomina este género en la mayoría de las hepatopatías (a excepción de la CEP, en donde se ha visto mayor frecuencia en hombres) (2–4,6). Dentro de las EHA, la CBP fue la más frecuente, seguida por la sobreposición HAI-CBP, la HAI, la CEP, y la sobreposición HAI-CBP-CEP, lo cual es consistente con lo mencionado en la literatura1,6.
Encontramos una alta frecuencia de pacientes con patologías autoinmunes diferentes a la hepatopatía, en donde el 29,1% de los pacientes con comorbilidades presentaron más de una enfermedad autoinmune entre las que se destacan el síndrome de Sjögren, la esclerosis sistémica, el lupus eritematoso sistémico y la artritis reumatoide, asociación que ha sido descrita en la literatura1,4. El único paciente con CEP tenía además colitis ulcerativa, patología de alta prevalencia en esta enfermedad6.
Nuestros datos demostraron que la mediana de los valores de APRI fue discretamente mayor entre los pacientes con cirrosis (METAVIR F4) comparado con los pacientes sin fibrosis o con fibrosis leves (METAVIR F0, F1 y F2), sin embargo, esta diferencia no fue estadísticamente significativa tras el ajuste por comparaciones múltiples. Adicionalmente se encontró que un punto de corte de APRI de 2 tiene una sensibilidad muy baja (37%) para el diagnóstico de cirrosis, menor aún que la reportada por Shanshan (70%) en una revisión sistemática que incluyo cuatro estudios previos en pacientes con HAI. Lo que sugiere que este punto de corte detectaría solo una mínima proporción de los pacientes con cirrosis. La sensibilidad fue discretamente mayor con un punto de corte de 0,84, por lo que sugerimos este valor para pacientes con EHA.
En el presente estudio el AUC para la detección de cirrosis en pacientes con EHA fue de 0,77. Este dato es similar a lo reportado en estudios previos, tales como el llevado a cabo por Yuan et al., que reportó un área bajo la curva de 0,798 (0,69-0,90) para la detección de cirrosis mediante índice APRI17 en pacientes con HAI, y a otros estudios llevados a cabo en población predominantemente europea y asiática18–20. Estos hallazgos sugieren que la capacidad diagnóstica del APRI para el diagnóstico de cirrosis no es diferente en población latinoamericana, a pesar de que se ha descrito un comportamiento clínico diferente en esta población21,22. Adicionalmente encontramos AUC similares para hepatitis autoinmune, colangitis biliar primaria y sobreposición, sugiriendo que las características operativas del APRI son similares, e igualmente limitadas para las diferentes EHA.
Nuestros resultados demuestran adicionalmente una baja concordancia entre el valor del índice APRI (con un punto de corte > 2) y la biopsia hepática (escala de METAVIR F4) en el diagnóstico de cirrosis en la población de pacientes con enfermedad hepática autoinmune (κ 0,213; IC 95% 0,094-0,332 p = 0,07). Cuando se disminuyó el punto de corte del índice APRI a valores menores (valores previamente propuestos por otros autores), se sigue manteniendo una baja concordancia entre estas dos pruebas en este grupo de pacientes, lo que sugiere que estos resultados no pueden considerarse como clínicamente equivalentes. Hallazgos similares ya habían sido reportados por Anastasiou et al. quienes demostraron que no existía una correlación significativa entre el APRI y el grado de fibrosis obtenido en la biopsia hepática en pacientes con HAI (coeficiente de correlación de Pearson de 0,163, valor de p = 0,25)23. Los hallazgos presentes refuerzan esta misma conclusión en las demás EHA.
Este es el primer estudio que evalúa la capacidad predictiva del APRI en pacientes con síndromes de sobreposición y el primero que reporta la concordancia entre un método no invasivo serológico y la biopsia hepática en el diagnóstico de cirrosis en múltiples enfermedades hepáticas autoinmunes, demostrando que sus resultados no pueden considerarse como clínicamente equivalentes. Son necesarios nuevos estudios para evaluar si la combinación del APRI con otros marcadores serológicos (como el FIB4 score) o con el fibroscan mejoran la concordancia con los resultados de la biopsia en estas patologías.
Existen algunas limitaciones que deben tenerse en cuenta. Si bien se realizó un cálculo estadístico del tamaño de muestra con base en la prevalencia de los pacientes con EHA atendidos en nuestra consulta, el número de pacientes por subgrupo de hepatopatía autoinmune es relativamente pequeño, sin embargo, los resultados son consistentes entre los diferentes subgrupos, lo que fortalece las conclusiones. Adicionalmente, la diferencia de tiempos entre la toma de biopsia y muestra sanguínea fue variable entre pocos días y un año, lo cual podría generar sesgo por longitud de tiempo, sin embargo, en la mayoría de los casos este tiempo fue menor a tres meses, lo que limita el impacto de este riesgo. Se requerirán nuevos estudios a futuro, que incluyan más pacientes de cada patología individual y en los que las dos pruebas (biopsia y APRI) sean realizadas de forma simultánea para confirmar los resultados de este estudio.
ConclusionesLos resultados de este estudio sugieren que existe un pobre acuerdo entre el resultado del APRI y la biopsia hepática para el diagnóstico de cirrosis en pacientes con enfermedad hepática autoinmune. Por lo anterior, consideramos que, a la luz de la evidencia, no es posible en el momento recomendar el uso del APRI como herramienta aislada para diagnóstico de cirrosis en este grupo de pacientes. El diagnóstico deberá, por tanto, considerar el uso simultáneo de otras pruebas no invasivas como la elastografía.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflictos de interesesLos autores declaran no tener ningún conflicto de intereses.