Los tumores de la ampolla de Vater se denominan ampulomas, y se pueden originar sobre cualquiera de los tres epitelios (duodenal, pancreático y biliar) que delimitan la papila. Estos tumores tienen una especial relevancia clínica, por lo que es fundamental realizar un diagnóstico precoz, una estadificación apropiada y un tratamiento correcto. La sintomatología clínica de estos tumores es inespecífica, y no siempre es evidente. Puesto que todos los ampulomas deben resecarse, la controversia surge al intentar establecer qué tipo de resección es la más adecuada. En la actualidad no disponemos de estudios controlados, por lo que debemos individualizar la decisión en función de las características del tumor y del paciente. El tratamiento curativo de estos tumores puede ser endoscópico o quirúrgico. Para los pacientes no tributarios de un tratamiento curativo, se opta por un tratamiento endoscópico paliativo de drenaje.
Tumors of the ampulla of Vater are called ampullary tumors and can arise from any of the three epithelia (duodenal, pancreatic and biliary) that delimit the papilla. These tumors are clinically important and early identification, appropriate staging and proper treatment are essential. The symptoms of these tumors are non-specific and not always evident. All ampullary tumors must be resected but opinions differ on the optimal method of excision. Currently, controlled trials are lacking and consequently the treatment chosen must be individually tailored according to the characteristics of the patient and the tumor. Curative treatment may be endoscopic or surgical. In patients who are not candidates for curative treatment, palliative treatment through drainage can be performed.
La ampolla de Vater es la parte del duodeno donde confluyen y desembocan los conductos biliar y pancreático, y fue descrita inicialmente por Abraham Vater en 17201. La ampolla se abre en el duodeno a través de una pequeña elevación mucosa que conocemos como papila de Vater. Los tumores de la ampolla de Vater se denominan ampulomas, representan el 2% de todos los tumores del tracto digestivo2 y se pueden originar sobre cualquiera de los tres epitelios (duodenal, pancreático y biliar) que conforman la papila. Estos tumores tienen una especial relevancia clínica, por lo que es fundamental realizar un diagnóstico precoz, una estadificación apropiada y un tratamiento correcto. Los ampulomas presentan un mejor pronóstico y una mayor tasa de resecabilidad, en comparación con otros tumores peripapilares, gracias a que presentan síntomas de forma más precoz y a que tienden a ser más diferenciados desde el punto de vista histológico3.
Los tumores de la papila de Vater se pueden clasificar en benignos (adenoma [tubular, tubulovelloso y velloso], lipoma, fibroma, linfangioma, leiomioma y hamartoma) y malignos (adenocarcinoma, linfoma y tumor neuroendocrino o carcinoide). En la papila también pueden metastatizar otros tumores: melanoma maligno, hipernefroma y linfoma. El tumor más frecuente es el adenoma, y su progresión a adenocarcinoma está admitida en el mismo sentido que la secuencia adenoma-carcinoma de los pólipos de colon2,4. El método habitual de estudio histológico con pinza de biopsia ha demostrado sus limitaciones para descartar la presencia de focos de adenocarcinoma5, dado que no es infrecuente la coexistencia de adenoma y adenocarcinoma en el mismo tumor papilar6. A la vista de esta situación, en la actualidad se recomienda la escisión como único método fiable de estudio histológico.
Etiología y sintomatología clínicaLos adenomas de la papila de Vater pueden aparecer de forma esporádica o en el contexto de un síndrome de poliposis familiar. Se ha propuesto que el tabaco y la raza son factores de riesgo de aparición de ampulomas malignos, y se ha especulado sobre la influencia que pueden tener el sobrepeso, la infección por Helicobacter pylori y el antecedente de histerectomía y colecistectomía7. Las neoplasias esporádicas de la papila de Vater inciden en pacientes con edades comprendidas entre los 40 y los 90 años, con un pico de incidencia en torno a los 70 años. Por el contrario, en los pacientes con poliposis familiar, éstos se presentan más precozmente8. El manejo de los adenomas de papila en los pacientes con poliposis familiar es controvertido, ya que la resección del adenoma no elimina el riesgo de aparición de nuevos tumores, por lo que se recomienda la vigilancia endoscópica estricta9. El riesgo de adenocarcinoma de papila de Vater en los pacientes con poliposis familiar es 100 veces mayor que la población general10.
La sintomatología clínica de estos tumores es inespecífica, y no siempre es evidente. Cuando está presente, refleja la obstrucción del conducto biliar o pancreático. Según su frecuencia, el primer síntoma clínico es la ictericia (en un 50% de los casos), seguida por el dolor abdominal más o menos intenso, presente en una tercera parte de los pacientes. Otros síntomas clínicos menos frecuentes son: pancreatitis aguda, anemia ferropénica, hemorragia digestiva, y colangitis. La ictericia fluctuante, secundaria a necrosis tumoral, asociada a hemorragia digestiva es la manifestación clínica que evoca el diagnóstico de ampuloma. Los pacientes con tumores malignos suelen presentar un síndrome constitucional con astenia, anorexia y pérdida de peso. Por otra parte, un 15–30% de estos pacientes tienen asociada una coledocolitiasis secundaria a la colestasis11.
DiagnósticoPruebas de laboratorioLa evaluación de estos pacientes comienza con los estudios de laboratorio, que confirma la obstrucción biliar y/o pancreática. Suele ser frecuente una hiperbilirrubinemia a expensas de la bilirrubina directa, con una modesta elevación de la aspartato aminotransfersa (AST) y la alanino aminotransferasa (ALT), y un pronunciado incremento de los valores de fosfatasa alcalina (FA) y gammaglobulina transferasa (GGT). Esta elevación de las transaminasas se produce en el momento de la obstrucción aguda de la vía biliar, con un posterior descenso rápido a valores normales o próximos a la normalidad. La obstrucción prolongada de la vía biliar ocasiona malabsorción de las vitaminas liposolubles, y aparece un déficit de vitamina K y una prolongación del tiempo de protrombina. Los pacientes con obstrucción pancreática presentan una elevación de los valores de amilasa y lipasa. La presencia de colangitis ocasiona una leucocitosis con neutrofilia.
Ecografía abdominal, tomografía computarizada abdominal y colangiografía por resonancia magnéticaLa identificación de estos tumores en estadio precoz requiere una adecuada sospecha clínica y una pronta evaluación de los pacientes con ictericia. La ecografía abdominal es la primera exploración que se debe realizar, ya que pone de manifiesto una dilatación extrahepática de la vía biliar, así como dilatación del Wirsung, con o sin litiasis, y localiza el lugar de la obstrucción. Su gran ventaja es su gran disponibilidad, la ausencia de irradiación y su bajo coste; pero su mayor inconveniente es que resulta una exploración insuficiente, inadecuada técnicamente, en el 15–20% de los casos. La tomografía computarizada (TC) abdominal desempeña un papel importante en el estudio preoperatorio12, ya que es capaz de detectar tumores con tamaño superior a 2cm. En la actualidad, la TC abdominal helicoidal con contraste oral e intravenoso es la técnica más apropiada para evaluar el área peripapilar; no obstante, al igual que la ecografía abdominal, no permite diagnosticar ampulomas con un tamaño inferior a 2cm. En la actualidad se está dilucidando qué papel que puede desempeñar la colangiografía por resonancia magnética (CRM) en estos casos13; pero hasta la fecha no hay datos que sugieran que la esta técnica posea una utilidad superior a la ecografía y la TC en el diagnóstico de los ampulomas de pequeño tamaño14. Los datos disponibles nos sugieren que debemos solicitar una CRM en los pacientes en quienes la sospecha de obstrucción biliar en la papila requiera una prueba confirmatoria antes de realizar una prueba invasiva.
Colangiopancreatografía retrógrada endoscópicaLa colangiopancreatografía retrógrada endoscópica (CPRE) y la duodenoscopia con un endoscopio de visión lateral son los principales procedimientos diagnósticos para estos tumores, y son de elección para diagnosticar ampulomas de pequeño tamaño, obtener muestras para el estudio histológico, solventar la obstrucción biliar o pancreática, cuantificar el grado de extensión intraductal y decidir si el tumor es tributario de resección endoscópica. La CPRE presenta una sensibilidad para detectar malignidad del 69%, que se incrementa al 77% si las biopsias endoscópicas se realizan tras la esfinterotomía15. El aspecto endoscópico no permite diferenciar entre tumores benignos y malignos, pero hay una serie de signos que sugieren malignización: induración, ulceración y friabilidad15. No se dispone de una detallada descripción de estos tumores, pero pueden clasificarse en tres tipos: polipoideo, ulcerado o mixto; además, el tumor polipoideo puede ser de crecimiento extraductal o intraductal. Otras veces puede adoptar la forma de papila aumentada de tamaño con corona preservada («papila embarazada»). La CPRE presenta limitaciones para determinar el crecimiento intraductal por colagiografía, a menos que sea muy patente. En estos casos es muy aconsejable la realización de una esfinterotomía endoscópica amplia, ya que permite una colangioscopia y una evaluación del grado de extensión intraductal del tumor16, especialmente en los pacientes con dilatación del colédoco en ausencia de litiasis, y en los pacientes con dilatación inexplicable del Wirsung.
Ultrasonografía endoscópicaLa ultrasonografía endoscópica (USE) es tan sensible como la CPRE en el diagnóstico de los tumores de papila de Vater17; no obstante, ambas técnicas no son suficientes para indicar con seguridad una ampulectomía endoscópica o quirúrgica15. La gran utilidad de la USE radica en ser la prueba más sensible para determinar el estadío T del tumor, ya que en numerosas series se ha constatado una sensibilidad del 70–90%; sin embargo, su fiabilidad se reduce a la hora de establecer el grado de afectación ganglionar14,18,19, sabiendo que la presencia de invasión linfática (adenopatías) es más frecuente en los casos de invasión intraductal (24%) y en los tumores ulcerados (69%)20. La USE, al igual que la CPRE, es útil para determinar la extensión intraductal del tumor, aunque con más capacidad discriminatoria que ésta21. Las indicaciones actuales de la USE son el estudio de extensión preoperatorio y la identificación de focos de invasión ocultos en las neoplasias de aspecto benigno. La realización de una USE no es necesaria en todos los pacientes con tumores de la papila de Vater; de hecho, la mayoría de los expertos no creen necesaria la realización de esta técnica si la lesión tiene un tamaño inferior a 1cm, o si no hay signos macroscópicos de malignidad22. Sin embargo, si la lesión tiene un tamaño superior a 1cm, se debería realizar una USE para determinar si hay una contraindicación para un tratamiento endoscópico con intención curativa (tumores que invaden la pared duodenal o el tejido pancreático, y presencia de un crecimiento intraductal amplio).
Estudio histológicoLas características anatomopatológicas de la papila y las limitaciones en la toma de biopsia, hace que el diagnóstico histológico preoperatorio correcto mediante endoscopia no sea sencillo ni fiable. La realización de macrobiopsias y citología por cepillado ayudan en la precisión diagnóstica; pero su adecuada catalogación exige la resección completa del tumor y su biopsia extemporánea, ya que se detectan focos de adenocarcinoma en el 15–50% de los adenomas resecados23. Se producen falsos negativos en el 25–60% de los pacientes con adenocarcinoma, y la tasa de fiabilidad de la biopsia es del 45–80%24,25, por lo que la ausencia de adenocarcinoma en una biopsia de adenoma de papila no excluye la presencia de cáncer. Estos datos abogan por la resección de los tumores de papila como único método fiable para el estudio histológico. Para mejorar la rentabilidad diagnóstica de la biopsia se han propuesto las siguientes estrategias: realizar la biopsia diferida (10 días) a la esfinterotomía11, realizar un mínimo de 6 biopsias26, realizar una biopsia intraductal, practicar estudios de inmunohistoquímica (p5327 y K-ras28), efectuar un estudio con citometría de flujo para detectar aneuploidía, e incluso emplear endoscopios de magnificación con NBI, para poder predecir la características histológicas en función del aspecto de la mucosa y de los vasos, lo que permite detectar la presencia de cáncer en los casos de biopsias negativas29. Queda por evaluar el papel que podrían tener las diferentes técnicas endoscópicas de histología virtual.
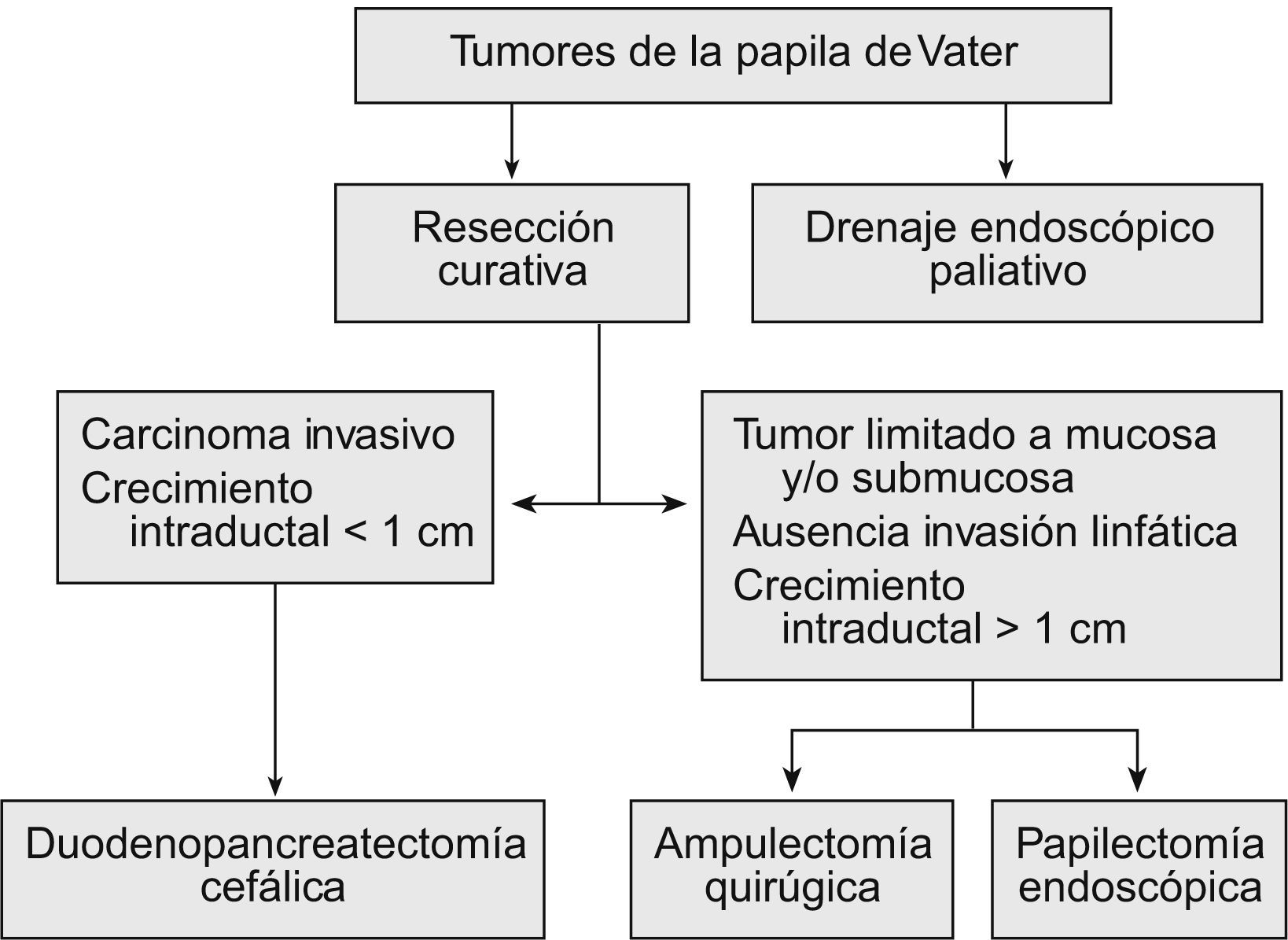
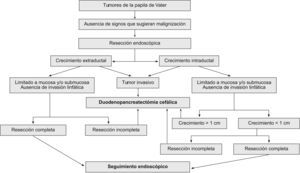
TratamientoEl tratamiento curativo de estos tumores puede ser endoscópico o quirúrgico. Para los pacientes no tributarios de un tratamiento curativo, se opta por un tratamiento endoscópico paliativo de drenaje (fig. 1).
Resección curativaLa elección de la técnica para resecar estos tumores es un tema que genera controversias. En la actualidad no disponemos de estudios prospectivos aleatorizados que nos ayuden a tomar la decisión de una cirugía radical frente a una resección local, ya sea endoscópica o quirúrgica; por todo ello, esta decisión se continúa tomando en función de la experiencia, las posibilidades técnicas y las características de los pacientes. Dado que un porcentaje elevado de estos pacientes son mayores (con una media de edad superior a 60 años), también debe valorarse el riesgo quirúrgico; así, en los pacientes con riesgo quirúrgico elevado, se deberá valorar la ventaja que ofrece el tratamiento endoscópico (tabla 1).
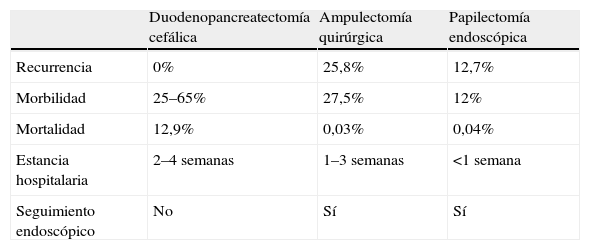
Resultados globales de los diferentes tratamientos curativos de los tumores de la papila de Vater
| Duodenopancreatectomía cefálica | Ampulectomía quirúrgica | Papilectomía endoscópica | |
| Recurrencia | 0% | 25,8% | 12,7% |
| Morbilidad | 25–65% | 27,5% | 12% |
| Mortalidad | 12,9% | 0,03% | 0,04% |
| Estancia hospitalaria | 2–4 semanas | 1–3 semanas | <1 semana |
| Seguimiento endoscópico | No | Sí | Sí |
Los resultados del tratamiento quirúrgicos de este tipo de tumores han mejorado en la última década, debido a diversos factores, como la mayor fiabilidad del diagnóstico preoperatorio, el mejor soporte perioperatorio y anestésico, el uso de nutrición parenteral postoperatoria, la quimioterapia y la radioterapia adyuvantes, y la concentración de estos pacientes en unidades quirúrgicas especializadas30. El estadio tumoral y la presencia de invasión linfática son los principales factores pronóstico del tratamiento quirúrgico. El pronóstico de los ampulomas malignos es superior al de los adenocarcinomas pancreáticos, con una supervivencia a los 5 años del 35–67%, en comparación con una tasa menor del 20% de aquellos. Las opciones quirúrgicas de elección para los tumores malignos de la ampolla de Vater son dos: la duodenopancreatectomía cefálica y la ampulectomía quirúrgica.
Duodenopancreatectomía cefálicaLa duodenopancreatectomía cefálica (DPC)31 es el tratamiento de elección en las neoplasias invasivas de la papila de Vater y en los tumores con crecimiento intraductal amplio, por lo que no está indicada en los pacientes con tumores benignos. Su gran ventaja es que es el procedimiento que presenta la menor tasa de recurrencias, además de que no necesita una vigilancia endoscópica. Su mayor inconveniente es la gran morbilidad (25–65%) y mortalidad (12,9%)32 que conlleva.
Ampulectomía quirúrgicaLa ampulectomía quirúrgica fue descrita por primera vez por Halsted en 189933. La literatura médica sugiere que esta técnica es apropiada en los tumores donde la biopsia endoscópica no detecte displasia o atipias. Desde el punto de vista quirúrgico, esta técnica se acepta como curativa cuando el tumor se limita a la mucosa (T0 o T in situ), y se desaconseja en los pacientes con crecimiento intraductal amplio34. Se asocia con una menor morbilidad (27,5%) y mortalidad (0,03%), y una menor estancia hospitalaria que la DPC. La desventaja que presenta es la posibilidad de resección incompleta, con el riesgo de recurrencia que conlleva (5–30%), así como la necesidad de vigilancia endoscópica.
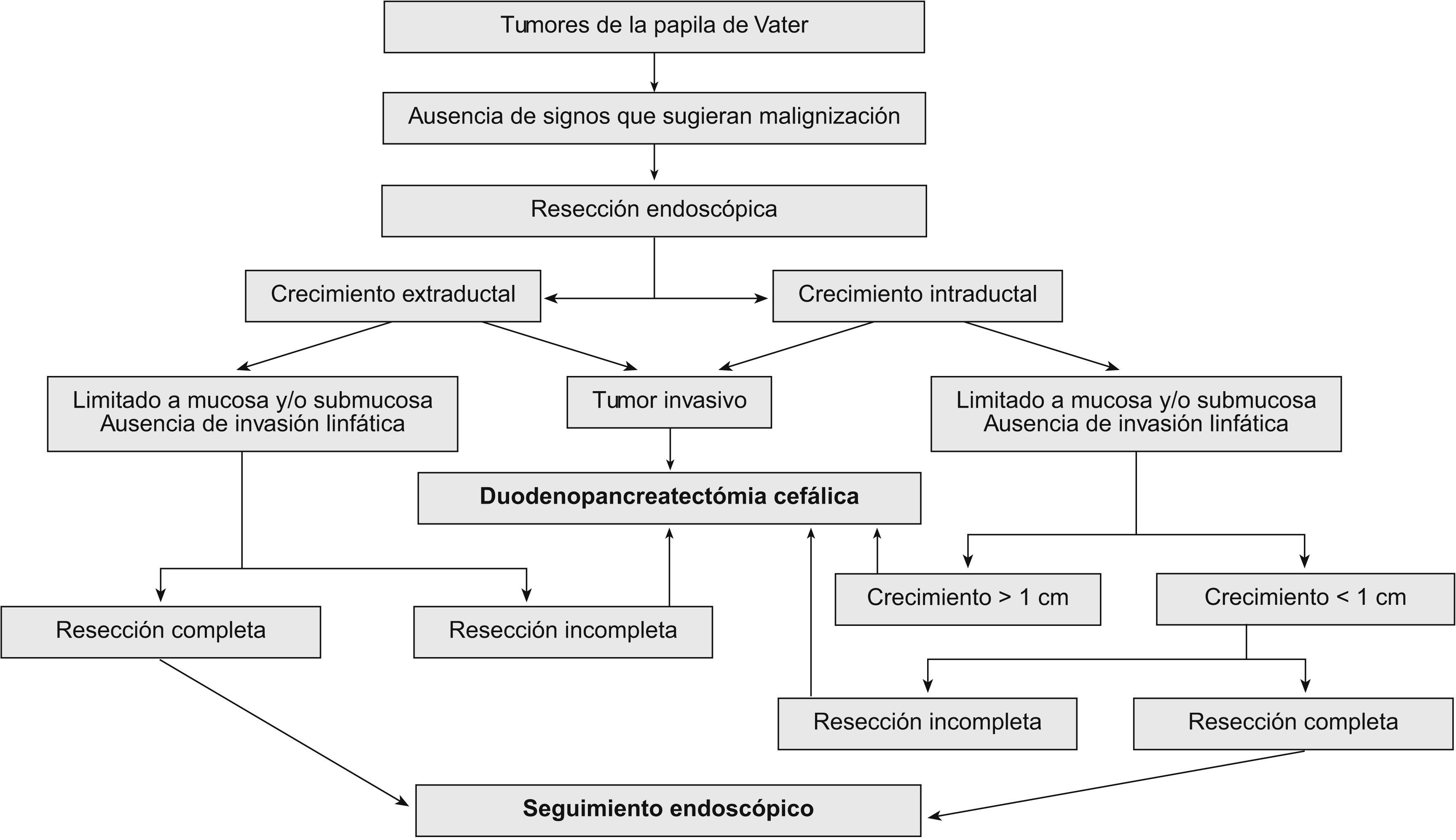
Tratamiento endoscópico: papilectomía endoscópicaLa papilectomía endoscópica, también denominada ampulectomía35, es una técnica que tiene que limitarse a centros de referencia con endoscopistas expertos. Es una opción que sólo es posible cuando el tumor se limita a la mucosa y/o la submucosa (T0 o T in situ, y T1 sin invasión linfática). La falta de estudios a largo plazo, con una muestra amplia de pacientes, nos impide el generalizar su indicación36, y nos obliga a considerar la cirugía en todos los tumores con displasia de alto grado; no obstante, en los tumores que presentan únicamente un crecimiento extraductal, y donde la resección endoscópica se ha confirmado histológicamente como completa, la papilectomía endoscópica se debe considerar como curativa. La resección completa y la invasión linfática son los dos factores pronóstico decisivos en los tumores T1. Esta técnica conlleva una morbilidad del 12%, una mortalidad del 0,04% y una tasa de recurrencia del 0–26%. Las indicaciones para optar por el tratamiento endoscópico no están claramente establecidas, y varían de un centro a otro. Por una parte tenemos las indicaciones clásicas35: tumor<4cm, sin evidencia macroscópica de malignidad (márgenes definidos, ausencia de ulceración, consistencia blanda), histología benigna en al menos 6 muestras histológicas, y ausencia de crecimiento intraductal. Hoy en día se acepta que el tamaño del tumor no excluye el tratamiento endoscópico, y que las neoplasias no invasivas T0 o T137 se pueden beneficiar de él. Hay discrepancias sobre la conveniencia de considerar a la papilectomía endoscópica una técnica curativa en los tumores T1, debido a la alta frecuencia de invasión linfática38. La única contraindicación es la presencia de un crecimiento intraductal amplio (>1cm), ya que la posibilidad de resección endoscópica completa es incierta, por lo que es importante realizar una USE en estos casos. Bohnacker et al39, en un estudio prospectivo con 106 pacientes, demostraron que la papilectomía endoscópica es una técnica segura y eficaz, con una tasa de curación del 83 y el 46% en los pacientes sin y con crecimiento intraductal, respectivamente (fig. 2).
Técnica endoscópicaPara la resección endoscópica se emplea un asa de polipectomía estándar, capturando el tumor en dirección cefalocaudal. No hay consenso en lo referente al tipo de corriente que se debe emplear, aunque se tiende a evitar la coagulación pura para reducir el edema pospapilectomía. Siempre que se pueda, se optará por una resección en bloque, que permite un correcto estudio histológico, o bien una resección en fragmentos, que consigue la resección completa del tumor en una media de 2,7 sesiones40.
La electrocoagulación a través de plasma de argón (EPA) es una técnica complementaria a la resección endoscópica, que ha demostrado su utilidad para cauterizar y eliminar restos de tejido en los márgenes de resección34. Es importante fulgurar los bordes de resección y la base de implantación del tumor para destruir todos los restos macroscópicos que no se pueden resecar mediante asa de polipectomía, al igual que los restos adenomatosos no visibles (microscópicos) para reducir la recurrencia tras la resección endoscópica.
¿Se puede obviar la inyección submucosa?La inyección submucosa con solución salina o adrenalina diluida, con o sin azul de metileno, no es de aplicación sistemática. Su principal ventaja es que permite sospechar la presencia de un tumor invasivo (signo del acolchamiento), y que reduce el riesgo de sangrado41. Su desventaja es que dificulta la captura del tumor con el asa de polipectomía, y que atenúa los márgenes de éste. Los estudios realizados sin inyección submucosa no han demostrado una mayor dificultad en la resección ni un mayor número de complicaciones11,35,42–48.
¿Hay que realizar una esfinterotomía previa a la papilectomía?Hay discrepancias sobre la utilidad y la seguridad de realizar una esfinterotomía endoscópica previa a la papilectomía. Esta técnica ha demostrado ser segura, capaz de reducir las complicaciones de la resección endoscópica y facilitar un tratamiento más agresivo49. Además, una esfinterotomía amplia permite realizar un estudio de extensión intracoledocal del tumor35. La presencia de un ampuloma es un factor de riesgo para la presencia de hemorragia tras la esfinterotomía; por otra parte, puede ser artefacto para el ulterior estudio histológico del tumor. Otros autores creen aconsejable la colocación de una prótesis pancreática postesfinterotomía, y previa a la papilectomía, debido a la distorsión anatómica que produce la esfinterotomía50.
¿Es necesario colocar prótesis pancreática y/o biliar?Muchos autores recomiendan su uso, aunque no está claramente establecido si la colocación de la prótesis reduce el riesgo de pancreatitis37. Hemos documentado la existencia de un único estudio aleatorizado, que incluyó un número escaso de pacientes (n=11), el cual demuestra una reducción estadísticamente significativa de pancreatitis en los pacientes a quienes se les coloca una prótesis pancreática de plástico, previamente a la papilectomía endoscópica51. Las evidencias actuales sugieren que no hay necesidad de colocar una prótesis si se visualiza claramente el orificio pancreático, y si éste se puede canular sin dificultad34,43,51,52. Si se opta por colocar una prótesis, ésta tiene que ser de pequeño diámetro (3–5 F), de unos 6–8cm de longitud, carecer de aletas para permitir la migración espontánea, y se debe retirar entre los 2 días y los 3 meses para reducir el traumatismo pancreático ocasionado por la misma prótesis49.
Con respecto a las prótesis biliares de plástico, no está establecido que su empleo sea necesario. Quizás se plantee su uso si el orificio coledocal no se visualiza con facilidad, o si la canulación de éste resulta dificultosa34,41,47,52,53. En ocasiones, cuando se presenta una hemorragia en la vertiente coledocal de la papila tras la esfinterotomía, puede estar indicada la colocación de una prótesis expandible recubierta.
Otras opcionesOtra opción es realizar una papilectomía guiada con hilo guía54, para mantener permeable el Wirsung, si se opta por colocar una prótesis después de la resección endoscópica, en los pacientes que presentan un edema significativo.
ResultadosLa resección endoscópica completa se alcanza en el 46–92% de los casos, y la tasa de recurrencia oscila entre el 0 y el 33%40. Los factores favorecedores de recurrencia son: el tamaño del tumor y la no ablación de los restos adenomatosos con EPA. La presencia de una extensión intraductal amplia obliga a un tratamiento quirúrgico35, si bien podría tratarse mediante coledocoscopia si el tumor no es muy extenso.
ComplicacionesLas complicaciones del tratamiento endoscópico pueden clasificarse en tempranas (pancreatitis 8–15%, hemorragia 2–13%, perforación 0–4%, y colangitis 0–2%) y tardías (estenosis papilar 0–8%). La morbilidad global se sitúa en el 23% (rango, 10–58%) y la mortalidad en el 0,04% (rango, 0–0,07%)40. Las complicaciones más frecuentes son la hemorragia, que se controla durante el procedimiento endoscópico mediante fulguración con EPA, la coagulación, la inyección o la colocación de hemoclips, y la pancreatitis, que suele ser leve y resolverse con tratamiento conservador55.
Tratamiento paliativoEl papel de la CPRE en el manejo paliativo de los tumores de la papila de Vater está claramente establecido. El drenaje endoscópico de la obstrucción biliar, mediante la realización de una esfinterotomía y la colocación de una prótesis expandible, está claramente aceptado desde hace 20 años56,57.
Seguimiento endoscópicoNo hay un consenso respecto al seguimiento endoscópico, ya que varía de un estudio a otro, y según las preferencias del endoscopista40. Se acepta que si la resección es incompleta, se debe realizar una duodenoscopia cada 1–3 meses hasta completar la resección, y que cuando la resección sea completa, se realice una duodenoscopia cada 6 meses, con toma de múltiples biopsias, en los primeros 2 años de seguimiento. En los pacientes con poliposis familiar se debe realizar un control endoscópico cada 3 años. En estos pacientes no hay consenso respecto al tratamiento idóneo, y se sugiere que la vigilancia endoscópica con toma de biopsias es mejor que la resección, en los casos de tumores de aspecto benigno y sin displasia21.