La diarrea crónica es un síntoma de presentación frecuente, tanto en las consultas de medicina de familia como en las de digestivo. Se estima que >5% de la población sufre diarrea crónica y que cerca del 40% de estos sujetos son mayores de 60 años. El clínico se enfrenta con frecuencia a la necesidad de decidir cuál es el mejor enfoque diagnóstico de estos pacientes y elegir entre las múltiples pruebas diagnósticas existentes. En 2014 la Societat Catalana de Digestologia creó un grupo de trabajo con el objetivo principal de crear algoritmos diagnósticos en base a la práctica clínica y evaluar las pruebas diagnósticas disponibles y la evidencia científica para su utilización. Para clasificar la evidencia científica y la fuerza de las recomendaciones se utilizó el sistema GRADE. Se han establecido 28 recomendaciones y 6 algoritmos diagnósticos. Se describen los criterios de derivación desde medicina primaria a digestivo de un paciente con diarrea crónica.
Chronic diarrhoea is a common presenting symptom in both primary care medicine and in specialized gastroenterology clinics. It is estimated that >5% of the population has chronic diarrhoea and nearly 40% of these patients are older than 60 years. Clinicians often need to select the best diagnostic approach to these patients and choose between the multiple diagnostic tests available. In 2014 the Catalan Society of Gastroenterology formed a working group with the main objective of creating diagnostic algorithms based on clinical practice and to evaluate diagnostic tests and the scientific evidence available for their use. The GRADE system was used to classify scientific evidence and strength of recommendations. The consensus document contains 28 recommendations and 6 diagnostic algorithms. The document also describes criteria for referral from primary to specialized care.
La diarrea crónica es un síntoma de presentación frecuente, tanto en las consultas de medicina de familia como en las de digestivo. Se estima que >5% de la población sufre diarrea crónica y que cerca del 40% de estos sujetos son mayores de 60años1. La lista de causas que pueden ocasionar diarrea crónica es extensa (tabla 1), y a menudo se hace necesaria la realización de múltiples pruebas diagnósticas antes de llegar a un diagnóstico definitivo1-5. El clínico se ve enfrentado con frecuencia a la necesidad de decidir cuál es el mejor enfoque diagnóstico de estos pacientes y elegir entre las múltiples pruebas diagnósticas existentes. En un número importante de pacientes no se llega a ningún diagnóstico definitivo y se realiza el diagnóstico de diarrea funcional o de diarrea idiopática.
Clasificación de la diarrea crónica
| Diarrea crónica acuosa 1. Osmótica Laxantes osmóticos (Mg+2, PO-, SO4-2) Malabsorción de hidratos de carbono Ingestión excesiva de hidratos de carbono poco absorbibles Lactulosa Sorbitol i manitol (chicles «sin azúcar») Fructosa (frutas, refrescos) 2. Secretora Clorhidrorrea congénita Enterotoxinas bacterianas Malabsorción de ácidos biliares Enfermedad inflamatoria intestinal Colitis ulcerosa Enfermedad de Crohn Colitis microscópica Vasculitis Abuso de laxantes estimulantes Fármacos Alergias alimentarias Envenenamiento por metales pesados Alteraciones de la motilidad Diarrea post-vagotomía Diarrea post-simpatectomía Neuropatía autónoma diabética Síndrome de intestino irritable Impactación fecal Incontinencia anal Causa endocrinológica Enfermedad de Addison Hipertiroidismo Gastrinoma Vipoma Somatostatinoma Síndrome carcinoide Mastocitosis Otros tumores Carcinoma de colon Linfoma intestinal Adenoma velloso secretor del recto Diarrea secretora idiopática Otros: amiloidosis Diarrea crónica inflamatoria Enfermedad inflamatoria intestinal Colitis ulcerosa Enfermedad de Crohn Diverticulitis Yeyunoileítis ulcerativa Enfermedades infecciosas Bacterias: Shigella, Salmonella, Campylobacter, Yersinia, Clostridium difficile Virus: herpes simple, CMV Parásitos: amebiasis, estrongiloides Colitis isquémica Colitis por radiación Neoplasias Cáncer de colon Linfoma Diarrea crónica con esteatorrea Causas entéricas Enfermedades de la mucosa: celiaquía, Whipple, giardiasis, linfoma, Crohn, enteritis rádica, linfangiectasia intestinal, amiloidosis, gastroenteritis eosinofílica, esprúe tropical, esprúe, colágeno Síndrome de intestino corto Sobrecrecimiento bacteriano Isquemia mesentérica crónica Síndromes de maldigestión Insuficiencia exocrina del páncreas Concentración inadecuada de ácidos biliares en la luz intestinal |
En este sentido se han publicado varias guías de práctica clínica de cara a establecer un esquema óptimo de investigación de los pacientes con diarrea crónica2,4,6 y que intentan maximizar el número de diagnósticos positivos utilizando el menor número de exploraciones posible. Estas guías necesitan ser actualizadas y adaptadas a nuestro medio, ya que en los últimos años se han identificado una serie de enfermedades de base orgánica que se presentan con características de «funcionalidad». De hecho, se ha puesto en duda la existencia de la diarrea funcional per se7,8.
En un esfuerzo para ayudar a los clínicos en el diagnóstico de la diarrea crónica, la Societat Catalana de Digestologia propuso en 2014 la creación de un grupo de trabajo de cara a elaborar un consenso sobre el diagnóstico de diarrea crónica. El documento fue presentado durante el congreso de la Sociedad en enero de 2015 y está disponible online en la web de la Sociedad en forma abreviada (http://www.scdigestologia.org/index.php?link=docs_posicio). El principal objetivo del grupo de trabajo fue crear algoritmos diagnósticos en base a la práctica clínica y evaluar las pruebas diagnósticas disponibles y la evidencia científica para su utilización.
Para clasificar la evidencia científica y la fuerza de las recomendaciones se utilizó el sistema Grading of Recommendations Assessment, Development and Evaluation (GRADE) (http://www.gradeworkinggroup.org/). En la tabla 2 se describen las categorías sobre calidad de la evidencia (CE) y grado de recomendación (GR)9.
Sistema GRADE
| Calidad de la evidencia (CE) | |
| Alta | Es muy poco probable que nuevos estudios cambien la confianza que tenemos en el resultado estimado |
| Moderada | Es probable que nuevos estudios tengan un impacto importante en la confianza que tenemos en el resultado estimado y que puedan modificar el resultado |
| Baja | Es muy probable que nuevos estudios tengan un impacto importante en la confianza que tenemos en el resultado estimado y que puedan modificar el resultado |
| Muy baja | Cualquier resultado estimado es muy incierto |
| Grado de recomendación (GR) | |
| Fuerte | Muy seguros que los beneficios son claramente superiores a los riesgos y a los inconvenientes, o contrariamente no lo son |
| Débil | Los beneficios, los riesgos y los inconvenientes mantienen un equilibrio estrecho, o existe una incertidumbre apreciable sobre la magnitud de los beneficios y riesgos |
La diarrea crónica consiste en un cuadro de más de 4 semanas de duración de disminución de la consistencia de las heces, deposiciones que causan urgencia o malestar abdominal, o un aumento en la frecuencia de estas2,5. La consistencia es el resultado de la relación entre el agua fecal y la capacidad de retención de agua de los sólidos insolubles fecales. Como es difícil cuantificar la consistencia de las heces y estas son predominantemente agua (60 a 85%), el peso fecal puede constituir una estimación indirecta razonable de la consistencia. En este sentido, la diarrea puede definirse por el peso o el volumen de las heces medido en un período de 24 a 72h (media de 2 a 3días). El peso normal de las heces de 24h en niños y adultos es inferior a 200g, de modo que un peso de heces de 24h >200g es una definición objetiva de diarrea. Sin embargo, hay que tener en cuenta que no quedan incluidos en esta definición hasta un 20% de los pacientes con diarrea líquida, que presentan un peso de heces inferior.
Por tanto, una definición pragmática incorpora estos elementos: presencia de más de 3 deposiciones al día líquidas o blandas y/o un volumen de heces superior a 200g/día de consistencia líquida/blanda.
Anamnesis y clasificaciónLa anamnesis y la exploración física son importantes para enfocar el diagnóstico3-5. En la anamnesis hay que valorar, inicialmente, antecedentes familiares de enfermedades como la celiaquía o la enfermedad inflamatoria intestinal —ya que presentan predisposición familiar—, antecedentes personales de viajes a zonas endémicas, prácticas sexuales de riesgo, enfermedades sistémicas (p.ej., diabetes mellitus, enfermedades sistémicas o neurológicas, amiloidosis, etc.), antecedentes de cirugía gastrointestinal (p.ej., colecistectomía, resecciones intestinales), ingesta de fármacos que pueden producir diarrea como efecto secundario o ingesta de chicles/caramelos con contenido elevado de sorbitol.
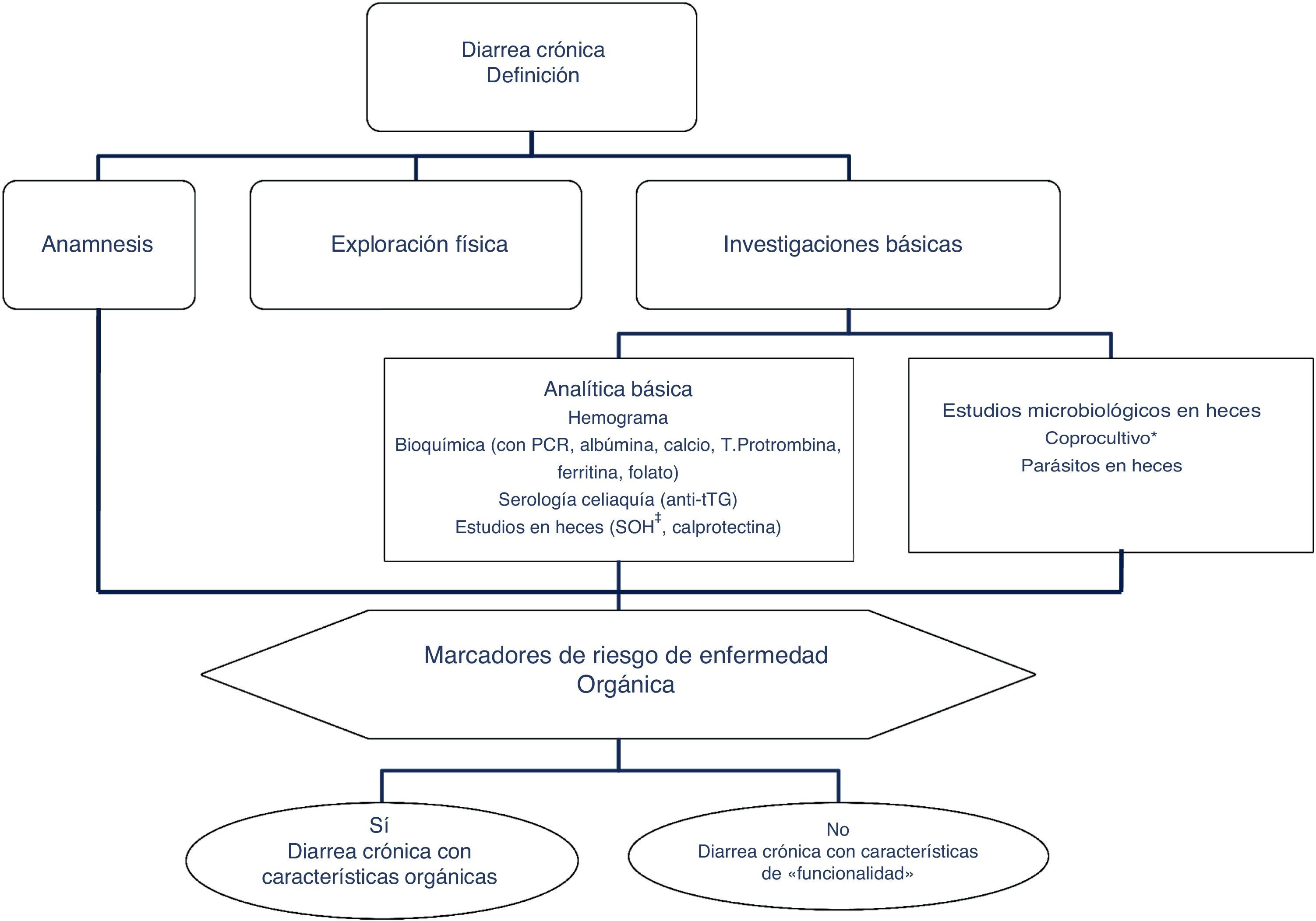
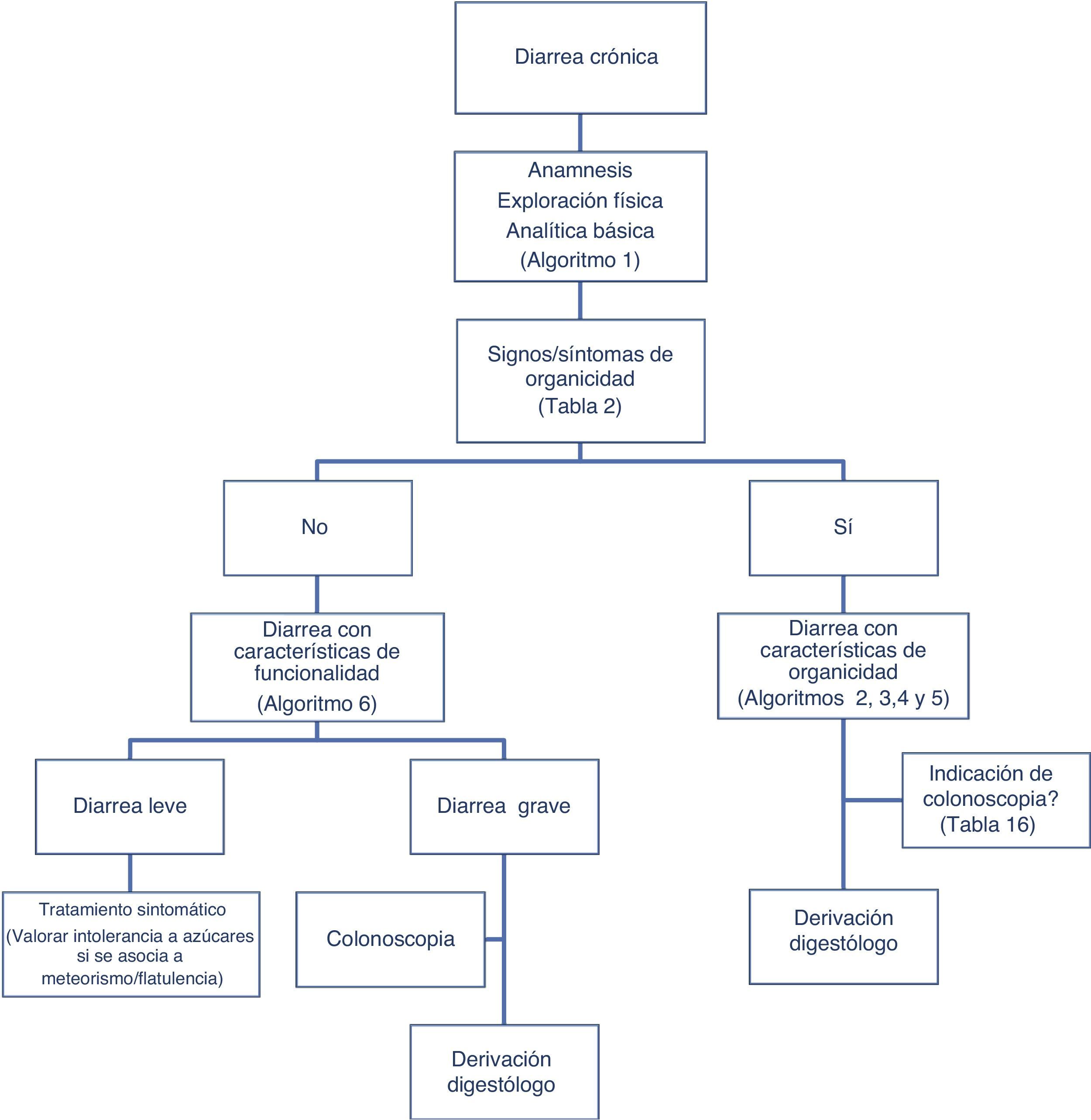
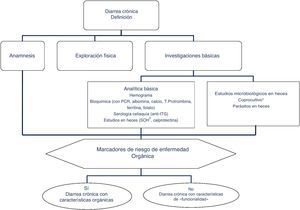
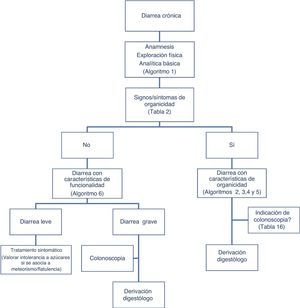
Clásicamente, se ha abordado el diagnóstico diferencial de la diarrea en base al mecanismo que la origina. Existen 4 mecanismos fisiopatológicos de diarrea: osmótica, secretora, exudativa y por motilidad alterada. Sin embargo, esta clasificación, adecuada desde el punto de vista académico, resulta poco práctica en la rutina habitual, ya que entre otros aspectos a menudo coexiste más de un mecanismo. Desde un enfoque práctico es útil clasificar a los pacientes con clínica de diarrea crónica en función de si presentan características que sugieran «funcionalidad» u «organicidad» (algoritmo 1, fig. 1).
Algoritmo 1. Enfoque inicial de un paciente con diarrea crónica.
* El coprocultivo solo está indicado en pacientes inmunodeprimidos o que reciben tratamiento con inmunosupresores (en muchos pacientes se habrán hecho en la fase aguda del proceso, antes de poder ser considerados por su duración como una diarrea crónica).
** El test de sangre oculta en las heces tiene una sensibilidad alta para inflamación intestinal.
PCR: proteína C reactiva; SOH: sangre oculta en heces; TTG: anticuerpos antitransglutaminasa tisular IgA;.
El primer paso en el diagnóstico debe orientarse, por tanto, a buscar síntomas, signos y alteraciones analíticas que sugieran la existencia de una enfermedad orgánica (tabla 3). La presencia de síntomas de alarma o alteraciones en la analítica general apuntan hacia la existencia de una causa orgánica. En estos casos la diarrea se puede tipificar como diarrea inflamatoria, diarrea con malabsorción (esteatorrea) y diarrea acuosa. La anamnesis permite, en muchos casos, establecer una orientación sobre la localización del segmento intestinal alterado causante de la diarrea. Así, la presencia de heces voluminosas, líquidas o pastosas, brillantes y que se acompañan de dolor cólico periumbilical (diarrea con características que sugieren malabsorción) sugiere que la diarrea tiene su origen en el intestino delgado proximal o que tiene un origen pancreático. En cambio, las deposiciones semilíquidas o líquidas, escasas en volumen, con sangre, moco o pus, que se acompañan de urgencia o tenesmo y de dolor hipogástrico o sacro, orientan más hacia una diarrea de origen en colon izquierdo y/o recto (diarrea de tipo inflamatorio).
Diarrea crónica: síntomas, signos y alteraciones analíticas sugestivas de causa orgánica
| Presencia de sangre en heces |
| Aparición de fiebre |
| Pérdida reciente de peso (>5kg) (en ausencia de síndrome depresivo concomitante) |
| Inicio reciente de los síntomas o cambio en les características previas de estos |
| Aparición en edades avanzadas (≥50años) |
| Historia familiar de cáncer o pólipos colorrectales |
| Existencia de diarrea nocturna |
| Diarrea que persiste después del ayuno |
| Heces muy abundantes o esteatorreicas |
| Peso de heces de 24h >400g/día |
| Anomalías en la exploración física (palidez cutánea, hepatoesplenomegalia, adenopatías, masa abdominal, etc.) |
| Presencia de anemia, macrocitosis, hipoprotrombinemia, hipoalbuminemia u otras alteraciones analíticas (p.ej., aumento de la VSG o de la proteínaC reactiva) |
| Análisis de heces con sangre oculta positiva, calprotectina fecal elevada |
Dentro del grupo que sugiere «funcionalidad» se encuentran algunas entidades que tienen una base orgánica y las auténticas diarreas funcionales; esta diferenciación se tratará en el apartado sobre diarrea funcional. En estos pacientes la diarrea suele presentarse en forma de diarrea crónica acuosa sin sangre, ya sea de forma recurrente, con episodios diarreicos frecuentes alternando con deposiciones normales, o en forma de diarrea persistente, con heces semilíquidas o líquidas. En estos casos la frecuencia de las deposiciones es variable, pero en algunos pacientes puede llegar a las 10-15 deposiciones diarias. A menudo puede existir urgencia e incontinencia que incapacitan al paciente para realizar una vida normal y disminuyen su calidad de vida. Puede haber una pérdida de peso moderada secundaria a la disminución de la ingesta al realizar dietas astringentes o restrictivas para evitar la diarrea.
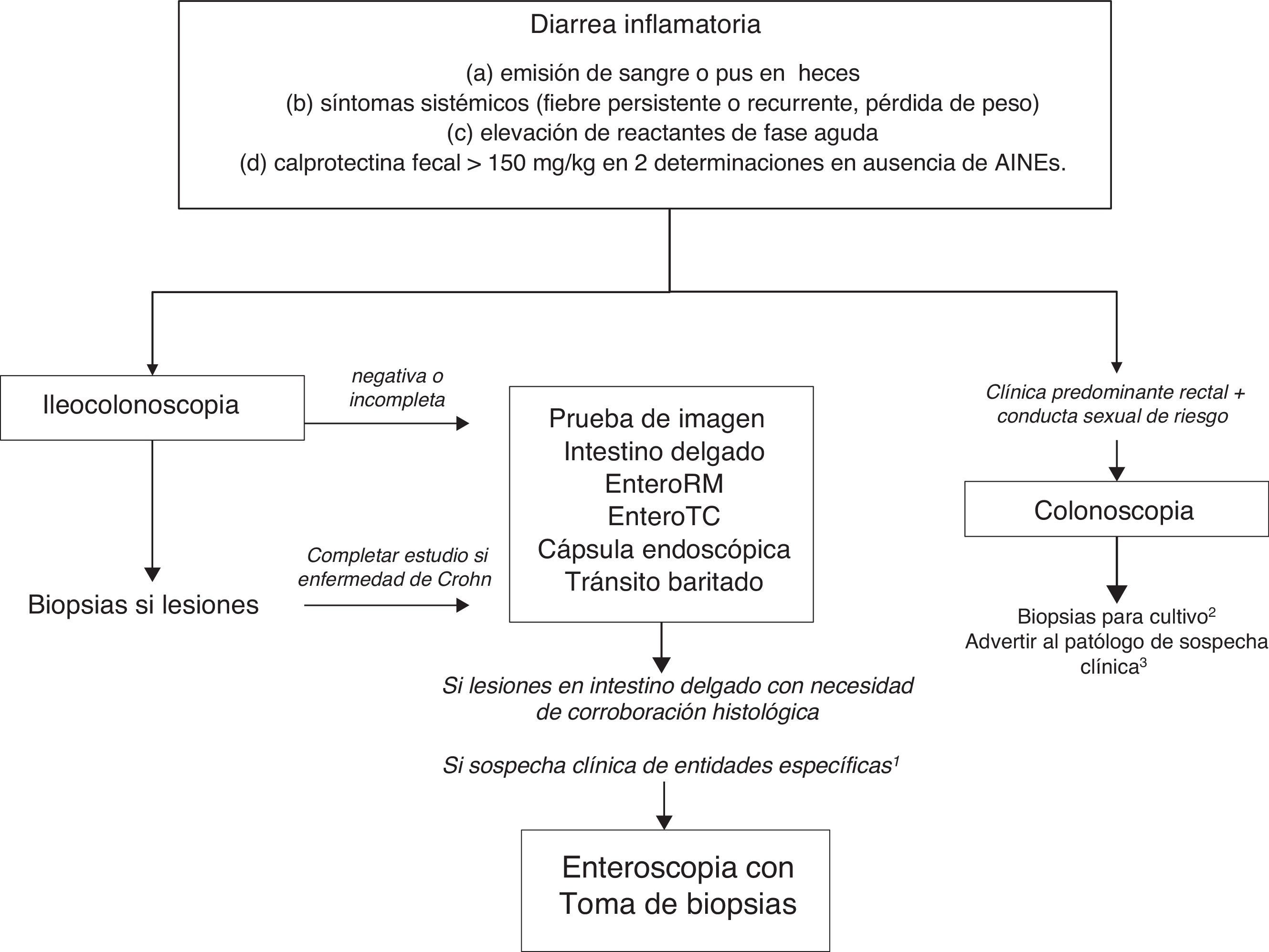
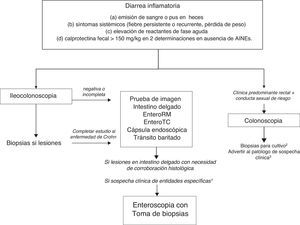
Diarrea crónica con características orgánicasDiarrea inflamatoriaLa definición clásica de la diarrea crónica inflamatoria se ha basado en la presencia de leucocitos en heces. Dado que esta determinación no se realiza en la mayoría de centros, una definición más práctica incluye las siguientes características: a)emisión de sangre o pus en las heces; b)se acompaña de síntomas sistémicos (fiebre persistente o recurrente, pérdida de peso) o de manifestaciones inflamatorias extraintestinales (fundamentalmente articulares, cutáneas u oculares), y c)cursa con elevación de reactantes de fase aguda (proteínaC reactiva, velocidad de sedimentación globular, cifra de plaquetas) o de calprotectina fecal >150mg/kg en 2 determinaciones separadas en el tiempo, en ausencia de consumo de AINE10,11.
Dado que la evaluación de la mucosa intestinal y la corroboración histológica son necesarias para el diagnóstico de la mayoría de entidades que causan diarrea crónica inflamatoria (tabla 1), la exploración inicial es la colonoscopia (con ileoscopia o no, dependiendo del cuadro clínico y de los hallazgos de colonoscopia hasta ciego) (algoritmo 2, fig. 2). Cuando la colonoscopia sea incompleta o cuando sea normal (incluyendo o no ileoscopia), habrá que explorar el intestino delgado por otras técnicas de imagen. Entre estas, la enterografía por RM sería la exploración de elección, ya que con precisión diagnóstica similar a la enterografía por TC la primera no irradia al paciente. Una alternativa a estas es la ecografía transabdominal con o sin contraste intravenoso; con una precisión diagnóstica comparable a la enterografía por RM y TC, es más barata, accesible en la mayoría de centros y sin irradiación12. Por sus características es especialmente atractiva como exploración inicial, especialmente en edad pediátrica. Sin embargo, la ecografía solo permite una correcta exploración del íleon terminal y depende del operador, lo que limita enormemente su uso en nuestro medio. En caso de no disponer de ninguna de ellas, se puede realizar un tránsito intestinal baritado, si bien son muchas las limitaciones de esta técnica. Su precisión diagnóstica es menor que la enterografía por RM, ya que no permite detectar complicaciones extraluminales, produce una irradiación del paciente nada despreciable y los radiólogos más jóvenes tienen una escasa formación en su realización. Por todo ello, es aconsejable evitarla. Los hallazgos en estas exploraciones indicarán la necesidad de realizar otras exploraciones, como gastroduodenoscopia, enteroscopia, cápsula endoscópica o gammagrafías específicas.
Algoritmo 2. Enfoque diagnóstico de la diarrea crónica inflamatoria.
1 Determinadas entidades pueden ser difíciles de diagnosticar si no existe sospecha clínica (por ejemplo, enfermedad de Whipple). En estos casos está indicada la exploración endoscópica del intestino delgado con enteroscopia para la toma de biopsias.
2 Cultivo de biopsia para gonorrea.
3 PCR en tejido para linfogranuloma venéreo y herpes simple.
La diarrea crónica inflamatoria de origen infeccioso es poco frecuente fuera del paciente inmunodeprimido, y sus causas principales se resumen en la tabla 4. Los coprocultivos, por ello, solo están indicados en pacientes inmunodeprimidos o que reciben tratamiento con inmunosupresores e incluyen de forma estándar el estudio de Salmonella, Shigella, Yersinia y Campylobacter. No es necesario cursar muestras seriadas, y se pueden conservar en nevera. Para el diagnóstico de infección por Clostridium difficile disponemos de diferentes métodos (detección de toxina en heces, cultivo, estudio de citotoxicidad y detección de glutamato deshidrogenasa), sin estar demostrado cuál es mejor13; la selección de uno u otro para lograr la máxima sensibilidad y especificidad con un coste mínimo y máxima rapidez es un punto en el que no hay una recomendación única, y los algoritmos diagnósticos sugieren basar el diagnóstico en 2 o 3 pruebas escalonadas.
Agentes causantes de diarrea crónica infecciosaa
| Bacteriana (poco frecuente) | Protozoos | Virus (inmunodeprimidos) |
|---|---|---|
| Salmonella Shigella Yersinia Campylobacter Aeromones Escherichia coli (enteroinvasiva) Clostridium difficile | Giardia Cryptosporidium Blastocystis hominis Entamoeba histolytica Diantomoeba Helmintos (Strongyloides) | Norovirus Citomegalovirus |
Para la detección de parásitos es imprescindible cursar muestras «frescas» y de 2días alternos. Si no se puede cursar en fresco, puede proporcionarse al paciente el medio para que aporte las heces «fijadas» y las conserve en nevera. La identificación de parásitos (trofozoítos, quistes, huevos) se hace por visualización directa al microscopio y la sensibilidad dependerá de la intensidad de la infección, que la muestra sea fresca y de la experiencia del personal de laboratorio.
Mención especial merecen las infecciones digestivas por transmisión sexual14, que se caracterizan por una presentación clínica preferente en forma de síndrome rectal (esputos rectales, tenesmo, incontinencia). Tienen unos agentes etiológicos específicos, pueden simular lesiones inflamatorias o neoplásicas en la endoscopia y requieren métodos específicos de diagnóstico (tabla 5).
Diagnóstico de proctitis de transmisión sexual
| Etiología | Técnica diagnóstica de elección |
|---|---|
| Gonorrea | Cultivo de biopsia |
| Linfogranuloma venéreo | PCR en tejido permite identificar los serotipos, pero disponibilidad limitada Serología permite el diagnóstico en pacientes con clínica y endoscopia compatible, pero dada la alta prevalencia de infección por Chlamydia en pacientes sexualmente activos no es específica de infección aguda |
| Sífilis | Visualización de treponemas en microscopia de «campo oscuro» del exudado rectal es poco sensible pero muy específica (válida en estadio precoz infección) Tests serológicos positivos a partir de la 2.ª-3.ª semana de la primoinfección |
| Herpes simple | PCR biopsias de las úlceras |
- 1
Se recomienda la determinación de calprotectina fecal como un biomarcador útil de diarrea crónica de causa inflamatoria (CE, alta; GR, fuerte).
- 2
La exploración inicial en un paciente con sospecha de diarrea crónica inflamatoria es la colonoscopia (CE, alta; GR, fuerte).
- 3
Cuando la colonoscopia ha sido negativa, incompleta o no se ha podido realizar ileoscopia, debe completarse el estudio para valorar el intestino delgado, siendo la enterografía por RM la exploración de elección (CE, alta; GR, fuerte).
Clásicamente, se define maldigestión como la alteración de la hidrólisis intraluminal de nutrientes, y malabsorción como la alteración en su absorción mucosa. Aunque esta distinción puede ser útil por razones fisiopatológicas, la presentación clínica y las complicaciones de la maldigestión y la malabsorción son similares. Por ello, en esta revisión se utiliza solo el término malabsorción.
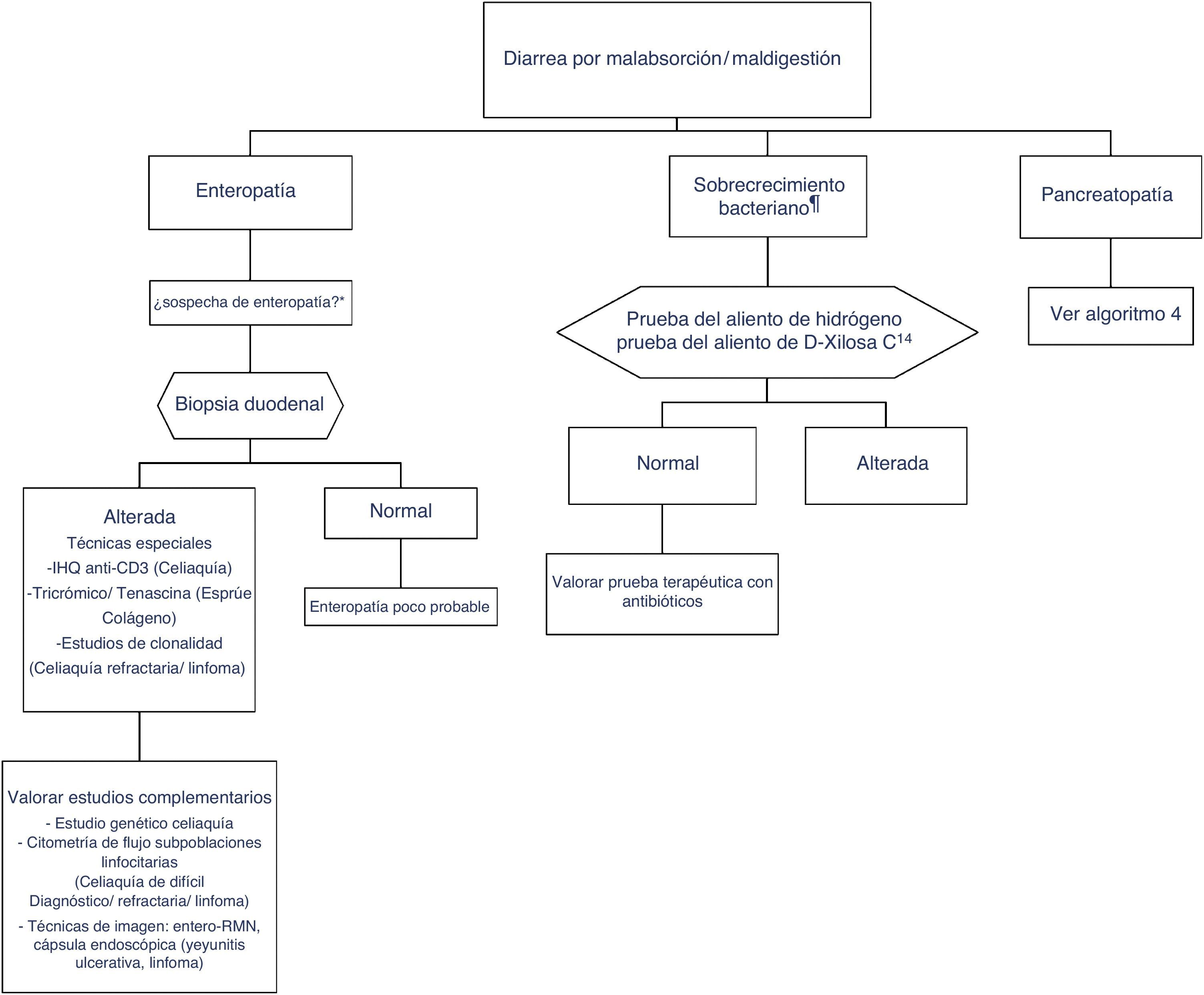
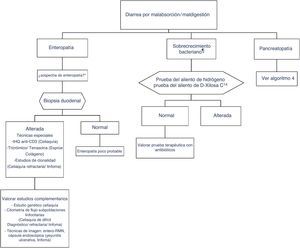
Desde el punto de vista de la práctica clínica debemos diferenciar entre diarrea por enteropatía, diarrea por sobrecrecimiento bacteriano y diarrea por pancreatopatía. El enfoque diagnóstico de cada una de ellas se describe en algoritmos separados (algoritmos 3 y 4, figs. 3 y 4).
Algoritmo 3. Enfoque diagnóstico de la diarrea crónica per enteropatía y sobrecrecimiento bacteriano.
* Sospecha de enteropatía: grupo de riesgo para enfermedad celiaca (familiares, síndrome de Down, enfermedades sistémicas autoinmunes organoespecíficas, clínica compatible, etc.), viajes a países tropicales, celiaquía con mala evolución, toma de olmesartán, etc.
** Sospecha de sobrecrecimiento bacteriano: alteración estructural del intestino (p.ej., by-pass, estenosis) o trastorno de la motilidad.
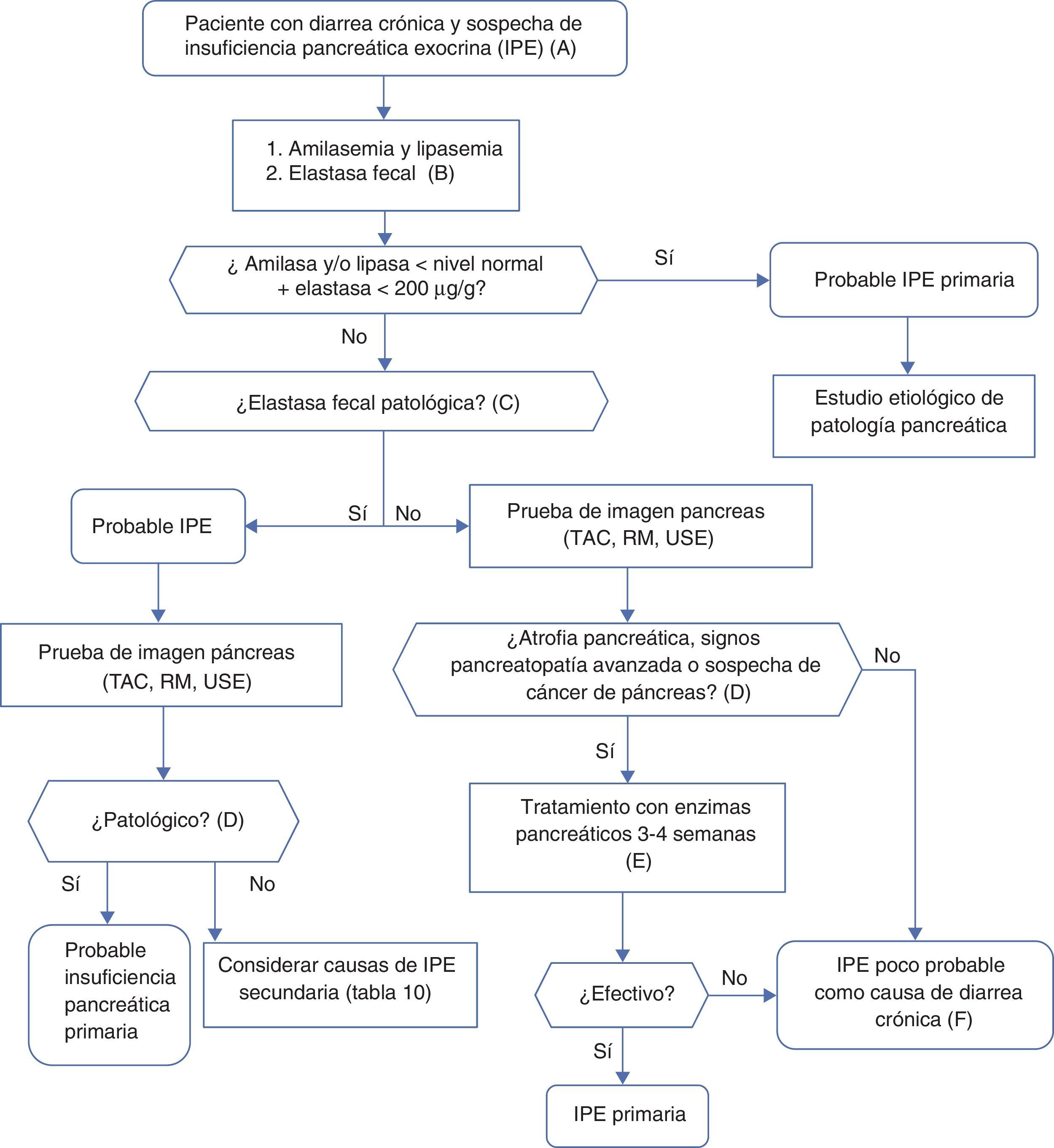
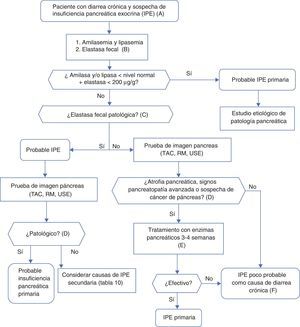
Algoritmo 4. Enfoque diagnóstico de la diarrea crónica por insuficiencia pancreática exocrina.
A. Sospecha marcada. Paciente con enolismo y tabaquismo importante, antecedentes de pancreatitis aguda o recurrente, dolor abdominal crónico de tipo pancreático, sospecha de mutación del gen de la fibrosis quística (bronquiectasias, esterilidad masculina, familiares con fibrosis quística), sospecha o diagnóstico de cáncer de páncreas, resección pancreática previa.
Sospecha menor. Tabaquismo aislado, diabetes mellitus, gastrectomía, edad avanzada, mejora de la diarrea con el ayuno, ausencia de anorexia.
B. La elastasa fecal es la prueba de función pancreática más utilizada y al alcance de la mayoría de centros hospitalarios. Se determinará en una muestra de heces sólidas. Muestras líquidas pueden dar falsos niveles bajos de elastasa.
C. La elastasa fecal es claramente patológica por debajo de 100μg/g. Concentraciones entre 100 y 200 son también patológicas, pero con niveles de sensibilidad y especificidad no tan buenos, deben considerarse con prudencia. En enfermos con pancreatectomía, concentraciones <200μg/g ya pueden indicar insuficiencia exocrina.
D. Aunque es causa de insuficiencia pancreática primaria, la atrofia pancreática puede ser en sí misma primaria (por pancreatopatia) o secundaria a otros procesos, como por ejemplo malnutrición prolongada o edad avanzada.
E. La respuesta al tratamiento enzimático debe evaluarse con dosis adecuadas y en ausencia de sobrecrecimiento bacteriano o de otras causas que inactiven las enzimas o que contribuyan a la diarrea. Dosis inicial recomendada de lipasa: 25.000UI en las comidas pequeñas y 50.000UI con las comidas grandes (± un inhibidor de la bomba de protones).
F. En caso de no encontrarse ninguna otra causa de diarrea y persiste la sospecha de insuficiencia exocrina es aceptable hacer un tratamiento de prueba.
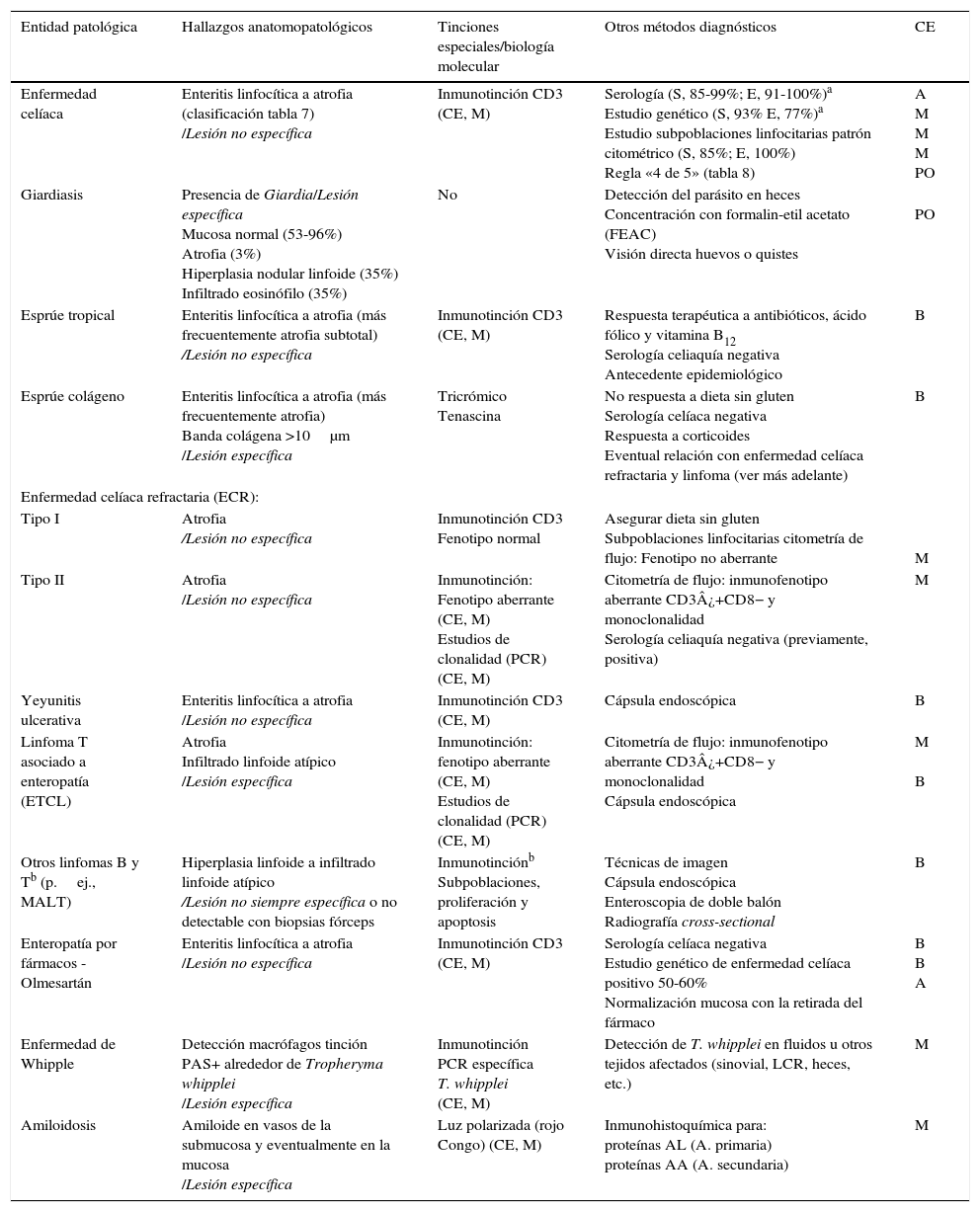
Es la diarrea producida por malabsorción de nutrientes secundaria a lesión del enterocito. La enfermedad celíaca es el paradigma de diarrea crónica por enteropatía, y es con mucho la causa más frecuente de atrofia de vellosidades. Pero hay otras entidades que también pueden producir atrofia vellositaria (tabla 6)15-20. La biopsia duodenal (6 muestras: 2 de bulbo duodenal y 4 de duodeno distal) permite en general llegar al diagnóstico, o al menos permite detectar la existencia de «enteropatía», independientemente de su etiología. En algunos casos, como la amiloidosis o la enfermedad de Whipple, la biopsia duodenal es diagnóstica porque el aspecto histopatológico es característico21. En cambio, la lesión intestinal por enfermedad celíaca es inespecífica (para cualquiera de los grados de lesión, desde enteritis linfocítica a atrofia) (tablas 6 y 7)22-25. El diagnóstico se debe reforzar o confirmar con otros métodos analíticos (serología, estudio genético, estudio de subpoblaciones linfocitarias) y clínicos (buena respuesta a la dieta sin gluten)26. Ninguno de estos criterios por separado es suficiente para diagnosticar una enfermedad celíaca, por lo que se han propuesto reglas diagnósticas basadas en una puntuación, como la regla «4 de 5» (tabla 8)27. En cualquier caso, la sospecha de diarrea por enteropatía obliga a la realización de biopsia intestinal, ya sea para establecer el diagnóstico o para determinar el grado de lesión. El contexto clínico (antecedentes epidemiológicos y/o familiares, antecedente de radioterapia en la enteritis por irradiación, trasplante de médula ósea en la enfermedad del injerto contra el huésped, o ingesta de fármacos, etc.) debe orientar el diagnóstico. En la tabla 6 se detallan las principales causas de enteropatía que pueden ocasionar diarrea y los métodos diagnósticos, así como la calidad de la evidencia disponible para su uso. Se describe, asimismo, el proceso diagnóstico en algunas situaciones especiales, como el esprúe tropical28, la celiaquía refractaria y la enfermedad linfoproliferativa intestinal20,29,30.
Principales causas de enteropatía que pueden ocasionar diarrea y métodos diagnósticos
| Entidad patológica | Hallazgos anatomopatológicos | Tinciones especiales/biología molecular | Otros métodos diagnósticos | CE |
|---|---|---|---|---|
| Enfermedad celíaca | Enteritis linfocítica a atrofia (clasificación tabla 7) /Lesión no específica | Inmunotinción CD3 (CE, M) | Serología (S, 85-99%; E, 91-100%)a Estudio genético (S, 93% E, 77%)a Estudio subpoblaciones linfocitarias patrón citométrico (S, 85%; E, 100%) Regla «4 de 5» (tabla 8) | A M M M PO |
| Giardiasis | Presencia de Giardia/Lesión específica Mucosa normal (53-96%) Atrofia (3%) Hiperplasia nodular linfoide (35%) Infiltrado eosinófilo (35%) | No | Detección del parásito en heces Concentración con formalin-etil acetato (FEAC) Visión directa huevos o quistes | PO |
| Esprúe tropical | Enteritis linfocítica a atrofia (más frecuentemente atrofia subtotal) /Lesión no específica | Inmunotinción CD3 (CE, M) | Respuesta terapéutica a antibióticos, ácido fólico y vitamina B12 Serología celiaquía negativa Antecedente epidemiológico | B |
| Esprúe colágeno | Enteritis linfocítica a atrofia (más frecuentemente atrofia) Banda colágena >10μm /Lesión específica | Tricrómico Tenascina | No respuesta a dieta sin gluten Serología celíaca negativa Respuesta a corticoides Eventual relación con enfermedad celíaca refractaria y linfoma (ver más adelante) | B |
| Enfermedad celíaca refractaria (ECR): | ||||
| Tipo I | Atrofia /Lesión no específica | Inmunotinción CD3 Fenotipo normal | Asegurar dieta sin gluten Subpoblaciones linfocitarias citometría de flujo: Fenotipo no aberrante | M |
| Tipo II | Atrofia /Lesión no específica | Inmunotinción: Fenotipo aberrante (CE, M) Estudios de clonalidad (PCR) (CE, M) | Citometría de flujo: inmunofenotipo aberrante CD3¿+CD8− y monoclonalidad Serología celiaquía negativa (previamente, positiva) | M |
| Yeyunitis ulcerativa | Enteritis linfocítica a atrofia /Lesión no específica | Inmunotinción CD3 (CE, M) | Cápsula endoscópica | B |
| Linfoma T asociado a enteropatía (ETCL) | Atrofia Infiltrado linfoide atípico /Lesión específica | Inmunotinción: fenotipo aberrante (CE, M) Estudios de clonalidad (PCR) (CE, M) | Citometría de flujo: inmunofenotipo aberrante CD3¿+CD8− y monoclonalidad Cápsula endoscópica | M B |
| Otros linfomas B y Tb (p.ej., MALT) | Hiperplasia linfoide a infiltrado linfoide atípico /Lesión no siempre específica o no detectable con biopsias fórceps | Inmunotinciónb Subpoblaciones, proliferación y apoptosis | Técnicas de imagen Cápsula endoscópica Enteroscopia de doble balón Radiografía cross-sectional | B |
| Enteropatía por fármacos -Olmesartán | Enteritis linfocítica a atrofia /Lesión no específica | Inmunotinción CD3 (CE, M) | Serología celíaca negativa Estudio genético de enfermedad celíaca positivo 50-60% Normalización mucosa con la retirada del fármaco | B B A |
| Enfermedad de Whipple | Detección macrófagos tinción PAS+ alrededor de Tropheryma whipplei /Lesión específica | Inmunotinción PCR específica T. whipplei (CE, M) | Detección de T. whipplei en fluidos u otros tejidos afectados (sinovial, LCR, heces, etc.) | M |
| Amiloidosis | Amiloide en vasos de la submucosa y eventualmente en la mucosa /Lesión específica | Luz polarizada (rojo Congo) (CE, M) | Inmunohistoquímica para: proteínas AL (A. primaria) proteínas AA (A. secundaria) | M |
CE: calidad de la evidencia (A, alta; M, moderada; B, baja); PO: patrón oro.
Serología enfermedad celíaca: anticuerpos anti-endomisio, anti-transglutaminasa, anti-péptidos de gliadina deamidada. Los valores de sensibilidad (S) y especificidad (E) se refieren en general a la enfermedad celíaca con atrofia. En la enteritis linfocítica por enfermedad celíaca la sensibilidad puede ser tan baja como del 15%.
Esquemas de clasificación para la evaluación histopatológica de la enfermedad celíaca
| Marsh 199222 | Oberhuber 199923 | Corazza 200524 | Ensari 201025 |
|---|---|---|---|
| Tipo 1. Lesión infiltrativa | Tipo 1. Lesión infiltrativa | Grado A | Tipo 1 |
| Tipo 2. Hiperplasia criptas | Tipo 2. Hiperplasia criptas | Desaparece. Se añade a grado A | Desaparece. Se añade a tipo 1 |
| Tipo 3. Atrofia | Tipo 3. Atrofia Tipo 3A. Parcial Tipo 3B. Subtotal Tipo 3C. Total | Atrofia Grado B1 Grado B1 Grado B2 | Atrofia Tipo 2 Tipo 2 Tipo 3 |
| Tipo 4. Lesión destructiva | Tipo 4. Lesión destructiva | Obsoleta | Obsoleta |
Regla «4 de 5» para el diagnóstico de enfermedad celíaca, considerada el patrón oro
| 1. Síntomas típicos (p.ej., diarrea, retraso de crecimiento, anemia…) 2. Positividad de autoanticuerpos de clase A a títulos elevados (se acepta IgG si déficit de IgA, los Ac IgG anti-péptidos gliadina deamidada añaden mayor valor al diagnóstico) 3. Positividad de los genotipos HLA-DQ2 y/o HLA-DQ8 4. Enteropatía en la biopsia intestinal (incluye desde Marsh 1 —con serología positiva o asociada a depósitos subepiteliales de IgA— a Marsh 3) 5. Respuesta clínica y serológica a la dieta sin gluten (respuesta histológica en pacientes seronegativos) |
Fuente: modificado de Catassi y Fasano27.
Aparte de estas enfermedades, otras menos frecuentes como la a- o hipo-betalipoproteinemia o la hipogammaglobulinemia pueden ser también causa de diarrea. El diagnóstico se realiza generalmente en la edad pediátrica y raramente se sospecha por la enteropatía que producen, sino por el contexto clínico y los resultados analíticos (bajo nivel de apoproteínaB, triglicéridos y colesterol en el primer caso, e hipogammaglobulinemia con ausencia de linfocitosB en el segundo).
Recomendaciones(Para la calidad de la evidencia de cada prueba diagnóstica, véase tabla 6.)
- 1.
La determinación de anticuerpos antitransglutaminasa IgA es la prueba de elección para el cribado de enfermedad celíaca en un paciente con diarrea crónica (CE, alta; GR, fuerte).
- 2.
Si la serología celíaca es negativa, se sugiere valorar la presencia de HLA-DQ2.5, y si es positivo, tomar biopsias intestinales para descartar enfermedad celíaca (CE, moderada; GR, fuerte).
- 3.
En caso de sospecha manifiesta de síndrome de malabsorción está indicada la biopsia de duodeno distal para diagnosticar celiaquía u otros tipos de enteropatía (CE, moderada; GR, fuerte).
La diarrea por sobrecrecimiento bacteriano (SCB) se produce por malabsorción de nutrientes, tanto grasas como hidratos de carbono31,32. En determinadas condiciones de incremento del pH, de estasis o de reducción de la velocidad del tránsito intestinal, el recuento de bacterias en el intestino delgado proximal puede cambiar en calidad y en cantidad, produciendo cambios microambientales muy importantes. La flora habitual de lactobacilos, enterococos, grampositivos y anaerobios facultativos puede verse parcialmente sustituida por flora de tipo cólico (coliformes y anaerobios: Bacteroides y Clostridium). Consecuentemente se produce un incremento de enzimas, como colilamidasas y proteasas. Las colilamidasas desconjugan los ácidos biliares, que son más fácilmente absorbidos por difusión pasiva en el yeyuno proximal, lo que dificulta la generación de micelas, dando lugar a malabsorción de grasas. El incremento de las proteasas reduce enzimas de la superficie vellositaria, como las disacaridasas, ocasionando malabsorción de hidratos de carbono. Son muchas las enfermedades que pueden producir SCB. Se debe sospechar en cualquier situación asociada a una motilidad anormal, ya sea por alteración estructural (estenosis, by-pass, etc.) o funcional (seudoobstrucción, enteropatía diabética, etc.). El incremento de pH en el duodeno o yeyuno proximal (tratamiento con inhibidores de la bomba de protones [IBP], gastrectomía, gastritis atrófica) aumenta el riesgo de SCB por falta de la función bacteriostática del ácido. El papel del SCB en la fisiopatología del síndrome del intestino irritable (sobre todo con predominio de diarrea y/o distensión) es controvertido, pero es posible que juegue un papel fisiopatológico, al menos en un subgrupo de pacientes. A falta de datos claros, no se puede recomendar la investigación de SCB de forma sistemática en estos pacientes. En la tabla 9 se resumen las pruebas recomendadas para detectar sobrecrecimiento bacteriano. El recuento cuantitativo del aspirado duodenal/yeyunal se considera el patrón oro, pero no se puede emplear en la práctica clínica rutinaria por su complejidad. Alternativamente, la prueba que muestra una mejor precisión diagnóstica es la prueba del aliento con 14C/13CD-Xylosa, pero hay menos evidencia disponible que con las pruebas del aliento de hidrógeno33,34.
Pruebas recomendadas para detectar el sobrecrecimiento bacteriano
| Técnica | Precisión diagnóstica | Nivel evidencia | |
|---|---|---|---|
| Recuento cuantitativo del aspirado yeyunal | Técnica compleja. Recogida de muestra en condiciones especiales para anaerobios, evitando contaminación por bacterias de la orofaringe y siembra rápida para anaerobios y aerobios Sobrecrecimiento bacteriano >105UFC/ml en el yeyuno proximal Falsos positivos: recogida de la muestra en un divertículo Falsos negativos: recogida de la muestra proximal a la alteración estructural | Patrón oro | |
| Prueba del aliento de hidrógeno | Administración 50 g de glucosa: sobrecrecimiento bacteriano: >20ppm de H2 durante 2h postadministración Administración de 10 g de lactulosa: sobrecrecimiento bacteriano: >20ppm de H2 en los primeros 90min (pico precoz), o presencia de doble pico, o aumento sostenido >10ppm sobre el valor basal Falsos negativos: Flora no productora de H2 Falsos positivos: Tránsito oro-cecal muy rápido (p.ej., gastrectomía) | S, 62,5% E, 81,8% S, 52,5% E, 85,7% | A |
| Prueba del aliento D-xilosa C14 | Administración de 1 gr de C14 unido a D-xilosa Sobrecrecimiento bacteriano: detección de C14 en el aire espirado Menos falsos positivos para la D-xilosa. Se absorbe en el intestino delgado y no llega al colon | S y E, ∼ 85-90% | A |
E: especificidad; S: sensibilidad; UFC: unidad formadora de colonias.
Se ha propuesto la utilización de una prueba terapéutica con antibióticos para el diagnóstico de SCB cuando la probabilidad pretest es elevada (causa predisponente clara y presentación clínica apropiada)33. Pero hay que tener en cuenta que, en general, el SCB se debe tratar de forma cíclica y, por lo tanto, es recomendable disponer de una prueba diagnóstica objetiva.
Recomendaciones- 1.
El test del aliento de hidrógeno presenta una sensibilidad baja pero una especificidad adecuada en el diagnóstico del SCB, siendo de utilidad si el resultado es positivo. El test del aliento de hidrógeno con glucosa es el recomendado (CE, alta; GR, fuerte).
- 2.
Se sugiere la utilización de una prueba terapéutica con antibióticos para el diagnóstico de SCB cuando la probabilidad pre-test es elevada (causa predisponente clara y presentación clínica apropiada) y el test del aliento de hidrógeno es negativo o no está disponible (CE, baja; GR, débil).
La deficiencia de enzimas pancreáticas resulta en malabsorción de los alimentos ingeridos (especialmente grasas), lo que provoca disminución de la consistencia de las heces y aumento del volumen diario. Se considera esteatorrea una eliminación de grasa >7g/día cuando se hace una dieta que aporta 100g de grasa al día (coeficiente de absorción de grasa <93%). La esteatorrea de causa pancreática solo se produce cuando queda muy poca reserva funcional35. Una esteatorrea moderada puede no asociarse a diarrea. Muchos pacientes con pancreatitis crónica o fibrosis quística e insuficiencia pancreática grave tienen estreñimiento. La diarrea secundaria a enfermedad pancreática primaria no suele ser voluminosa, casi nunca es acuosa (puede ser aceitosa) y se reduce con el ayuno. Los pacientes pueden perder peso pero no tienen anorexia, a no ser que la insuficiencia pancreática se deba a un cáncer de páncreas.
La insuficiencia pancreática puede ser primaria (debida a enfermedad pancreática) o secundaria. En este último caso la falta de niveles óptimos de enzimas tan solo es parcialmente responsable de la diarrea. Aun así, la administración de enzimas puede mejorar los síntomas, como en casos de gastrectomía, diabetes mellitus y cáncer de páncreas. La tabla 10 detalla las causas de insuficiencia pancreática. La causa primaria más frecuente es la pancreatitis crónica, seguida de la fibrosis quística y del cáncer de páncreas.
Causas de insuficiencia pancreática exocrina
| Causas primarias 1. Pancreatitis crónica 2. Fibrosis quística 3. Cáncer de páncreas 4. Pancreatitis aguda (generalmente de forma temporal) 5. Obstrucción ductal (incluso ampuloma, quistes y TPMI) 6. Pancreatectomía 7. Atrofia pancreática senil, atrofia adquirida (malnutrición severa persistente) o congénita (SBD, Johanson-Blizzar, lipomatosis pancreática, agenesia páncreas dorsal, MODY) Causas secundarias 1. Enfermedad celíaca y otras enteropatías (enfermedad de Crohn, inmunodeficiencia común variable con afectación intestinal, enteritis eosinofílica, etc.) 2. Gastrectomía - derivación pancreática (asincronía poscibal) 3. Síndrome de Zollinger-Ellison 4. Fármacos (octreótido en tratamiento prolongado) De origen incierto 1. Diabetes mellitus 2. Síndrome de intestino irritable 3. Insuficiencia renal crónica |
Abordaremos el diagnóstico de insuficiencia pancreática como causa de diarrea crónica y no como elemento diagnóstico de pancreatitis crónica. Se han descrito más de 20 pruebas para evaluar la insuficiencia pancreática, pero ninguna es del todo satisfactoria en la práctica clínica. Algunas habían sido pruebas de referencia (estimulación con secretina-ceruleína) o se habían utilizado (quimiotripsina fecal), pero hoy están en desuso. En cuanto a las pruebas de uso clínico frecuente, cabe destacar que los parámetros de sensibilidad, especificidad y valores predictivos dependen mucho del valor de referencia elegido (esteatorrea versus diagnóstico de pancreatitis crónica) y de la enfermedad de base (fibrosis quística, pancreatectomía, pancreatitis crónica, etc.).
Pruebas que pueden aportar información clínica relevante- 1.
Niveles de amilasa, lipasa y tripsina en suero. Tienen poca popularidad debido a su baja sensibilidad. Sin embargo, cifras bajas son indicativas y específicas (>90%) de insuficiencia exocrina primaria, particularmente en pacientes con fibrosis quística, pancreatitis crónica evolucionada, cáncer de páncreas y síndrome de Shwachman-Diamond. Dado que para ocasionar diarrea la función pancreática debe estar muy deteriorada, es posible que en situaciones de diarrea crónica la sensibilidad de las enzimas pancreáticas no sea tan mala, pero esta eventualidad no ha sido estudiada.Evidencias. En niños con fibrosis quística, niveles bajos de lipasa y tripsina se correlacionan con esteatorrea36, con sensibilidad del 95 y del 93% y especificidad del 86 y del 92%37. En enfermos con pancreatitis crónica, niveles bajos de tripsina o amilasa tienen una sensibilidad del 70-85% para detectar esteatorrea38, pero menor del 50% para detectar insuficiencia exocrina leve medida por el test de estimulación con secretina39. La especificidad es del 90-100% para esteatorrea pancreática40. Una actividad de lipasa sérica baja o indosificable es característica del déficit congénito de lipasa, enfermedad que cursa con esteatorrea y elastasa fecal normal.
- 2.
Determinación de la concentración de elastasa pancreática fecal. Es la prueba más utilizada para detectar insuficiencia pancreática y la recomendada en una guía clínica inglesa de diarrea crónica5. Se determina la concentración de elastasa pancreática humana (no la actividad enzimática) en heces. Los resultados no varían con el tratamiento con enzimas pancreáticas. Es una prueba sencilla, económica y reproducible (15% de variabilidad individual)41. Su determinación en heces líquidas ocasiona falsos positivos. Se consideran normales niveles superiores a 200μg/g de heces, mientras que niveles <100 indican insuficiencia pancreática grave. Valores entre 100 y 200 son indicativos de posible pancreatopatía, pero deben evaluarse en el contexto general del enfermo. Los datos de sensibilidad y especificidad son controvertidos, pero en general se considera una prueba útil para detectar insuficiencia pancreática grave, que es la situación clínica que se puede acompañar de diarrea crónica en ausencia de otros factores (p.ej., sobrecrecimiento bacteriano). En una primera estimación se encontró que por debajo de 200μg/g la sensibilidad era del 63% para insuficiencia leve y del 100% para insuficiencia moderada-grave (comparado con la prueba de secretina-ceruleína), con una especificidad del 93%, y con muy buena correlación con la secreción enzimática y de bicarbonato41. Cifras inferiores a 100μg/g tienen una sensibilidad y especificidad para esteatorrea del 93 y del 81%42. En pacientes con pancreatoduodenectomía cifras de elastasa fecal <200μg/g ya se acompañan de esteatorrea42. La sensibilidad para detectar esteatorrea en estos casos es del 91%, pero su especificidad es solo del 35%43. El motivo de esta diferencia en estos casos es que a la insuficiencia exocrina se añaden alteraciones anatómicas que dificultan la mezcla óptima de los nutrientes con ácidos biliares y con la secreción de enzimas y bicarbonato del remanente pancreático (asincronía poscibal).
- 3.
Quimiotripsina fecal. Actividades enzimáticas <3U/g tienen una especificidad del 49-100% y una sensibilidad del 50-90% para diagnosticar pancreatitis crónica. La especificidad para enfermedad pancreática es muy alta (90-100%) tanto para evaluar el origen de una esteatorrea44 como para detectar insuficiencia pancreática en pacientes con fibrosis quística45. Detecta insuficiencia pancreática en pacientes con pancreatitis crónica con una sensibilidad del 69% y una especificidad del 89%41. Si la diarrea es acuosa, da falsos positivos. Tiene una comercialización escasa.
- 4.
Prueba de aliento con triglicéridos marcados con C13. Se analiza la concentración de C13 en el aire exhalado tras ingesta de triglicéridos marcados isotópicamente. Su sensibilidad es del 89% y su especificidad del 81% para el diagnóstico de esteatorrea pancreática46. Cuando se ha comparado con pruebas de secreción directa (secretina-ceruleína), o con elastasa y quimiotripsina fecal, la especificidad y la sensibilidad para diagnosticar insuficiencia pancreática grave son del 85 y del 100%, pero tan solo del 69 y del 46% para insuficiencia moderada. Estos datos no mejoran los de la elastasa fecal47. La presencia de sobrecrecimiento bacteriano puede dar falsos negativos, particularmente en pacientes con pancreatectomía48. Otros factores que falsean los resultados son una dieta previa con nutrientes ricos en C13, vaciamiento gástrico anormal, el ejercicio físico y la producción basal de CO2. Inconvenientes son la longitud de la prueba (de 6 a 8h), el hecho de no poder comer nada ni hacer ejercicio, y la necesidad de personal especializado.
- 5.
Grasa total en heces y coeficiente de absorción de grasa. La cuantificación de la grasa en heces es un buen parámetro de insuficiencia exocrina cuando ya sabemos que hay lesión parenquimatosa pancreática. Se mide la grasa total en heces durante 72h, estando el enfermo con una dieta de 100g de grasa/día desde 2días previos al inicio de la recogida. Una grasa fecal >7g/día denota esteatorrea (coeficiente de absorción de grasa <93%). Aunque es la prueba de referencia para el diagnóstico de esteatorrea43, no es específica de pancreatopatía.
- 6.
Prueba de función pancreática endoscópica. Tan solo se ha optimizado en algunos centros. Se recoge la secreción pancreática vertida al duodeno mediante un endoscopio a intervalos de tiempo en respuesta a estimulación con secretina o ceruleína. Se ha mostrado una sensibilidad del 83% y especificidad del 87% para el diagnóstico de pancreatitis crónica49. Existe una versión reducida (15min de recogida de la secreción) con resultados satisfactorios50.
- 7.
Resonancia magnética con infusión de secretina. Se cuantifica la secreción duodenal en respuesta a secretina. Los resultados discriminan enfermos (pancreatitis crónica) de voluntarios sanos51, y se correlacionan con elastasa fecal52. Esta prueba solo mide volumen y no está estandarizada.
- 8.
Pruebas morfológicas. A más alteraciones en las pruebas de imagen, más reducción de la función pancreática. La insuficiencia sin alteraciones morfológicas es posible, pero rara. La correlación con pruebas directas de función es buena, pero no perfecta53,54. En resecciones pancreáticas parciales (estudios de función pancreática difíciles o imprecisos) la relación entre el diámetro del conducto principal y el grosor del parénquima se relaciona bien con insuficiencia exocrina55.
- 9.
Respuesta al tratamiento con enzimas pancreáticas. Este parámetro se emplea cuando existe sospecha fundada de insuficiencia pancreática y otras pruebas no aportan el diagnóstico concluyente. Es útil como elemento confirmatorio. Por ejemplo, en un grupo de enfermos con síndrome de intestino irritable con predominio de diarrea, un 6% tenía elastasa fecal <100mg/g y los síntomas mejoraron con tratamiento enzimático56.
- 1.
En el estudio de diarrea crónica la determinación de elastasa fecal en muestras no acuosas de heces debería ser la prueba de elección para evaluar insuficiencia pancreática exocrina (CE, alta; GR, fuerte). El estudio con triglicéridos marcados puede ser una alternativa en centros que tengan esta prueba validada (CE, moderada; GR, débil).
- 2.
Si los resultados del punto 1 son indeterminados, la presencia de alteraciones morfológicas del páncreas en pruebas de imagen puede indicar el diagnóstico de insuficiencia pancreática exocrina (CE, baja; GR, fuerte).
- 3.
En casos de diagnóstico no concluyente o cuando la insuficiencia pancreática es tan solo un factor más causante de diarrea crónica, puede estar indicado hacer una prueba terapéutica con enzimas pancreáticas (CE, baja; GR, bajo).
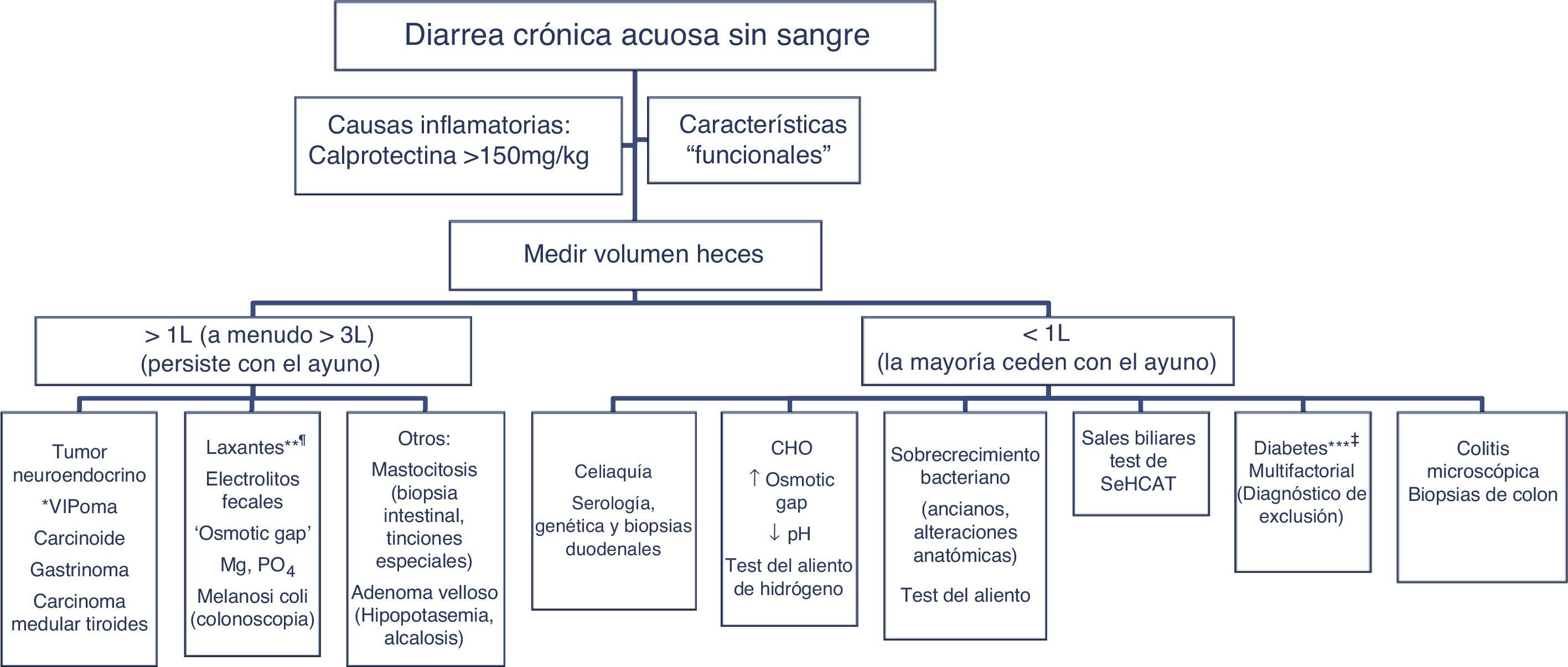
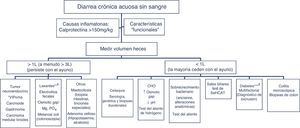
Los pacientes con diarrea crónica acuosa sin sangre con características de organicidad (tabla 3) se diagnostican en base a la estrategia diagnóstica descrita en el algoritmo 5 (fig. 5). En general, se trata de diarreas secretoras que se caracterizan por diarrea líquida de gran volumen, a menudo >1l por día; por persistencia de la diarrea después del ayuno, y porque en el análisis del agua fecal la osmolaridad medida es idéntica a la calculada a partir de los electrólitos presentes (ver más adelante)57. Dentro de los agentes que producen secreción y pueden causar diarrea crónica se encuentran una serie de hormonas y sustancias producidas por tumores neuroendocrinos (tabla 11)57-59. Sin embargo, estos tumores son causas muy poco frecuentes de diarrea crónica acuosa secretora, con una prevalencia entre 1 por 5.000 a 1 por 500.000 pacientes con diarrea crónica, dependiendo del tipo de tumor.
Algoritmo 5. Enfoque diagnóstico de la diarrea crónica acuosa sin sangre.
Otras causas de <1l/día: medicamentos, hipertiroidismo, alcohol.
* Frecuencia de falsos positivos de un panel de niveles de péptido séricos del 45% (valor predictivo positivo <1%); solo pedir estos niveles si hay síntomas o signos de un síndrome tumoral (tabla 11) o si presentan un tumor en TC/RM o en Octreoscan.
** Puede ser de grande o bajo volumen dependiendo de la dosis ingerida, puede responder al ayuno. El hallazgo de melanosis coli en la colonoscopia sugiere el uso de laxantes antraquinónicos como senna y cáscara sagrada.
*** La diarrea en pacientes diabéticos puede ser de origen multifactorial: ingesta de fructosa en exceso, sobrecrecimiento bacteriano, riesgo aumentado de celiaquía y colitis microscópica en DM tipo1, uso de algunos fármacos (metformina, acarbosa), neuropatía vegetativa.
CHO: hidratos de carbono (lactosa, fructosa y/o sorbitol).
Tumores neuroendocrinos productores de diarrea crónica y sus marcadores
| Tumor | Síntomas típicos | Marcador tumoral |
|---|---|---|
| Gastrinoma | Síndrome de Zöllinger-Ellison: úlcera péptica, diarrea, esteatorrea | Gastrina |
| VIPoma | Síndrome de Verner-Morrison: diarrea (>3l/día), hipokaliemia, hipoclorhidria | VIP |
| Carcinoma medular tiroides | Masa tiroidea | Calcitonina, prostaglandinas |
| Carcinoide | Flushing, broncoespasmo, valvulopatía derecha | Serotonina, cininas |
| Somatostinoma | Diabetes mellitus, litiasis biliar, esteatorrea | Somatostatina |
| Glucagonoma | Erupción cutánea (eritema migratorio necrosante), diabetes | Glucagón |
| Mastocitosis | Flushing, urticaria pigmentosa, dolor abdominal, vómitos | Histamina |
Algunos pacientes presentan diarrea crónica secretora por abuso de laxantes, que puede ser de gran volumen, o no, dependiendo de la dosis ingerida, y pueden «mejorar» con el ayuno. Estos casos deben sospecharse en las siguientes situaciones60,61: a)pacientes bulímicos (en general, mujeres jóvenes o adolescentes preocupadas por el peso corporal o con trastornos de alimentación reconocidos); b)pacientes que buscan un beneficio secundario (económico, manipulación familiar); c)síndrome de Münchausen (pacientes con necesidad psicológica de ser un reto diagnóstico), y d)síndrome de Polle (síndrome de Münchausen por poderes: niños o adultos dependientes a los que un cuidador administra laxantes para conseguir un beneficio propio).
En caso de diarrea crónica secretora asociada a hipokaliemia y alcalosis metabólica debe sospecharse la posibilidad de adenomas vellosos de gran tamaño.
DiagnósticoEl análisis rutinario de péptidos gastrointestinales en sangre/orina no está recomendado en el proceso diagnóstico de pacientes con diarrea crónica, ya que un 45% de estos pacientes pueden presentar valores falsamente positivos62. Si además tenemos en cuenta que la probabilidad pretest de presentar tumores neuroendocrinos como causa de diarrea crónica secretora es muy baja, resulta que el valor predictivo positivo de estos análisis es inferior al 1%. Por tanto, la determinación sérica de estos péptidos o de sus metabolitos urinarios debería limitarse a aquellos pacientes con diarrea crónica y síntomas o signos consistentes con un síndrome tumoral (tabla 11) o con evidencia de un tumor neuroendocrino en una prueba de imagen (TC, RM, USE). La mayoría de los tumores neuroendocrinos producen cromograninaA; sin embargo, su determinación rutinaria tiene poco valor diagnóstico, ya que se han descrito niveles elevados en otras neoplasias (páncreas, próstata, pulmón de célula pequeña), insuficiencia renal, SII-D, EII, colitis colágena, así como en gastritis atróficas y con en el uso de IBP, probablemente por hiperplasia de células enterocromafines63,64. Se considera que la especificidad de este marcador para el diagnóstico de un tumor neuroendocrino es solo del 10-35%, y que su sensibilidad oscila alrededor del 60%63. La gammagrafía con octreótido marcado (Octreoscan) puede ser útil para identificar los tumores neuroendocrinos productores de péptidos65.
El hallazgo de melanosis coli en la colonoscopia sugiere la toma habitual de laxantes antraquinónicos como senna y cáscara sagrada. Sin embargo, el hallazgo de «pseudomelanosis coli» en el estudio histológico de las biopsias de un colon macroscópicamente normal es inespecífica y se ha descrito asociada a un aumento de apoptosis epitelial secundaria al uso de este tipo de laxantes, pero también de otros fármacos66. El abuso de laxantes a base de sales de magnesio o de fosfatos y sulfatos puede detectarse por el análisis de electrólitos y del gap osmótico en agua fecal67. El gap osmótico normal en las heces, que es la diferencia entre la osmolalidad de las heces (290mOsm) y 2 veces las concentraciones de Na++ y K+ en el agua fecal, es de 50 a 125. En las diarreas secretoras el gap osmótico es menor de 50, mientras que en las diarreas osmóticas es >125. Los pacientes con diarrea inducida por Mg2++ presentan un gap osmótico elevado y niveles de Mg2+ fecal >50mmol/l. Las diarreas inducidas por aniones sódicos (Na2SO4, Na2PO4) imitan una diarrea secretora que puede diagnosticarse determinando la concentración de Cl− en el agua fecal, que se halla disminuida (en general, <20mmol/l).
La diarrea facticia también puede fingirse añadiendo agua u orina a las muestras de heces, lo que puede detectarse midiendo la osmolalidad fecal, que estará disminuida (<250mOsm) si hay contaminación con orina hipotónica o agua, o aumentada (>375mOsm) si hay contaminación con orina concentrada. En casos altamente sospechosos pueden ser necesarios métodos espectrofotométricos o cromatográficos para determinar la presencia de laxantes en muestras de heces u orina.
Recomendaciones- 1.
El valor predictivo positivo de la determinación de un panel de péptidos séricos para el cribado de un tumor neuroendocrino en pacientes con diarrea crónica acuosa es inferior al 1%, por lo que no se recomienda su utilización rutinaria (CE, moderada; GR, fuerte).
- 2.
El TC y RM son útiles para el diagnóstico y la estatificación de los tumores neuroendocrinos. La gammagrafía con octreótido marcado (Octreoscan) puede ser útil para identificar el tumor neuroendocrino funcionante (CE, alta; GR, fuerte).
- 3.
La determinación rutinaria de cromograninaA en pacientes con diarrea crónica acuosa tiene poco valor diagnóstico por su baja especificidad (CE, alta; GR, fuerte).
- 4.
El hallazgo de «pseudomelanosis coli» en el estudio histológico de las biopsias de un colon macroscópicamente normal es inespecífica y no debe ser considerada como un marcador de abuso de laxantes, ya que se ha descrito asociada también al consumo de otros fármacos (CE, moderada; GR, fuerte).
- 5.
Calcular el gap osmótico fecal puede ser de ayuda en el diagnóstico de las diarreas crónicas acuosas de gran volumen (CE, moderada; GR, fuerte).
La diarrea crónica funcional se define como la presencia de heces blandas o líquidas de forma continua o recurrente y que se presentan desde hace más de 4 semanas sin una causa orgánica aparente. Si además los síntomas se presentan desde hace al menos 6 meses y en más del 75% de las deposiciones en los últimos 3meses, se puede establecer el diagnóstico de diarrea funcional atendiendo a los criterios diagnósticos de los trastornos funcionales digestivos de RomaIII. Según estos mismos criterios, si la diarrea se acompaña de dolor abdominal que mejora o se asocia con las heces diarreicas, se puede establecer el diagnóstico de síndrome del intestino irritable con predominio de diarrea68.
La diarrea funcional puede afectar a aproximadamente al 5% de la población general68, y su diagnóstico diferencial debe establecerse con múltiples patologías que pueden provocar diarrea crónica (tabla 12) (algoritmo 6, fig. 6). En pacientes jóvenes, sin síntomas o signos de alarma, con exploración física normal y con diarrea leve sin síntomas nocturnos y con escaso impacto en las actividades cotidianas de los pacientes, sería suficiente con realizar una analítica general que incluya serología para enfermedad celíaca y una determinación de parásitos en heces. Si los síntomas son persistentes, incapacitantes o alteran significativamente la calidad de vida de los pacientes es necesario realizar otras exploraciones para descartar organicidad (tabla 13)7,69-72. Existen enfermedades de base orgánica que pueden simular una diarrea funcional, como la colitis microscópica, la diarrea colerética o la diarrea por malabsorción de azúcares, que se discutirán a continuación.
Diagnóstico diferencial de la diarrea funcional
| Diarrea inducida por fármacos |
| Malabsorción de azúcares Lactosa Fructosa-sorbitol |
| Malabsorción de ácidos biliares |
| Colitis microscópica |
| Enfermedad celiaca |
| Giardiasis |
| Sobrecrecimiento bacteriano |
| Insuficiencia pancreática exocrina |
| Enfermedad inflamatoria intestinal |
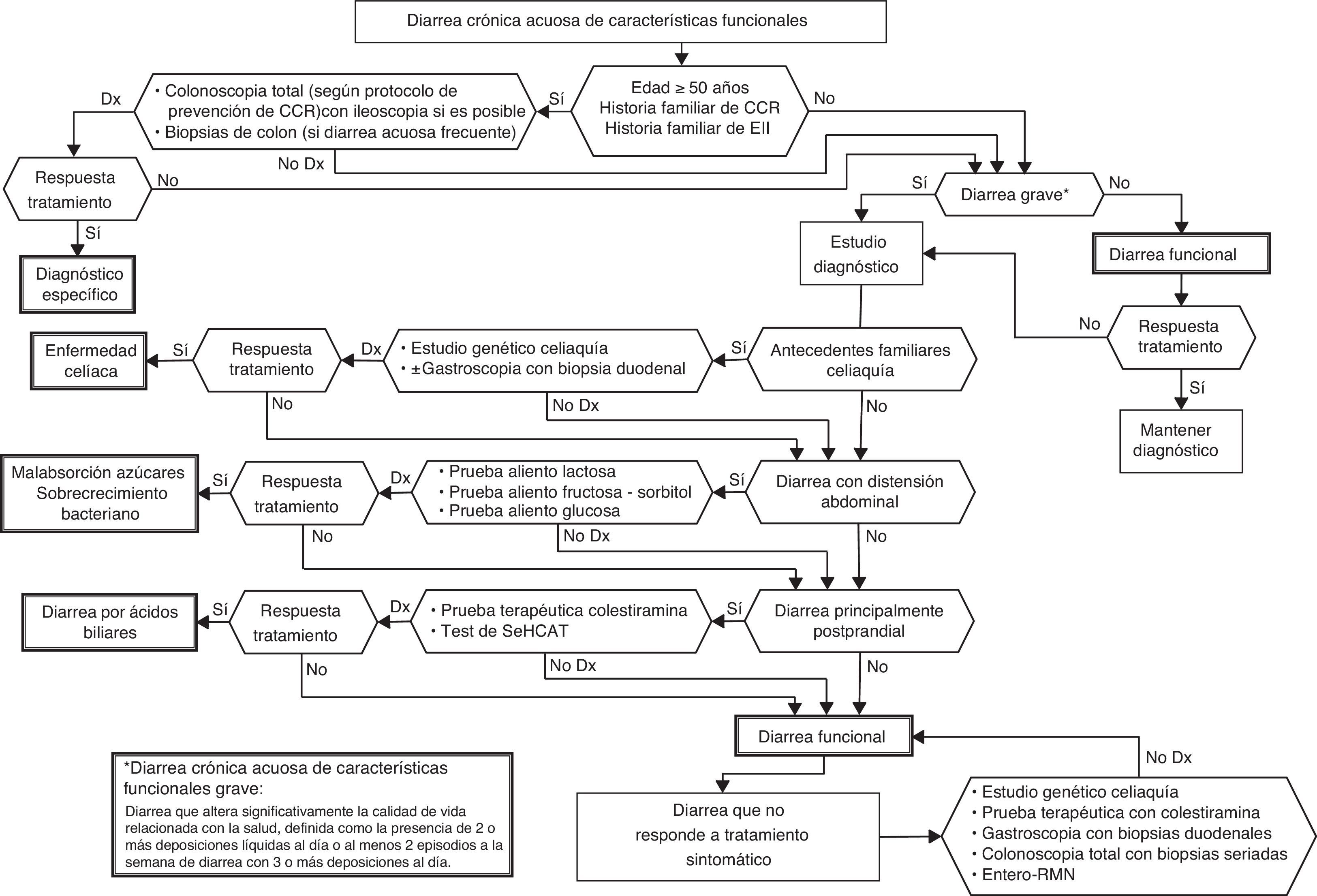
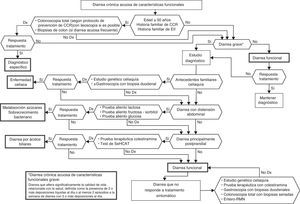
Algoritmo 6. Enfoque diagnóstico de la diarrea acuosa de «características» funcionales.
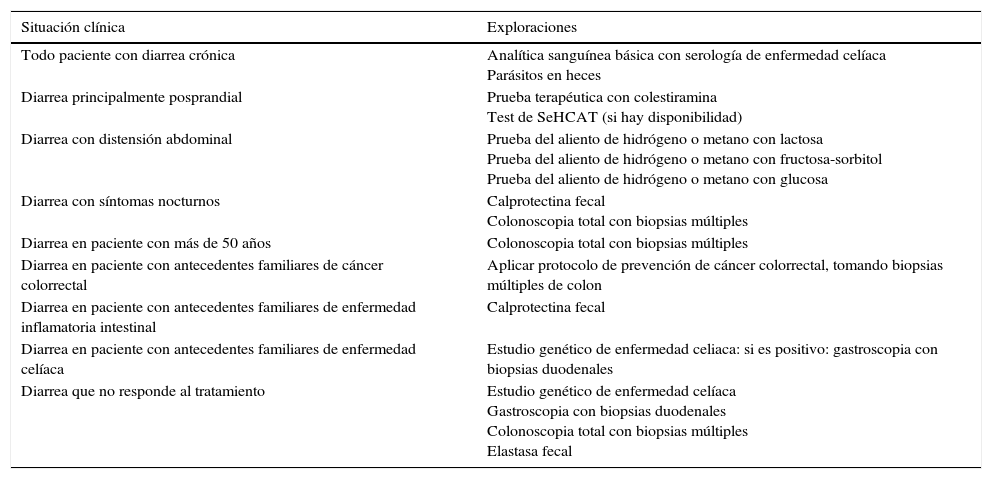
Todos los pacientes con diarrea crónica sin signos o síntomas de alarma, en los que no se detecten alteraciones analíticas (incluyendo serología de enfermedad celíaca) ni parásitos en heces, tienen en principio una diarrea funcional. En estos pacientes, si tienen 50 o más años de edad o tienen antecedentes familiares de cáncer colorrectal (CCR), es recomendable hacer colonoscopia total, dentro del protocolo de cribado de CCR en población de riesgo medio, con toma de biopsias múltiples para descartar colitis microscópica en aquellos con diarrea acuosa frecuente. También los antecedentes familiares de enfermedad inflamatoria intestinal serán una indicación para hacer colonoscopia total con ileoscopia. En estos casos, si las exploraciones no detectan patología, se actuará como con los pacientes menores de 50 años y sin antecedentes familiares, lo que significa que si la diarrea no es grave estableceremos el diagnóstico de diarrea funcional y los trataremos como tal. En los pacientes con diarrea grave es conveniente realizar algunos estudios diagnósticos. Así, si los pacientes tienen antecedentes familiares de enfermedad celíaca es recomendable realizar estudio genético de celiaquía (HLA-DQ2/8) y, en caso de ser positivo, hacer biopsias duodenales. En pacientes con diarrea con distensión abdominal debemos tener en cuenta que a pesar de que la distensión puede darse en multitud de trastornos funcionales digestivos, su presencia hará recomendable realizar pruebas del aliento de hidrógeno para descartar intolerancia a azúcares (lactosa o fructosa-sorbitol) o para descartar sobrecrecimiento bacteriano. En pacientes con diarrea principalmente posprandial debemos considerar que aunque la diarrea posprandial puede ser común en los trastornos funcionales digestivos, su presencia nos obliga a descartar una malabsorción de ácidos biliares, idealmente mediante test de SeHCAT, y si no al menos mediante prueba terapéutica con colestiramina. Si las exploraciones no son diagnósticas, o bien siendo diagnósticas el paciente no respondiera al tratamiento, debemos mantener el diagnóstico de diarrea funcional. Todos los pacientes con diarrea funcional grave sin diagnóstico que no respondan al tratamiento sintomático, deben someterse a un estudio completo para descartar malabsorción de ácidos biliares, enfermedad celíaca, colitis microscópica o enfermedad inflamatoria intestinal.
Exploraciones recomendadas en el manejo del paciente con sospecha de diarrea funcional
| Situación clínica | Exploraciones |
|---|---|
| Todo paciente con diarrea crónica | Analítica sanguínea básica con serología de enfermedad celíaca Parásitos en heces |
| Diarrea principalmente posprandial | Prueba terapéutica con colestiramina Test de SeHCAT (si hay disponibilidad) |
| Diarrea con distensión abdominal | Prueba del aliento de hidrógeno o metano con lactosa Prueba del aliento de hidrógeno o metano con fructosa-sorbitol Prueba del aliento de hidrógeno o metano con glucosa |
| Diarrea con síntomas nocturnos | Calprotectina fecal Colonoscopia total con biopsias múltiples |
| Diarrea en paciente con más de 50 años | Colonoscopia total con biopsias múltiples |
| Diarrea en paciente con antecedentes familiares de cáncer colorrectal | Aplicar protocolo de prevención de cáncer colorrectal, tomando biopsias múltiples de colon |
| Diarrea en paciente con antecedentes familiares de enfermedad inflamatoria intestinal | Calprotectina fecal |
| Diarrea en paciente con antecedentes familiares de enfermedad celíaca | Estudio genético de enfermedad celiaca: si es positivo: gastroscopia con biopsias duodenales |
| Diarrea que no responde al tratamiento | Estudio genético de enfermedad celíaca Gastroscopia con biopsias duodenales Colonoscopia total con biopsias múltiples Elastasa fecal |
Colitis microscópica (CM) es un término genérico que incluye 2 entidades principales: colitis colágena (CC) y colitis linfocítica (CL). Describe una forma de enfermedad inflamatoria intestinal con curso crónico y recidivante caracterizada por la tríada: a)diarrea acuosa sin sangre, crónica o intermitente; b)mucosa colónica en la colonoscopia macroscópicamente normal o casi normal, y c)hallazgos histopatológicos característicos (tabla 14)73.
Criterios histopatológicos diagnósticos de colitis microscópica
| Colitis colágena Banda colágena subepitelial >10micras Número de linfocitos intraepiteliales >7 por 100 células epiteliales Lesión epitelial (desprendimiento, aplanamiento) Infiltrado inflamatorio crónico lámina propia Colitis linfocítica Número de linfocitos intraepiteliales >20 por 100 células epiteliales Lesión epitelial (desprendimiento, aplanamiento) Infiltrado inflamatorio crónico lámina propia Banda colágena subepitelial <10micras |
En estas entidades la clínica es, en general, superponible a una diarrea funcional o a un síndrome de intestino irritable, y la analítica general suele ser normal. Tanto la CC como la CL se han considerado enfermedades poco frecuentes, estando muchos clínicos y patólogos poco familiarizados con este diagnóstico. En un estudio epidemiológico realizado en España se observó una incidencia media anual de CM de 4,8/105 habitantes/año74. Aunque pueden presentarse en personas jóvenes, el pico de incidencia se observa en mujeres de 60años o más, en las que la incidencia es superior a la de la enfermedad de Crohn y la colitis ulcerosa. En estas franjas de edad la CM es un diagnóstico frecuente y debería ser considerada como una de las primeras opciones en el diagnóstico diferencial de una diarrea crónica acuosa sin sangre.
¿Cómo se obtiene el diagnóstico?La toma de biopsias escalonadas de un colon macroscópicamente normal en todo paciente con diarrea crónica acuosa sin sangre es el estándar de oro para el diagnóstico de CC y CL73. Esta práctica rutinaria permite diagnosticar CM entre un 8 y 16% de los pacientes con diarrea crónica acuosa sin sangre remitidos para la práctica de una colonoscopia74-78, cifra que llega al 17% en mujeres de 50años o más y al 23% en hombres de 70años o más78. Los criterios histopatológicos diagnósticos han demostrado ser consistentes y presentar una excelente reproducibilidad interindividual e intraindividual para discriminar entre CM, histología normal y otros (grado de concordancia entre patólogos >90%)79,80, mientras que la capacidad para discriminar entre CC, CL y colitis microscópica incompleta (CMi) parece ser un poco más baja (grado de concordancia, 70-80%)80.
Un estudio reciente sugiere que para hacer el diagnóstico de CC y CL debe haber al menos 2 biopsias diagnósticas en 2 segmentos del colon, pero que en las otras biopsias y segmentos debe existir al menos inflamación crónica en lámina propia81. En este estudio se evidenció que solo el 47% de los pacientes con biopsias de 5 segmentos del colon tenían una banda colágena diagnóstica (>10micras) en todos ellos. Asimismo, se demostró que la toma de biopsias de colon ascendente, transverso y descendente se acompañaba de un rendimiento diagnóstico del 96,2%, superior a otras estrategias de toma de biopsias. En este sentido, se recomienda tomar biopsias de al menos colon derecho, colon transverso y colon izquierdo (2 muestras de cada segmento) en botes separados.
Recomendaciones- 1.
La toma de biopsias escalonadas de un colon macroscópicamente normal en todo paciente con diarrea crónica acuosa sin sangre es el patrón de oro para el diagnóstico de CC y CL (CE, moderada; GR, fuerte).
- 2.
Se recomienda tomar biopsias de al menos colon derecho, colon transverso y colon izquierdo (2 muestras de cada segmento) en botes separados (CE, moderada; GR, fuerte).
Los ácidos biliares son sintetizados en el hígado, secretados por la bilis y liberados a nivel duodenal, donde facilitan la absorción de las vitaminas liposolubles y contribuyen a la digestión de las grasas. Posteriormente son reabsorbidos en el íleon terminal para regresar al hígado mediante la circulación enterohepática. Menos del 5% alcanzan el colon82. Una elevada concentración de ácidos biliares en el colon da lugar a un aumento del movimiento de agua y electrólitos a la luz intestinal y de la motilidad colónica, provocando diarrea83. La clínica que encontraremos será una diarrea crónica acuosa y secretora que puede asociarse a dolor abdominal, distensión, urgencia, incontinencia, defecación nocturna y, rara vez, esteatorrea82,83.
La malabsorción de ácidos biliares (MAB) es una causa común y poco reconocida de diarrea crónica82. Entre el 20 y el 50% de los pacientes con diarrea crónica de características funcionales (diarrea funcional, síndrome del intestino irritable con predominio de diarrea o alternante) presentan MAB. Esta MAB en presencia de un íleon estructuralmente normal se ha denominado clásicamente tipo2, primaria o idiopática. En contraposición, la MAB asociada a enfermedad o resección ileal se conoce como tipo1 o secundaria. Es muy prevalente en pacientes con enfermedad de Crohn (30%) o enteritis radica (>50%) y casi constante después de una resección ileal (90%)84,85. La MAB también se asocia con frecuencia a la colitis microscópica (10-60%)86, y es la principal causa de diarrea crónica poscolecistectomía. Finalmente, se ha descrito la asociación de MAB a una miscelánea de trastornos como la cirugía del ulcus péptico, enfermedad celíaca, pancreatitis crónica, diabetes mellitus, fibrosis quística y al uso de algunos fármacos (p.ej., AINE, colchicina u olsalacina). Cuando se presenta junto a estos trastornos, se ha denominado MAB tipo3 o secundaria a trastornos gastrointestinales. Se ha observado también que la MAB es una causa común, y a menudo subestimada, de síntomas gastrointestinales asociados a tratamientos oncológicos87.
DiagnósticoEl método diagnóstico más utilizado en Europa (no disponible en EE.UU.) es el test de 75Se-homotaurocolato (SeHCAT). Este test valora, mediante gammagrafía, la retención abdominal de un ácido biliar marcado con selenio (75Se-homotaurocolato) administrado por vía oral. Su precisión diagnóstica es elevada, y un valor alterado predice una buena respuesta a los quelantes de ácidos biliares. La retención del marcador <10% al 7.°día presenta una alta sensibilidad (80-90%) y especificidad (70-100%)72,82,88. Los inconvenientes son la exposición a radiaciones (equivalente a una radiografía de tórax) y la necesidad de utillaje especializado.
La prueba terapéutica con quelantes de ácidos biliares (colestiramina), aunque frecuentemente utilizada, se ve limitada por la ausencia de estudios que hayan valorado su precisión diagnóstica y la necesidad de establecer un diagnóstico definitivo en un trastorno que a menudo requerirá un tratamiento a largo plazo82,88,89. En caso de realizarla, sería recomendable iniciar el tratamiento con quelantes de ácidos biliares a dosis bajas y progresivas y monitorizar la respuesta.
Recomendaciones- 1.
Se recomienda evaluar la presencia de MAB en pacientes con diarrea crónica de características funcionales (diarrea funcional, síndrome del intestino irritable con predominio de diarrea), en enfermedades intestinales de localización ileal (enfermedad de Crohn y enteritis radica) y en la colitis microscópica (CE, moderada; GR, fuerte).
- 2.
La presencia de MAB es prácticamente universal en la diarrea crónica poscolecistectomía o después de una resección ileal, por lo que en estas circunstancias se puede recomendar el tratamiento empírico (CE, baja; GR, fuerte).
- 3.
La prueba diagnóstica recomendable es el test de SeHCAT (CE, moderada; GR, fuerte).
- 4.
Se sugiere utilizar la prueba diagnóstica con colestiramina si no está disponible el test de SeHCAT (CE, muy baja; GR, débil).
La malabsorción de hidratos de carbono puede ocasionar síntomas de intolerancia digestiva de tipo diarrea, dolor abdominal, náuseas y meteorismo. Los azúcares más frecuentemente implicados son la lactosa, la fructosa y el sorbitol. En una pequeña proporción de casos se trata de enfermedades congénitas raras que afectan a las disacaridasas (lactasa, sacarasa-isomaltasa, trehalasa, aldolasaB) o al transportador intestinal (p.ej., la malabsorción congénita de glucosa-galactosa por mutación en el gen SLC5A1).
Los azúcares no absorbidos en el intestino delgado causan síntomas por un efecto osmótico y por su fermentación por parte de la microbiota colónica, generándose ácidos grasos de cadena corta y gases (hidrógeno, metano, dióxido de carbono). Dado que el paso de los hidratos de carbono por el tracto gastrointestinal es rápido, los síntomas comienzan poco después de la ingesta y pueden persistir durante 6-9h. Típicamente, el enfermo no presenta molestias si no ingiere el hidrato de carbono responsable. La sintomatología es muy inespecífica, y hay que hacer el diagnóstico diferencial con otras patologías digestivas.
Intolerancia a la lactosaLa intolerancia a la lactosa es la respuesta sintomática tras la ingesta de lácteos ocasionada por una hipolactasia o disminución de la actividad de la β-galactosidasa localizada en las vellosidades intestinales90. Esta enzima hidroliza la lactosa en monosacáridos (glucosa y galactosa) absorbibles por el yeyuno. La hipolactasia puede ser primaria (adquirida o congénita) o secundaria. La forma más frecuente es la hipolactasia adquirida, también llamada déficit primario de lactasa o lactasa no persistente. La persistencia o no de lactasa viene determinada por la herencia autosómica recesiva de polimorfismos en la región reguladora del gen de la lactasa91. Los individuos lactasa no persistente presentan una disminución progresiva de la actividad enzimática de lactasa desde la infancia. Este trastorno es muy prevalente y globalmente afecta al 70% de la población mundial, con ciertas variaciones geográficas. La mayoría de adultos de África, Asia, Latinoamérica y en gran proporción en la Europa del Sur (área mediterránea) son lactasa no persistentes, en tanto que la mayoría de individuos del norte y centro de Europa son lactasa persistentes.
La malabsorción de lactosa no comporta necesariamente la existencia de intolerancia con aparición de síntomas. Solo el 30-50% de los individuos con malabsorción de lactosa son intolerantes a la misma. Por otra parte, hay una pobre correlación entre la percepción subjetiva de intolerancia a la lactosa y la existencia de malabsorción de lactosa92-94, por lo que malabsorción de lactosa y intolerancia a lactosa no son términos intercambiables. Por este motivo, la anamnesis se considera poco útil para establecer el diagnóstico de intolerancia a la lactosa, por lo que se recomienda la confirmación diagnóstica antes de restringir la lactosa de por vida. La prueba patrón oro es la determinación de la actividad de lactasa en biopsias intestinales95, pero este método es poco utilizado porque los resultados están limitados por la distribución parcheada de la lactasa en el intestino96, y por ser un procedimiento costoso e invasivo. Las técnicas diagnósticas más utilizadas —ya que son sencillas de realizar—, no invasivas, económicas y de elevado rendimiento diagnóstico son el test del aliento de H2 con lactosa34 (sensibilidad, 73%; especificidad, 86%) y el test de gaxilosa97,98 (sensibilidad, 93%; especificidad, 92%). El test del aliento se basa en el incremento de H2 en el aire exhalado (>20ppm) tras la ingesta de 50g de lactosa. Posibles falsos positivos incluyen el sobrecrecimiento bacteriano y el tránsito intestinal rápido. El test puede desencadenar síntomas digestivos pero dar un resultado falsamente negativo en individuos con flora bacteriana no productora de H2 (15-20% de la población) o por un efecto nocebo (44% de los individuos con test del aliento negativo)99. El test de gaxilosa mide la cantidad de xilosa en orina acumulada de 5h tras la administración oral de 4-galactosil-xilosa, siendo diagnóstico de hipolactasia un valor de xilosuria <37,87mg.
El test genético analiza la existencia de polimorfismos (C/T-13910, G/A-22018) asociados a la no persistencia de lactasa. Los genotipos CC y GG se asocian a no persistencia, y los genotipos CT, TT, GA y AA, a persistencia de lactasa, aunque existen variantes polimórficas que afectan la precisión del test100. Este test tiene un alto valor predictivo negativo (98%), por lo que la posibilidad de tener un déficit primario de lactasa es casi imposible para genotipos CT y TT-1390101, siendo la concordancia con un test del aliento con lactosa positivo del 100%101-103. Los inconvenientes del test genético es que no es útil en casos de hipolactasia secundaria, que su coste es más elevado que el del test del aliento o el test de gaxilosa, y que está disponible en pocos centros.
Intolerancia a fructosa y sorbitolLa fructosa es un monosacárido presente en las frutas y algunas verduras y muy utilizado como edulcorante por la industria alimentaria. La absorción de la fructosa se puede producir a través de un número de rutas de transporte facilitado en el epitelio intestinal. Cuando la fructosa está presente en exceso de glucosa (también llamada «fructosa libre»), este exceso de fructosa se absorbe por un transportador facultativo de baja capacidad (GLUT-5), de manera que cuanto mayor es la sobrecarga, más probabilidades existen de que se produzca malabsorción. La presencia de glucosa facilita la absorción de fructosa por una ruta más eficiente, que utiliza el sistema de transporte GLUT-2 (cotransporte glucosa:fructosa)104,105.
El sorbitol es un azúcar alcohol presente en algunas frutas y muy utilizado como sustituto del azúcar, por lo que se encuentra en pasteles, mermeladas, chicles y productos bajos en calorías. Su absorción es por difusión pasiva en el intestino delgado y se comporta como un inhibidor de la GLUT-5 utilizada para la fructosa, por lo que el consumo conjunto de sorbitol y fructosa empeora los síntomas secundarios a la malabsorción de fructosa.
La aparición de síntomas con un consumo de fructosa <25-30g define la intolerancia a la fructosa104. La prueba diagnóstica para confirmar la malabsorción de fructosa es el test del aliento de H2 tras sobrecarga oral de 25g fructosa, mientras que el test del aliento de H2 tras sobrecarga oral de 5g de sorbitol proporciona el diagnóstico de malabsorción de este azúcar. Ahora bien, algunos autores prefieren valorar la malabsorción de una mezcla de fructosa más sorbitol en vez de fructosa sola (20-25g de fructosa+3,5-5g de sorbitol)104, dado que con frecuencia estos azúcares se ingieren juntos y, como hemos comentado, el sorbitol dificulta la absorción de fructosa. Sin embargo, el principal problema en el diagnóstico tanto de la malabsorción de fructosa como de sorbitol es la incertidumbre en torno a la capacidad de absorción normal de estos azúcares en pacientes sanos94,106. Todavía no sabemos la dosis correcta y la concentración de fructosa y/o de sorbitol que se debe utilizar para diferenciar entre una capacidad normal o anormal para absorber estos azúcares.
Otros hidratos de carbonoRecientemente se ha introducido el término «oligosacáridos fermentables, disacáridos, monosacáridos y polioles» (FODMAP) para definir un grupo de hidratos de carbono de cadena corta pobremente absorbidos, que previamente se consideraban sin relación, pero que presentan un destino final parecido en el intestino delgado y el colon104,107. Este término incluye fructosa y lactosa cuando son malabsorbidos, distintos azúcares polialcoholes (sorbitol, maltitol, xilitol, etc.), que en general se absorben mal, y fructanos y galactanos (galactooligosacáridos tales como rafinosa y estaquiosa), que siempre son malabsorbidos. Todos los FODMAP comparten efectos osmóticos en el colon y fermentabilidad rápida por la microflora bacteriana. La fructosa y los fructanos pueden presentar efectos aditivos en la inducción de síntomas, de forma parecida a la descrita para fructosa y sorbitol. Este hecho debe tenerse en cuenta al diseñar las dietas restringidas en azúcares malabsorbidos.
Recomendaciones- 1.
Existe una pobre correlación entre las manifestaciones subjetivas de intolerancia a la lactosa y la existencia de malabsorción de lactosa. Por tanto, ante la sospecha de diarrea secundaria a un déficit primario de lactasa se recomienda confirmar el diagnóstico antes de restringir de por vida la ingesta de lactosa (CE, alta; GR, fuerte).
- 2.
Las técnicas diagnósticas recomendadas para confirmar la existencia de malabsorción de lactosa son el test del aliento con H2 tras sobrecarga de lactosa, el test de gaxilosa y el test genético (CE, alta; GR, fuerte).
- 3.
Ante la sospecha clínica de intolerancia a la fructosa y/o sorbitol se sugiere realizar un test del aliento con estos sustratos (CE, baja; GR, débil).
Las alteraciones de la motilidad pueden ser un factor etiopatogénico común a diferentes trastornos digestivos en que el síntoma principal es la diarrea crónica. En estos trastornos las alteraciones de la motilidad son un factor coadyuvante más que el mecanismo fundamental de la producción de diarrea. El presente apartado se centra en la diarrea crónica que se produce por enfermedad neuromuscular del intestino que puede producir diarrea crónica por la alteración motora propiamente dicha (p.ej., diabetes mellitus) o secundariamente a la existencia de sobrecrecimiento bacteriano (p.ej., esclerodermia). Las enfermedades neuromusculares del intestino (seudoobstrucción crónica intestinal y dismotilidad entérica) son entidades raras y son causas relativamente poco frecuentes de diarrea crónica, por lo que su diagnóstico debe plantearse cuando se han descartado otras causas más frecuentes de diarrea crónica108,109.
ClasificaciónLa enfermedad neuromuscular del intestino se divide en:
- 1.
Enfermedad neuromuscular primaria. Se caracteriza por presentar:
- •
Síntomas crónicos y recurrentes de crisis suboclusivas o distensión abdominal.
- •
Diarrea continua o intermitente y asociada a estreñimiento, que puede ser diurna y nocturna, con pérdida de peso y parámetros analíticos de malnutrición/malabsorción. Suele ser frecuente la existencia de sobrecrecimiento bacteriano (ver apartado correspondiente), y la diarrea puede mejorar o desaparecer cuando el sobrecrecimiento está controlado.
- •
Técnicas endoscópicas y radiológicas (TC, tránsito, enterografía por RM), que descartan otras enfermedades estructurales y suelen ser normales o mostrar dilatación de asas de intestino delgado.
- •
Puede haber síntomas extraintestinales por afectación de otros órganos o sistemas (urológico, cardiovascular y sistema nervioso autónomo más frecuentemente).
- •
- 2.
Secundaria a una enfermedad general con afectación intestinal:
- •
Enfermedades del colágeno: esclerodermia, dermatomiositis, lupus eritematoso sistémico.
- •
Alteraciones endocrinometabólicas: diabetes mellitus, hipertiroidismo.
- •
Enfermedades neurológicas: neuropatías disautonómicas, enfermedad de MNGIE, enfermedad de Parkinson.
- •
Enfermedades musculares: distrofias musculares, enfermedad de Steinert.
- •
Enfermedades infiltrativas: amiloidosis.
- •
Poscirugía gástrica con vagotomía.
- •
Se basa en: a)historia clínica compatible: síntomas sugestivos y técnicas radiológicas que descartan otras patologías orgánicas. Como son entidades poco frecuentes, se deben excluir previamente otras causas más frecuentes de diarrea crónica. En los casos más leves puede ser difícil de diferenciar de algunas patologías funcionales (SII/diarrea funcional); b)comprobar la presencia de sobrecrecimiento bacteriano (ver apartado correspondiente), y c)comprobar la existencia de trastorno motor mediante manometría intestinal, que es el estándar de oro para el estudio de la motilidad del intestino delgado110-112.
La manometría intestinal es específica pero poco sensible. Hay unos criterios internacionalmente aceptados como criterios de anormalidad110. Permite diagnosticar la existencia del trastorno motor y diferenciar entre trastorno de tipo miopático o neuropático. Es una técnica de realización e interpretación compleja y solo está disponible en los centros especializados.
No existe buena correlación entre las anormalidades motoras y el tiempo de tránsito oro-cecal, por lo que una alteración del tiempo de tránsito no puede considerarse indicativa de la existencia de un trastorno motor.
RecomendacionesLa manometría intestinal puede ser útil para diagnosticar un trastorno neuromuscular en un paciente con episodios recurrentes de diarrea y un contexto clínico adecuado (CE, moderada; GR, débil).
Diarrea crónica secundaria a alergia alimentariaLas reacciones adversas a alimentos incluyen 2 grandes subgrupos: a)las alergias alimentarias, que son un subgrupo de reacciones de hipersensibilidad generadas por mecanismos inmunológicos, dependientes de activación mastocitaria IgE dependiente o mediada por otros mecanismos inmunológicos, generalmente hipersensibilidad tardía tipoiv113-115, y b)las intolerancias alimentarias, que incluyen un variado grupo de reacciones mediadas por mecanismos no inmunológicos y dependientes de defectos enzimáticos, de transporte o de las propiedades farmacológicas de ciertos componentes alimentarios116. La prevalencia de alergia alimentaria es mayor en la infancia y disminuye con la edad; se estima que cuando se aplican los métodos de confirmación diagnóstica aceptados, varía entre el 3,5% para la leche de vaca hasta el 0,5-1,3% para el resto de alimentos comúnmente implicados (huevo, frutos secos, cereales, frutas, pescados y mariscos)114,117. En cambio, la prevalencia de las intolerancias alimentarias se sitúa en el 15-20%, siendo especialmente frecuente en las enfermedades funcionales digestivas como el síndrome del intestino irritable y la dispepsia funcional118. Dentro del subgrupo de intolerancias alimentarias tenemos patologías comunes y otras menos frecuentes, que pueden causar diarrea y otras manifestaciones digestivas como flatulencia, distensión abdominal, náuseas, vómitos y dolor abdominal y/o epigástrico. Entre las más comunes se encuentran la malabsorción de azúcares, la sensibilidad al gluten no celíaca y la intolerancia a hidratos de carbono fermentables de cadena corta (FODMAP), que ya han sido tratadas anteriormente en esta monografía. Entre las menos comunes se encuentran las intolerancias a salicilatos, aminas biógenas, cafeína y glutamato, las reacciones tóxicas a productos microbianos o fúngicos, como las aflatoxinas, y las reacciones de naturaleza psicológica116. Esta distinción es importante, ya que las manifestaciones digestivas de las alergias alimentarias son a menudo superponibles a las de las intolerancias, aunque en el caso de las alergias comúnmente aparecen asociadas otras manifestaciones extraintestinales específicas como la urticaria o el angioedema, que suelen iniciarse de forma inmediata a la exposición o ingesta del alérgeno implicado en la sensibilización. Además, a diferencia de las intolerancias alimentarias, dónde la diarrea puede persistir mientras continúe de manera inadvertida la ingesta del alimento causante, las alergias alimentarias pueden causar diarrea aguda pero raramente son causa de diarrea crónica per se. Un caso especial a tener en cuenta es el síndrome del intestino irritable con predominio de diarrea, en el que puede ser difícil establecer el papel que juegan las alergias y las intolerancias alimentarias en el origen de la diarrea, ya que es frecuente en estos paciente la asociación de las 2 entidades, e incluso la combinación con reacciones adversas alimentarias de naturaleza psicológica. De hecho, en los últimos años en estos pacientes se han implicado y discutido la participación de reacciones de hipersensibilidad tardías a alimentos, mediadas por IgG o IgG4119-121, en la generación y gravedad de las manifestaciones clínicas, incluida la diarrea, sin que exista una postura unánime al respecto.
DiagnósticoEl primer paso y más importante en el diagnóstico de la alergia alimentaria y su diferenciación de las intolerancias alimentarias es una historia clínica y dietética completa haciendo énfasis en los alimentos ingeridos por el paciente en las 2h anteriores al inicio de las manifestaciones clínicas. Hay que tener en cuenta la tolerancia previa y posterior del alimento implicado, ya que una buena tolerancia posterior del alimento excluye un mecanismo IgE mediado, excepto en los casos de alergia a alimentos potenciada/amplificada por cofactores (ejercicio, AINE, estrés o alcohol). Una vez confirmada la sospecha clínica, se debe establecer si la sintomatología asociada al alimento se debe a una reacción de hipersensibilidad mediada por IgE. Para demostrarlo existen diferentes pruebas122: a)pruebas de punción intraepidérmica con extractos comerciales (skin prick test [SPT]) o con alimentos naturales frescos (prick-prick test); b)determinación de IgE específica a alimentos en suero (UniCAP100, ImmunoCAP250, Immulite System, TheHYTEC-288 system), y en menor medida c)la utilización de moléculas de alérgenos purificados o recombinantes (separación de componentes) que hace posible identificar con precisión los alérgenos a los que cada paciente está sensibilizado (microarray chip, ISAC; UNICAP, Thermofisher) y que se utiliza principalmente para diferenciar si la sensibilización es genuina o debida a reactividad cruzada; d) pruebas de cribado para alimentos o pólenes, útiles en atención primaria, que contienen una mezcla de los alérgenos más comunes (multiallergen screen IgE test, Phadiatop), y e)otras determinaciones analíticas en sangre: triptasa, proteína catiónica del eosinófilo, carboxipeptidasa, catepsina G y quimasa del mastocito, IFN-γ, TNF-α, FGF, IL-4, IL-5, IL-6, IL-13, histamina, condroitín sulfato, heparina, leucotrieno C4, PGD2, IgE total y IgE libre. La tabla 15 muestra la especificidad y la sensibilidad de las técnicas complementarias más utilizadas123. La prueba de provocación oral controlada con placebo a doble ciego se considera como el patrón oro de las pruebas de diagnóstico. Sin embargo, es poco práctica, ya que consume mucho tiempo y recursos y puede inducir anafilaxia.
Precisión diagnóstica aproximada de las pruebas complementarias principales en el diagnóstico de alergia alimentaria
| Alimento | Técnica | Precisión diagnóstica |
|---|---|---|
| Huevo | s-IgE SPT | S, 93% (82-98); E, 49% (40-58) S, 92% (80-97); E, 58% (49-67) |
| Leche de vaca | s-IgE SPT | S, 87% (79-94); E, 48% (36-59) S, 88% (76-94); E, 68% (56-77) |
| Trigo | s-IgE SPT | S, 83% (69-92); E, 43% (20-69) S, 73% (56-85); E, 73% (48-89) |
| Soja | s-IgE SPT | S, 83% (64-93); E, 38% (24-54) S, 55% (33-75); E, 68% (52-80) |
| Frutos secos | s-IgE SPT | S, 96% (92-98); E, 59% (45-72) S, 95% (88-98); E, 61% (47-74) |
| Pescado | s-IgE SPT | S, —% (67-94); E, —% (65-88) S, 91-100% (—); E, 57% (—) |
| Marisco | s-IgE SPT | S, 100% (80-100); E, 45% (23-68) S, 100% (—); E, --% (32-50) |
E: especificidad; S: sensibilidad; SPT: skin-pricks test.
Fuente: tomada de Soares-Weiser et al.123.
Los métodos que no han demostrado ser efectivos y seguros en ensayos controlados deben ser calificados como «métodos no comprobados» o «métodos no validados» y, por tanto, no recomendables para el diagnóstico124. Entre ellos se incluyen: a)pruebas controvertidas in vivo: provocación y neutralización sublingual, subcutánea e intradérmica; el test ricerca intolleranze alimentaria (DRIA), que incluye el uso de extractos sublinguales y la medición de la fuerza muscular mediante ergometría; electroacupuntura y prueba electrodérmica (método Voll); kinesiología aplicada (fuerza medida de forma manual), y la biorresonancia, y b)pruebas controvertidas in vitro: determinación de IgG por ELISA en muestras de sangre (test A200, test IADM y test food intolerance screening [FIS] e IgG4 contra alimentos (IgG4 Screen Nutritional); determinación mediante análisis de ADN de pelo de intolerancia alimentaria, y medición de leucocitos en coulter, después de incubación o no con extractos de alimentos (test ALCAT). En la actualidad no existe un nivel de evidencia suficiente para recomendar el uso de pruebas basadas en la detección de IgG o IgG4 contra componentes alimentarios para el manejo dietético de la diarrea crónica.
Recientemente se ha recomendado descartar alergia al trigo antes de diagnosticar a un paciente de sensibilidad al gluten no celíaca125. Sin embargo, la alergia al trigo es poco frecuente, suele dar manifestaciones respiratorias, sobre todo rinitis, y especialmente en asociación con cofactores como el ejercicio y el estrés. Se diagnostica mediante pricks (trigo entero, gluten y gliadina) y también mediante la determinación de IgE contra la ω5-gliadina recombinante.
Recomendaciones- 1.
Se recomienda realizar una historia clínica exhaustiva que nos permita orientar si el proceso diarreico se asocia a una reacción inmunológica o se trata de otros mecanismos más propios de las intolerancias alimentarias.
- 2.
Ante la sospecha clínica de alergia alimentaria se recomienda consultar con un alergólogo/a para determinar IgE específicas y realizar skin-prick tests, que son pruebas sensibles pero poco específicas (CE, alta; GR, fuerte).
- 3.
La prueba de provocación oral controlada con placebo a doble ciego se considera el patrón oro de las pruebas de diagnóstico. Sin embargo, es poco práctica, ya que consume mucho tiempo y recursos y puede inducir anafilaxia (CE, alta; GR, fuerte).
En medicina primaria es necesario realizar el enfoque inicial de la diarrea crónica (algoritmo 7, fig. 7). Debe valorarse si el paciente cumple la definición de diarrea crónica y realizar una anamnesis correcta y los estudios analíticos básicos en sangre y heces. Es crucial valorar si existen criterios de organicidad y si es necesario derivar al paciente al especialista de digestivo. Además, hay que valorar si existe indicación para pedir una colonoscopia (tabla 16).
Indicaciones de colonoscopia en pacientes con diarrea crónica
| Diarrea crónica de inicio reciente en pacientes con edad ≥50años Diarrea crónica y antecedentes familiares de primer grado de cáncer colorrectal Diarrea crónica inflamatoria (ver definición en el texto) Diarrea crónica sin sangre con sangre oculta en heces positiva Diarrea crónica sin sangre con calprotectina >150mg/kg Diarrea crónica sin sangre con proteínaC reactiva aumentada Diarrea crónica acuosa con criterios de diarrea funcional grave o con signos, síntomas o alteraciones analíticas sugestivas de organicidad (ver el texto) |
Por otra parte, en muchos pacientes con diarrea acuosa recurrente pero leve (menos de 2 episodios de diarrea a la semana) se puede hacer un tratamiento empírico sintomático (con loperamida o racecadotrilo). En estos pacientes se debe valorar si de forma asociada predominan síntomas de meteorismo y distensión abdominal; si es así, hay que descartar la presencia de malabsorción de azúcares (lactosa y/o fructosa-sorbitol).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.