La disección submucosa endoscópica (DSE) es una técnica terapéutica endoscópica aplicable a las neoplasias digestivas precoces y desarrollada con los objetivos de conseguir una resección radical curativa y una disminución de las intervenciones quirúrgicas innecesarias. Diseñada en los países orientales, se encuentra poco extendida en Occidente.
Aunque la DSE representa un avance terapéutico endoscópico significativo y persigue la curación completa del paciente, ofrece en contrapartida una mayor incidencia de complicaciones (hemorragia, perforación) que obligan a la adquisición de una destreza técnica y experiencia mediante un programa de entrenamiento estructurado y progresivo con el fin de disminuir la morbilidad asociada a esta técnica e incrementar los beneficios potenciales de la misma. Aunque se ha publicado una importante evidencia científica sobre sus aplicaciones y resultados, las publicaciones relacionadas con su enseñanza son escasas y no hay un programa estandarizado de aprendizaje. El autor ha tratado de describir las diversas propuestas de entrenamiento pero también los principios básicos de la técnica, sus indicaciones y los resultados obtenidos, ya que antes del aprendizaje es conveniente disponer de una base teórica de conocimiento que permita guiar al endoscopista durante la aplicación clínica de esta técnica endoscópica. El adiestramiento en una técnica endoscópica no sirve de nada si no se conoce para qué se emplea, en qué situaciones se debe aplicar y qué resultados se debe esperar de ella.
Endoscopic submucosal dissection (ESD) can be applied to early gastrointestinal cancers. This technique was developed to achieve radical curative resection and to reduce unnecessary surgical interventions. ESD was designed in eastern countries and is not widely used in the West.
Although ESD represents a major therapeutic advance in endoscopy and is performed with curative intent, the complication rate (hemorrhage, perforation) is higher than reported in other techniques, requiring from endoscopists the acquirement of technical skill and experience through a structured and progressive training program to reduce the morbidity associated with this technique and increase its potential benefits. Although there is substantial published evidence on the applications and results of ESD, there are few publications on training in this technique and a standardized training program is lacking. The current article aims to describe the various proposals for training, as well as the basic principles of the technique, its indications, and the results obtained, since theoretical knowledge that would guide endoscopists during the clinical application of ESD is advisable before training begins. Training in an endoscopic technique has a little value without knowledge of the technique's aims, the situations in which it should be applied, and the results that can be expected.
La resección endoscópica es actualmente un tratamiento emergente para la neoplasia superficial gastrointestinal, habiendo ganado una mayor aceptación en los últimos años. En este tipo de lesiones superficiales y precoces, la resección endoscópica puede ofrecer una efectividad similar a la cirugía, siendo una técnica menos invasiva y más barata. Básicamente, disponemos de 2 técnicas endoscópicas para la resección de neoplasias gastrointestinales precoces: la resección mucosa endoscópica (RME) y la disección submucosa endoscópica (DSE). Ambas técnicas son superiores a la biopsia en el diagnóstico y estadificación de las neoplasias, facilitando las decisiones terapéuticas más adecuadas al disminuir la posibilidad de sobretratamiento o subtratamiento derivada de una estadificación histológica incompleta inherente a la biopsia1. No obstante, ambas técnicas difieren en sus indicaciones, tasas de resección, complicaciones y pronóstico.
La DSE es una técnica terapéutica que permite la resección de lesiones mayores a aquellas extirpadas mediante RME, posibilitando su extirpación en bloque, en una sola pieza. La resección en bloque y con márgenes libres de tumor (resección R0) es un principio fundamental en la cirugía oncológica. Trasladando este principio al campo de la endoscopia terapéutica, la DSE posibilita la resección R0 de lesiones de gran tamaño y de neoplasias precoces con ulceración asociada. La DSE ofrece las siguientes ventajas frente a la RME: 1) mayores tasas de resección en bloque (92 vs. 52%), constituyendo además un procedimiento que permite la estadificación precisa de la lesión neoplásica; 2) mayores tasas de resección completa (92 vs. 43%); 3) mayor porcentaje de resecciones curativas (79 vs. 59%), y 4) menor riesgo de recurrencia local (1 vs. 5%). En cambio, la DSE se ha asociado a un mayor riesgo de perforación (4,5 vs. 1%), sin haber diferencias entre otras complicaciones como la hemorragia o mortalidad2–4, siendo este riesgo variable y dependiente de la experiencia del endoscopista y de ciertas características de la neoplasia (ulceración, tamaño, presencia de fibrosis o localización5).
La DSE es una técnica terapéutica que requiere una gran experiencia en gastroscopia y colonoscopia diagnósticas, así como habilidades en técnicas diagnósticas como la cromoendoscopia o la endoscopia de magnificación, y en técnicas endoscópicas terapéuticas como la biopsia caliente, la polipectomía con asa, la mucosectomía o la mucosectomía en varios fragmentos. La DSE es un procedimiento difícil que requiere el aprendizaje de maniobras que no se realizan en la endoscopia terapéutica más común como el corte circunferencial o el corte lateral, caracterizándose su entrenamiento por una curva de aprendizaje prolongada que precisa un entrenamiento inicial en modelo animal. Si bien todas las técnicas endoscópicas tienen 2 componentes, técnico y cognitivo, la DSE añade la dificultad de requerir una capacidad constante de toma de decisiones que abarca la detección de la displasia en la evaluación inicial de la lesión, la definición de los bordes adecuados de resección, la selección de los accesorios endoscópicos más apropiados, la identificación de los vasos submucosos que se exponen durante la disección para su coagulación y la exposición del plano más adecuado para la disección de la capa submucosa6. La DSE es una técnica endoscópica consolidada en Oriente y progresivamente se asiste a una diseminación lenta en Occidente7. Aunque se ha publicado una importante evidencia científica sobre sus aplicaciones y resultados, las publicaciones relacionadas con su aprendizaje son escasas. Si bien este artículo intenta describir dicha evidencia relativa al aprendizaje, creemos que se deben describir los principios básicos de la técnica, sus indicaciones y los resultados obtenidos, ya que no sirve de nada aprender una técnica si no se conoce para qué se emplea, en qué situaciones se debe aplicar y qué resultados se deben esperar de ella.
Conocimientos básicos en DSEIndicacionesEl principal objetivo de la disección submucosa endoscópica es la resección completa de una lesión neoplásica con la finalidad de obtener la curación del paciente. Por tanto, en este objetivo se incluyen 2 conceptos, la resección y la curación, y ambos se pueden reunir en uno solo, la resecabilidad endoscópica. En consecuencia, una lesión neoplásica será resecable endoscópicamente si esta resección endoscópica supone la curación. La resecabilidad endoscópica de una lesión neoplásica, cualquiera que sea su localización, tamaño o naturaleza histológica, se basa en 3 premisas8:
- 1)
La efectividad terapéutica endoscópica no debería ser inferior a la efectividad terapéutica quirúrgica.
- 2)
No debe quedar tejido residual neoplásico tras el tratamiento endoscópico, esto es, la resección debe ser completa, radical o R0.
- 3)
La probabilidad de metástasis linfáticas regionales asociadas a la neoplasia resecada debe ser mínima.
Por tanto, nos podemos plantear la siguiente cuestión: ¿cumple la DSE las 3 premisas? En otras palabras, podríamos reformular la pregunta de 2 maneras diferentes: ¿puede conseguir la DSE la resección endoscópica con intención curativa? ¿La resecabilidad endoscópica es un objetivo alcanzable con la DSE? Como se comentará más adelante, la DSE consigue tasas más elevadas de resección radical o en bloque que otras técnicas de resección endoscópica con cifras superiores al 90%8. Aunque la DSE se desarrolló inicialmente para el tratamiento de las neoplasias gástricas precoces, su uso se ha ido expandiendo hacia las neoplasias colorrectales y esofágicas, con resultados similares de resección completa9–11. Estas elevadas tasas de resección respaldan que la DSE puede cumplir las 2 primeras premisas previamente comentadas. En cambio, ¿cómo puede la DSE cumplir la tercera premisa? La probabilidad de metástasis linfáticas regionales de una neoplasia digestiva (esofágica, gástrica o colónica) no depende de la técnica de la DSE. El riesgo de metástasis linfáticas viene determinado por factores propios de la neoplasia como son la estirpe histológica, el tamaño, la existencia de ulceración, el grado de diferenciación, la profundidad de invasión o la presencia de invasión linfática o vascular. A partir de amplias series quirúrgicas12–16, se ha estimado la probabilidad de invasión linfática regional en función de las características neoplásicas previamente comentadas, pudiendo identificar por tanto aquellas características de las neoplasias que se asocian a un riesgo muy bajo o nulo de invasión linfática y que, por ende, pueden ser extirpadas endoscópicamente sin necesidad de tratamiento quirúrgico complementario. Como el cumplimiento de la tercera premisa que sustenta la resecabilidad endoscópica no depende de la técnica de la DSE sino de la histología neoplásica, se desprenden 2 consecuencias con implicaciones terapéuticas:
- 1)
La resecabilidad endoscópica tiene 2 fases o componentes: un componente endoscópico relacionado con la técnica y que es el que posibilita la resección completa, radical, R0 o con márgenes libres de tumor, y un componente histológico, derivado del análisis exhaustivo de la pieza de resección endoscópica y que va a confirmar si la técnica endoscópica ha sido satisfactoria o si, por el contrario, se va a requerir de un tratamiento quirúrgico complementario.
- 2)
A pesar de las elevadas tasas de resección, la DSE es una técnica endoscópica compleja y con una elevada curva de aprendizaje, con una incidencia de hemorragia y perforación superiores a otras técnicas endoscópicas. Por ello, antes de realizar la DSE se debe examinar detenidamente la lesión neoplásica para lograr la identificación de características endoscópicas que predigan la existencia de invasión en profundidad y un mayor riesgo de metástasis linfáticas17–22. Este paso previo a la DSE es muy importante, pues puede evitar resecciones endoscópicas o quirúrgicas innecesarias23.
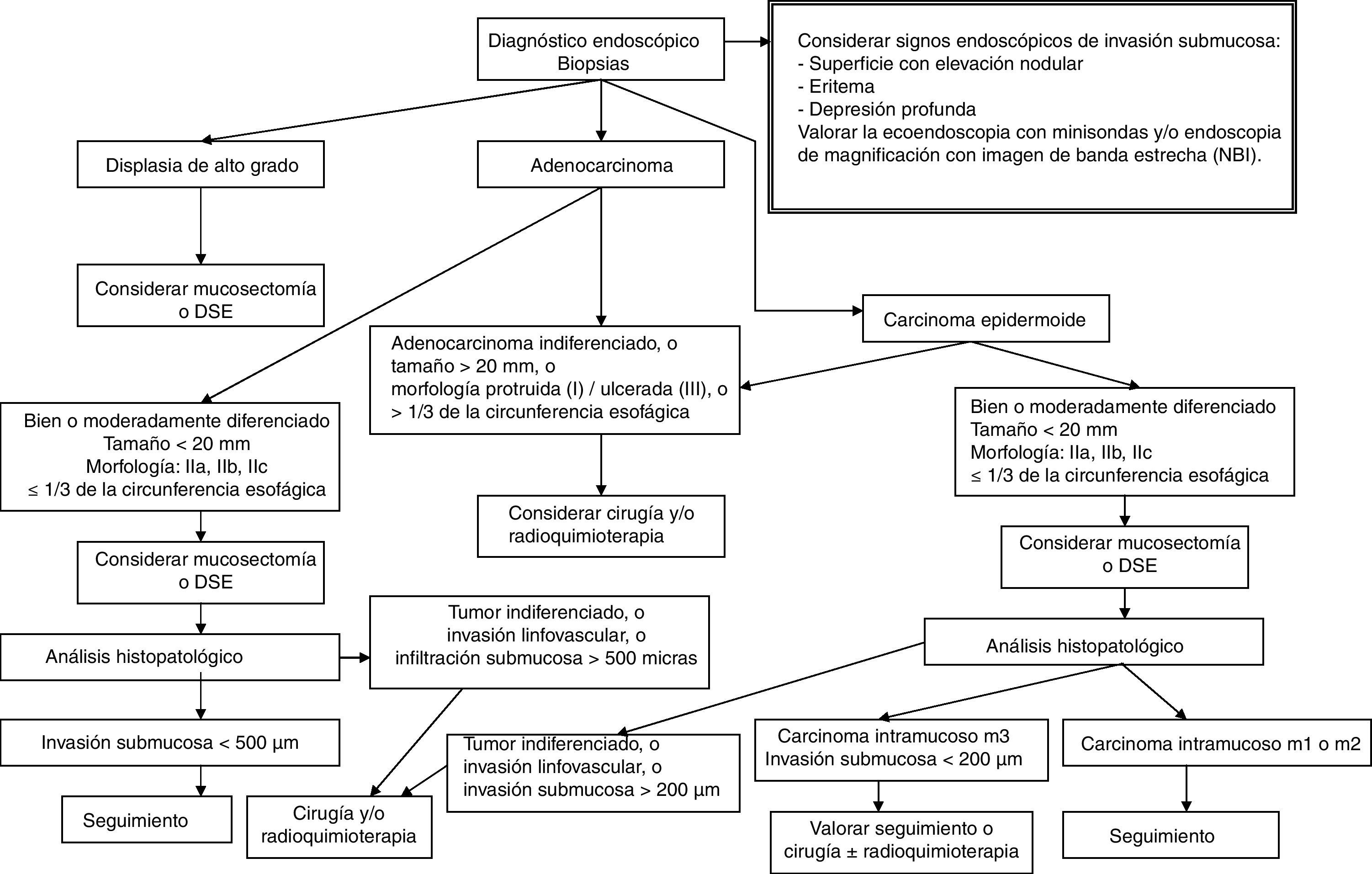
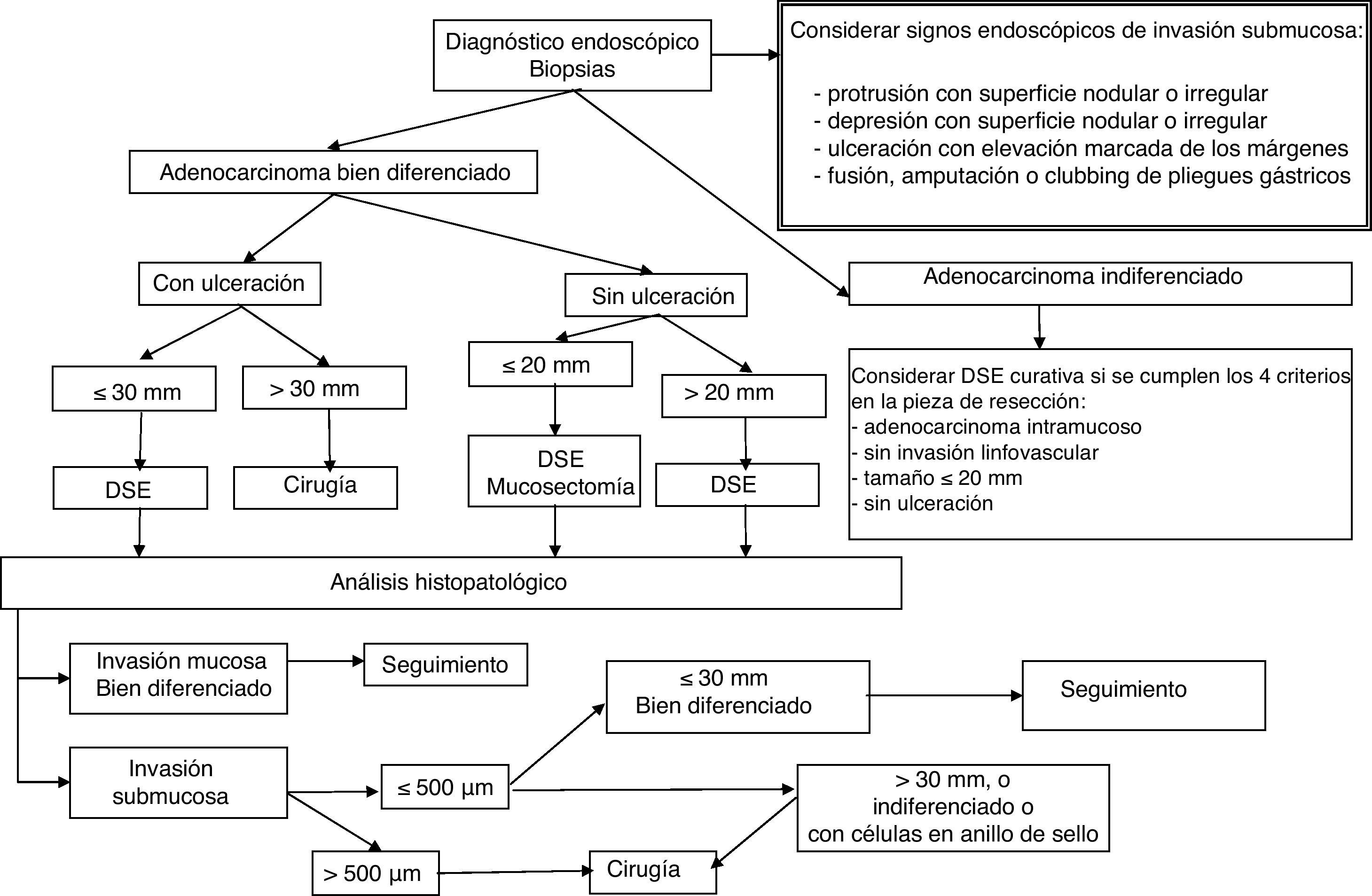
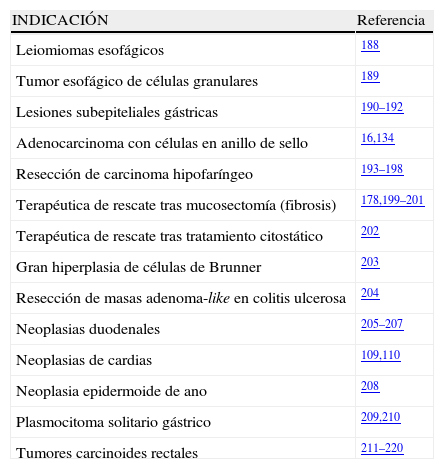
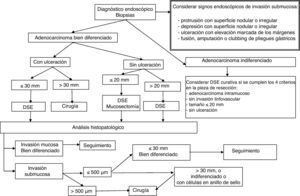
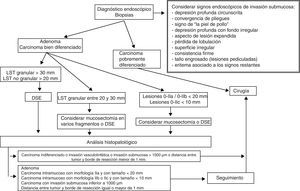
La identificación de las lesiones con riesgo nulo o muy bajo de metástasis linfáticas constituye el grupo de indicaciones donde la DSE encuentra su razón de ser, su aplicabilidad y su potencial terapéutico. En la tabla 1 se resumen las indicaciones por localización en el tubo digestivo. Otras indicaciones novedosas pero con menor evidencia científica se exponen en la tabla 2, entre las que cabe destacar la neoplasia gástrica en células con anillo de sello, el carcinoma epidermoide hipofaríngeo o el carcinoide rectal.
Indicaciones de disección submucosa endoscópica en las neoplasias precoces gastrointestinales1,5,13,140,155,186,187
| Localización | Indicación |
| Esófago | Bien o moderadamente diferenciado |
| Carcinoma epidermoide | Morfología: IIa, IIb, IIc |
| Tamaño inferior a 20mm | |
| Profundidad de invasión: | |
| - Intramucoso (m1 o m2) | |
| - Intramucoso (m3) o submucoso (< 200μm)* | |
| - Sin evidencia de afectación linfática o vascular | |
| Extensión: menor a un tercio de la circunferencia esofágica | |
| Bien o moderadamente diferenciado | |
| Adenocarcinoma | Morfología: IIa, IIb, IIc |
| Tamaño inferior a 20mm | |
| Profundidad de invasión: | |
| - Intramucoso | |
| - Submucoso (< 500μm) | |
| - Sin evidencia de afectación linfática o vascular | |
| Extensión: menor a un tercio de la circunferencia esofágica | |
| Displasia de alto grado | |
| Estómago | |
| Adenocarcinoma | Bien o moderadamente diferenciado: |
| - sin evidencia de invasión linfática o vascular | |
| - Carcinoma intramucoso de morfología IIa, inferior a 20 mm | |
| - Carcinoma intramucoso de morfología IIb o IIc, inferior a 10mm | |
| CRITERIOS EXPANDIDOS**: | |
| ○ Tamaño: | |
| ¿ Lesiones intramucosas y sin ulceración: cualquier tamaño | |
| ¿ Lesiones intramucosas y con ulceración asociada: tamaño igual o inferior a 30mm | |
| ¿ Lesiones con afectación submucosa: | |
| ¿ Tamaño igual o inferior a 30mm | |
| ¿ Invasión submucosa menor de 500μm | |
| Pobremente diferenciado (CRITERIO EXPANDIDO): | |
| - Intramucoso | |
| - Sin evidencia de afectación linfática o vascular. | |
| - Sin ulceración asociada | |
| - Tamaño igual o inferior a 20mm | |
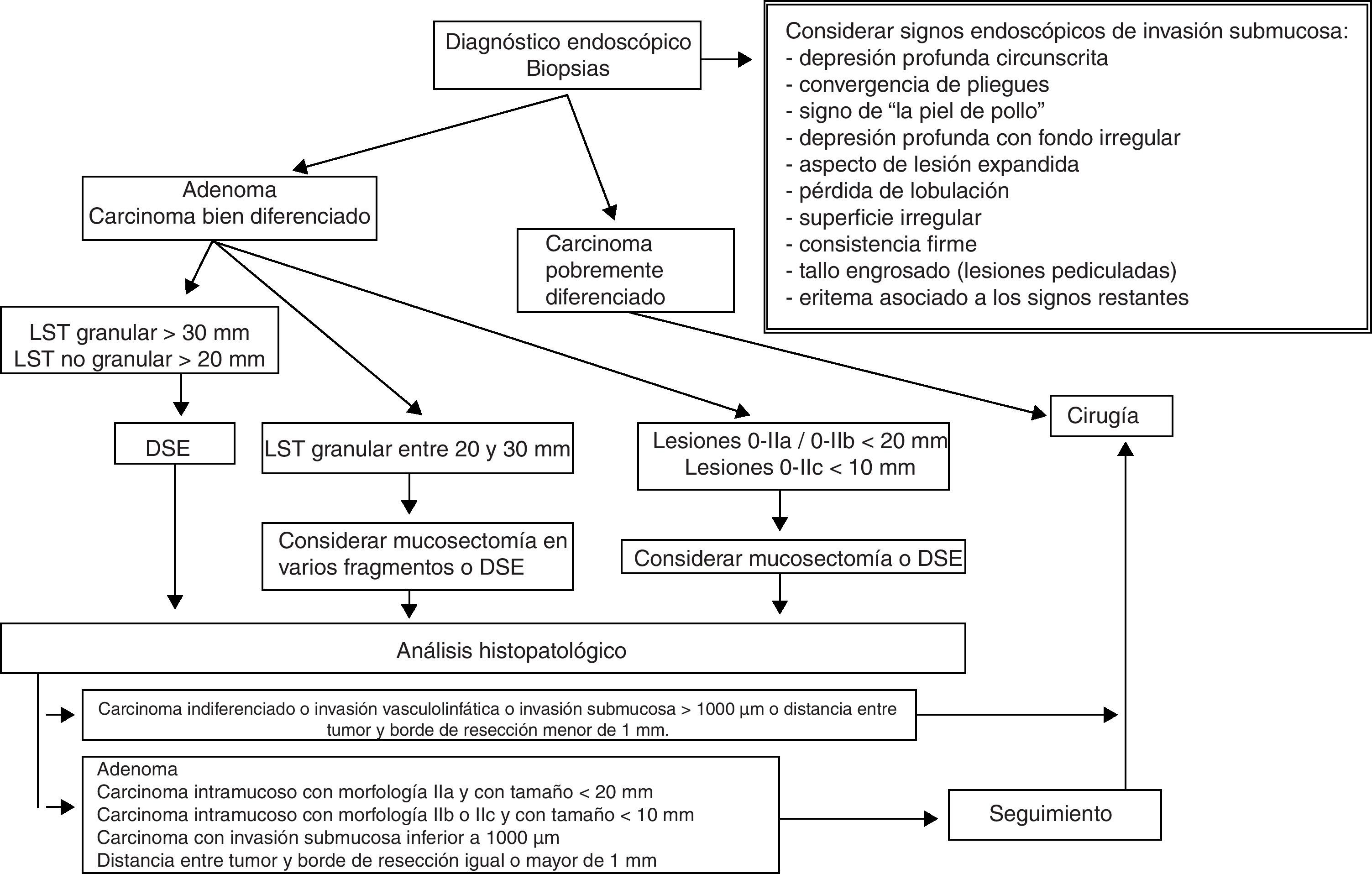
| Colon – recto | |
| Adenocarcinoma | Bien o moderadamente diferenciado |
| Ausencia de invasión linfática o vascular | |
| Carcinoma intramucoso con morfología IIa con tamaño inferior a 20mm | |
| Carcinoma intramucoso con morfología IIb o IIc con tamaño inferior a 10mm | |
| Carcinoma con invasión submucosa inferior a 1000μm | |
| Pólipos de extensión lateral no granular mayores de 20 mm | |
| Pólipos de extensión lateral granular mayores de 30 mm | |
Otras indicaciones potenciales de la disección submucosa endoscópica
| INDICACIÓN | Referencia |
| Leiomiomas esofágicos | 188 |
| Tumor esofágico de células granulares | 189 |
| Lesiones subepiteliales gástricas | 190–192 |
| Adenocarcinoma con células en anillo de sello | 16,134 |
| Resección de carcinoma hipofaríngeo | 193–198 |
| Terapéutica de rescate tras mucosectomía (fibrosis) | 178,199–201 |
| Terapéutica de rescate tras tratamiento citostático | 202 |
| Gran hiperplasia de células de Brunner | 203 |
| Resección de masas adenoma-like en colitis ulcerosa | 204 |
| Neoplasias duodenales | 205–207 |
| Neoplasias de cardias | 109,110 |
| Neoplasia epidermoide de ano | 208 |
| Plasmocitoma solitario gástrico | 209,210 |
| Tumores carcinoides rectales | 211–220 |
La técnica de la DSE se basa en la realización de varios pasos secuenciales encaminados a identificar claramente los márgenes de la lesión neoplásica, el aislamiento de la lesión neoplásica del tejido sano circundante mendiante un corte circunferencial y la exéresis de la lesión mediante la disección de la capa submucosa. En este apartado se comentará brevemente la técnica de la DSE, remitiendo al lector a varias revisiones sobre aspectos técnicos variados de la DSE, incluyendo soluciones de inyección, configuración del equipo electroquirúrgico o la amplia variedad de bisturíes endoscópicos desarrollados para esta técnica24–31. También remitimos al lector a otras referencias bibliográficas donde podrá encontrar información acerca de nuevos bisturíes, accesorios, prototipos o modificaciones de la técnica de la DSE que salen de los objetivos marcados en este artículo29,32–54.
El paso preliminar y no menos importante que se debe realizar, antes de la resección endoscópica, es la evaluación de la neoplasia con el fin de descartar signos de invasión local mediante uso de tinción (cromoendoscopia con índigo carmín), magnificación, imagen de banda estrecha (NBI) o ecoendoscopia (en el caso de las neoplasias esofágicas), e identificación de los signos endoscópicos de invasión mucosa y submucosa (figs. 1–3)18–22,55,56. Tras la estimación endoscópica de la profundidad de invasión de la neoplasia, si se descarta invasión submucosa profunda, el paso siguiente es la realización de la disección submucosa endoscópica propiamente dicha. La obtención de un espécimen en bloque permitirá la obtención de una estadificación precisa del parámetro T y las características histopatológicas detalladas de la lesión. Así, la DSE se puede convertir no solo en una técnica endoscópica terapéutica con intención curativa sino también en una prueba de referencia o «patrón oro» donde se pueden comparar las exactitudes diagnósticas de otras modalidades diagnósticas endoscópicas.
Tras la evaluación inicial de la lesión, el primer paso de la DSE es marcar la periferia de la lesión. Se debe delimitar la periferia de la lesión mediante cauterización con aguja de precorte, gas argón u otro bisturí endoscópico (Flex knife, Triangle tip knife, Hook knife) para así asegurar un margen libre de resección. En el colon y recto no se suele realizar el marcaje de la periferia pues la lesión suele quedar bien delimitada y puede haber un mayor riesgo de perforación al ser la pared colónica más fina.
Después del marcaje periférico, se inyecta en la submucosa una solución de suero fisiológico, glicerol o ácido hialurónico, para elevar la lesión y prepararla para el siguiente paso que es la incisión y corte circunferencial. La inyección submucosa pretende disminuir la posibilidad de perforación durante el corte. A la solución de inyección se le puede añadir adrenalina e índigo carmín. La adrenalina induce una vasoconstricción local y puede disminuir el débito de una eventual hemorragia mientras que el índigo se usa para teñir la capa submucosa de modo que el endoscopista visualice continuamente el plano de la submucosa y evite la lesión de la capa muscular y un mayor riesgo de perforación transmural.
Tras la inyección submucosa, se procede al corte circunferencial de la lesión tomando como referencia las marcas realizadas al inicio del procedimiento. Antes del corte circunferencial, se realizan unas incisiones con aguja de precorte o Flex-knife en cada cuadrante de la lesión que van a servir como puntos de inicio y unión del corte circunferencial. Tras estas incisiones, se procede al corte circunferencial uniendo cada una de las incisiones descritas. Esta fase del procedimiento puede realizarse con el bisturí IT-knife, cuyo extremo de porcelana evita un corte o incisión profunda en la pared de la víscera, disminuyendo el riesgo de perforación. Durante la fase de corte circunferencial, se puede inyectar más solución en la submucosa para reducir al mínimo el riesgo de perforación.
El siguiente paso es la disección de la capa submucosa. Para ello, se debe inyectar solución con glicerol o ácido hialurónico en la submucosa para facilitar el procedimiento y disminuir el riesgo de perforación. Los bisturíes habitualmente más empleados son el IT-knife o el Flush-knife. Durante la disección, se deben efectuar movimientos de derecha a izquierda para disecar la capa submucosa (corte lateral). Es conveniente tomar algunas precauciones: 1) para disminuir la incidencia de hemorragia peridisección, se pueden coagular los vasos visibles submucosos mediante electrocoagulación o pinzas de hemostasia; 2) para mantener un adecuado campo visual de la submucosa y del plano de disección, se puede recurrir a la inserción de un capuchón para movilizar la pieza parcialmente disecada y crear tracción que facilite la disección, a cambios posturales del paciente para que la fuerza de la gravedad movilice la pieza parcialmente disecada, o el uso de sistemas de tracción de los cuales hay varios descritos en la literatura médica, como clips metálicos o dispositivos magnéticos32,39, y 3) en casos de hemorragia persistente, se debe lograr la hemostasia inmediata dado que la hemorragia puede disminuir el campo visual del endoscopista. En caso de producirse una perforación, también se debe proceder a su cierre inmediato (véase el apartado dedicado a complicaciones).
Una vez completada la disección submucosa y tras haber obtenido un espécimen completo, se realiza la hemostasia de los vasos del lecho submucoso mediante pinza hemostática. Esta maniobra puede disminuir la incidencia de hemorragia diferida57.
Concluido el procedimiento de disección, el espécimen obtenido debe ser extendido y bien orientado para comprobar que la disección se realizó por fuera de los puntos del marcaje y para facilitar al patólogo el estudio de los bordes de la lesión y la profundidad de invasión.
Finalmente, y en relación con los cuidados posdisección del paciente, no hay una pauta estándar de cuidado, existiendo una gran variabilidad en cuanto a la realización de una endoscopia de control, reintroducción de la ingesta o realización de radiografías de control para descartar perforación58.
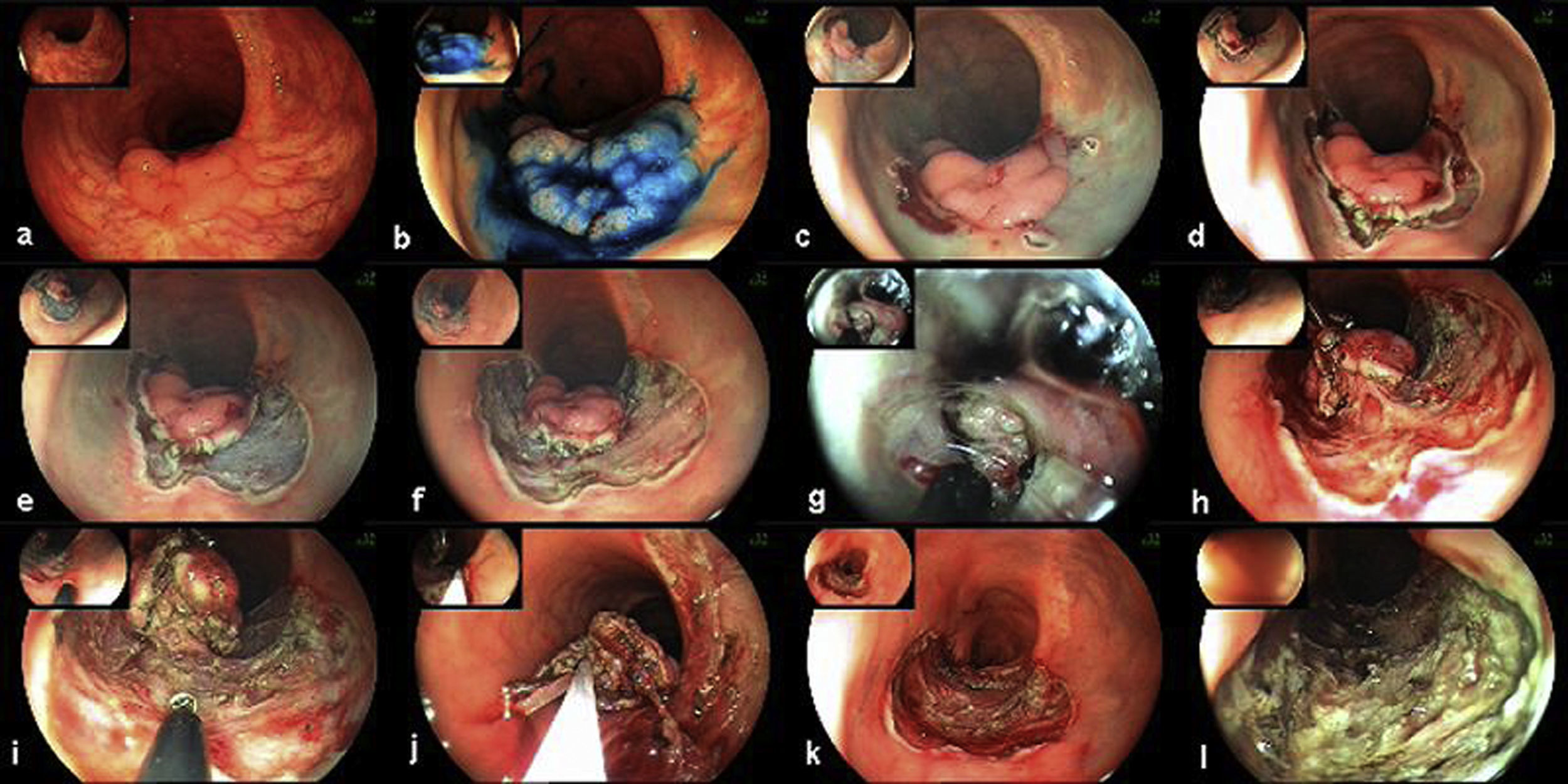
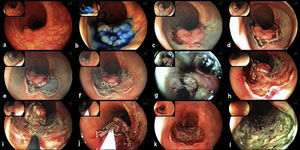
En la figura 4 se muestra un ejemplo del procedimiento completo de disección submucosa. El caso expuesto corresponde a un pólipo rectal, plano-elevado de extensión lateral granular de unos 35mm, que asentaba sobre una cicatriz mucosa ya que se había realizado 10 años atrás una resección transanal con recurrencia posterior. Este caso de DSE se expone por varios motivos con finalidad docente: 1) se reseca una lesión que asienta sobre una cicatriz (fibrosis), siendo la DSE una técnica endoscópica terapéutica de rescate; 2) se muestran las diversas fases del procedimiento, y 3) se expone el uso de bisturíes y otros accesorios para facilitar la disección (p. ej., tracción con clips).
Disección de un pólipo rectal de extensión lateral granular sobre cicatriz: a) el pólipo tiene una mofologia plana-elevada con nodularidad y asienta sobre una cicatriz (resección transanal previa); b) la misma lesión tras tinción con índigo carmín; c) cortes en los cuadrantes mediante Flex-knife; d) corte circunferencial con IT-knife; e) y f) diversas fases de la disección submucosa; g) uso de capuchón para facilitar la disección mientras se tracciona la lesión; h) uso de clips metálicos para traccionar la lesión y facilitar la exposición de la base; i) continuación de la lesión tras la aplicación de clips metálicos; j) se muestra la lesión sujeta a los clips metálicos y con un fino pedículo antes de concluir la disección; k) escara posdisección; l) escara tras coagulación de los vasos expuestos. Informe anatomopatológico: pólipo túbulo-velloso de recto con adenocarcinoma intramucoso y mínima invasión submucosa, alcanzando el foco más invasivo una profundidad de 880 micras, a 1,1mm del margen profundo de resección.
La DSE ofrece una oportunidad para la resección de neoplasias digestivas precoces en bloque y con intención radical. No obstante, su dificultad técnica y su tiempo prolongado de ejecución tienen la contrapartida de una mayor tasa de complicaciones. Las 2 complicaciones más frecuentes son la hemorragia y la perforación, siendo importantes no solo por su frecuencia sino porque pueden incidir de manera notable en el pronóstico y éxito terapéutico de la disección24,59. La hemorragia post-DSE puede observarse en un 13-38% de los pacientes, y puede clasificarse en inmediata (ocurre en el transcurso del procedimiento y en las primeras 24 h tras la DSE) y diferida (ocurre tras 24 h desde la DSE). La hemorragia inmediata suele ser una hemorragia de bajo débito que puede ocurrir durante el proceso de corte circunferencial o de disección propiamente dicho, y habitualmente no representa un serio problema para el paciente. En cambio, la hemorragia diferida puede requerir soporte transfusional y evaluación endoscópica de urgencia. Dado que la úlcera post-DSE puede requerir un período prolongado de cicatrización (unas 8 semanas), puede producirse una hemorragia durante este tiempo. Se ha recomendado el uso de inhibidores de la bomba de protones en dosis doble para favorecer el proceso de cicatrización ulcerosa post-DSE60,61. En caso de hemorragia durante el procedimiento de disección, se ha recomendado el uso de electrocoagulación o coagulación con gas argón, mientras que los clips metálicos se deberían usar solo en casos de hemorragia no controlable por los métodos anteriores ya que tienen el inconveniente de ocultar el campo visual del endoscopista y pueden dificultar las maniobras con los bisturíes endoscópicos. Para evitar la hemorragia, se puede efectuar una coagulación previa a la disección de la submucosa o usar una pinza de hemostasia para coagular los vasos de grueso calibre62,63. Se han descrito varios factores asociados a un mayor riesgo de hemorragia. Así, en el caso de la DSE gástrica, algunos autores han observado que el tamaño tumoral o la localización en el tercio superior se han asociado a un mayor riesgo de hemorragia59,64–66, mientras que otros autores han asociado la hemorragia post-DSE a la localización antral, la existencia de malignidad, la inexperiencia del endoscopista o a un tiempo de disección prolongado64,67–69.
La perforación es la complicación más temida de la DSE por el riesgo de intervención quirúrgica urgente si no se puede controlar endoscópicamente. Las tasas de perforación se sitúan en torno a un 5% aunque en series occidentales con menor experiencia, la tasa puede aumentar al 20%70–73. El manejo de las perforaciones durante la DSE debe realizarse tan pronto sean identificadas y mediante el uso de clips metálicos. Si no se puede cerrar la perforación, se debe interrumpir el procedimiento de disección e indicar una intervención quirúrgica. El empleo de clips metálicos puede impedir una mayor contaminación peritoneal y localizar la peritonitis asociada al proceso, permitiendo el manejo conservador de esta complicación62,74. Se han sugerido diversas maniobras que potencialmente pueden prevenir, precipitar o ayudar a manejar conservadoramente la perforación durante una DSE. Así, se puede prevenir la perforación mediante el empleo apropiado de equipos electroquirúrgicos y bisturíes endoscópicos, la inyección de suficiente volumen de inyección, la disposición ergonómica y ordenada de todos los accesorios y aparataje endoscópico, y la planificación previa del procedimiento endoscópico de disección. Se puede precipitar una perforación si no se identifica claramente la capa muscular propia. Por ello, se debe usar índigo carmín en la solución de inyección pues la existencia de un plano de disección de color azulado subyacente al campo de intervención indica que estamos en el plano correcto de resección. La presencia de un plano de coloración rojizo indica lesión de la capa muscular y un riesgo evidente de lesión serosa y perforación. Finalmente, el empleo de dióxido de carbono (CO2) durante la insuflación, la aspiración de contenido líquido luminal o el uso de clips metálicos pueden ayudar al manejo conservador de esta complicación grave63,75,76. Según el tamaño de la perforación y la localización anatómica, se pueden aplicar diversas técnicas de sellado con clips e incluso inserción de prótesis recubiertas para el caso de las perforaciones esofágicas. Entre los factores asociados a un mayor riesgo de perforación, se han descrito el tamaño tumoral, la presencia de fibrosis, el empleo de bisturíes no aislados en su extremo (Triangle tip, Hook-knife, aguja) y un tiempo prolongado de disección64,77–81.
Otra complicación descrita con menor frecuencia en la literatura especializada es la estenosis cicatricial. Esta complicación se asocia a resecciones extensas en el antro gástrico o a resecciones de más de la mitad de la circunferencia esofágica. El manejo de esta complicación se basa en la realización de dilatación habiéndose ensayado la inyección de esteroides intralesionales, inserción de prótesis biodegradables o la aplicación de capas celulares para prevenir la formación de estenosis82–87.
Finalmente, otras complicaciones muy infrecuentes o raras, con diversa significación clínica y publicadas en la literatura médica son neumonía aspirativa62, bacteriemia transitoria88,89, gastritis flemonosa90, isquemia gástrica91, hematoma gástrico92, neumatosis transmural93,94, enfisema gástrico95, enfisema mediastínico y neumomediastino96,97 y neumoperitoneo a tensión98. La carcinomatosis peritoneal es una complicación muy rara y solo se ha publicado un caso tras perforación de una disección gástrica. Una serie retrospectiva de 90 pacientes que sufrieron una perforación gástrica no evidenció esta temible complicación a largo plazo99–101.
Resultados de la DSEEn este apartado expondremos sintéticamente el éxito terapéutico y el pronóstico de algunas series que han aplicado la DSE en el tratamiento de las neoplasias precoces esofágicas, gástricas y colónicas.
Neoplasias esofágicas precocesLa aplicación de la DSE en la resección de las neoplasias precoces de esófago ha sido menor en comparación con la publicada en estómago o en colon. La pared fina del esófago y la estructura tubular del mismo aumentan la dificultad técnica y añaden un mayor riesgo de complicaciones. Por tanto, la casuística publicada en DSE esofágica no es muy abundante. No obstante, las limitaciones que ofrece la RME en la resección de lesiones mayores de 10-15mm y la descripción de una baja tasa de metástasis linfáticas en el carcinoma escamoso submucoso superficial han favorecido la introducción progresiva de la DSE en el manejo terapéutico de las neoplasias esofágicas13,102,103.
Una serie retrospectiva de casos con carcinoma escamoso, que se sometieron a DSE o RME (n=300), detectó que la DSE obtenía mayores porcentajes de resección completa con menor tasa de recurrencia local en comparación con la resección mucosa9. Aunque la supervivencia general entre ambos grupos no fue significativamente diferente, la supervivencia libre de enfermedad fue mayor en el grupo de pacientes tratados con DSE, sin diferencias en la incidencia de perforación aunque con una tendencia a una mayor frecuencia de estenosis en pacientes sometidos a DSE frente a la resección mucosa. Se debe destacar que en este estudio 47 pacientes tenían un carcinoma escamoso m3 (afectaba a todo el espesor mucoso y a la muscularis mucosae sin afectación submucosa), con una incidencia de metástasis linfáticas de 8,5%. Esto va en contra de las cifras previas detectadas en el estudio de Tajima et al.13, lo que supone que los pacientes con carcinoma escamoso esofágico m3 y sm1 pueden tener un mayor riesgo de metástasis linfáticas y, por tanto, no acogerse al principio de resecabilidad endoscópica expuesto con anterioridad. Por tanto, se debe ser cauteloso en el seguimiento de las neoplasias esofágicas escamosas con afectación m3 o sm1. Estas neoplasias pueden ser subsidiarias de tratamiento endoscópico en pacientes con comorbilidad significativa y con elevado riesgo quirúrgico. Otras series con menor número de pacientes incluidos han publicado su experiencia en DSE esofágica. Teoh et al., en una serie de 22 pacientes con neoplasia esofágica superficial obtienen un tasa de resección completa en el 95% de los pacientes sin recurrencias locales tras un seguimiento medio de 22 meses104. Nonaka et al. exponen su experiencia en 27 pacientes con una tasa de resección completa del 89% sin recurrencias locales o a distancia durante el seguimiento. De las 27 lesiones resecadas, 4 y 2 pacientes tenían una neoplasia escamosa m3 y sm2, respectivamente105. Ono et al. describen los resultados técnicos y el seguimiento prolongado de una serie de 107 neoplasias escamosas. En este estudio, los autores agruparon a los pacientes incluidos en 2 subgrupos, un grupo con neoplasias m1/m2 (n=77) y otro grupo con neoplasias m3/sm (n=30). La tasa de resección completa fue del 88% con un 4% de perforaciones y un 18% de estenosis cicatriciales. Tras un seguimiento mediano de 632 días (8-2.358), la supervivencia a los 5 años en ambos grupos fue del 100 y 85%, respectivamente, falleciendo 3 pacientes por recurrencia de la enfermedad neoplásica10. En Occidente, Repici et al. exponen su experiencia en DSE aplicada a una serie corta de 20 pacientes con neoplasias esofágicas escamosas. En este estudio, se obtuvo una tasa de resección completa del 90%, con 2 resecciones incompletas en pacientes con neoplasias con afectación submucosa. La incidencia de perforación fue del 0% y tras un seguimiento de 11-30 meses, no se detectó recurrencias ni metástasis106. Deprez et al. también han demostrado que la DSE puede ser llevada a cabo de modo seguro en el tratamiento del cáncer esofágico escamoso superficial, de acuerdo a los datos de su serie de 30 pacientes, consiguiendo nulas tasas de perforación y hemorragia, y una mayor tasa de resección completa en comparación con la mucosectomía en varios fragmentos (80 vs. 63%), así como una menor recurrencia (3 vs. 26%), aunque con un 20% de estenosis postratamiento107.
La mayor casuística en DSE esofágica se centra en el carcinoma escamoso o epidermoide, neoplasia muy prevalente en Japón. En cambio, el adenocarcinoma esofágico no ha sido para los endoscopistas orientales uno de los focos hacia donde dirigir la DSE. Esto puede ser debido a la baja incidencia de adenocarcinoma sobre esófago de Barrett en Japón en comparación con los países occidentales102. Otra posible razón para la escasa expansión de la DSE en el adenocarcinoma esofágico es la disponibilidad de otros tratamientos para la resección del adenocarcinoma superficial o la displasia de alto grado, así como del propio esófago de Barrett, como la mucosectomía o la ablación con radiofrecuencia. No obstante, se ha apuntado que el adenocarcinoma sobre esófago de Barrett puede ser una oportunidad para el desarrollo de la técnica de la DSE y para su expansión en Occidente, dada su mayor prevalencia en comparación con los países orientales108. Dos publicaciones con un número escaso de pacientes incluidos han evaluado la DSE como tratamiento de los adenocarcinomas superficiales de cardias, consiguiendo unas tasas de resección curativa superiores al 70% y una tasa de recurrencia casi nula tras un seguimiento prolongado109,110.
Neoplasias gástricas precocesEl desarrollo de la DSE va unido a la neoplasia gástrica precoz. La elevada prevalencia de las neoplasias gástricas en Japón y la existencia de programas de cribado poblacional han propiciado el desarrollo de diversas técnicas de resección endoscópica con intención radical y con mínima invasividad para el control del cáncer gástrico24,111, llegando a desarrollarse técnicas híbridas endoscópico-quirúrgicas que combinan la resección endoscópica con la disección ganglionar regional laparoscópica para preservar el estómago112. Por tanto, la mayor experiencia y casuística disponible en DSE hace referencia a las neoplasias gástricas. Como se comentó previamente, las indicaciones para la aplicación de una resección endoscópica en las neoplasias gástricas se basan en series quirúrgicas que estiman la probabilidad de invasión linfática regional a partir de ciertas características macroscópicas y microscópicas de las neoplasias. De los datos de una gran serie de 5.265 pacientes japoneses, se desarrollaron unos criterios guía estándar y unos criterios expandidos para la DSE con el fin de facilitar la estrategia terapéutica de las neoplasias gástricas precoces15,24. El desarrollo de los criterios expandidos respondía a una necesidad de ampliar las indicaciones estándar de resección endoscópica que eran muy estrictas, dado que surgieron en un período temporal donde sólo se disponía de la RME y sus variantes como técnica de resección. Todos los criterios estándar (también denominados en la literatura médica como guía, convencionales o indicaciones absolutas) y expandidos recogen las características de aquellas neoplasias gástricas que pueden ser tratadas endoscópicamente con intención curativa (tabla 1). Junto a estas 2 series amplias, otras series quirúrgicas orientales observaron una baja incidencia de metástasis linfáticas en pacientes con neoplasias mucosas113–115, mientras que otras series quirúrgicas occidentales con menor número de pacientes observaron una mayor incidencia de metástasis linfáticas en las neoplasias mucosas116–118. Se ha sugerido que puede haber un mayor riesgo de metástasis linfáticas del previamente publicado, en aquellas lesiones que cumplen los criterios expandidos115,119–121. Por otra parte, aún queda por establecer la significación de las micrometástasis linfáticas regionales y que pueden suponer una limitación a la efectividad del tratamiento endoscópico. Así, Cai et al. analizaron la presencia de micrometástasis en pacientes con cáncer gástrico precoz en 4.522 ganglios procedentes de 162 pacientes usando tinción con hematoxilina-eosina (H-E) e inmunohistoquímica frente a citoqueratina, así como inmunohistoquímica frente a E-cadherina en el tumor primario. Los autores observaron que la tinción frente a citoqueratina detectaba más micrometástasis que la tinción con H-E (6,8 vs. 27%) y que a un 21% de pacientes con micrometástasis detectadas por citoqueratina no se les detectó con tinción con H-E. Los pacientes con positividad para micrometástasis tuvieron una peor supervivencia a los 5 años. Las características tumorales asociadas a las micrometástasis fueron un tamaño superior a 1cm, pobre grado de diferenciación, invasión submucosa, invasión linfática y vascular, y expresión reducida de E-cadherina en el tumor primario122. Aunque se precisan datos derivados de un seguimiento prolongado para establecer la aplicación clínica de los criterios expandidos, se ha observado que entre 1.955 pacientes tratados endoscópicamente mediante DSE, no hubo diferencias en la supervivencia general a los 5 años entre aquellos pacientes con resección endoscópica curativa definida según los criterios expandidos y los pacientes con resección no curativa a los que tuvo que practicarse cirugía adicional. Este hallazgo señala que la DSE usando criterios expandidos como criterios de curabilidad endoscópica puede obtener un pronóstico excelente a largo plazo123,124.
Con estos resultados e indicaciones, varios grupos han publicado han publicado los resultados de la DSE gástrica. En una serie de 1.370 lesiones resecadas endoscópicamente, 833 lesiones fueron extirpadas mediante DSE y 537 se resecaron mediante RME. La tasa de resección completa fue mayor en pacientes con neoplasias gástricas que cumplían los criterios expandidos, con menos complicaciones, observando que la DSE conseguía una mayor tasa de resección frente a la RME (91 vs. 83%). Tras un seguimiento mediano de 32 meses, no hubo diferencias en la tasa de recurrencia local por indicaciones absolutas o expandidas (1%). La incidencia de hemorragia significativa y perforación fue del 1,4 y 1,3%, respectivamente125.
Yamaguchi et al., en su serie de 589 neoplasias gástricas precoces, obtienen una tasa de resección curativa del 90%, con unas tasas de hemorragia y perforación del 2,5 y 4,4%, respectivamente. Tras un seguimiento mediano de 30 meses (6-89 meses), las tasas de supervivencia a los 5 años entre los pacientes que tenían lesiones con indicación absoluta e indicación extendida fue de 96,9 y 93,4%, respectivamente126. Lee et al., en una serie coreana de 780 pacientes, obtienen una tasa de resección más baja en los pacientes con indicaciones extendidas que con indicaciones absolutas (o convencionales), sin diferencias en la tasa de recurrencia local o supervivencia libre de enfermedad. En cambio, la perforación en los pacientes con indicación extendida fue mayor (6,6%)127.
La DSE puede ser aplicable a pacientes ancianos, con edad superior a 75 años, y puede obtener unas elevadas tasas de resección completa. Isomoto et al., en una serie de 260 pacientes ancianos, consiguen unas tasas de resección en una pieza y completa del 93,9 y 87,4%, respectivamente. Al comparar los resultados de esta serie con otra de 401 pacientes más jóvenes, la tasa de resecabilidad y de resección completa fue menor en el grupo de pacientes ancianos. Por complicaciones, la tasa de hemorragia y perforación fue similar en ambos grupos de pacientes aunque hubo una mayor incidencia de neumonía en los pacientes de mayor edad. No hubo ningún fallecimiento asociado al procedimiento o a la neoplasia gástrica128. Otro estudio multicéntrico japonés realizado en 10 hospitales japoneses y con 440 pacientes con una edad superior a 80 años obtiene resultados similares en curabilidad, complicaciones y supervivencia a los 5 años129.
Se debe comentar que se ha señalado que aquellos pacientes con neoplasias gástricas precoces indiferenciadas podrían beneficiarse de la DSE como opción de tratamiento endoscópico con intención curativa. Los datos que avalan esta sugerencia proceden de algunas series quirúrgicas que demuestran una incidencia casi nula de metástasis linfáticas en pacientes con carcinomas indiferenciados intramucosos y submucosos superficiales (tabla 1)14,15,130–132. Otras series quirúrgicas indican una incidencia baja de metástasis linfáticas en las neoplasias gástricas precoces con células en anillo de sello133–135. No obstante, ante la escasez de datos procedentes de series endoscópicas y la falta de un seguimiento prolongado, se debe ser cauto al indicar la DSE en estas situaciones, y puede ser una opción terapéutica en pacientes con comorbilidad significativa y riesgo quirúrgico elevado.
Finalmente, exponer que de acuerdo a las series publicadas, la DSE puede ofrecer una elevada tasa de resección curativa y puede tener un impacto en la estrategia terapéutica de los pacientes afectados de un cáncer gástrico precoz, disminuyendo el número de intervenciones quirúrgicas innecesarias136. Por el contrario, en casos de DES no curativa, se ha señalado que la cirugía debe ser considerada un tratamiento de rescate en pacientes con riesgo de metástasis linfáticas137,138.
Neoplasias colónicas precocesCon el incremento en la incidencia del cáncer colorrectal y la expansión de los programas de cribado poblacional y familiar, se asiste a un incremento en el número de colonoscopias realizadas, así como a la diseminación de técnicas que contribuyen al diagnóstico de lesiones preneoplásicas como los adenomas planos. Aunque la mayoría de estas lesiones planas pueden ser extirpadas mediante polipectomía con asa de diatermia, un subgrupo de lesiones planas denominadas pólipos o tumores de extensión lateral (LST) plantean una mayor dificultad técnica para su exéresis. Estas lesiones, definidas por su morfología y un tamaño superior a 10mm, deben ser resecadas mediante RME o DSE. Los LST pueden tener una superficie granular (LST-G) o no granular (LST-NG) y este segundo subgrupo de lesiones tiene un mayor riesgo de malignización139. La resección mediante mucosectomía de los LST-NG es técnicamente difícil y suele precisar una resección en varios fragmentos, lo que aumenta el riesgo de exéresis incompleta, recurrencia local y dificultad en la evaluación histopatológica por los artefactos derivados de la resección en varios fragmentos. La DSE es una técnica adecuada para la resección de este tipo de lesiones al facilitar la resección en bloque y una mayor probabilidad de resección completa. En Japón, la principal indicación de la DSE en colon son los LST-NG mayores de 20mm y los LST-G mayores de 30mm110,140, habiéndose sugerido que la DSE puede tener un impacto en el manejo terapéutico de estas neoplasias, con reducción en la indicación quirúrgica141. No obstante, la DSE aplicada en la enfermedad neoplásica colónica presenta una mayor dificultad técnica derivada de la estrechez de la luz colónica que limita los movimientos del endoscopio, y por la delgadez de la pared colónica, que incrementa el riesgo de perforación142.
Una publicación reciente que incluía 499 pacientes con lesiones neoplásicas colorrectales (71% de LST) obtuvo una tasa de resección en bloque del 95%, con una tasa de perforación de 7,4%. Entre los factores asociados a un mayor riesgo de perforación, los autores identificaron la localización en el colon derecho, una menor experiencia en DSE (< 100 casos), los tumores de extensión lateral y el uso de ácido hialurónico como factores de riesgo, siendo factores predictivos de perforación solo los 2 últimos143.
En la serie más extensa publicada, Saito et al. exponen su experiencia tras la realización de 1.111 DES colónicas (956 tumores de extensión lateral, 419 de las cuales eran LST-NG) durante un período de casi 10 años en 10 hospitales japoneses11. En esta serie, la tasa de resección curativa fue del 89%, con una incidencia de perforación del 4,9%. En esta serie, se debe destacar que 511 lesiones (46%) se localizaban en el colon derecho, siendo esta localización especialmente difícil para la realización de la DSE por la degadez de la pared colónica. En este estudio, se observó que los centros hospitalarios con menor experiencia en DSE (< 50 DSE) tenían una mayor tasa de perforación en comparación con las instituciones con mayor experiencia (> 100 DSE), con unas cifras respectivas de 17,6 y 5,1%. En este estudio no se disponía de seguimiento y recurrencia a largo plazo.
Un estudio japonés reciente ha comparado diversas técnicas endoscópicas de resección en el tratamiento de 269 LST con un tamaño mayor de 20mm. Se compararon las siguientes técnicas: DSE, DSE híbrida (contempla el uso de asa de diatermia en la fase final del procedimiento), REM y resección en varios fragmentos. Tras un seguimiento mínimo de un año, se observó que la tasa de recurrencia endoscópica fue del 0, 0, 1,4 y 12,1%, respectivamente, siendo el tamaño de las lesiones resecadas mediante DSE o DSE híbrida significativamente mayores a las lesiones resecadas mediante las otras 2 técnicas, y significativamente mayor el porcentaje de carcinomas en los pacientes tratados con DES/DES híbrida. No hubo diferencias significativas en la tasa de perforación o hemorragia diferida entre las 4 técnicas144.
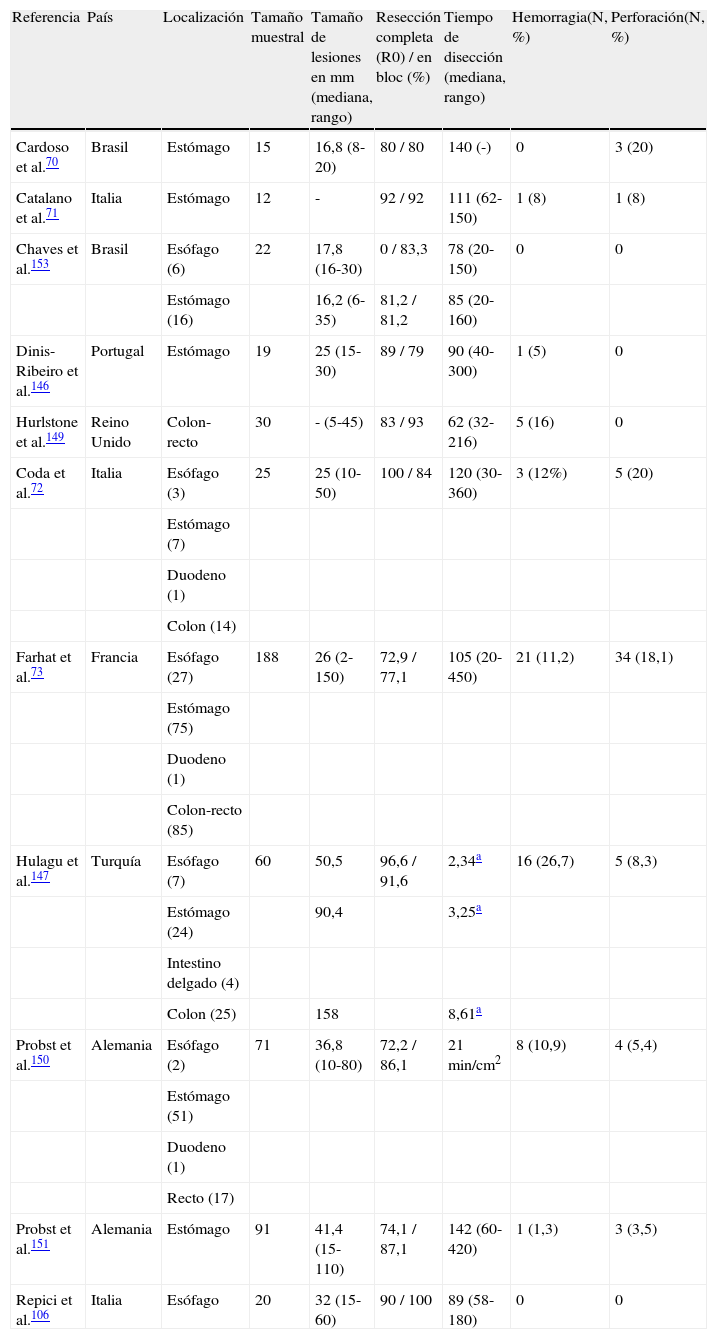
Expansión de la DSE en occidenteEl tratamiento de las neoplasias precoces gastrointestinales en los países occidentales sigue basándose en la cirugía, a diferencia de la actitud terapéutica que se adopta en Oriente. No obstante, progresivamente se asiste a un aprendizaje y difusión de las técnicas de resección endoscópica en los países occidentales, principalmente de la REM y DSE (tabla 3) y recientemente se publicó un artículo de consenso entre varios endoscopistas expertos en el que se abordaron varios aspectos relacionados con el aprendizaje de la DSE, la diseminación de la técnica en Europa, los estándares de calidad en la realización de la DSE o la necesidad de registros nacionales o europeos de DSE70–73,106,145–153.
Experiencia occidental en disección submucosa endoscópica
| Referencia | País | Localización | Tamaño muestral | Tamaño de lesiones en mm (mediana, rango) | Resección completa (R0) / en bloc (%) | Tiempo de disección (mediana, rango) | Hemorragia(N, %) | Perforación(N, %) |
| Cardoso et al.70 | Brasil | Estómago | 15 | 16,8 (8-20) | 80 / 80 | 140 (-) | 0 | 3 (20) |
| Catalano et al.71 | Italia | Estómago | 12 | - | 92 / 92 | 111 (62-150) | 1 (8) | 1 (8) |
| Chaves et al.153 | Brasil | Esófago (6) | 22 | 17,8 (16-30) | 0 / 83,3 | 78 (20-150) | 0 | 0 |
| Estómago (16) | 16,2 (6-35) | 81,2 / 81,2 | 85 (20-160) | |||||
| Dinis-Ribeiro et al.146 | Portugal | Estómago | 19 | 25 (15-30) | 89 / 79 | 90 (40-300) | 1 (5) | 0 |
| Hurlstone et al.149 | Reino Unido | Colon-recto | 30 | - (5-45) | 83 / 93 | 62 (32-216) | 5 (16) | 0 |
| Coda et al.72 | Italia | Esófago (3) | 25 | 25 (10-50) | 100 / 84 | 120 (30-360) | 3 (12%) | 5 (20) |
| Estómago (7) | ||||||||
| Duodeno (1) | ||||||||
| Colon (14) | ||||||||
| Farhat et al.73 | Francia | Esófago (27) | 188 | 26 (2-150) | 72,9 / 77,1 | 105 (20-450) | 21 (11,2) | 34 (18,1) |
| Estómago (75) | ||||||||
| Duodeno (1) | ||||||||
| Colon-recto (85) | ||||||||
| Hulagu et al.147 | Turquía | Esófago (7) | 60 | 50,5 | 96,6 / 91,6 | 2,34a | 16 (26,7) | 5 (8,3) |
| Estómago (24) | 90,4 | 3,25a | ||||||
| Intestino delgado (4) | ||||||||
| Colon (25) | 158 | 8,61a | ||||||
| Probst et al.150 | Alemania | Esófago (2) | 71 | 36,8 (10-80) | 72,2 / 86,1 | 21 min/cm2 | 8 (10,9) | 4 (5,4) |
| Estómago (51) | ||||||||
| Duodeno (1) | ||||||||
| Recto (17) | ||||||||
| Probst et al.151 | Alemania | Estómago | 91 | 41,4 (15-110) | 74,1 / 87,1 | 142 (60-420) | 1 (1,3) | 3 (3,5) |
| Repici et al.106 | Italia | Esófago | 20 | 32 (15-60) | 90 / 100 | 89 (58-180) | 0 | 0 |
Sin embargo, se han apuntado varias razones para el uso limitado de la DSE en los países occidentales. En primer lugar, la selección de las lesiones apropiadas para efectuar una DSE es muy importante, como lo son también aquellas herramientas diagnósticas para facilitar la identificación de tales lesiones. Se ha recomendado el empleo de la magnificación óptica y de la cromoendoscopia para la evaluación del patrón de criptas, la vasculatura de la superficie de la lesión y la profundidad de invasión, para así establecer una mejor selección de aquellas lesiones susceptibles de DSE. En segundo lugar, la DSE es un procedimiento endoscópico muy demandante técnicamente, requiriendo un elevado nivel de habilidad endoscópica y un entrenamiento intensivo con una curva prolongada de aprendizaje habiéndose recomendado una fase de entrenamiento en modelo animal. A diferencia de los países occidentales, en Japón hay una mayor disponibilidad para el entrenamiento en modelo animal incluido el estómago porcino aislado. En tercer lugar, la DSE se considera una técnica más económica y menos invasiva que la intervención quirúrgica. Sin embargo, se ha apuntado, por parte de los endoscopistas japoneses, que la estancia media hospitalaria tras una DSE es de 5 días, lo cual puede representar un problema en los centros hospitalarios occidentales donde hay una menor disponibilidad de camas. Además, se podría defender que la cirugía laparoscópica y la resección transanal para lesiones del colon y recto son técnicas más consolidadas que la DSE requiriendo una menor o igual estancia hospitalaria, y son preferibles a la DSE. En cuarto lugar, el cáncer gástrico precoz representa un problema significativo de salud en Japón debido a su elevada prevalencia154. El desarrollo de campañas poblacionales de cribado en este país (aunque solo se criba un 20% de la población elegible), junto con el empleo de un examen minucioso de la mucosa gástrica, han permitido el diagnóstico de las neoplasias gástricas en un estadio precoz, llegando a suponer el cáncer gástrico precoz más del 50% de todas las neoplasias gástricas diagnosticadas111. Este incremento en el diagnóstico de neoplasias gástricas precoces susceptibles de tratamiento endoscópico ha permitido la emergencia y consolidación de la DSE como técnica endoscópica que posibilita la resecabilidad endoscópica de estas lesiones. En cambio, la baja prevalencia de este tipo de lesiones en los países occidentales y la ausencia de programas de cribado poblacional inciden en una menor frecuencia diagnóstica de las neoplasias gástricas en estadios precoces, disminuyendo por tanto las oportunidades de aplicación de un tratamiento endoscópico con intención curativa. En quinto lugar, en el transcurso de las disecciones submucosas realizadas en Japón, varios endoscopistas suelen estar presentes, realizando el procedimiento endoscópico o monitorizando al paciente, sin requerir apoyo de un anestesiólogo durante el procedimiento. En cambio, se ha sugerido que en los países occidentales esto puede ser una dificultad añadida para la implementación de la DSE en las unidades endoscópicas155.
Como se comentó al inicio de este apartado, se asiste a un creciente uso de la DSE en el tratamiento de las neoplasias digestivas precoces en los países occidentales. Una encuesta europea reciente entre 58 endoscopistas europeos (de un total de 490) detectó una media de 4 disecciones submucosas gástricas por endoscopista y año (en el último año previo a la encuesta). De un total de 510 disecciones gástricas registradas, se alcanzó un 77% de resecciones completas con un 13% de complicaciones (hemorragia y perforación en el 8 y 5% de los casos, respectivamente)152. De este estudio, a pesar de la baja tasa de participación (12%) que puede introducir un sesgo de selección, se debe destacar que a pesar del escaso número de disecciones efectuadas por endoscopista y año, se consiguen unas elevadas tasas de resección completa con un razonable porcentaje de complicaciones mayores. Por tanto, esta encuesta indica que, a pesar de que la DSE es un procedimiento endoscópico poco extendido en Europa, la realización de esta técnica consigue unos resultados aceptables en términos de resección completa, con un bajo porcentaje de complicaciones. No obstante, también señala la escasa diseminación de esta técnica y la necesidad de un mayor conocimiento de la misma, así como la implementación de programas de entrenamiento que permitan aumentar las tasas de resección completa y disminuir la incidencia de complicaciones.
En la tabla 3 se muestra un extracto de publicaciones donde se recoge la incipiente experiencia en DSE en países occidentales.
Evidencia sobre entrenamiento y curva de aprendizajeEl aprendizaje y el desarrollo de la disección submucosa endoscópica en Japón han sido posibles por la elevada prevalencia de cáncer gástrico precoz en dicho país. Las lesiones gástricas con frecuencia se encuentran en el estómago distal donde la capa muscular propia es relativamente gruesa y donde las maniobras endoscópicas pueden ser más fáciles de realizar en comparación con el estómago proximal o esófago108. La realización de disecciones en esta localización permite la adquisición de una cierta habilidad con un riesgo bajo de complicaciones (perforación) para ir progresivamente adquiriendo una mayor destreza que permita enfrentar el tratamiento de lesiones de mayor tamaño y de localización menos cómoda. En cambio, la situación para el aprendizaje y la práctica de la disección submucosa endoscópica en los países occidentales es diferente por varias razones como: 1) la técnica de la DSE no está muy extendida en conocimiento y disponibilidad siendo derivados los pacientes a una intervención quirúrgica, y 2) la prevalencia de la neoplasia gástrica precoz es menor en comparación con los países asiáticos orientales (Japón, Corea, China).
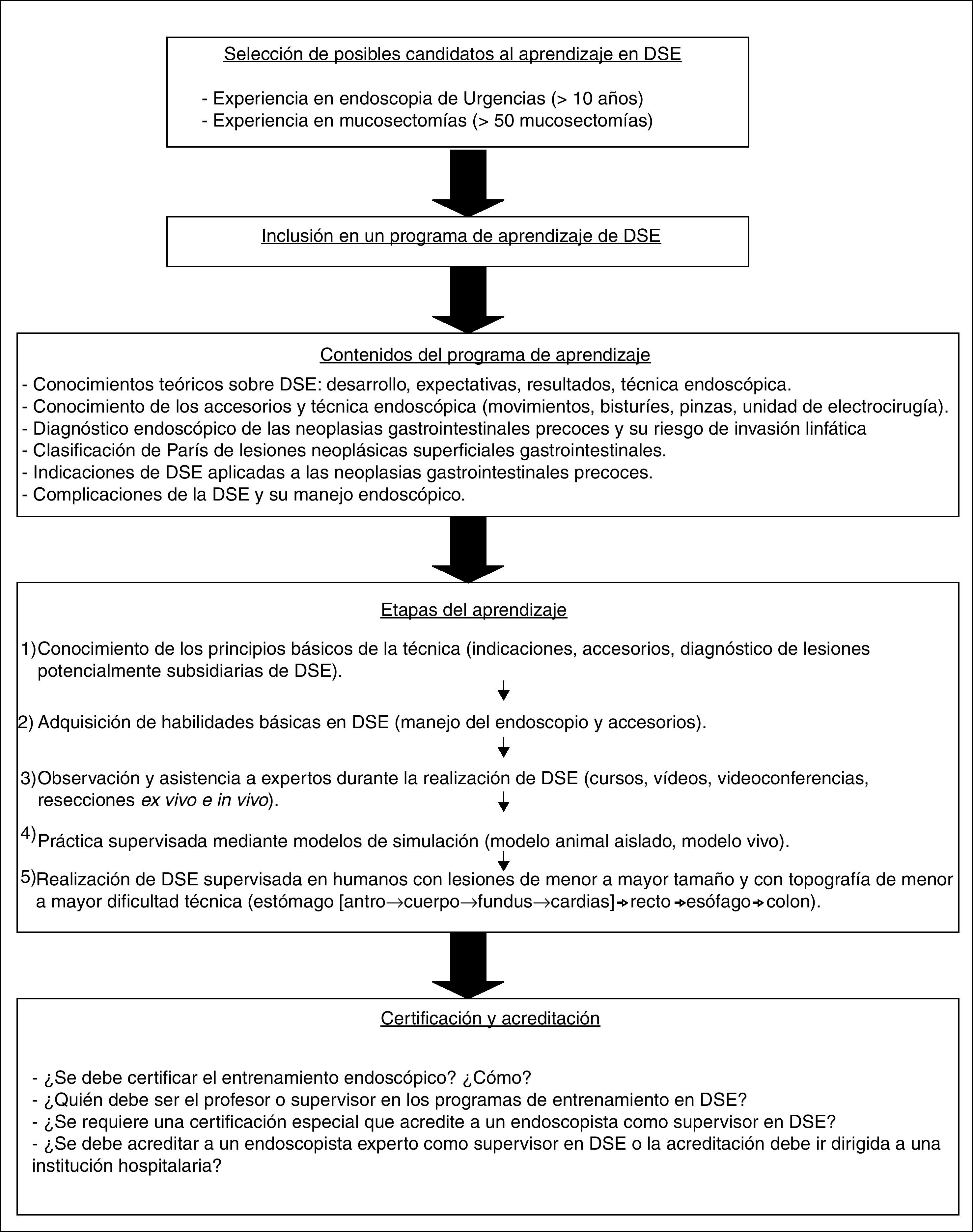
No hay un protocolo consensuado para el aprendizaje y desarrollo de la destreza necesaria aplicable a la DSE. Un adecuado programa estructurado de entrenamiento es esencial para el alumno ya que el pronóstico de la DSE depende en gran medida de la experiencia del endoscopista156. Se ha propuesto una secuencia progresiva en el aprendizaje de la DSE con varias fases diferenciadas (fig. 5): 1) conocimiento de los principios básicos de la técnica (indicaciones, accesorios, diagnóstico de lesiones potencialmente subsidiarias de la aplicación de esta técnica); 2) adquisición de habilidades básicas en DSE (inserción del endoscopio y manejo de accesorios); 3) observación y asistencia a expertos durante la realización de DSE (uso de atlas, cursos, vídeos, videoconferencias, resecciones ex vivo e in vivo); 4) práctica mediante modelos de simulación (modelo animal aislado, modelo vivo, simulador biológico inanimado), y 5) realización de DSE en humanos con lesiones de menor a mayor tamaño y con topografía de menor a mayor dificultad técnica (estómago -antro, cuerpo, fundus, cardias-, recto, esófago, colon)157–159. En este aprendizaje progresivo, los contenidos de un programa de aprendizaje en DSE deberían abarcar aspectos relacionados con el diagnóstico endoscópico, tratamiento y prevención de complicaciones. De un modo más detallado, se puede resumir en los siguientes puntos: 1) identificación de las lesiones potencialmente candidatas a disección submucosa endoscópica: reconocimiento de la neoplasia gastrointestinal precoz, conocimiento del riesgo de invasión linfática propio de las lesiones precoces, conocimientos básicos de la información que debe suministrar el patólogo en el análisis del espécimen; 2) conocer los aspectos técnicos básicos de la DSE: posición segura del endoscopio, elección del endoscopio, conocimiento y elección de accesorios, configuración de los parámetros de corte y coagulación en todas las fases de la disección submucosa; 3) conocer y manejar diversas posibilidades para el manejo de complicaciones inmediatas surgidas durante el proceso de DSE e incluso las complicaciones tardías: manejo de la hemorragia y de la perforación, modos de evitar las complicaciones más frecuentes, dilatación de estenosis y resección de lesiones recurrentes o con fibrosis, y 4) posibilidades de expansión de la DSE (otras indicaciones potenciales).
Propuesta de secuencia en el aprendizaje y adquisición de destreza en disección submucosa endoscópica81,157,175.
La destreza técnica que exige la disección submucosa endoscópica y la escasa oportunidad de su aplicación en los países occidentales en comparación con los orientales obligan al desarrollo de técnicas y modelos de entrenamiento que permitan la adquisición de un aprendizaje y una habilidad que faciliten el éxito de la DSE con una baja incidencia de complicaciones. Por tanto, en la enseñanza de la DSE y su diseminación posterior, nos podríamos plantear las siguientes cuestiones: 1) ¿qué modelos de entrenamiento se han desarrollado o están disponibles para el aprendizaje de la DES?; 2) ¿qué número de exploraciones se requiere para alcanzar una cierta competencia en esta técnica endoscópica?; 3) ¿debe existir una preparación y experiencia previas en endoscopia terapéutica y de urgencia para abordar el aprendizaje de la DES?, y 4) ¿cuáles son los contenidos y el cronograma de un programa de aprendizaje?
Los requisitos y criterios para comenzar a realizar la DSE no se han clarificado en la actualidad. En Japón se ha sugerido que aquellos gastroenterólogos que van a iniciarse en el aprendizaje de la DSE para la resección de neoplasias gástricas precoces deben asistir a conferencias o charlas explicativas acerca del procedimiento para posteriormente permanecer durante un año como endoscopistas asistentes de endoscopistas expertos que realicen DSE. Las conferencias tienen una participación multidisciplinaria pues gastroenterólogos, cirujanos y anatomopatólogos desarrollan la base teórica a aplicar en la práctica. Con ello, no solo se pretende el aprendizaje de la técnica endoscópica sino que los endoscopistas puedan diagnosticar, a partir de las características endoscópicas de la neoplasia, la extensión y profundidad de invasión, conocer la mejor estrategia de tratamiento a priori y establecer la resecabilidad endoscópica de la lesión y, por tanto, saber si el tratamiento endoscópico es suficiente, a partir de los hallazgos histopatológicos de la neoplasia extirpada. Durante la fase de asistente, los endoscopistas pueden adquirir destreza en DSE, capacidad para abordar situaciones de dificultad técnica o entrenamiento para resolver la aparición de complicaciones (hemostasia de sangrado intraprocedimiento, cierre de perforaciones)160, siendo aconsejable iniciar el aprendizaje con lesiones de pequeño tamaño, preferentemente inferiores a 2cm, no ulceradas y localizadas en el tercio inferior gástrico (antro), pues plantean menor dificultad técnica y se asocian a una menor duración del procedimiento así como a una mayor probabilidad de curación23,161,162.
Se ha descrito que en una modificación de la técnica de la DSE, aquella que contempla la realización de un corte circunferencial seguida de la resección con asa de la pieza aislada, tras la realización de 40 resecciones gástricas, se puede alcanzar una tasa de resección en bloque desde un 45% basal al 85%, en ausencia de supervisión por un experto163, si bien esta técnica de autoaprendizaje ha sido desaconsejada164, teniendo presente además que en este artículo no se desarrolla el aprendizaje de la DSE típica. Otros autores han descrito que se requiere al menos la realización de unas 30 disecciones submucosas gástricas para alcanzar un cierto grado de habilidad en esta técnica164, con el fin de maximizar la seguridad en el paciente en términos de resección completa y complicaciones, ya que al inicio de la curva de aprendizaje se ha estimado que la tasa de perforación puede alcanzar el 20%165, cifras similares a las observadas en las disecciones realizadas en colon73,77. Se han propuesto como marcadores de competencia en DSE el descenso del tiempo empleado en el procedimiento o la tasa de resección completa sin necesidad de ayuda por el endoscopista supervisor.
Aprendizaje en modelo animal y práctica clínicaEl empleo de modelos animales ex vivo, principalmente de esófago y estómago porcinos, son un medio barato y fácil de usar para lograr la adquisición de un entrenamiento inicial antes de avanzar hacia la práctica en un modelo porcino vivo. Se ha propuesto que los modelos animales son un medio de ascenso rápido en la curva de aprendizaje en esta técnica en un tiempo relativamente corto164, pudiendo favorecer el aprendizaje de esta técnica en los países occidentales donde la técnica difícilmente puede expandirse en ausencia de programas de cribado de neoplasia gástrica por razones ya comentadas previamente. Además de favorecer el aprendizaje en DSE, los modelos animales ofrecen la posibilidad de simulación de lesiones similares a las detectadas en la práctica clínica humana y adiestramiento en otros procedimientos endoscópicos, diagnósticos y hemostáticos166–169.
Hon et al. han publicado su experiencia inicial en el entrenamiento de la DSE colónica aplicada en un modelo colónico porcino ex vivo170. En este estudio, se realizó 10 DSE en colon porcino por parte de un solo endoscopista. A pesar del escaso número de disecciones que impedía una evaluación de la curva de aprendizaje, se observó un descenso del tiempo invertido en la disección a lo largo del estudio. Solo hubo 2 perforaciones en las primeras 2 disecciones. Para los autores de este estudio, la realización de DSE colónicas debe estar precedida de un aprendizaje en modelo animal. El modelo colónico porcino ex vivo ofrece las ventajas de ser más barato que el modelo porcino vivo, no requiriendo ni anestesia general ni una preparación colónica, que es difícil de conseguir, ni el sacrificio del animal. El examen patológico de los especímenes resecados en este estudio demostró que la pared colónica porcina es similar a la humana, con una capa submucosa bien definida. Por el contrario, el modelo ex vivo tiene varias desventajas en comparación con el colon humano que hacen que el aprendizaje no sea tan reproducible. En concreto, el colon porcino aislado no está perfundido y, por tanto, no se puede tratar ni entrenar la eventualidad de una hemorragia intraprocedimiento. Además, la falta de peristaltismo resta dificultad al procedimiento. Otra posible desventaja podría ser que la pared colónica porcina es más delgada que la humana aunque esto puede favorecer el entrenamiento de movimientos más sutiles durante la realización del corte circunferencial y corte lateral en la disección. Los cambios de posición del modelo ex vivo pueden realizarse para remedar los cambios de posición del paciente ya que la fuerza de la gravedad puede favorecer la disección.
En Occidente, ante la baja incidencia de neoplasia gástrica precoz, la principal indicación de DSE puede ser la neoplasia colorrectal precoz aunque la localización de la lesión en el colon, la luz colónica estrecha, el peristaltismo, los haustras, las angulaciones, la distensión aérea y el calibre fino de la pared colónica incrementan notablemente la dificultad técnica y el riesgo de perforación (1-10%)11,158,171–174. Ante las dificultades técnicas comentadas en el colon, es aconsejable la realización de varias disecciones en modelos animales previamente a la aplicación clínica en humanos.
Berr et al. exponen la experiencia docente desarrollada en cursos teórico-prácticos llevados a cabo en Austria. Estos autores realizan un entrenamiento protocolizado basado en un seminario teórico y un entrenamiento práctico en modelos porcinos anestesiados. El entrenamiento en modelo animal se llevaba a cabo bajo la supervisión de expertos durante 2 días y se dirigía a endoscopistas con gran experiencia en procedimientos endoscópicos diagnósticos y terapéuticos (incluía experiencia en endoscopia de emergencia durante más de 10 años, realización de más de 50 mucosectomías) y procedentes de centros hospitalarios de referencia donde se realizaban más de 2.000 gastroscopias y 1.500 colonoscopias anuales175. Durante las sesiones prácticas de entrenamiento, se experimentaba con diversos accesorios endoscópicos de corte y disección, estando dedicada la parte final del aprendizaje al entrenamiento del manejo de las complicaciones. Las disecciones realizadas en el estómago porcino se localizaban en áreas diferentes y eran crecientes en dificultad, mientras que en esófago y colon se seleccionaron 5 zonas para disección. Se efectuó un examen post mortem del modelo animal para investigar signos de sangrado, perforación, efectividad de la hemostasia con clips y extensión de la disección submucosa. Al final del entrenamiento, se interrogó a cada participante sobre diversos aspectos del aprendizaje: calidad científica, organización del programa docente, instrumentación suministrada durante la actividad docente, tiempo dedicado al entrenamiento individual, valoración del taller práctico para la labor endoscópica futura de los aprendices, y evolución y avance de las habilidades en DSE. Finalmente, los autores del programa evaluaron la realización de la DES en la práctica clínica de los aprendices en el año siguiente al taller práctico y la compararon con su experiencia previa al taller. Sin extendernos en los resultados del estudio, y aunque el estudio no fue diseñado para evaluar el progreso individual de los alumnos durante la actividad práctica, el taller sirvió para el afianzamiento de la técnica de la DSE y para su difusión en los centros de trabajo de los participantes, estimulando la realización de procedimientos progresivamente más difíciles.
En España, la DSE se encuentra aún poco extendida y su aplicación clínica se circunscribe a unos pocos centros hospitalarios de tercer nivel. Los cursos dedicados al aprendizaje de esta técnica endoscópica son también escasos y hasta la fecha se ha celebrado en nuestro país 3 cursos avanzados teórico-prácticos en disección submucosa endoscópica en modelo animal, estando pendiente la realización de un cuarto curso en septiembre del año 2012. En España, como en otros países occidentales, la estandarización de la docencia en DSE no existe y la falta de expertos en esta técnica impide la difusión de la misma. Frente a este inconveniente, se ha señalado que la práctica docente de la DSE en instituciones donde no exista experto en esta técnica puede acometerse mediante la combinación de un entrenamiento en modelos animales y la práctica endoscópica humana176. Algunos centros han descrito su experiencia experimental y docente en la adquisición de la técnica de la DSE. Parra-Blanco et al. han propuesto una estrategia de aprendizaje en DSE basada en un modelo porcino gástrico ex vivo y en un modelo porcino vivo165. Tras un periodo inicial de aprendizaje en DSE aplicada en estómagos animales aislados y supervisada por un experto, se realizó un entrenamiento en esófago y estómago en un modelo porcino vivo, dividiendo el período de aprendizaje en 2 fases, realizando en cada fase 11 DSE. Durante el avance del aprendizaje se observó que, sin haber diferencias en el tamaño de los especímenes resecados, no las hubo tampoco en el tiempo invertido en la resección al comparar las 2 fases. En cambio, si solo se tenían en cuenta las resecciones gástricas, los tiempos empleados en la fase de disección y los tiempos globales eran menores en la segunda fase en comparación con la primera, lo que sugería la adquisición de una cierta destreza en la realización de la DSE. La ausencia de diferencias significativas al incluir todos los especímenes gástricos y esofágicos señala que las disecciones realizadas en esófago comportan una mayor dificultad técnica siendo necesario un mayor número de resecciones o un entrenamiento más prolongado para adquirir la habilidad necesaria. Respecto a este estudio y de acuerdo con los autores, se debería hacer las siguientes observaciones: 1) no se evaluó el impacto del entrenamiento previo animal ex vivo bajo un supervisor, con lo que no queda establecido si este paso inicial es necesario para enfrentar un autoaprendizaje en modelo animal; 2) no se evaluó el impacto posterior de este entrenamiento animal en la realización de DSE en humanos; en este punto, los autores recomiendan especialmente el entrenamiento en los casos humanos bajo la supervisión de un experto, sin obviar la realización o asistencia a cursos y videoconferencias con modelos animales o pacientes bajo supervisión experta, y 3) la realización de DSE en un modelo porcino presenta unas diferencias en comparación a la DSE en humanos: a) en este estudio, no hubo casos de hemorragia complicando la resección, ya que el sangrado en la mucosa gástrica porcina es más infrecuente y de menor cuantía; b) la mucosa gástrica porcina es más gruesa que la mucosa gástrica humana y la maniobra de inyección submucosa es más laboriosa; c) los especímenes gástricos porcinos resecados proceden de mucosa gástrica sana y, por tanto, es esperable que no haya fibrosis que dificulte el procedimiento como así se ha comunicado en las disecciones gástricas en humanos79,177,178, y d) la morfología y tamaño de los estómagos del modelo porcino vivo pueden dificultar las maniobras de posicionamiento del endoscopio y disección submucosa, existiendo diferencias en la técnica al aplicarla en humanos.
Vázquez-Sequeiros et al. han descrito un programa secuencial de entrenamiento en DSE con el fin de identificar un modelo barato, seguro, efectivo y fácilmente reproducible para el aprendizaje y difusión de la DSE en España179. Para estos autores, se puede realizar dicho entrenamiento en 4 fases: 1) fase teórica basada en la adquisición de conocimientos básicos en DSE y en la revisión de la literatura científica publicada sobre esta técnica endoscópica; 2) entrenamiento en un modelo animal ex vivo, basado en la anatomía e histología esofagogástricas similares entre el modelo porcino y el ser humano; 3) entrenamiento en modelo animal vivo bajo la supervisión de un experto, y 4) aplicación de la DSE en un paciente potencialmente beneficiario de esta técnica. Para los autores de este trabajo, la adquisición de habilidades en DSE en los pasos 3 y 4 de este proceso de aprendizaje puede ser difícil en España, debido principalmente al elevado coste del modelo porcino vivo, al limitado número de cursos con modelo porcino en nuestro país y al escaso número de pacientes que se puedan beneficiar de la aplicación de esta técnica en nuestro medio (principalmente por la baja prevalencia de neoplasia gástrica precoz). Una de las posibles soluciones que exponen Vázquez-Sequeiros et al. es la centralización de esta técnica en centros hospitalarios de referencia, lo que permitiría una concentración de casos para que aquellos endoscopistas con entrenamiento básico en DSE pudieran adquirir un mayor grado de experiencia y conocimiento de esta técnica, pudiendo enfrentarse progresivamente a disecciones más difíciles y en localizaciones más incómodas. Este incremento en la experiencia en DSE tendría una doble consecuencia: 1) desarrollo de programas nacionales de entrenamiento para más gastroenterólogos endoscopistas; 2) incrementar la seguridad de los pacientes a quienes se les aplique esta técnica endoscópica con el descenso de complicaciones asociada a una mayor habilidad técnica y experiencia, y 3) facilitar la implementación de la DSE en el sistema sanitario y su generalización.
Ono et al.180 han efectuado una valoración de la curva de aprendizaje de la DSE en modelo porcino gástrico, ex vivo y vivo, realizando 27 disecciones submucosas. En este trabajo, presentado como abstract, el tiempo medio de duración del procedimiento fue de 37,3 min y el tamaño medio de las lesiones resecadas fue de 21,37mm. La perforación se constató en 3 casos siendo todas transmurales. A pesar del tamaño de las lesiones extirpadas, los autores hicieron observar que el tiempo prolongado que requiere la técnica y las dificultades que dicho procedimiento conlleva, determinan la necesidad de realizar un mayor numero de DES en el modelo animal antes de poder iniciar el procedimiento en el paciente, con el objetivo de estandarizar dicha técnica.
Aunque el modelo porcino es el más extendido para la iniciación en el aprendizaje de la DSE, se ha usado otros modelos animales. Tanimoto et al. han evaluado la utilidad de un modelo animal canino para la práctica de DSE en esófago y estómago. Aun cuando el número y tamaño de las muestras resecadas fue escaso, los autores no describen ningún tipo de complicación durante el proceso de disección, teniendo la ventaja, al ser un modelo vivo, de realizar el proceso de aprendizaje en un contexto más real y próximo a la disección realizada en humanos181.
Tras la fase de entrenamiento animal, se puede proceder a la práctica clínica progresiva, con la resección de lesiones con escasa dificultad técnica y con migración progresiva a lesiones de mayor dificultad técnica, de acuerdo con lo expuesto previamente. Kakushima et al. exponen la curva de aprendizaje en DSE en 383 disecciones gástricas realizadas por 13 endoscopistas (306 disecciones fueron realizadas por dos endoscopistas). En este estudio, la tasa de resección radical y en bloque, hemorragia y perforación fue del 91; 3,4 y 3,9%, respectivamente182. Durante la realización del estudio y con el incremento del número de disecciones, se observó un aumento del tamaño de los especímenes que se acompañaba de un descenso en el tiempo invertido en la disección. Tras la realización de 50 disecciones, se apreció un incremento en la tasa de resección en bloque de uno de los endoscopistas. No hubo diferencias significativas en las tasas de hemorragia o perforación durante el incremento en el número de las disecciones.
Tsuji et al. han publicado recientemente su experiencia docente en la DSE gástrica176. Para estos autores, el aprendizaje en DSE gástrica debe basarse en los siguientes requisitos: 1) realización previa de más de 1.000 gastroscopias; 2) conocimientos básicos teóricos de la técnica de la DSE y de sus complicaciones; 3) conocimiento de la técnica de la biopsia gástrica y reconocimiento endoscópico de las neoplasias gástricas; 4) observación del procedimiento de la DSE gástrica realizado por un experto endoscopista, prestando especial atención a las maniobras técnicas de la DSE, uso de bisturíes y soluciones de inyección; 5) iniciación en la técnica práctica de la DSE a través de la coagulación de los vasos de la escara post-DSE y mantenimiento de un campo endoscópico visible y estable; 6) realización de DSE gástrica en localizaciones de creciente dificultad (antro, incisura, curvatura menor) bajo supervisión por experto, y 7) grabación de las DSE gástricas para la posterior visualización por el propio endoscopista novel que ha realizado la disección. En el estudio de Tsuji et al. se analizó el impacto de este programa de aprendizaje en 4 endoscopistas noveles que realizaron 117 DSE gástricas aplicando los criterios expandidos para la indicación de DSE. Según la experiencia documentada por estos autores, la tasa de finalización del procedimiento por parte de los endoscopistas noveles fue del 80%, siendo las principales causas de resección incompleta la presencia de hemorragia no controlable o la falta de habilidad en la realización de la disección.
Hotta et al. describen su experiencia en el entrenamiento y adquisición de experiencia en la DSE colónica183. Se realizaron 120 disecciones por un solo endoscopista y se dividió todo el periodo temporal en que se realizaron las disecciones en 3 subperíodos de 40 casos. Se pudo observar que tras la realización de 80 disecciones no había diferencias en las tasas de resección en bloque o de resección radical, ni las hubo tampoco en el tiempo empleado en la disección ni en la incidencia de perforaciones. Para los autores, en la DSE colónica, se requieren 40 y 80 disecciones para la adquisición de suficiente habilidad para evitar la perforación y para conseguir la destreza en la resección de neoplasias colorrectales precoces, respectivamente. Otro grupo japonés, tras la realización de 102 DSE colónicas por parte de 2 endoscopistas en fase de entrenamiento y supervisados por un experto, observó que tras la realización de más 30 procedimientos, las tasas de resección completa eran significativamente más elevadas en comparación con la realización de un menor número de disecciones184.
La enseñanza de la DSE lleva asociados los conceptos de certificación y acreditación. No obstante, es muy pronto aún para hablar de una certificación del aprendizaje en DSE y de la acreditación de centros formadores. Tal y como defendían Vázquez-Sequeiros et al., la formación en DSE puede basarse en la centralización de esta técnica en centros hospitalarios de referencia, lo que permitiría una concentración de casos para que aquellos endoscopistas con entrenamiento básico en DSE pudieran adquirir un mayor grado de experiencia y conocimiento de esta técnica, para abordar disecciones de mayor complejidad técnica. La experiencia acumulada y la adquisición de gran destreza serían los pasos previos a la acreditación de estos centros como centros de aprendizaje y desarrollo de la DSE.
En definitiva, un adecuado programa estructurado de entrenamiento en DSE es esencial para el alumno ya que el pronóstico de la DSE depende en gran medida de la experiencia del endoscopista. Se debe considerar muy útil la colaboración estrecha entre endoscopistas orientales y occidentales185, ya que los primeros pueden aportar su experiencia y dominio de la técnica a los segundos, mientras que éstos, conocedores de la realidad clínica de su entorno y de las necesidades asistenciales, podrán adecuar su experiencia en la creación de programas específicos de entrenamiento en consonancia con dichas necesidades y permitirán la implementación e introducción de esta técnica endoscópica curativa y potencialmente radical en el catálogo de prestaciones médicas de nuestra especialidad.
Diez consejos finales para la aplicación clínica de la disección submucosa endoscópica- 1.
Abordar la disección submucosa de una lesión tras un periodo de aprendizaje, preferentemente si es posible, basado en modelos animales y con supervisión por experto.
- 2.
Es preferible que las disecciones submucosas iniciales sean lesiones neoplásicas gástricas o rectales de un tamaño no mayor a 2cm, preferentemente sin ulceración.
- 3.
Antes de iniciar el procedimiento de la disección, se deben analizar las características endoscópicas de la lesión (tamaño, morfología, localización, patrón de criptas) para realizar una estimación de la invasión parietal, y así valorar la dificultad técnica y el riesgo de invasión linfática, y en definitiva, evaluar si la lesión es resecable endoscópicamente. El término resecable equivale a curable, dejando claro que el procedimiento endoscópico va a ser potencialmente curativo.
- 4.
Es aconsejable disponer de una biopsia previa tomada de la periferia para evitar la aparición de fibrosis posbiopsia y conocer si hay datos de mal pronóstico que no aconsejen el tratamiento endoscópico (pobre grado de diferenciación, neoplasia con células en anillo de sello).
- 5.
Es conveniente disponer de una variedad de dispositivos para realizar una disección submucosa, pudiendo citar como básicos los siguientes: capuchones para el extremo distal del endoscopio, sustancias para inyección (glicerol, ácido hialurónico), aguja de precorte, Flex-knife, IT-knife, pinza de hemostasia (Coagrasper), asa de diatermia, aguja de esclerosis para inyección y clips metálicos.
- 6.
Es muy importante procurar un ambiente tranquilo durante el procedimiento con una colocación ordenada y ergonómica de todos los accesorios a emplear, incluyendo los monitores y torres de videoendoscopia.
- 7.
Durante la fase de corte circunferencial, es conveniente la inyección abundante de glicerol o ácido hialurónico en la submucosa de la lesión. Con ello, se reduce al mínimo la posibilidad de perforación durante las fases iniciales del corte y, al separar con el volumen inyectado la capa submucosa de la muscular propia, se facilitará el procedimiento ulterior de disección.
- 8.
Durante la fase de disección, es también muy conveniente la inyección de glicerol para separar la capa submucosa de la muscular, repitiendo la inyección tantas veces como se considere necesario para minimizar el riesgo de perforación.
- 9.
En caso de perforación y si esta se identifica durante el procedimiento, se debe intentar su cierre inmediato mediante clips. La decisión de continuar el procedimiento depende de la situación clínica del paciente y si la perforación puede ser cerrada endoscópicamente. Ante esta complicación, se puede valorar acortar el procedimiento mediante exéresis con asa de diatermia.
- 10.
Tras la finalización satisfactoria del procedimiento endoscópico, aun cuando se haya conseguido la resección completa y en bloque (en un fragmento) de la lesión neoplásica, se debe tener en cuenta que será el análisis histopatológico de ésta lo que determine si finalmente se ha conseguido la resección curativa endoscópica. Este análisis histopatológico debe incluir el estudio del grado de diferenciación de la pieza, la búsqueda de invasión linfática o vascular, la medición (en micras) de la invasión submucosa de la neoplasia y el estudio de la indemnidad (ausencia de células tumorales) de los márgenes lateral y vertical (o profundo) de la pieza resecada.
La DSE representa un paso más evolucionado en el tratamiento mínimamente invasivo de las neoplasias digestivas precoces, posibilitando la exéresis de neoplasias digestivas superficiales de gran tamaño o asociadas a ulceración, no subsidiarias de resección por otras técnicas endoscópicas, consiguiendo alcanzar unos índices de curación y de supervivencia similares a los de la cirugía. No obstante, la complejidad técnica de este procedimiento se asocia a una mayor tasa de complicaciones a las que se debe enfrentar el endoscopista. Por ello, es preciso la adquisición de un aprendizaje teórico y unas habilidades prácticas básicas que capaciten al endoscopista en la resección de la lesión y en la resolución de eventuales complicaciones. El aprendizaje de la DSE es heterogéneo y puede variar en función de la habilidad individual, de los modelos de entrenamiento disponibles o de la disponibilidad de expertos en la técnica. Aunque no hay un estándar en la docencia y entrenamiento en DSE, se aconseja un aprendizaje en modelo animal que debe preceder a la aplicación progresiva en la práctica clínica humana bajo la tutela de un experto. El aprendizaje progresivo y continuado puede habilitar al endoscopista en el dominio de un procedimiento endoscópico muy resolutivo, de calidad y potencialmente eficiente.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.
El autor desea expresar su agradecimiento al Dr. Adolfo Parra Blanco por haber promovido la iniciación del propio autor en el aprendizaje de la disección submucosa endoscópica, al Dr. Enrique Quintero Carrión por el estímulo continuado para el desarrollo y perfeccionamiento en esta técnica y a la Dra. María Rosa Arnau por su gran apoyo y colaboración durante el aprendizaje de la técnica de disección submucosa endoscópica en modelo porcino vivo.