INTRODUCCIÓN
La endoscopia digestiva se ha transformado considerablemente en los últimos años, tanto en lo referente al material endoscópico como a la complejidad técnica, cada vez mayor, de los procedimientos, aunque paralelamente, gracias a la sedoanalgesia, es también menos molesta para el paciente, quien, por otra parte, cada vez solicita intervenciones médicas que causen menor malestar. Las indudables ventajas en cuanto a comodidad de la sedoanalgesia suponen, por otra parte, una dificultad añadida para el profesional, que debe adquirir y mantener las habilidades necesarias para el uso de fármacos con propiedades sedoanalgésicas y el manejo de las posibles complicaciones. En algunas unidades se han incorporado médicos anestesiólogos para el control directo de la sedación durante los procedimientos endoscópicos1, con lo que ha surgido una importante polémica en torno a quién debe controlar la sedación y cómo debe llevarse a cabo. El propósito de esta publicación es proporcionar a los especialistas en aparato digestivo y endoscopia una sinopsis de las recomendaciones actuales fundadas en la evidencia científica más reciente y de mayor calidad metodológica (anexo 1). El presente documento de consenso se ha dividido en 2 grandes apartados por sus diferentes características y necesidad de monitorización: sedación consciente y sedación profunda. Previamente se exponen los conceptos básicos de sedación, los fundamentos del uso de la sedoanalgesia por personal no anestesiólogo y los requisitos que deben cumplir las unidades.
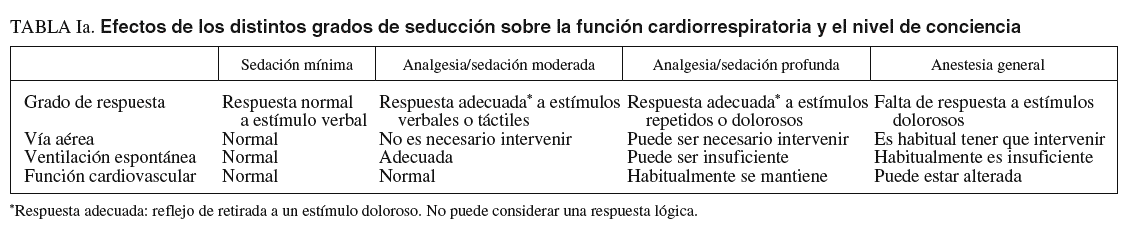
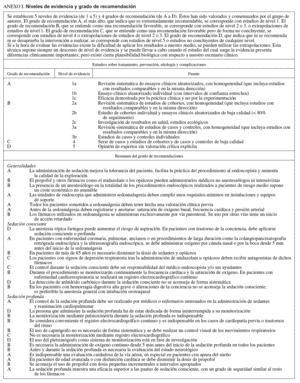
NIVELES DE SEDACIÓN (tablas Ia, Ib y Ic)
Se definen 4 niveles de sedación, de menor a mayor profundidad: ansiólisis, sedación consciente, sedación profunda y anestesia2. No obstante, debe considerarse que durante la exploración es posible progresar de un nivel mínimo a otro más profundo dependiendo de las características del paciente y de la medicación administrada, por lo que estos niveles se contemplan como un continuo desde la sedación mínima o ansiólisis hasta la anestesia general1,3. El nivel de sedación ha de ser progresivo con el fin de conseguir un grado óptimo de bienestar para el paciente y de eficacia en la exploración. Cada paciente puede requerir diferentes grados de sedación para un mismo procedimiento. En general, las exploraciones diagnósticas y terapéuticas no complejas pueden realizarse con éxito con grados moderados de sedación (sedación consciente). Los niveles más profundos se indican para los procedimientos endoscópicos más desagradables, dolorosos, prolongados o complejos, o bien en los casos en que es preferible que el paciente esté inmóvil durante la exploración. La sedación profunda también es imprescindible en pacientes difíciles de sedar con los fármacos habituales para la sedación consciente4-8.
Aunque hasta hace muy poco la ansiólisis y la sedación consciente se consideraban suficientes para la mayor parte de las endoscopias digestivas, paulatinamente la aceptación de las molestias que comportan ha disminuido desde el momento en que se ha conocido que existen opciones más cómodas gracias a la disponibilidad de nuevos fármacos. Así, la sedación profunda ha pasado a considerarse necesaria, en la mayor parte de las unidades, para procedimientos complejos como la colangiopancreatografía retrógrada endoscópica (CPRE) y ultrasonografía endoscópica (USE), así como para los pacientes con exploraciones previas no toleradas o incompletas (pacientes con elevada sensibilidad al dolor, problemas psiquiátricos, alcohólicos o adictos a drogas, narcóticos o benzodiacepinas).
Es esencial reconocer que el límite entre la sedación profunda y la anestesia general es muy sutil, por lo que deben conocerse los conceptos de sedación superficial, sedación profunda y anestesia (tablas Ia, Ib y Ic). Por otra parte, no es posible anticipar con exactitud la respuesta a los sedantes de un paciente concreto8-11. Por todo ello, los facultativos deben tratar de prever los efectos negativos de los fármacos administrando las dosis más pequeñas efectivas y ser capaces de reanimar a los pacientes que muestren respuestas más profundas que las inicialmente deseadas. Como normal general, cuando se pretenda una sedación consciente, se deberá estar capacitado para reanimar a pacientes con sedación profunda, mientras que cuando se busque una sedación profunda es necesario tener capacidad para recuperar enfermos con un estado de anestesia general8-11.
PERSONAL RESPONSABLE DE LA SEDOANALGESIA
Justificación
El desarrollo de la cirugía ambulatoria, en general, y de las técnicas de endoscopia avanzada, en particular, ha impulsado el desarrollo y la utilización de pautas de sedoanalgesia con fármacos cuya biodisponibilidad permita una buena tolerancia por parte de los pacientes, pocos efectos secundarios y, a la vez, recuperación y alta rápida de aquéllos. Los propios endoscopistas, que desde hace años administraban sedación moderada (con benzodiacepinas y opiáceos) para las exploraciones más molestas, prolongadas o dolorosas, han mostrado un interés creciente por nuevos fármacos (propofol, fentanilo y remifentanilo) con perfiles farmacodinámicos que se adaptan mejor a las necesidades de las exploraciones endoscópicas que se realizan en la actualidad.
¿Es necesario el anestesiólogo para la sedación en endoscopias?
La legislación española no es clara respecto a la sedación en la endoscopia digestiva y las sociedades científicas no han llegado a ningún acuerdo sobre la utilización de los diferentes fármacos sedantes. En concreto, la ficha técnica del Ministerio de Sanidad y Consumo sobre la utilización del propofol, que se emplea en la inducción anestésica y en anestesias de corta duración, hace referencia a su forma de administración; indica que debe administrarse en hospitales o unidades «adecuadamente equipados» y por médicos anestesiólogos o intensivistas, y que no debe administrarse por la misma persona que hace la exploración. Desde el punto de vista científico hay múltiples referencias en la bibliografía médica acerca de la administración del propofol y de otros fármacos, como el midazolam y los opiáceos, por parte de médicos no anestesiólogos ni intensivistas, de tal manera que en general la operatividad y los costes se reducen, sin que ningún estudio haya demostrado un menor nivel de seguridad en la administración del fármaco6,12-25. (Grado de recomendación B; nivel de evidencia 2a.)
No obstante, no se han realizado estudios comparativos y suficientemente completos para evidenciar cuál de los 2 sistemas de administración (por anestesiólogo o no) es más seguro y coste-efectivo, y en ninguno de los llevados a cabo se indica qué grado de experiencia y formación específica poseían los médicos que participaron en ellos.
Un estudio reciente publicado en forma de resumen encuentra que el propofol administrado por anestesiólogos se asocia a un riesgo menor de complicaciones cardiopulmonares (definidas de forma amplia como dolor torácico, bradicardia, taquicardia, hipoxia, reacciones vasovagales, distrés respiratorio, hipotensión o hipertensión) que cuando son endoscopistas quienes administran el fármaco26. No obstante, en este estudio no se detectaron efectos adversos graves en ninguno de los 2 grupos (anestesiólogos frente a no anestesiólogos)26. Tampoco se observaron diferencias en cuanto a efectos adversos cuando se comparó el propofol administrado por endoscopistas con las pautas sedantes habituales con narcóticos opiáceos y benzodiacepinas27. Estos datos indican que la administración de propofol es razonablemente segura tanto si la realizan endoscopistas entrenados, asistidos por ayudantes técnicos sanitarios (ATS) o diplomados universitarios en enfermería (DUE) especializados en reanimación y control del paciente en estas situaciones, como anestesiólogos28. (Grado de recomendación B; nivel de evidencia 2a.)
En la mayoría de los estudios en los que no eran anestesiólogos quienes administraban el propofol, las situaciones eran favorables –pacientes menores de 70 años de edad, grados I-II de la clasificación de la American Society of Anesthesiologists (ASA) o exploraciones habituales en las que el propofol se administra en bolos–. Algunos investigadores, no obstante, han analizado la seguridad de la sedación profunda con propofol en pacientes de edad avanzada21,22,27 o en exploraciones endoscópicas de larga duración (colangiopancreatografía retrógada endoscópica [CPRE] y ultrasonido endoscópico [USE])6,16 y han evidenciado que, si bien la frecuencia de aparición de incidencias respiratorias o alteraciones hemodinámicas es mayor en estas situaciones, es posible utilizar pautas de sedación profunda con propofol sin riesgo, si se adaptan las dosis a la situación clínica del paciente y se mantiene una monitorización adecuada. (Grado de recomendación A; nivel de evidencia 1c.)
Todos estos datos indican que la sedación profunda con propofol puede realizarse con un grado de seguridad razonable sin necesidad de disponer de la presencia física de un anestesiólogo en la sala de exploraciones. (Grado de recomendación B; nivel de evidencia 2a.)
A pesar de que se dispone de pocos datos publicados acerca del coste-eficacia o coste-beneficio de la administración de sedación profunda con o sin anestesiólogo/médico entrenado6, las sociedades científicas de endoscopia indican que la presencia de un anestesiólogo para exploraciones endoscópicas habituales en pacientes con riesgo medio supone un coste económico no asumible9. (Grado de recomendación B; nivel de evidencia 2a.)
El problema reside, por tanto, en conocer de qué forma se regula esta área de posible conflicto en la que, por una parte, es preciso garantizar la seguridad de los pacientes y, por otra, posibilitar su aplicación generalizada a un coste razonable. Teniendo en cuenta estas evidencias científicas, y considerando los escenarios reales en la práctica endoscópica en España, podemos indicar que la mayoría de los procedimientos bajo sedoanalgesia se llevan a buen término con el control del médico endoscopista y los ayudantes (ATS-DUE). Sin embargo, hay situaciones concretas que aconsejan la consulta y presencia de un especialista en anestesiología y reanimación28-31. Estas situaciones se caracterizan por la necesidad de sedación profunda y por tener asociado al menos uno de los siguientes factores:
1. Pacientes con riesgo médico elevado:
– Enfermedad coronaria grave o insuficiencia cardíaca descompensadas.
– Enfermedad pulmonar obstructiva crónica (EPOC) grave, necesidad de oxigenoterapia continua.
– Drogadicción o alcoholismo activo.
– Pacientes no colaboradores en exploraciones previas realizadas con sedación profunda.
– Complicaciones médicas durante sedaciones o anestesias anteriores.
2. Pacientes con dificultades teóricas de intubación orotraqueal:
– Complicaciones médicas durante anteriores sedaciones o anestesias.
– Intubación previa dificultosa.
– Historia de apnea del sueño que requiere presión positiva continua de la vía aérea.
– Alteraciones anatómicas graves en la boca, el cuello o las mandíbulas que pueden dificultar la intubación.
– Exploraciones endoscópicas en niños.
– Otras situaciones consideradas por el endoscopista.
Ante la escasa disponibilidad de los anestesiólogos en los procedimientos endoscópicos8, se han propuesto medidas alternativas, como son la existencia de un anestesiólogo disponible en un área próxima y la presencia de un médico no anestesiólogo o ATS-DUE no involucrado en el acto endoscópico, que administra el propofol sin la presencia de un anestesiólogo12-16,18-26,32-37.
Formación del personal en sedoanalgesia
Es evidente, y existe acuerdo general, que los médicos y enfermeras responsables de la administración y control de los fármacos sedantes deben poseer una formación adecuada. Por ello se hace necesario posibilitar su formación reglada, lo que debe permitir la aplicación generalizada de la sedoanalgesia adaptada a las necesidades de las diferentes técnicas endoscópicas diagnósticas y terapéuticas3. Esta formación reglada debe incluirse en los programas de formación del especialista en aparato digestivo y estar supervisada tanto por gastroenterólogos endoscopistas como especialistas en anestesiología y reanimación.
En el período de formación en endoscopia de los especialistas en el aparato digestivo se deberían incluir los siguientes conceptos3:
– Información a los pacientes de la sedoanalgesia.
– Valoración clínica previa a la sedoanalgesia.
– Conocer los diferentes niveles de sedación.
– Conocimiento de la farmacología de los medicamentos usados en sedoanalgesia: mecanismo de acción, dosis, interacciones, influencia de las enfermedades asociadas y de la edad, fármacos antagonistas.
– Fisiología de las vías aéreas, mantenimiento de la función respiratoria.
– Monitorización durante el procedimiento. Conocimiento del instrumental y la interpretación de los parámetros.
– Conocer las complicaciones asociadas de la sedoanalgesia.
– Conocimiento sobre recuperación cardiorrespiratoria.
– Conocimiento de la sedación adecuada a cada una de las técnicas endoscópicas.
Es muy probable que esta formación del personal sanitario de las unidades de endoscopia en el manejo de los fármacos usados en sedoanalgesia mejore la calidad de la sedación y reduzca el riesgo de las complicaciones que de ella se derivan.
Requisitos de la unidad de endoscopia para la administración de edoanalgesia8,9,38 (grado de recomendación A; nivel de evidencia 1c)
1. Personal médico y de enfermería familiarizado con la administración de los fármacos utilizados en la sedoanalgesia y sus antagonistas, y capacitados para la reanimación cardiopulmonar.
2. Salas de endoscopia con tomas de oxígeno y de vacío y con sondas de aspiración.
3. Sala de recuperación y observación tras la sedación.
4. Monitores para la determinación de pulsioximetría que incluyan alarmas en todas las salas. Es recomendable disponer, además, de medición no invasiva de la presión arterial y electrocardiograma.
5. Capnógrafo para registrar la capacidad ventilatoria del paciente e identificar lo antes posible la aparición de apnea. Aunque el uso de capnógrafos puede ser útil en algunos pacientes que reciben sedación profunda, no está indicado su uso sistemático en endoscopia alta por la dificultad para su interpretación.
6. Debe disponerse de un equipo de emergencia y reanimación para sedación y analgesia8 que incluya:
– Equipo intravenoso: guantes, torniquetes, gasas de alcohol, apósitos estériles, catéteres intravenosos (también pediátricos: 22 y 24 G), equipos de suero (también pediátricos: microgotero, 60 gotas/ml), líquidos intravenosos, diferentes tipos de agujas para aspirar medicación e inyección intramuscular, jeringuillas de medidas apropiadas (para niños, de 1 ml) y cinta adhesiva.
– Equipo básico de manejo respiratorio: fuente de aire comprimido, fuente de oxígeno, fuente de succión, catéteres de succión/aspiración (también pediátricos), sondas de succión tipo Yankauer, mascarillas faciales de oxígeno (también para niños), ambús (también de medidas pediátricas), gafas orales y nasales de oxígeno (también para edades pediátricas), mascarillas especiales para traqueostomizados y lubricante.
– Equipo avanzado de manejo respiratorio: laringoscopio completo revisado (también pediátrico), mascarillas de respiración laríngea (también pediátricas) y tubos endotraqueales de diferentes medidas.
– Antagonistas farmacológicos: naloxona y flumazenil.
– Medicaciones para urgencias: adrenalina; efedrina; vasopresina; atropina; nitroglicerina; amiodarona; lidocaína; glucosa (50%); difenhidramina; hidrocortisona, metilprednisolona o dexametasona; salbutamol, y diazepam o midazolam.
7. Debe disponerse en todo momento de un equipo completo de resucitación cardiopulmonar, con revisiones periódicas y sistemáticas (como mínimo semanales) y sustitución del instrumental utilizado de forma inmediata después de su uso9-11,38-40.
8. De la misma forma que para la sedación de los pacientes con enfermedades cardiovasculares, para aquellos que requieran sedación profunda es necesario disponer de un desfibrilador8,9,11,38,39.
9. Es necesario, asimismo, contar con un equipo apropiado para mantener y establecer una vía aérea permeable y proporcionar ventilación con presión positiva con oxígeno suplementario. Debe disponerse de forma rápida de un equipo de succión, un respirador y medicación para resucitación8,9,11,38,39.
10. Ante cualquier complicación debida a la sedación se actuará según los criterios de reanimación cardiopulmonar adecuados. Si se considera necesario, se establecerá contacto de forma urgente con la unidad de cuidados intensivos y/o el servicio de anestesia y reanimación para conseguir la recuperación del paciente. Debe disponerse de teléfonos de contacto directo o alarma que permitan disponer rápidamente de esta colaboración.
SEDACIÓN CONSCIENTE
Es la situación originada tras administrar fármacos y en la que el paciente puede responder a las órdenes verbales o a la estimulación táctil y mantiene la totalidad de las funciones cardiorrespiratorias8.
Objetivos de la sedación consciente
Los objetivos de la sedación consciente son lograr un bienestar y una seguridad adecuados en la realización de la exploración endoscópica. El bienestar del paciente durante la endoscopia digestiva alta y la colonoscopia debería ser suficiente para que estuviese dispuesto a repetirlas en las mismas condiciones, si fuera preciso.
Valoración previa del paciente (grado de recomendación A; nivel de evidencia 1c)
Antes del procedimiento se deben recoger en la historia clínica datos de especial interés para el procedimiento y la sedoanalgesia que se deba realizar:
– Una evaluación previa para clasificar el tipo de riesgo según la clasificación de la ASA (tabla II).
– Exploraciones endoscópicas previas y tolerancia del paciente a ellas.
– Enfermedades asociadas, sobre todo cardiopatía, EPOC, hepatopatía e insuficiencia renal crónica avanzada.
– Alergias medicamentosas.
– Toma de fármacos.
– Adicción a alcohol o drogas.
– Ayuno de al menos 6 h antes de procedimiento (gastroscopia o colonoscopia con anestesia). En casos de urgencia se puede acelerar el vaciamiento gástrico administrando eritromicina por vía intravenosa41.
Procedimientos endoscópicos en los que se utiliza la sedación consciente
La administración de sedación mejora la tolerancia del paciente, facilita la práctica del procedimiento al endoscopista y aumenta la calidad de la exploración. (Grado de recomendación B; nivel de evidencia 2a.)
Existe mucha variabilidad en el uso de la sedoanalgesia en la práctica de la endoscopia digestiva. Así, mientras en Estados Unidos la mayoría de los procedimientos se realizan con sedoanalgesia, en Alemania el 95% de las colonoscopias y las gastroscopias se efectúan sin sedación, y en Francia más del 75% de las colonoscopias se llevan a cabo con anestesia general42,43. (Grado de recomendación A; nivel de evidencia 1c.)
En algunos centros la endoscopia digestiva alta diagnóstica se realiza únicamente con anestesia faríngea o bien con una sedación mínima, dada la corta duración de la exploración. Por otro lado, se ha observado que algunos pacientes toleran mejor la endoscopia (varones, mayores y no ansiosos)44. El uso de endoscopios de calibre pequeño puede evitar el uso de sedación, pero sus principales problemas son la calidad de la imagen y la capacidad de aspirar secreciones45. No obstante, aun asumiendo que determinados procedimientos pueden efectuarse sin sedación, su administración mejora la tolerancia del paciente, facilita la práctica del procedimiento al endoscopista y aumenta la calidad de la exploración.
En los siguientes procedimientos es recomendable la administración de sedación consciente:
– Gastroscopia diagnóstica y terapéutica.
– Colonoscopia diagnóstica y terapéutica.
– Aunque es posible realizar la CPRE y la USE con sedación consciente, es recomendable la sedación profunda, ya que son exploraciones prolongadas, complejas y en las que la posición del paciente puede facilitar la aparición de complicaciones respiratorias.
– Algunos de los procedimientos antes mencionados deben realizarse con sedación profunda cuando exploraciones previas se han tolerado mal con sedación consciente, y también en los casos en que es previsible que se generen problemas que pueden alterar la eficacia o la posibilidad de efectuar la técnica endoscópica, tales como procedimientos previsiblemente complejos, en personas con adicción a alcohol o drogas o en pacientes con ASA ≥ III.
Preparación del paciente
Todos los pacientes a quienes vaya a realizárseles un procedimiento endoscópico deben ser informados previamente acerca de éste y de las técnicas asociadas con la sedación. El documento de consentimiento informado, junto con la hoja de enfermería, debe guardarse en la historia clínica del paciente.
Monitorización previa a la exploración
Todos los pacientes deben disponer de un registro basal de saturación de oxígeno (SaO2), frecuencia cardíaca y presión arterial, que se anotarán en el informe endoscópico, en una hoja de control específica o en la historia clínica. Lo ideal sería que este registro se obtuviera de forma automatizada. (Grado de recomendacion A; nivel de evidencia 1c.)
La hipoxemia (SaO2 < 90%) es frecuente durante las exploraciones endoscópicas y puede deberse a la administración de sedoanalgesia, a la posición del paciente o a la duración de la exploración46-48. Algunas circunstancias contribuyen a la aparición de hipoxemia e hipoventilación, tales como: uso combinado de sedantes y analgésicos, procedimientos prolongados como la CPRE o USE, dolor motivado por la endoscopia (colonoscopia), hemorragia digestiva activa, ancianos, anemia, obesidad, enfermedad pulmonar asociada, demencia y uso de dosis elevadas de analgésicos o narcóticos.
La administración de oxígeno suplementario ayuda a corregir la hipoxemia en los pacientes sometidos a cualquier procedimiento endoscópico49-51. Esto es especialmente importante en pacientes con EPOC o con historia de enfermedad coronaria en quienes la taquicardia asociada puede también influir negativamente. En esta situación, la oxigenoterapia puede evitar la aparición de complicaciones52.
Sin embargo, la administración de oxígeno retrasa la detección de la hipoventilación, por lo que en estas circunstancias pueden ser de utilidad la monitorización del anhídrido carbónico (CO2) espirado y la curva de actividad respiratoria mediante el uso del capnógrafo53.
Debe administrarse oxígeno suplementario durante los procedimientos de larga duración (CPRE y USE), en pacientes sometidos a sedación en los que la hipoxemia pueda acentuar las lesiones miocárdicas (anemia grave, enfermedad coronaria y ancianos), o en los que se produzca desaturación de oxígeno (SaO2 < 90%) durante el procedimiento. (Grado de recomendación A; nivel de evidencia 1c.)
Si se produce desaturación a pesar de la administración de oxígeno, deben valorarse la situación del paciente, la necesidad de interrumpir la exploración y la conveniencia de administrar fármacos antagonistas de la sedoanalgesia.
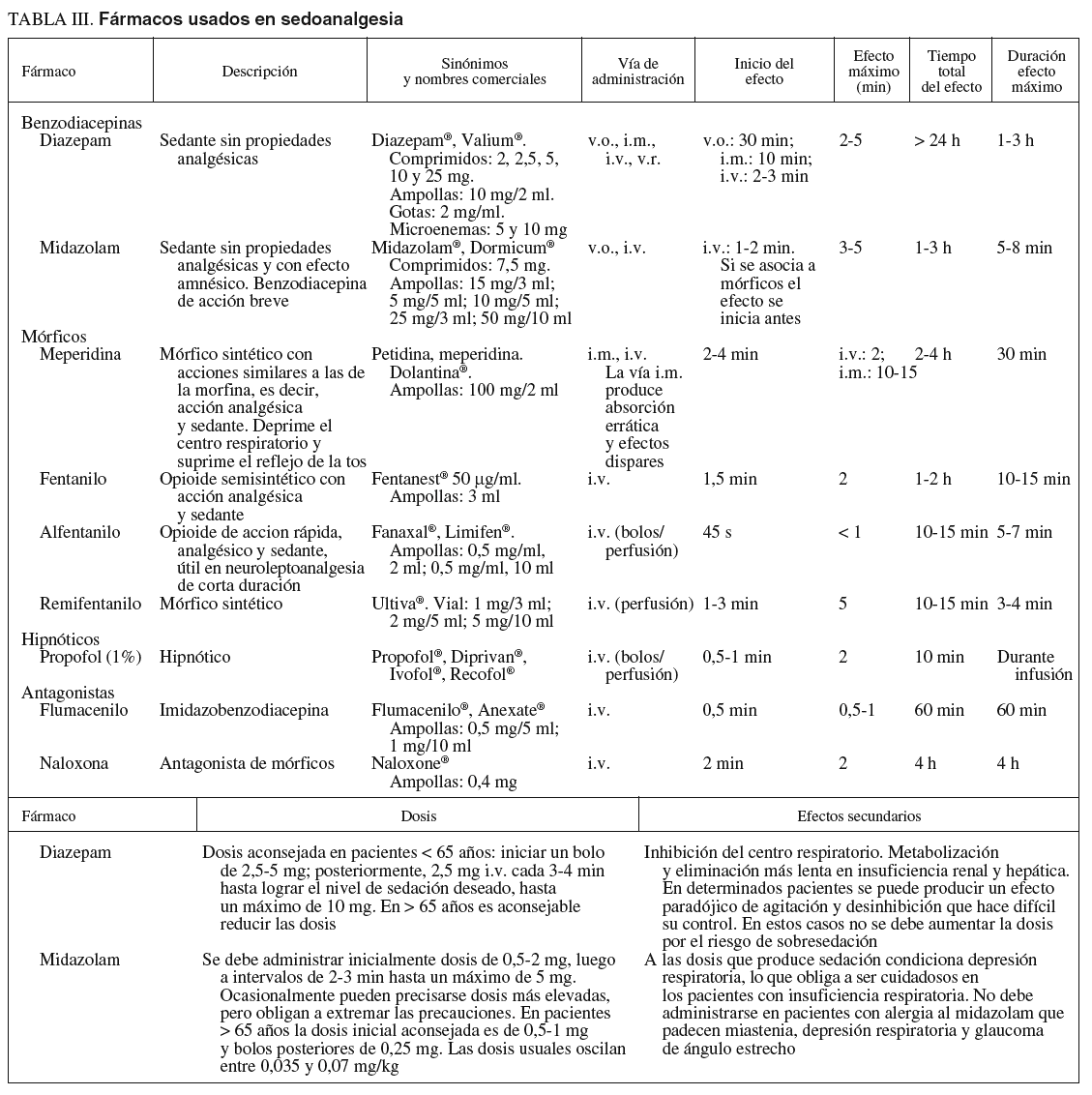
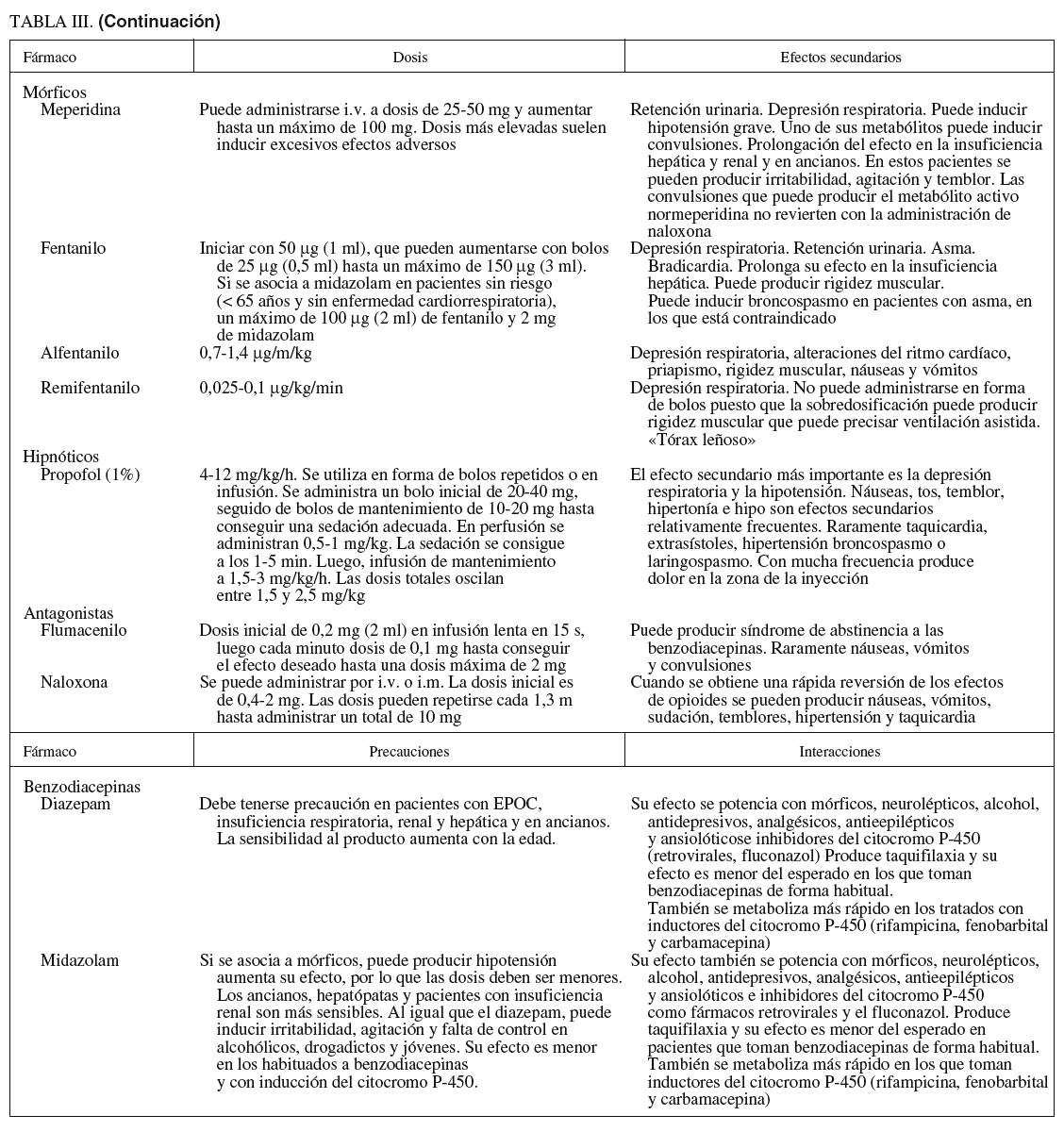
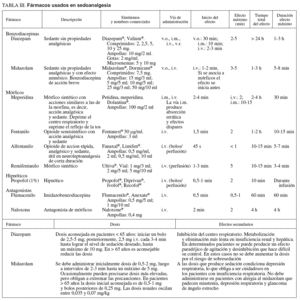
Fármacos (tabla III)
La elección de la medicación y de la dosis más apropiada debe individualizarse en cada paciente, considerando asimismo el grado de sedación necesario para completar el procedimiento previsto.
Para la sedoanalagesia en endoscopia digestiva se utilizan diversos fármacos con los que se pueden lograr distintos niveles de sedación.
Anestesia tópica faríngea
Se utiliza para disminuir el reflejo nauseoso y las molestias faríngeas ocasionadas durante la endoscopia digestiva alta. Se administra habitualmente lidocaína, benzocaína o tetracaína en forma de aerosol y su efecto dura generalmente menos de 1 h, por lo que se recomienda no ingerir alimentos durante este período.
Los ensayos clínicos que han utilizado anestesia faríngea frente a sedación consciente han mostrado resultados discrepantes, que han sido favorables para la primera en algunos trabajos44 o en algún subgrupo de pacientes54. Sin embargo, puede aumentar el riesgo de aspiración en pacientes con trastornos de la conciencia, sedación consciente o profunda. (Nivel de evidencia 5; grado de recomendación D.)
Dados su posible beneficio en términos de comodidad, su perfil de seguridad y su bajo coste, puede aconsejarse su uso en pacientes sometidos a endoscopia digestiva alta sin sedación o con sedación mínima. No obstante, el riesgo de aspiración se incrementa con el uso de anestesia tópica al estar inhibido el reflejo nauseoso, por lo que se desaconseja en pacientes ancianos o debilitados o con trastornos de la conciencia.
Sedantes. Benzodiacepinas
Los más utilizados son el midazolam y el diazepam.
1. La acción del midazolam es relativamente corta y, administrado en forma de bolos, con frecuencia consigue amnesia durante un período muy corto pero variable. En pacientes mayores de 65 años o con enfermedades cardiorrespiratorias es aconsejable valorar los efectos y, como normal general, disminuir la dosis. La presentación farmacéutica de 1 mg/ml suele ser más fácil de dosificar que la más concentrada de 5 mg/ml, que corresponde a la presentación alternativa. La extravasación produce menos problemas que el diazepam.
2. El diazepam tiene un perfil similar al midazolam, pero con menor potencia. Puede producir dolor en el punto de inyección si hay extravasación. Su efecto más prolongado y su menor potencia han limitado su uso, en el que deben tenerse las mismas precauciones que para el midazolam.
En diversos estudios controlados se ha observado que la eficacia en la sedación con estos 2 fármacos es similar, existiendo únicamente diferencias en la dosificación y en la potencia55. Sin embargo, los datos de consumo en Estados Unidos indican una mayor utilización del midazolam (el 73 frente al 49%)56, probablemente debido a su inicio de acción más rápido, su menor vida media y el mayor efecto amnésico que produce.
Opiáceos. Analgésicos
1. Meperidina y petidina. Se considera que los efectos sedantes y analgésicos son más erráticos e impredecibles que con otros mórficos, por lo que los anestesiólogos tienen tendencia a sustituirlos por el fentanilo, un fármaco 100 veces más potente a la misma dosis y con un perfil farmacodinámico mejor por su menor vida media. Sus efectos secundarios son sensación nauseosa, depresión del sistema nervioso central y del centro respiratorio. Interactúa con fármacos depresores del sistema nervioso central e inhibidores de la monoaminooxidasa. En pacientes con insuficiencia hepática la vida media puede ser más larga.
2. Fentanilo. Sus efectos secundarios son menores y más predecibles que con la meperidina y es 100 veces más potente. Su vida media es relativamente corta y se adapta bien a la duración de los procedimientos endoscópicos. A los 20-25 min de la inyección la mayoría de los pacientes presentan estabilidad en los signos vitales y se les puede dar el alta si están acompañados.
Los efectos secundarios a destacar son: riesgo de depresión respiratoria, náuseas o vómitos, prurito e hipotensión, relacionados con la liberación de histamina. Todos estos efectos se potencian con la asociación a benzodiacepinas.
No se dispone de estudios comparativos entre meperidina y fentalino. Las encuestas de consumo entre gastroenterólogos demuestran que un 89% utiliza la meperidina, pero cuando el entrevistado es un anestesiólogo prefiere el fentanilo, por su vida media corta y su acción más rápida, además de porque produce menor sensación nauseosa56.
Combinación de fármacos
En la práctica diaria se utiliza con frecuencia la asociación de un sedante y un opiáceo, sobre todo en procedimientos de larga duración o en pruebas como la colonoscopia, donde el mayor problema es el dolor57,58. Sin embargo, esta combinación de fármacos aumenta el riesgo de desaturación y de complicaciones cardiorrespiratorias. La dosificación de los fármacos es la misma que cuando se administran individualmente, con la precaución de administrar antes el mórfico para evitar una sobredosificación.
Antagonistas de sedantes y opiáceos
Los fármacos que revierten los efectos de los sedantes y opiáceos son importantes en los casos de sobredosificación. En la práctica diaria los antagonistas de las benzodiacepinas se utilizan en los pacientes ambulantes para acelerar el período de recuperación y disminuir el tiempo de control tras la exploración. La administración del antagonista puede crear un efecto de resedación, causada por la desaparición de su efecto debido a una menor vida media, aunque no parece que éste sea un problema clínico relevante, a menos que se haya producido sobredosificación.
Flumazenil. Antagonista de las benzodiacepinas que se utiliza para revertir la sedación y las alteraciones psicomotrices. Su acción sobre la depresión respiratoria es más limitada. Si aparece depresión respiratoria con el uso combinado de sedantes y analgésicos, hay que utilizar primero el antagonista de los opiáceos.
En varios ensayos clínicos59-61 se ha demostrado la eficacia del flumazenil para revertir la sedación y disminuir el tiempo de recuperación. Sin embargo, el coste elevado del fármaco ha sido una limitación en su utilización. Ocasionalmente puede inducir crisis de pánico.
Naloxona. Antagonista de los opioides que se utiliza para revertir la sedación y depresión respiratoria producida por los narcóticos. Cuando se utilizan conjuntamente sedantes y opiáceos y el paciente desarrolla depresión respiratoria, es más eficaz administrar naloxona en primer lugar, por el mayor efecto sobre la depresión respiratoria. Su uso determina una liberación de catecolaminas que puede producir complicaciones cardíacas.
Indicaciones de los fármacos antagonistas (grado de recomendación C; nivel de evidencia 4):
– Pacientes con signos de depresión respiratoria (hipoxemia) a pesar de oxígeno suplementario o movimientos respiratorios lentos que no responden a estímulos.
– No hay datos convincentes acerca del uso sistemático en todos los procesos de sedación59-61. En este punto el coste económico de la reversión hay que compararlo con el menor uso de la sala de recuperación. Su empleo no elimina el rie resedación cuando se utilizan narcóticos o sedantes de vida media larga.
Monitorización durante el procedimiento
En los procedimientos en que se realiza sedación superficial o sedación consciente se ocupará del control el médico endoscopista y/o ayudantes. Si progresa a sedación profunda (respuesta únicamente de retirada ante un estímulo doloroso), es necesario que una persona no implicada en la exploración y capacitada para técnicas de resucitación realice el control de la sedación3. (Grado de recomendación C; nivel de evidencia 4.)
Durante el procedimiento se registrarán de forma continua la frecuencia cardíaca y la SaO262 (grado de recomendación B; nivel de evidencia 2b). Una vez estabilizada la sedación, deben controlarse la presión arterial y la frecuencia cardíaca. En pacientes con enfermedad cardiorrespiratoria se realizará además un registro continuo de electrocardiograma. (Grado recomendación B; nivel de evidencia 2b.)
La utilización del pulsioxímetro en todos los procedimientos endoscópicos es necesaria, pero no detecta la hipoventilación y la hipercapnia, sobre todo si se administra oxígeno suplementario. En estos casos únicamente la detección de CO2 permite evaluar mejor la hipoventilación. Aunque sería aconsejable en pacientes sometidos a exploraciones de larga duración o con sedación profunda, las guías de práctica clínica de sedación no aconsejan su uso sistemático, ya que no existen estudios que lo recomienden, por lo que se debe realizar un control visual de los movimientos respiratorios. (Grado de recomendación D; nivel de evidencia 5.)
Complicaciones de la sedación consciente
Un número variable de complicaciones están relacionadas con la sedoanalgesia. De ella, las más frecuentes son las cardiorrespiratorias. La tasa global de complicaciones oscila entre el 0,1 y el 0,2%, con una mortalidad del 0,0014%63,64.
Flebitis
La frecuencia de la flebitis es pequeña y se da más a menudo cuando se utiliza diazepam en venas de pequeño calibre. También aumenta con la duración de la perfusión65.
Complicaciones cardiorrespiratorias
Son las más frecuentes y graves. Incluyen hipoxemia, hipotensión, arritmias y aspiración broncopulmonar.
Hipoxemia. La desaturación de oxígeno es más frecuente de lo que se piensa, en muchas ocasiones porque no se registra. Diversos estudios prospectivos ponen de manifiesto que aproximadamente un 50% de los pacientes sometidos a endoscopia desarrollan hipoxemia, y ésta se relaciona más con la sedación que con el tipo de endoscopia48, si bien puede aparecer sin administrar sedación.
Hipotensión. Es una alteración relativamente frecuente, sobre todo en los casos en que se asocian sedantes y analgésicos, o con el uso de propofol62,63.
Taquicardia sinusal. Es la arritmia más frecuente, aunque pueden aparecer otras arritmias clínicamente relevantes (extrasístoles, ritmos ectópicos, cambios en la repolarización, etc.). La aparición de arritmias se relaciona con la edad del paciente, con la presencia de enfermedades asociadas, sobre todo cardíacas, con el tipo de endoscopia realizada y con la presencia de hipoxemia.
Aspiración. De especial importancia en los pacientes con hemorragia digestiva alta. Por ello, cuando la hemorragia es activa y el paciente tiene un nivel bajo de conciencia, la endoscopia se realizará con intubación orotraqueal66. En pacientes con hemorragia digestiva alta grave o alteraciones mentales no se aconseja el uso de sedación consciente. (Grado de recomendación B; nivel de evidencia 2a.)
Criterios de recuperación y alta después de la sedación
Véase apartado «Sedación profunda».
SEDACIÓN PROFUNDA
La provisión de una adecuada sedación y analgesia es una parte consustancial a la práctica de la endoscopia gastrointestinal38,39. La sedación profunda es aquella parte del espectro, previa a la anestesia general, en la que los pacientes responden sólo a estímulos dolorosos y el soporte respiratorio, si bien puede ser necesario, sólo lo es de forma ocasional. El siguiente paso es la anestesia general, en la que los pacientes no responden a ningún estímulo y es imprescindible mantener artificialmente la función respiratoria (tablas Ia, Ib y Ic)8,9,39.
El propofol, por sus características farmacodinámicas, ha sido el fármaco sedante que mejor se adapta a las necesidades de sedación profunda de la endoscopia digestiva. A diferencia de las benzodiacepinas o de la mayoría de los opiáceos, consigue un inicio rápido de la acción sedante, un grado de sedación más profundo y una recuperación más rápida; por tanto, es el de elección en la realización de las exploraciones endoscópicas que necesiten sedación profunda12,32-36,67. Estas ventajas, junto a los escasos efectos adversos referidos, han motivado que algunos autores hayan aconsejado también pautas de sedación profunda con propofol, para acortar el acto endoscópico, en las exploraciones más habituales (gastroscopia y colonoscopia).
Objetivo de la sedación profunda
El objetivo de la sedación profunda es mejorar la tolerancia del paciente y la calidad de las exploraciones endoscópicas para: a) facilitar la exploración; b) conseguir que el procedimiento sea cómodo para el paciente, y c) minimizar el riesgo de la exploración.
Para que la exploración endoscópica sea de calidad, la sedación debe conseguir que el paciente esté tranquilo y que los movimientos originados se deban únicamente a la respiración y a la actividad cardíaca.
La comodidad se relaciona con un grado de sedación que permita que la percepción de las molestias originadas por la endoscopia sea mínima o nula, pero conservando la función respiratoria espontánea (reflejos de tos y vómito) y el grado de oxigenación adecuado.
El riesgo que condiciona la sedación dependerá de cada paciente, de la propia exploración a realizar y de la dosis y forma de administración de los fármacos utilizados.
Personal responsable de la sedación profunda
Existe acuerdo en que la sedación profunda debe realizarla personal entrenado en la administración de sedantes y en reanimación cardiopulmonar, así como en ciertas condiciones de control (pulsioximetría, presión arterial y, en determinados pacientes, trazado electrocardiográfico y capnografía). También existe acuerdo en que los pacientes con ASA I y II tienen menor riesgo que aquéllos con ASA III y IV, en quienes el control debe ser más intenso16. (Grado de recomendación A; nivel de evidencia 1c.)
La formación específica para efectuar sedoanalgesia profunda incluye reconocer las alteraciones en la permeabilidad de las vías respiratorias, alteraciones de ventilación y cardiocirculatorias, así como poder intervenir eficazmente sobre ellas. Además, es necesario tener conocimiento de la farmacodinámica de las sustancias utilizadas para la sedoanalgesia, así como de los fármacos vasoactivos empleados para resolver las alteraciones cardiocirculatorias que se puedan presentar y posibilidad de intubar si fuese necesario. (Grado de recomendación B; nivel de evidencia 2a.)
La cualificación del personal sanitario responsable de la administración de pautas de sedación profunda debe incluir:
– Conocimiento y experiencia con los diferentes niveles de sedación y analgesia.
– Conocimiento y experiencia con los principios de la sedación profunda y la resucitación.
– Entrenamiento en la administración de sedación profunda.
– Conocimiento de los fármacos utilizados para la sedación profunda en endoscopia (midazolam, benzodiacepinas, propofol, petidina, fentalino, alfentanilo y remifentanilo).
– Capacidad para reconocer a los pacientes que progresen a un nivel más profundo de sedación que el que se quiere conseguir.
– Capacidad para recuperar a los pacientes que no respondan de forma adecuada a los estímulos repetidos o dolorosos, que sean incapaces de proteger su vía aérea o que pierdan su función respiratoria o cardiovascular espontánea.
Con la información de que se dispone, por lo tanto, se puede recomendar que el equipo que realice la sedación profunda debe estar compuesto por al menos:
– Médico entrenado en técnicas de sedación profunda y con capacidad para rescatar a los pacientes de cualquier nivel de sedoanalgesia. Este profesional puede ser el propio endoscopista si cuenta con una enfermera exclusiva entrenada y responsable de la administración y monitorización del paciente.
– Enfermera experta en la administración de propofol para sedación endoscópica.
Criterios de selección de los pacientes
Valoración del paciente
Aunque existen pocos datos sobre la relación entre sedoanalgesia y la mortalidad, es necesario establecer unas normas de valoración del paciente para determinar si hay factores específicos que condicionen riesgo al administrar pautas de sedación profunda. Esta valoración debe incluir8,9,68:
1. Una evaluación previa para clasificar el tipo de riesgo según la clasificación de la ASA (tabla II).
2. Valoración de la vía aérea:
– Historia clínica dirigida con el fin de detectar: a) historia previa de convulsiones o alergia a la soja, a los huevos o al propofol; b) historia de apnea del sueño, estridor o ronquera, cuello corto o estrecho, incapacidad para abrir suficientemente la boca, o bien historia previa de intubación difícil; c) pacientes con problemas previos con la sedación profunda o anestesia general; d) artritis reumatoide avanzada, y e) anormalidades cromosómicas (p. ej., trisomía 21).
– Examen físico, que deberá incluir una valoración de:
a) hábito externo; b) obesidad significativa, especialmente la que afecte al cuello y a las estructuras faciales; c) cabeza y cuello: cuello corto con extensión limitada, distancia hioidementoniana reducida (< 3 cm), enfermedades o traumatismos de la columna cervical, desviación de la tráquea y signos de dismorfia facial (p. ej., síndrome de Pierre Robin); d) boca: apertura menor a 3 cm en el adulto, incisivos protrusivos, malformaciones o traumatismos dentales, macroglosia, paladar estrecho o arqueado, hipertrofia tonsilar, úvula no visible, y e) mandíbulas: micrognatia, retrognatia, trismos y mala oclusión significativa.
3. Pacientes con dificultad de vaciamiento gástrico o riesgo de broncoaspiración por cualquier causa.
Todos estos elementos pueden ser útiles en la predicción de problemas con el manejo de la vía aérea. Una evaluación rápida de estos problemas en cada paciente debe incluir69 (grado de recomendación A; nivel evidencia 1c):
– Apertura de la boca (preferiblemente > 3 cm) y estado de dentición.
– Posibilidad o no de ver la úvula.
– Capacidad de extensión de la columna cervical.
– Grado de obesidad y tamaño del cuello.
– Distancia desde el mentón al cartílago tiroides (preferiblemente > 3 cm).
Si no se detecta ninguna de estas situaciones, la sedación con propofol puede realizarse directamente en los pacientes con ASA I-II. Los que presenten alguna de las eventualidades mencionadas y/o tengan grados de riesgo de la clasificación ASA de tipo III o IV han de ser valorados previamente, antes de proceder a la sedación, por el anestesiólogo o el médico responsable de la ésta, quien debe realizar las exploraciones y valoraciones pertinentes para garantizar la máxima seguridad durante la sedación.
Exploraciones endoscópicas en las que se indica sedación profunda
Las indicaciones de sedación profunda incluyen tanto determinados procedimientos como las características de cada paciente con independencia de la complejidad de la exploración.
1. Indicaciones en relación con la exploración endoscópica:
– CPRE y técnicas asociadas.
– USE alta y técnicas asociadas (punción, neurólisis, tratamiento de seudoquistes).
– Colonoscopias totales con o sin ileoscopia o terapéuticas. Aun cuando es posible realizarlas con sedación consciente e incluso sin sedación70,71, en algunos casos en que la exploración puede ser muy dolorosa y técnicamente dificultosa, la sedación profunda es imprescindible: mujeres con histerectomía o cirugía ginecológica previa y personas con índice de masa corporal bajo.
– Gastroscopias que se consideren prolongadas (p. ej., estudio de esófago de Barrett, estudio de lesiones mucosas con tinción/magnificación) o en las que se aplique tratamiento invasivo.
– Enteroscopia.
– Procedimientos terapéuticos: escleroterapia; ligadura de varices esofágicas o gástricas; colocación de prótesis esofágicas, gastroduodenales, enterales; aplicación de argón ionizado (beam); láser en cualquiera de sus modalidades; mucosectomía en cualquiera de sus modalidades; gastrostomía endoscópica percutánea; extracción de cuerpos extraños; dilataciones de estenosis del aparato digestivo; colocación de sondas de alimentación nasoenteral; colocación de sondas de descompresión en colon; colocación de balones intragástricos; alcoholización de tumores; procedimientos endoscópicos antirreflujo; tratamiento endoscópico del divertículo de Zenker.
2. Indicaciones relacionadas con las características de los pacientes
– Pacientes de edad pediátrica.
– Malas experiencias previas.
– Exploraciones previas incompletas por intolerancia.
– Colonoscopia en pacientes con antecedentes quirúrgicos abdominales bajos, diverticulosis masiva, mujeres de edad avanzada.
– Necesidad de conseguir la máxima inmovilidad posible del paciente.
La sedación profunda puede considerarse indispensable en todas las exploraciones que puedan prolongarse y sean dolorosas, como la CPRE, la USE, la colonoscopia y todas las que impliquen tratamiento. También es indispensable para las que se realizan en pacientes no colaboradores (por edad o estado mental, e incluso los que son aprensivos). Es adecuada para los pacientes con exploraciones incompletas por mala tolerancia y que las consideran intolerables, para aquellos que, por razón de su enfermedad, se presuma que han de ser explorados periódicamente69 y cuando sea necesaria la inmovilidad del paciente.
Preparación del paciente
La sedación profunda se caracteriza por la pérdida de contacto verbal con el paciente, ya que éste únicamente responde a estímulos intensos, en general dolorosos. En esta situación el límite entre sedación profunda y la anestesia general es difícil de percibir. Por consiguiente, se recomienda una preparación previa del paciente, que incluirá (grado de recomendación B; nivel de evidencia 2a):
1. La información relativa a la exploración a realizar y su riesgo.
2. La obtención del consentimiento informado específico para la sedación profunda y para la exploración endoscópica que se realice.
3. La información relativa a la situación médica general del paciente, incluidas las enfermedades asociadas que padezca y sobre todo aquellas que puedan condicionar un riesgo para la sedación (clasificación ASA) (tabla II).
4. Historia de reacciones indeseables previas a cualquier sedante o anestésico, o de problemas cardiorrespiratorios anteriores.
5. Medicación actual, habitual y alergias farmacológicas.
6. La preparación física para el procedimiento:
– Ayunas para alimentos sólidos durante 8 h y para líquidos durante 4 h antes de la prueba.
– Acceso venoso.
– Premedicación que se requiera por el procedimiento endoscópico.
– Datos demográficos y antropométricos (sexo, edad, peso y talla).
7. Monitorización. Aparte de la pulsioximetría, existe escasa evidencia científica que cuantifique el beneficio obtenido con estos controles, que en definitiva se han establecido en reuniones de consenso8.
– Pulsioximetría. La monitorización indispensable para el uso de pautas de sedación profunda es la determinación de la SaO2 mediante pulsioximetría. Es aconsejable que ésta disponga de sistema de sonido para el ritmo cardíaco y alarmas para señalar auditivamente los descensos de oximetría40. Habitualmente, el grado de sedación se valora indirectamente por la inhibición que los sedantes pueden producir sobre el centro respiratorio, de forma que el grado de oxigenación de la hemoglobina circulante (presión parcial de oxígeno) se relaciona con el grado de sedación. La curva de saturación de la hemoglobina se modifica de forma lenta entre el 100 y el 90%, mientras que las variaciones son mucho más rápidas por debajo del 90%. Esta característica se utiliza durante la sedación, de forma que es aconsejable mantener valores de SaO2 iguales o superiores al 90%. El uso del pulsioxímetro no excluye la necesidad de de controlar los movimientos respiratorios. (Grado de recomendación B; nivel de evidencia 2b.)
– Presión arterial. Debe determinarse antes de iniciar la sedoanalgesia profunda y luego periódicamente durante la sedación. (Grado de recomendación B; nivel evidencia 2b.)
– Trazado electrocardiográfico. Se considera conveniente disponer de una pantalla con trazado electrocardiográfico, que es indispensable si el paciente padece una cardiopatía o tiene trastornos del ritmo. (Grado de recomendación B; nivel de evidencia 2b.)
– Capnografía. No hay datos publicados que demuestren de forma clara que la capnografía sea capaz de prevenir las complicaciones relacionadas con la desaturación de oxígeno. Sin embargo, la mayoría de sociedades de endoscopia y de anestesia recomiendan que en las exploraciones que requieren sedación profunda durante períodos prolongados se realice una evaluación gráfica automática de la actividad respiratoria y la saturación de CO2 mediante capnografía. Dos estudios indican que la capnografía permite anticipar la aparición de depresión respiratoria, ya que los episodios de apnea pueden visualizarse en el monitor del capnógrafo como pérdida de la actividad respiratoria (línea plana) y ello se produce antes que la disminución de la SaO2 detectada en el oxímetro13,53,72. (Grado de recomendación B; nivel de evidencia 2b.)
– Sistemas de monitorización de la sedación profunda basados en el registro electroencefalográficos. Si bien algunos estudios73-77 han señalado la utilidad de éstos para determinar los niveles de sedación y las dosis de sedantes durante la endoscopia digestiva, su utilización sistemática todavía requiere nuevas investigaciones que permitan concretar mejor el papel de este tipo de monitorización. (Grado de recomendación C; nivel de evidencia 4.)
– Se están evaluando también otros tipos de monitorización, como la pletismografía, que permite anticipar la depresión y la permeabilidad respiratoria; los sistemas de control que evalúan la respuesta del sistema vegetativo autónomo a las situaciones de estrés asociadas a una sedoanalgesia no adecuada y que se traducen en hipertensión y taquicardia. La mayoría de estos métodos están en la actualidad en fase de investigación y no se han demostrado aún los beneficios que puedan aportar a la práctica clínica diaria. (Grado de recomendación D; nivel de evidencia 5.)
8. Administración sistemática de oxígeno desde 5 min antes del inicio de la exploración, ya que la administración suplementaria de oxígeno disminuye la magnitud de su desaturación en las exploraciones con sedación49-51. Además, se ha demostrado también que la oxigenación previa y durante la exploración disminuye la incidencia de desviación del ST en pacientes con cardiopatía isquémica78. A pesar de ello, la relevancia clínica de episodios transitorios de hipoxemia se ha cuestionado, y se debe tener en cuenta que la administración suplementaria de oxígeno puede retrasar el reconocimiento de las apneas y la retención de CO2 que refleja la hipoventilación alveolar, un hecho que tiene una significación clínica superior a la disminución de la SaO2. (Grado de recomendación B; nivel de evidencia 2a.)
9. Valoración de la situación neurológica: nivel de conciencia, estado de orientación temporal y espacial antes y durante la sedación. (Grado de recomendación B; nivel de evidencia 2b.)
10. Evaluación de la vía respiratoria, con interés particular en los pacientes con apnea del sueño, problemas dentales, faciales, mandibulares, de la boca o del cuello (véase «Valoración de la vía aérea» en «Criterios de selección de los pacientes»). (Grado de recomendación A; nivel de evidencia 1a.)
Sedantes utilizados en la sedación profunda
La sedación representa un continuo de respuesta. La estrecha ventana terapéutica de los fármacos utilizados habitualmente para la sedación profunda significa que pequeñas dosis de estos fármacos pueden producir disminuciones imprevisibles del nivel de conciencia o de la actividad respiratoria o cardíaca. Además, la combinación de diferentes sedantes y/o analgésicos puede potenciar la depresión respiratoria y crea la necesidad de ajustar apropiadamente las dosis de cada componente y monitorizar de forma continuada la función cardiorrespiratoria8,9,38,39. Los fármacos utilizados en la actualidad para la sedación profunda en endoscopia digestiva son el propofol, las benzodiacepinas y los opiáceos. Algunos de ellos se han explicado en el apartado de sedación consciente, y las características, normas de utilización, indicaciones y efectos adversos son aplicables a la sedación profunda. En esta parte de la guía se hará referencia al propofol y al remifentanilo como fármacos utilizados en la sedación profunda.
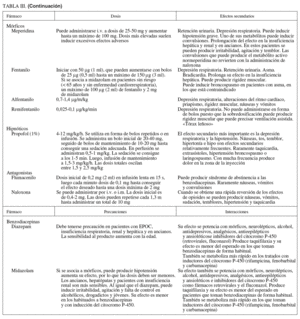
Propofol
Propiedades farmacológicas. El propofol es un agente hipnótico de duración ultracorta con propiedades sedantes, hipnóticas y amnésicas pero mínima acción analgésica79. Está aprobado por la Agencia Española del Medicamento para la inducción y el mantenimiento de la anestesia general y para la sedación en pacientes ventilados. También está indicado para la sedación consciente o profunda durante procedimientos menores como la endoscopia. El propofol es lipofílico y contiene aceite de soja, glicerol y lecitina de huevo, por lo que está contraindicado en pacientes con hipersensibilidad a los huevos y la soja10,40,80-82.
La acción sedante y amnésica del propofol es dependiente de la dosis y produce efectos hipnóticos sinérgicos cuando se combina con determinados opiáceos, midazolam y tiopental, mientras que con el fentanilo tiene efectos aditivos79. Produce disminución de la presión sanguínea y del gasto cardíaco. La administración concomitante de opiáceos incrementa los efectos hemodinámicos del propofol, pero éstos son menores cuando se utilizan opiáceos que no inducen liberación de histamina como el fentanilo y el remifentanilo.
El propoa sedación es de 30 a 60 s y su vida media plasmática tiene un intervalo de 1,3 a 4,13 min10,40,80-83, lo que representa una ventaja sustancial para la realización de exploraciones endoscópicas, ya que el fármaco finaliza su efecto y se elimina con rapidez. La depresión respiratoria y de la conciencia que puede inducir desaparece también con rapidez.
Sus propiedades farmacocinéticas no cambian significativamente en pacientes con enfermedades hepáticas o renales crónicas moderadas10,40,80-83. Es necesario reducir la dosis en enfermos con disfunción cardíaca y en pacientes de edad avanzada, debido a que está disminuido el aclaramiento plasmático del fármaco84. (Grado de recomendación A; nivel de evidencia 1b.)
El propofol no tiene antagonistas específicos, lo que, junto a la estrecha ventana terapéutica, puede incrementar el riesgo de complicaciones si no se administra apropiadamente. Por esto son necesarios el entrenamiento del personal que lo utiliza y la monitorización adicional del paciente a fin de que su administración sea segura10,11. Respecto a las benzodiacepinas y los opiáceos, la rapidez de eliminación del fármaco representa una ventaja para la endoscopia si se dispone de capacidad, conocimientos y medios para mantener la función respiratoria durante los cortos episodios de depresión respiratoria que puedan presentarse. En la tabla IV se muestran las ventajas y desventajas del propofol para la sedación profunda. (Grado de recomendación A; nivel de evidencia 1a.)
Administración de propofol. El propofol puede administrarse en bolos sucesivos o bien mediante perfusión intravenosa continua con bomba de infusión. Una u otra forma de administración dependerá del tiempo de duración de la exploración. Cuando se administre en bolos, se inyectará en dosis sucesivas hasta el objetivo deseado de sedación. Antes de cada dosis se deben evaluar el nivel de sedación del paciente y los parámetros fisiológicos. La duración y la dificultad del procedimiento endoscópico, así como la respuesta individual del paciente a la administración de propofol, determinarán la dosis apropiada y máxima de sedación. La dosis variará con la edad del paciente, superficie corporal, morbilidad asociada, grado de ASA, historia previa de uso de fármacos psicotrópicos y la administración concomitante de otros agentes sedantes8.
Las dosis iniciales pueden ser más altas y se pueden administrar a intervalos más frecuentes para inducir la sedación; las dosis subsiguientes, para mantener el nivel apropiado de sedación, deben ser menores e infundirse a intervalos de tiempo más largos9,39.
Opiáceos en la sedación profunda (petidina, fentanilo, alfentanilo y remifentanilo)
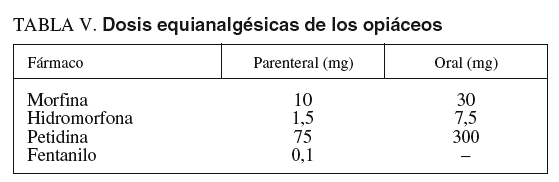
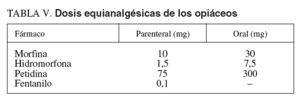
Las exploraciones endoscópicas en que el dolor es un componente importante en la tolerancia pueden requerir la administración asociada de opiáceos por su efecto predominantemente analgésico49,85. Aunque la función del dolor es protectora, su aparición durante los procedimientos endoscópicos necesita un control adecuado. El objetivo debería ser conseguir una analgesia adecuada con unos efectos secundarios tolerables. Para su utilización en la sedación profunda durante la endoscopia digestiva, los opiáceos deberían tener un inicio rápido de acción, dosificación fácil y efectos predecibles86. Las características, la dosificación, las vías de administración y los efectos adversos de los opiáceos más frecuentemente utilizados (petidina y fentanilo) en la sedoanalgesia se explican bajo el epígrafe «Opiáceos. Analgésicos» del apartado «Sedación consciente». Tiene interés, desde el punto de vista de la sedación profunda, conocer las dosis equianalgésicas de estos fármacos (tabla V), es decir, la potencia relativa de 2 opiáceos para producir el mismo efecto analgésico. Se considera como efecto analgésico estándar el que se consigue con la administración parenteral de 10 mg de morfina en pacientes que no son tratados de forma crónica con opiáceos o que los han recibido previamente (pacientes que toleran los opiáceos), ya que las dosis en estas situaciones pueden ser diferentes87.
En cuanto a la forma de administración, se aconseja que se utilice en dosis pequeñas, que se incrementarán hasta alcanzar el objetivo de sedación deseado. La medicación debe darse a intervalos apropiados. Cuando la vía de administración no es la parenteral, el inicio de acción se retrasa debido a la absorción. No se aconseja la administración de dosis orales repetidas8. (Grado de recomendación B; nivel de evidencia 2b.)
El remifentanilo es un fármaco opiáceo 10 a 20 veces más potente que el alfentanilo, tan potente como el fentanilo y 10 veces menos potente que el sufentanilo. La vida media de eliminación en de 9,5 min88. Al igual que el fentanilo, no induce liberación de histamina y por tanto tiene pocos efectos sobre la presión arterial, lo que hace que sea un analgésico especialmente útil en pacientes con inestabilidad cardiovascular89.
El remifentanilo debe administrarse siempre mediante bomba de infusión para evitar la sobredosificación, que produce rigidez torácica y necesidad de ventilación asistida. La administración en perfusión hace que el efecto tarde unos minutos, el tiempo necesario para que las concentraciones plasmáticas sean las adecuadas. El remifentanilo tiene un efecto analgésico muy notable, mientras que los efectos sedantes y amnésicos son muy moderados, lo que se debe valorar en cada caso. Como los demás mórficos, su acción se ve potenciada al asociar pequeñas dosis de derivados benzodiacepínicos.
Un estudio reciente indica que las pautas de remifentanilo más propofol tienen mayor eficacia sedoanalgésica durante la colonoscopia que la administración de fentanilo más midazolam o meperidina más midazolam90.
Controles de vigilancia durante y después de la sedación
Durante la sedación profunda se deberán cumplir las siguientes premisas:
– En ausencia de un anestesiólogo o de cualquier otro médico específicamente designado para realizar la sedación, ésta y todas las decisiones respecto de la medicación sedante y de su dosificación serán responsabilidad del médico endoscopista.
– Deberán monitorizarse la SaO2, la frecuencia cardíaca, la presión arterial y el registro electrocardiográfico en todos los pacientes que reciban sedación6,91,92. El endoscopista y el médico o ATS-DUE experto encargado de la sedación son los responsables de monitorizar estos parámetros fisiológicos durante la exploración.
– Durante la sedación profunda es recomendable aplicar de forma repetida alguna de las escalas de valoración del grado de respuesta del paciente a estímulos sensoriales (nivel de alerta/respuesta): escala de Ramsay93 (tabla Ic), Escala de Evaluación de Alerta/Sedación (Observer Assessment of Alertness/Sedation: OAAS)94 (tabla Ib), escala de niveles de percepción de la ASA69 (tabla VI).
– La monitorización apropiada y efectiva es fundamental para conseguir una sedación segura. El tipo de monitorización se basa en las 4 variables fisiológicas (nivel de alerta/respuesta, vía aérea, ventilación espontánea y función cardiovascular) que definen los diferentes niveles de sedación (tabla Ia). La monitorización correcta incluye varias tareas y es necesario que una sola persona se dedique de forma exclusiva a la monitorización8,9,38,39. La mayoría de profesionales, especialmente aquellos que estén realizando procedimientos que requieran un grado importante de concentración (como los procedimientos de la endoscopia terapéutica), centran su atención en la exploración y tienden a entrar en lo que los psicólogos llaman una «desconexión cognitiva» de todo cuanto sea diferente del propio procedimiento; en consecuencia, el endoscopista, de forma involuntaria, tiende a olvidar el contexto global del paciente (p. ej., los signos vitales). Es por ello recomendable que otro profesional monitorice al paciente sedado y que los monitores tengan las alarmas apropiadas20. Por tanto, la persona que administra la sedación profunda ha de estar dedicada solamente a la monitorización ininterrumpida y continua de los parámetros fisiológicos del paciente mientras se administra la medicación. No deberá realizar actividades diferentes de la propia sedación.
– Se debe mantener un acceso intravenoso durante todo el procedimiento y hasta que no haya riesgo de depresión cardiopulmonar.
– La persona experta responsable de la sedación también ha de monitorizar la actividad y el esfuerzo respiratorios durante la exploración y ha de informar al médico endoscopista de cada dosis administrada del sedante en el momento de su infusión intravenosa8,9,20,38,39.
– Se administrarán suplementos de oxígeno de forma sistemática, bien por la boca, bien con gafas nasales, desde 5 min antes de iniciar la exploración. Si la SaO2 baja del 90%, se realizarán maniobras para mejorar la ventilación del paciente, tales como estímulos verbales, levantar la barbilla e incrementar el flujo de oxígeno a 6-8 l/min. Se debe tener en cuenta, especialmente en exploraciones prolongadas, que la oxigenación puede enmascarar la retención de CO2, que es un reflejo de la hipoventilación alveolar.
– La ventilación ha de monitorizarse por observación de la actividad respiratoria espontánea (p. ej., por palpación de la espiración o por auscultación de los ruidos respiratorios). La utilización de un capnógrafo para monitorizar el CO2 y detectar tempranamente las apneas es recomendable, especialmente durante las exploraciones de larga duración.
Tras la exploración no deberá trasladarse sin vigilancia específica a los pacientes mientras estén bajo los efectos de la sedación profunda.
Complicaciones
La morbimortalidad relacionada con la sedación profunda es muy baja. Heuss et al95, en una amplia encuesta realizada en Suiza con un total de 179.953 endoscopias, de las que en un 78% se realizó sedación, detectaron una morbilidad del 0,18% y una mortalidad de 0,0014%. En esta encuesta el propofol se utilizó en el 43% de los casos, en la mayoría administrado por gastroenterólogos (38%) y sólo en un 5% por anestesiólogos.
La desaturación de oxígeno es una de las complicaciones más comunes de la sedación durante la endoscopia. Estudios iniciales, en pacientes no oxigenados previamente, y en algunos que no recibían sedación, ofrecen cifras de incidencia de episodios de desaturación que varían entre el 45 y el 54%. Sin embargo, la relevancia clínica de estos episodios en un individuo normal es cuestionable. En estudios más recientes en pacientes oxigenados y monitorizados, la incidencia de episodios de disminución de la SaO2 por debajo del 90% durante las exploraciones endoscópicas realizadas con propofol es inferior al 10%12-27,37, sin que existan diferencias, en la mayoría de estudios, respecto de la sedación convencional20-22. En algunos estudios, sin embargo, se ha demostrado una mayor incidencia de hiposaturación de oxígeno con la sedación convencional (midazolam y petidina) que con el propofol6,23. La necesidad de intervenir ante la disminución de la SaO2 u otras complicaciones cardiopulmonares relacionadas con la administración de propofol es mucho menor, y de hecho los datos colectivos publicados sobre procedimientos en los que es el propio endoscopista o ATS-DUE especializados (sin anestesiólogo) quien administra el propofol, y que incluyen ya a un número de pacientes superior a 120.000, no han referido ningún caso que precisara intubación endotraqueal o indujera la muerte. (Grado de recomendación A; nivel de evidencia 1c.)
Un estudio efectuado en Canadá en 500 pacientes con ASA I y II explorados y sedados con propofol por gastroenterólogos y que recibieron oxigenación por cánula nasal permitió determinar que en el 92% de los casos el procedimiento endoscópico fue satisfactorio y que sólo en un 1% de los casos se produjeron descensos de la SaO2 inferiores al 90%. Este estudio concluyó que en pacientes seleccionados la utilización de propofol fue eficaz y segura16.
En resumen, con los datos de que se dispone en la actualidad puede decirse respecto de la sedación profunda en la endoscopia digestiva que el propofol muestra una eficacia superior a las pautas de sedación convencional, con un grado de seguridad cuando menos similar y posiblemente mayor que el resto de fármacos. (Grado de recomendación A; nivel de evidencia 1a.)
Registro clínico
Deberán registrarse por escrito los datos del paciente, de los parámetros clínicos y de control cardiopulmonar básicos a intervalos regulares, así como las órdenes médicas referentes a la administración de todos los fármacos utilizados y de su dosis8-11,38-40. Para ello se utilizarán: hoja de órdenes médicas, gráficas de enfermería y gráficas de controles de constantes.
Criterios de recuperación y alta después de la sedación y analgesia
Todos los pacientes a los que se administre sedación/ analgesia (consciente o profunda) para los procedimientos endoscópicos han de seguir un proceso de recuperación hasta el alta de la unidad que cumpla unos criterios específicos apropiados a cada paciente, procedimiento realizado y tipo de sedación administrada8-11,38-40,69. Los conceptos básicos que es recomendable tener en cuenta son los siguientes:
1. Principios generales:
– La supervisión de la recuperación y del alta después de la sedación moderada y profunda es responsabilidad del médico que ha llevado la sedación.
– El área de recuperación debe estar equipada con el material de monitorización y resucitación necesario.
– Se debe monitorizar a los pacientes que hayan recibido sedación moderada o profunda hasta que se cumplan los criterios apropiados de alta. La duración y la frecuencia de la monitorización deben individualizarse dependiendo del nivel de sedación alcanzada, el estado general del paciente y la naturaleza del procedimiento realizado. La oxigenación ha de monitorizarse hasta que el paciente no tenga riesgo de depresión respiratoria.
– El período de observación deberá prolongarse en los pacientes que hayan presentado depresión respiratoria o recibido antagonistas por el riesgo de resedación.
– Se han de controlar y registrar a intervalos regulares el nivel de conciencia, los signos vitales y la oxigenación.
– Los pacientes han de ser atendidos por personal sanitario entrenado capaz de reconocer las complicaciones que se puedan presentar.
– Debe disponerse de una persona capacitada para el manejo de las complicaciones (p. ej., mantener y establecer la vía aérea permeable y proporcionar ventilación con presión positiva) hasta que el paciente recupere las funciones vitales y el nivel de conciencia previos a la exploración.
2. Recomendaciones para el alta:
– Los pacientes han de estar conscientes y orientados; los niños y adultos con estado mental inicialmente anormal han de alcanzar su estado basal previo a la sedación.
– Los signos vitales han de ser estables y hallarse dentro de unos límites aceptables.
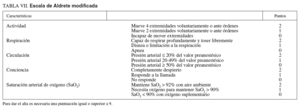
– Se recomienda aplicar sistemas de puntuación como la escala Aldrete (tabla VII)73,91 para evaluar el estado del paciente y documentar la pertinencia del alta. Cuando la puntuación es igual o superior a 9, puede darse el alta de la unidad al paciente.
– Dada la posibilidad de que se pueda presentar resedación después de la administración de determinados fármacos sedantes y sus antagonistas, tiene que pasar un tiempo suficiente después de la última dosis de agentes antagonistas antes de dar el alta al paciente.
– A los pacientes ambulatorios que hayan recibido sedación se les dará el alta en presencia de un adulto responsable que pueda acompañarlos y comunicar las posibles complicaciones después del alta.
– Es recomendable proporcionar a los pacientes ambulatorios y a sus acompañantes instrucciones escritas referentes a la dieta, medicaciones y actividades en el período siguiente al alta, así como facilitar un sistema de contacto en caso de emergencia.
– Los pacientes que hayan recibido fármacos sedantes no podrán conducir ni tomar decisiones importantes durante las siguientes horas. Se aconseja que no realicen estas actividades al menos en las 12 h siguientes.
– Podrán ingerir líquidos o dieta después de recibir el alta de la unidad.
REVISIÓN
El manuscrito ha sido revisado antes de su publicación por un grupo de gastroenterólogos que han emitido sugerencias sobre el texto original, muchas de las cuales han incorporado los autores. El grupo de revisores ha estado constituido por Adolfo Parra, Ángel Lanas, Fernando Gomollón, Antoni Castells, Vicente Garrigues, Xavier Calvet, Agustín Balboa, Antonio López-Sanromán, Javier P. Gisbert, Antoni Obrador, Enrique Domínguez y Montserrat Andreu.