El dolor abdominal funcional es un trastorno en el que confluyen procesos de sensitización central y periférica productores de hipersensibilidad y alodinia. El diagnóstico diferencial se hace con enfermedades orgánicas digestivas, renales, ginecológicas, endocrinas o neurológicas. El tratamiento debe de individualizarse para cada paciente. En casos de dolor invalidante se puede iniciar una terapia combinando fármacos con diferentes mecanismos de acción, mientras en casos menos graves se aconseja una terapia con introducción progresiva de fármacos en función de la respuesta clínica. La primera línea incluye consejos generales del estilo de vida y sustancias espasmolíticas como el aceite de menta piperita, anticolinérgicos/antimuscarínicos y antagonistas de los canales de calcio. En la segunda línea de tratamiento se añaden agentes neuromoduladores. Finalmente, cuando fallan estas medidas planteamos tratamientos de tercera línea, como los gabapentinoides y los antipsicóticos atípicos. Las intervenciones psicológicas deben de considerarse si se disponen terapeutas especializados en el manejo de estos trastornos.
Functional abdominal pain is a disorder in which central and peripheral sensitization processes converge, leading to hypersensitivity and allodynia. Differential diagnosis is made with organic digestive, renal, gynecological, endocrine, or neurological diseases. Treatment should be individualized for each patient. In cases of debilitating pain, therapy combining drugs with different mechanisms of action can be initiated, while in less severe cases, therapy with a progressive introduction of drugs based on clinical response is advised. The first line includes general lifestyle advice and antispasmodic substances, like peppermint oil, anticholinergic/antimuscarinic, and calcium channels antagonists. In the second line of treatment, neuromodulating agents are added. Finally, when these measures fail, third-line treatments such as gabapentine and atypical antipsychotics are considered. Psychological interventions should be considered if specialized therapists are available to manage these disorders.
El dolor abdominal funcional es aquel que se produce en ausencia de una enfermedad orgánica, metabólica o infecciosa que lo cause. Puede presentarse de forma aislada, denominado síndrome de dolor abdominal mediado centralmente (SDAMC), o como parte de otro trastorno funcional digestivo como el síndrome de intestino irritable (SII) o la dispepsia funcional. Para su diagnóstico, se requiere descartar la presencia de enfermedades orgánicas causantes del dolor, y su tratamiento es un reto en muchas ocasiones ya que la respuesta a las diferentes medidas terapéuticas es variable. En este documento, la Asociación Española de Neurogastroenterologia y Motilidad (ASENEM) presenta una puesta al día del manejo de los pacientes que presentan dolor abdominal funcional, con un enfoque práctico, basado en la evidencia científica disponible.
Bases biológicas del dolor visceralEl dolor, de acuerdo con La International Association for the Study of Pain (IASP) se define como «Una experiencia sensorial y emocional desagradable asociada o similar a la asociada, con un daño tisular real o potencial»1. Según la región corporal afectada, podemos dividir al dolor en 2 tipos básicos: somático y visceral. El dolor somático es el originado en estructuras superficiales, somáticas, del organismo (piel, músculos, articulaciones); mientras que el dolor visceral es el originado en órganos internos (vísceras), siendo el originado en el tracto gastrointestinal de gran importancia clínica.
El dolor visceral de origen gastrointestinal presenta características diferenciales con respecto al somático o al originado en otras vísceras (particularmente vísceras sólidas): carácter difuso (difícil localización); pobre relación con la enfermedad (o la intensidad del estímulo) que lo origina; capacidad de producir respuestas autonómicas de gran intensidad y capacidad de generar sensaciones referidas (dolor referido). En el tracto gastrointestinal la relación daño tisular y dolor no es obvia, así estímulos relativamente leves (contracción tónica de la musculatura lisa, inflamación leve de la mucosa o isquemia leve) pueden producir reacciones intensas de dolor.
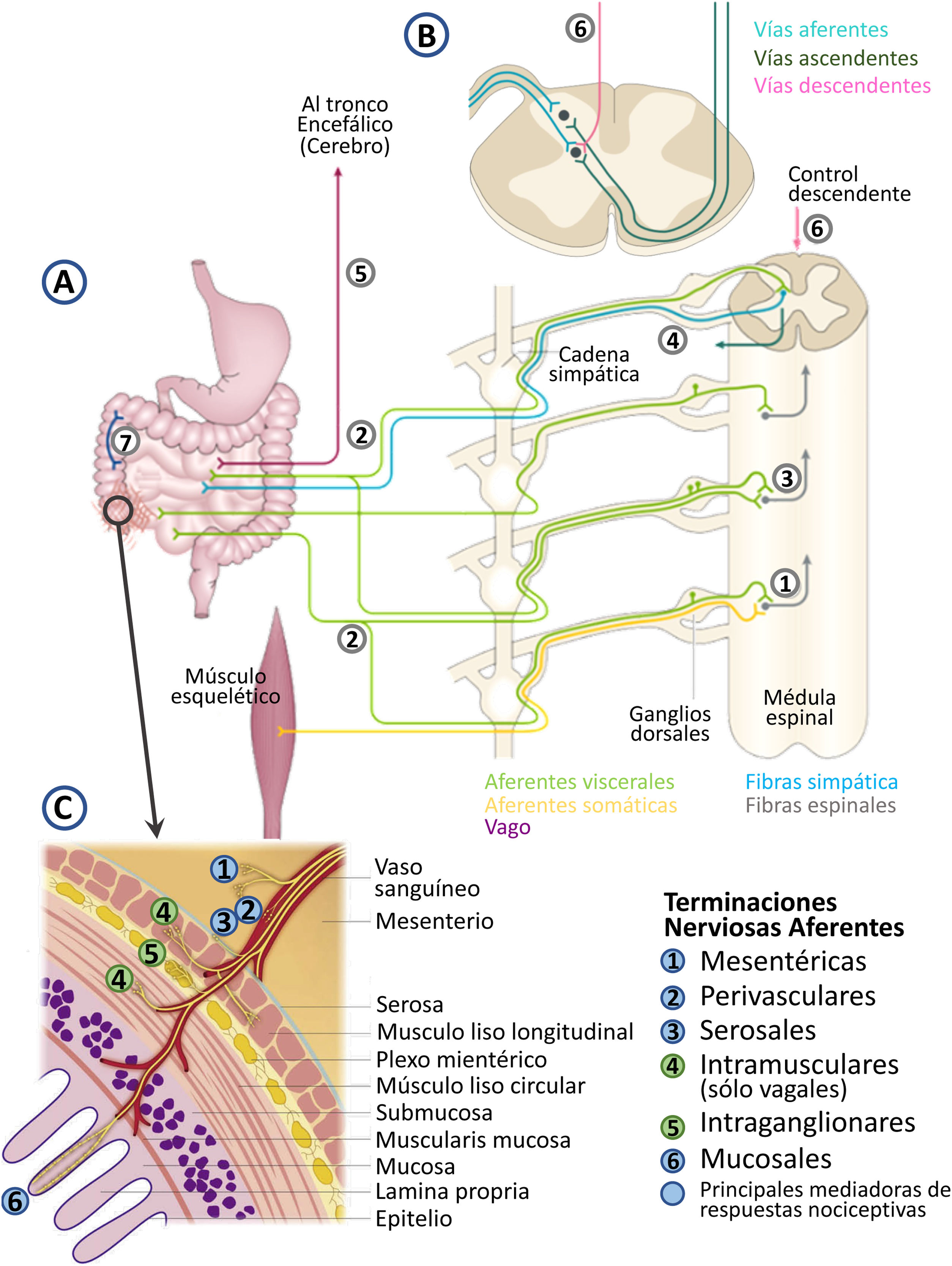
Organización de las vías sensoriales en el tracto gastrointestinalLa inervación sensorial del tracto gastrointestinal y, por tanto, la generación de respuestas nociceptivas, depende tanto de vías nerviosas extrínsecas (que pueden ser de origen vagal o de origen espinal) como del sistema nervioso entérico. En general, las vías sensitivas son polimodales y responden a estímulos tanto químicos como mecánicos, siendo estos particularmente importantes a nivel gastrointestinal. A partir de la médula espinal, vías ascendentes (dependientes de neuronas de segundo orden) permitirían la integración central y la generación del conjunto de respuestas autonómicas y conductuales que caracterizan la respuesta nociceptiva. De la misma forma, vías descendentes originadas a nivel del cerebro, actúan también como moduladoras de las respuestas nociceptivas2–4 (fig. 1).
Representación de las vías nerviosas implicadas en el procesamiento e integración de señales nociceptivas viscerales originadas en el tracto gastrointestinal. Frente a las vías nerviosas somáticas (por ejemplo, del músculo esquelético), que tienen una clara organización somatotópica en el sistema nervioso central, las vías de origen visceral terminan en múltiples niveles de la médula espinal, confiriendo su carácter difuso al dolor visceral (incluido el gastrointestinal) y presentan una organización compleja (A). Las aferentes viscerales convergen con las vías somáticas a nivel de la asta dorsal de la médula espinal (convergencia somato-visceral)1, lo que explica el fenómeno de dolor referido. Las aferentes primarias viscerales pueden dividirse para acabar simultáneamente en múltiples niveles de la médula espinal2. En la médula espinal puede darse, además, convergencia de aferentes procedentes de diferentes vísceras (convergencia viscero-visceral)3. Esto explicaría porqué las alteraciones digestivas pueden producir síntomas en órganos/vísceras remotas. Las vías aferentes viscerales llegan a la médula espinal con los nervios simpáticos, lo que puede producir reflejos autonómicos simpáticos asociados a la estimulación visceral4. El componente aferente parasimpático (nervio vago y otros nervios parasimpáticos)5 media normalmente reflejos fisiológicos no nociceptivos, pero su integración en la base del cerebro (tronco encefálico) puede modular la actividad de los sistemas descendentes espinales moduladores del dolor (B-6). El sistema nervioso entérico7 puede también participar modulando la actividad sensorial y los reflejos autonómicos asociados a la misma, lo que explicaría algunos de los síntomas asociados al dolor intestinal, como son las alteraciones motoras y secretoras. C) Detalle de las terminaciones aferentes sensoriales presentes en el tracto gastrointestinal. Las terminaciones nerviosas se localizan en todas las capas del intestino, así como en vasos sanguíneos y mesenterio. Las terminaciones intramusculares y las intraganglionares (4 y 5 en la figura) no tienen una función demostrada en la transmisión de estímulos dolorosos. Fuente: Modificado a partir de: Knowles et al.70; Drewes et al.71 y Martínez4.
Las enfermedades funcionales gastrointestinales se caracterizan en gran medida por la presencia de alteraciones en los mecanismos nociceptivos. Las alteraciones en la percepción del dolor se asocian a la sensibilización de las vías conductoras del dolor y/o de los mecanismos de integración de señales nociceptivas que llevan a estados de aumento de la sensibilidad (hipersensibilidad), que se puede manifestar de 2 formas: hiperalgesia y alodinia. En estados de sensibilización es normal que los cambios en el procesamiento de señales nociceptivas se asocien a una combinación de modificaciones tanto a nivel periférico (sensibilización periférica) como a nivel central (sensibilización central).
En su conjunto, la hipersensibilidad visceral que caracteriza las enfermedades funcionales se genera, probablemente, por la interacción entre cuatro mecanismos: a) sensibilización de aferentes sensoriales (sensibilización periférica); b) sensibilización a nivel del asta dorsal de la médula espinal (sensibilización central); c) alteraciones en los sistemas moduladores descendentes (facilitadores e inhibidores); y d) alteraciones cognitivo/emocionales (incluyendo la respuesta a estados de estrés) que alteran la interpretación central de señales sensoriales periféricas4.
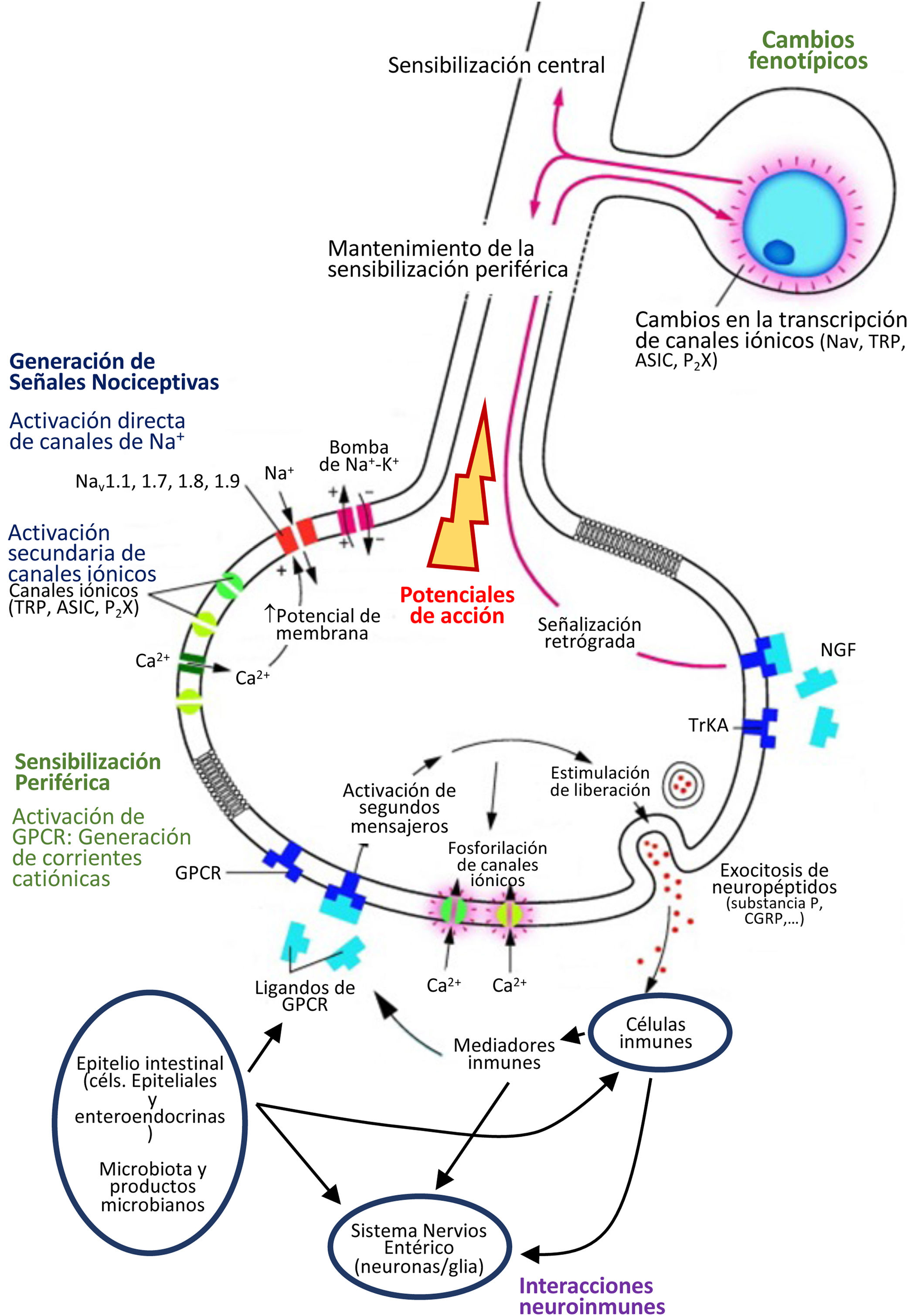
Los mecanismos moleculares implicados en las respuestas nociceptivas viscerales y en los procesos de sensibilización no se han dilucidado totalmente y parecen depender de sistemas altamente redundantes que implicarían múltiples mediadores: canales iónicos (como canales de sodio voltaje/dependientes, canales iónicos de potencial receptor transitorio [TRPV] o receptores purinérgicos), cininas, aminas biógenas (histamina o serotonina), prostanoides (PGE2), factores de crecimiento (NGF o GDNF), proteasas, citocinas, quimioquinas, ATP, endocanabionides u opioides endógenos4–7 (fig. 2). Numerosas evidencias clínicas y experimentales indican, además, que la microbiota puede tener un papel relevante como moduladora de los mecanismos nociceptivos8.
Mecanismos implicados en la generación de señales nociceptivas viscerales en una aferente sensorial. El esquema muestra los mecanismos generadores de señales nociceptivas en condiciones normales, y los mecanismos de sensibilización periférica. En el epitelio intestinal, los mecanismos sensoriales generadores de señales nociceptivas dependen de interacciones complejas que implican múltiples niveles de señalización, en muchos casos con acciones bidireccionales y mecanismos de retroalimentación. En condiciones normales, la generación de señales nociceptivas depende de la activación de diferentes canales iónico (canales de Na+, TRP, ASIC, P2X, etc.). La actividad de estos canales aumenta en estados de sensibilización, y contribuye a los cambios de excitabilidad que caracterizan estos estados. Los mecanismos de sensibilización implican la activación de receptores de membrana (generalmente receptores acoplados a proteínas G [GPCR], como receptores para bradiquininas, prostaglandinas, PAR, histamina, serotonina, neurotropinas tipo NGF, sustancia P o CGRP) por ligandos específicos. Este proceso depende de interacciones de tipo neuroinmune en las cuales participan células inmunes (mastocitos, linfocitos, células dendríticas, macrófagos y neutrófilos), el sistema nervioso entérico (neuronas entéricas y glía entérica) y el epitelio intestinal (células epiteliales y células enteroendocrinas, respondiendo básicamente a estímulos químicos y mecánicos). A este sistema de interacciones se ha adicionado recientemente la microbiota como un componente activo. Así derivados microbianos pueden penetrar en el epitelio y actuar como ligandos directos de receptores o modificar la actividad neuroinmune local. En determinadas circunstancias se pueden producir cabios fenotípicos persistentes en las neuronas sensoriales. Estos cambios mantienen los estados de sensibilización a largo plazo y pueden afectar la actividad sináptica en la médula espinal, pudiendo generar estados de sensibilización a nivel central (médula espinal). En conjunto estos procesos parecen ser especialmente importantes mediando la sensibilización que acompaña a estados inflamatorios o infecciosos. Fuente: Modificado a partir de: Knowles et al.70 y Martínez4.
El dolor abdominal crónico, como síntoma, representa un reto diagnóstico dada su elevada frecuencia, baja especificidad y amplio diagnóstico diferencial, que incluye además órganos fuera de la esfera digestiva (genito-urinario). Todo ello dificulta establecer el origen funcional del cuadro, generando múltiples visitas médicas, pruebas complementarias e incluso abordaje quirúrgico, en un intento de definir la causa del dolor9. Un correcto diagnóstico diferencial, que comienza por una historia clínica detallada y exploración física minuciosa, permite el diagnóstico temprano y el abordaje terapéutico dirigido.
La tabla 1 recoge causas de dolor abdominal crónico en base al origen visceral o somático del dolor y su relación con enfermedades sistémicas.
Criterios diagnósticos de Roma IV para el diagnóstico del síndrome de dolor abdominal mediado centralmente (SDAMC) y diagnóstico diferencial del dolor abdominal crónico
| Criterios diagnósticos Roma IV del SDAMC |
|---|
| Cumplimiento de los criterios durante los últimos 3 meses con inicio de los síntomas al menos 6 meses antes del diagnóstico. Debe incluir todo lo siguiente:1. Dolor abdominal continuo o casi continuo.2. Relación nula u ocasional del dolor con acontecimientos fisiológicos (p. ej., comer, defecar o menstruar), aunque puede haber algún grado de disfunción gastrointestinal.3. El dolor limita algún aspecto del funcionamiento diario (alteraciones en el trabajo, la intimidad, la vida social y de ocio, la vida familiar y el cuidado de uno mismo o de otras personas).4. El dolor no es fingido.5. El dolor no se explica por otro trastorno gastrointestinal estructural o funcional u otra afección médica.El SDAMC suele asociarse a comorbilidad psiquiátrica, pero no existe un perfil específico que pueda utilizarse para el diagnóstico. |
| Diagnóstico diferencial: otras causas de dolor abdominal crónico | |
|---|---|
| Origen visceral | Enfermedad del páncreas (pancreatitis crónica, quistes, adenocarcinoma)Enfermedad hepato-biliar (litiásica, tumoral)Enfermedad renal (litiásica, tumoral)Enfermedad gastroduodenal (enfermedad péptica, tumor)GastroparesiaSíndrome poscolecistectomíaEnfermedad inflamatoria intestinalSíndrome adherencial abdominal (cuadros oclusivos/suboclusivos)Síndrome de Fitz-Hugh-Curtis (perihepatitis crónica por enfermedad pélvica inflamatoria)69Enterocolitis actínicaEnfermedad diverticularHernias abdominalesRelacionado con estructuras vasculares:- Síndrome de compresión del tronco celiaco (o del ligamento arcuato)- Síndrome de la arteria mesentérica superior- Isquemia mesentérica crónicaOrigen ginecológico:- Endometriosis- Enfermedad pélvica inflamatoria (EPI) |
| Origen somático | Pared abdominal:- Síndrome de atrapamiento de nervio cutáneo abdominal (signo de Carnett)- Neuralgia postherpéticaCostal:- Neuralgia intercostal o segmentaria- Síndrome de la duodécima costilla- Condritis costal |
| Enfermedades sistémicas | Fiebre mediterránea familiarPorfirias |
| Enfermedad funcional | Síndrome de intestino irritable (asocia alteración del hábito defecatorio, el dolor no es el síntoma predominante)Dispepsia funcional tipo dolor epigástrico (relación con la ingesta, asocia otros síntomas dispépticos)Disfunción de la vesícula biliar o esfínter de Oddi (relación con la ingesta, características biliares)Síndrome del intestino narcótico o hiperalgesia inducida por opiáceos |
SDAMC: síndrome de dolor abdominal mediado centralmente.
A su vez, el dolor abdominal funcional puede estar presente de forma aislada, o como un síntoma más de otros trastornos funcionales digestivos. El dolor abdominal funcional aislado, actualmente denominado SDAMC, se caracteriza por dolor abdominal como síntoma dominante, de al menos 6 meses de evolución, poco localizado, a menudo intenso, recurrente, que ocurre casi a diario en los últimos 3 meses, raramente relacionado con estímulos fisiológicos como la menstruación, ingesta o defecación y que afecta a las actividades del individuo en la esfera personal, laboral y/o familiar10. Por el contrario, cuando el dolor se relaciona con cambios en el hábito deposicional, o a cambios en la frecuencia y consistencia de las heces, hablaremos de dolor funcional asociado a un SII. Para establecer el diagnóstico de dolor abdominal funcional se debe excluir causa estructural y metabólica, cuando se sospeche, mediante los métodos diagnósticos disponibles. Los criterios Roma IV para el diagnóstico del SDAMC quedan recogidos en la tabla 111.
Para orientar el diagnóstico se deben considerar los siguientes aspectos:
- -
Comorbilidad asociada: Enfermedades relacionadas con trastornos funcionales digestivos como fibromialgia o síndrome de fatiga crónica son frecuentes en este contexto, así como enfermedad psiquiátrica de diversa índole10. El antecedente de cirugía abdominal puede llevar al diagnóstico erróneo de síndrome adherencial, que cursa con cuadros oclusivos/suboclusivos, más que con dolor abdominal aislado, por lo que el diagnóstico de SDAMC debe plantearse en estos casos12. Las comorbilidades ginecológicas deben ser expresamente valoradas en la mujer (p. ej., enfermedad pélvica inflamatoria o endometriosis) y las urológicas en el varón (p. ej., prostatitis).
- -
Fármacos, especialmente antiinflamatorios no esteroideos (AINE) y opiáceos (hiperalgesia inducida por opiáceos).
- -
Características del dolor, como la localización, la forma de inicio y la evolución en el tiempo, los factores precipitantes, los agravantes o los que alivian el dolor13. El dolor abdominal funcional puede tener una serie de características que, aunque no son específicas, pueden facilitar el diagnóstico: suele ser de localización generalizada, expresado con términos emocionales (verbales y no verbales), con énfasis en su carácter crónico y recurrente incluso desde la infancia. Suelen demandar pruebas complementarias, exigiendo un alivio completo del dolor y a menudo sin conciencia de la implicación de factores psicosociales en el desarrollo del problema10.
- -
Síntomas y signos de alarma: inicio del dolor después de los 60 años, hiporexia, pérdida ponderal, signos de sangrado digestivo o anemia ferropénica, vómitos persistentes e historia familiar de cáncer colorrectal, gástrico o de enfermedad inflamatoria intestinal13.
- -
Otros síntomas digestivos y síntomas sistémicos. Ayudan a orientar el origen del dolor, permiten descartar otros trastornos funcionales digestivos y enfermedades sistémicas que cursen con dolor continuo (tabla 1).
- -
Situación psicosocial y afectación sobre la calidad de vida: traumas no superados, depresión, personalidad histriónica14 o historia de abuso sexual/físico pueden ser desencadenantes de dolor abdominal funcional y causar una peor respuesta a los tratamientos15. Se debe abordar la posibilidad de ser un dolor fingido o dependencia de opioides.
La realización de pruebas diagnósticas no es siempre necesaria. De forma general, se aprueba la realización de analítica de sangre que incluya hemograma, perfil básico, férrico, hepático, PCR y anticuerpos antitransglutaminasa tisular16. En casos en los que la situación psicosocial, comorbilidades y características del dolor orienten a SDAMC puede evitarse la realización de más pruebas diagnósticas. En ocasiones, la intensidad del dolor y/o la demanda por parte del paciente obligan a completar el estudio, siempre tras fomentar la relación médico/paciente y concienciar sobre las posibles causas del dolor.
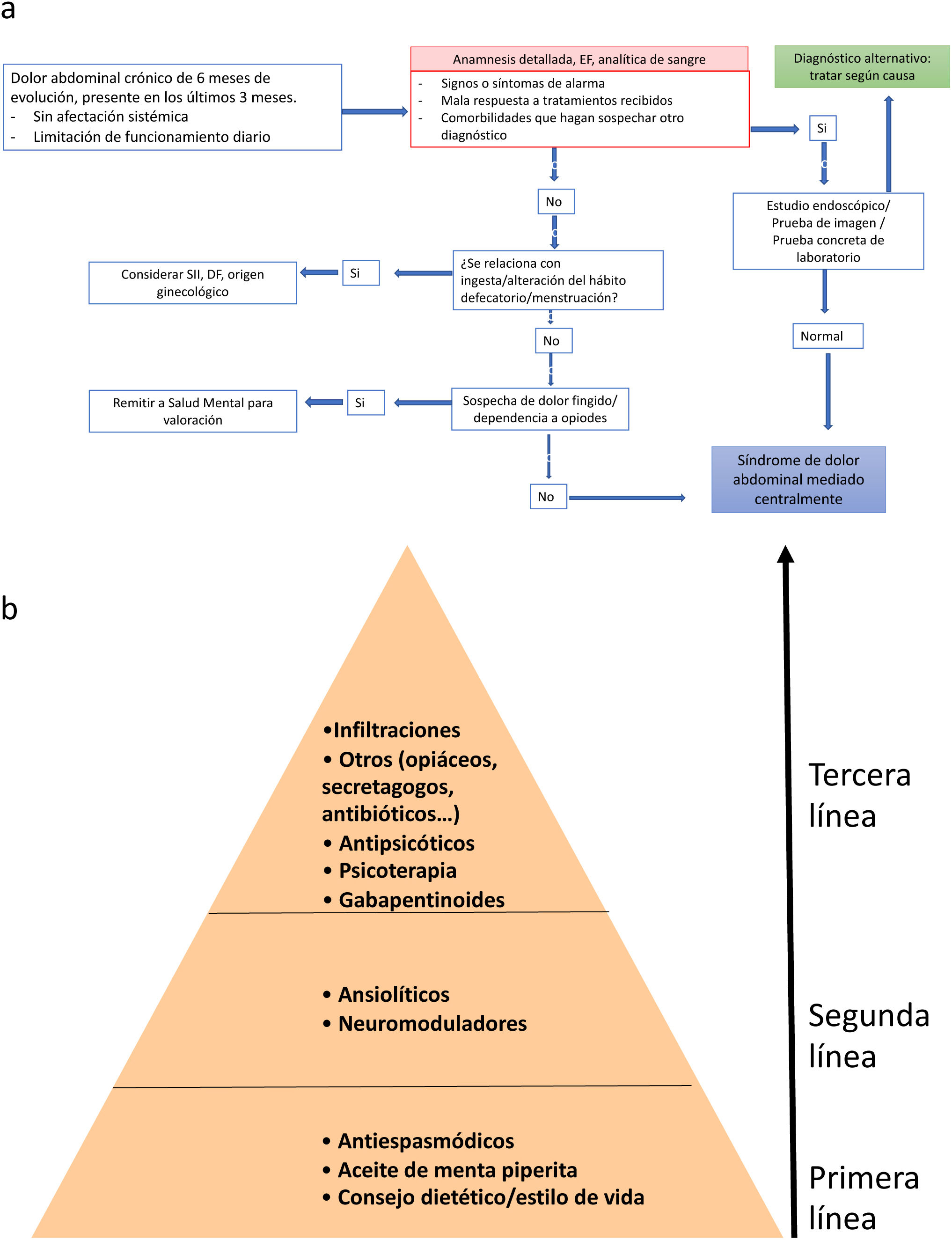
La realización de estudio endoscópico y prueba de imagen (ecografía, tomografía o resonancia magnética en función de la sospecha diagnóstica) se debe indicar en casos con síntomas/signos de alarma, mala respuesta a tratamiento y síntomas graves que limiten el funcionamiento diario16. El algoritmo diagnóstico queda recogido en la Figura 3A.
A) Algoritmo diagnóstico del SDAMC. DF: dispepsia funcional; EF: exploración física; SII: síndrome de intestino irritable. * Determinación de hemograma, perfil básico, férrico, hepático, PCR y anticuerpos antitransglutaminasa tisular. Fuente: Adaptado de Sperber et al.72. B) Manejo del dolor abdominal funcional. El tratamiento de primera línea incluye revisión de medidas dietéticas y de estilo de vida, y tratamiento con aceite de menta piperita y antiespasmódicos. Si esto fracasa se incluirán neuromoduladores como los antidepresivos tricíclicos. La tercera línea de tratamiento incluye gabapentinoides, intervenciones psicológicas, antipsicóticos atípicos u otros fármacos con acción indirecta sobre el dolor. En casos de dolor invalidante se puede iniciar un tratamiento combinado con fármacos de diferentes niveles. Así mismo, si se dispone de psicoterapia esta se puede realizar en estadios precoces del tratamiento.
Como en cualquier trastorno funcional digestivo, es importante recomendar un estilo de vida ordenado, como seguir unos hábitos horarios y de sueño adecuados, con una alimentación equilibrada, intentando evitar las situaciones que favorecen el estrés. En muchos casos los pacientes van a referir que su dolor puede exacerbarse con la ingesta. En estos casos es importante aconsejar al paciente que solamente excluya los alimentos que claramente le producen sus síntomas, evitando entrar en una espiral de restricción alimentaria creciente que termina generando déficits nutricionales no deseados. En algunos pacientes es recomendable un control alimentario más estricto por un nutricionista, para evitar complicaciones derivadas de dietas restrictivas17,18.
EspasmolíticosLos espasmolíticos representan un grupo heterogéneo de fármacos utilizados en el tratamiento del dolor abdominal presente en los pacientes con trastornos del eje intestino/cerebro. Globalmente actúan inhibiendo la motilidad intestinal y según su mecanismo de acción se pueden clasificar en: relajantes directos del músculo liso (mebeverina), anticolinérgicos/antimuscarínicos (hioscina, hiosciamina, diciclomina) y antagonistas de los canales de calcio (aceite esencial de menta piperita, otilonio, pinaverio, citrato de alverina, trimebutina), si bien con frecuencia el mecanismo de acción es múltiple19.
Varios metaanálisis han demostrado beneficio terapéutico de los espasmolíticos con respecto al placebo en el alivio del dolor abdominal funcional20–24. Un reciente metaanálisis de 51 ensayos clínicos aleatorizados (ECA) en 4.644 pacientes, comparó las fibras solubles, los antiespasmódicos y los neuromoduladores24, y concluyó que el aceite de menta, los antidepresivos tricíclicos (ADT) y los espasmolíticos fueron más eficaces que el placebo tanto para los síntomas globales como para el dolor abdominal en el SII, con el aceite de menta piperita en primer lugar para los síntomas globales y los ADT en primer lugar para el dolor abdominal, si bien estos últimos son los que produjeron mayor número de efectos adversos, por lo que generalmente se aconseja reservarlos para segunda línea de tratamiento. En una revisión Cochrane22 tampoco se evidenció un beneficio estadísticamente significativo con respecto al placebo para los antimuscarínicos ni para la mebeverina. Sin embargo, una revisión sistemática25 publicada más recientemente que incluyó 6 ECA en los que se analizó el efecto de la mebeverina sobre el dolor abdominal, mostró un efecto positivo de la misma con respecto al placebo. Es importante tener en cuenta que la mayoría de los ensayos clínicos con espasmolíticos son antiguos y están limitados por su metodología subóptima y heterogeneidad considerable, habiéndose desarrollado en muchos casos con anterioridad a la publicación de las recomendaciones de Roma26. En general son bien tolerados y presentan buen perfil de seguridad siendo los efectos adversos más frecuentes los derivados de la acción anticolinérgica tales como sequedad de boca, mareos y visión borrosa27 (tabla 2).
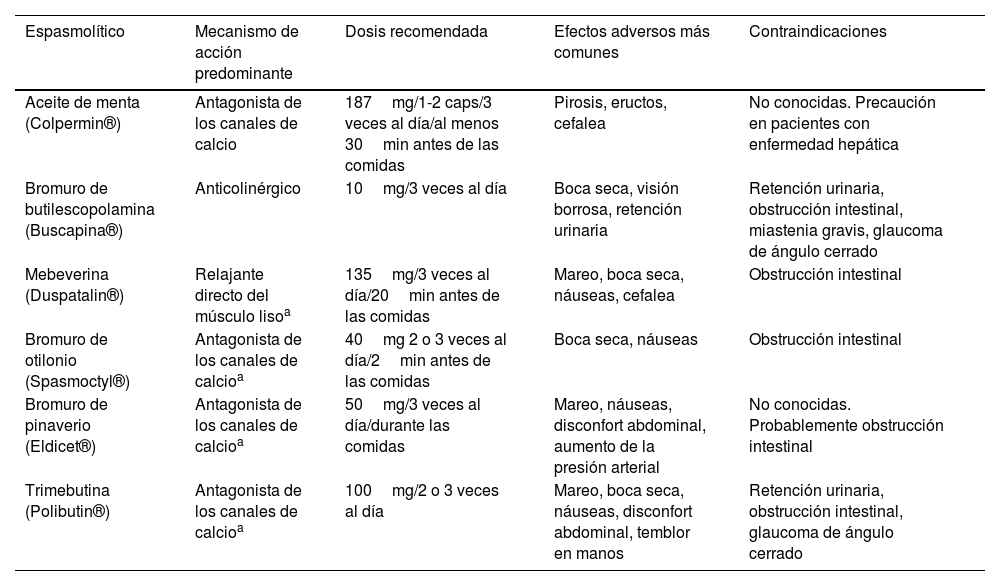
Posología, efectos adversos y contraindicaciones de los espasmolíticos comercializados en España
| Espasmolítico | Mecanismo de acción predominante | Dosis recomendada | Efectos adversos más comunes | Contraindicaciones |
|---|---|---|---|---|
| Aceite de menta (Colpermin®) | Antagonista de los canales de calcio | 187mg/1-2 caps/3 veces al día/al menos 30min antes de las comidas | Pirosis, eructos, cefalea | No conocidas. Precaución en pacientes con enfermedad hepática |
| Bromuro de butilescopolamina (Buscapina®) | Anticolinérgico | 10mg/3 veces al día | Boca seca, visión borrosa, retención urinaria | Retención urinaria, obstrucción intestinal, miastenia gravis, glaucoma de ángulo cerrado |
| Mebeverina (Duspatalin®) | Relajante directo del músculo lisoa | 135mg/3 veces al día/20min antes de las comidas | Mareo, boca seca, náuseas, cefalea | Obstrucción intestinal |
| Bromuro de otilonio (Spasmoctyl®) | Antagonista de los canales de calcioa | 40mg 2 o 3 veces al día/2min antes de las comidas | Boca seca, náuseas | Obstrucción intestinal |
| Bromuro de pinaverio (Eldicet®) | Antagonista de los canales de calcioa | 50mg/3 veces al día/durante las comidas | Mareo, náuseas, disconfort abdominal, aumento de la presión arterial | No conocidas. Probablemente obstrucción intestinal |
| Trimebutina (Polibutin®) | Antagonista de los canales de calcioa | 100mg/2 o 3 veces al día | Mareo, boca seca, náuseas, disconfort abdominal, temblor en manos | Retención urinaria, obstrucción intestinal, glaucoma de ángulo cerrado |
El aceite esencial de menta piperita es un agente de origen herbal que contiene mentol como principal constituyente28. Actúa como espasmolítico mediante el antagonismo de los canales de calcio del tracto gastrointestinal29. También posee efecto analgésico gracias a la modulación de la nocicepción visceral mediada por canales transitorios de tipo TRP30,31, el agonismo del receptor opioide k32 y la inhibición de los receptores 5-HT333. Asimismo, se ha sugerido que posee propiedades antiinflamatorias34, antibacterianas35 y carminativas, lo que podría disminuir los gases intestinales36. En España está disponible en forma de cápsulas con cubierta entérica que contienen 187mg de aceite esencial de menta piperita, con liberación prolongada desde el intestino delgado y a lo largo del colon. Las revisiones sistemáticas y metaanálisis disponibles hasta la fecha muestran beneficio del aceite de menta con respecto al placebo en la mejoría del dolor abdominal con un NNT variable entre 4 y 737–39. Los efectos adversos reportados son leves y transitorios, siendo los más frecuentes la acidez y los eructos derivados de la relajación del esfínter esofágico inferior (tabla 2). En general el producto es bien tolerado, y se recomienda iniciar con la dosis completa (1-2 cápsulas/3 veces/día). En pacientes con mala tolerancia se ha reportado que una titulación progresiva de dosis durante la primera semana de tratamiento mejora la tolerancia40.
Tratamiento de segunda línea: neuromoduladoresEl uso de psicofármacos o neuromoduladores en pacientes con dolor abdominal por trastornos de la interacción cerebro/intestino no es generalizado y se recomienda reservarlos para pacientes con un grado de afectación moderada a grave. El primer punto a tener en cuenta es que el paciente este informado de cuál es la razón de su uso, cuáles son sus interacciones, la utilidad que tienen en la alteración del eje cerebro/intestino, los efectos secundarios e informarlos de que tienen una respuesta terapéutica retardada.
En los pacientes con dolor abdominal crónico, particularmente por alteraciones a nivel central, los fármacos más estudiados y usados son los ADT seguidos de los inhibidores de la recaptación de serotonina y noradrenalina (IRNS). Ambos aumentan los niveles de norepinefrina y tienen propiedades analgésicas. La experiencia con el uso de ADT es mayor. Los ADT preferidos son sus formas secundarias como la nortriptilina o la desimipramina41,42 que tienen menos efectos secundarios que la amitriptilina o imipramina. Para evitar los efectos secundarios se recomienda iniciar el tratamiento con dosis bajas, de 10 a 25mg, e ir incrementando la dosis para conseguir la respuesta terapéutica adecuada y evitar la frustración del paciente41,42. El efecto analgésico se produce entre 1-8 semanas y el efecto antidepresivo es más tardío y se inicia entre la semana 8-12. La trazodona es un antidepresivo heterocíclico (HTC) que también tiene efecto analgésico, con marcada acción sedante e inductora del sueño, también útil en el manejo del dolor.
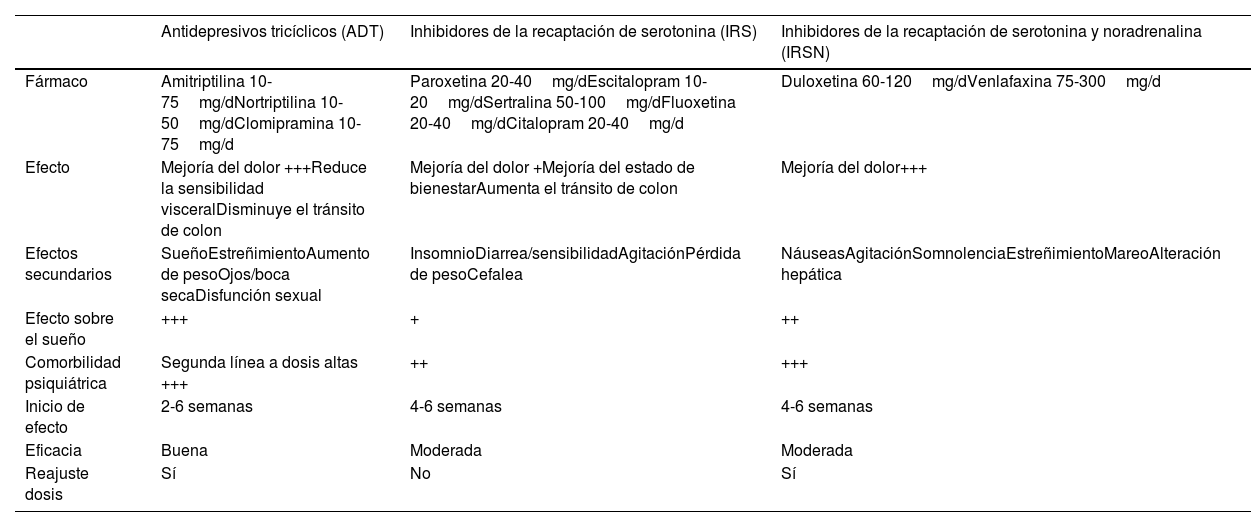
De los inhibidores selectivos de la recaptación de aminas, destacan los inhibidores selectivos de recaptación de serotonina (ISRS) y los IRNS. Estos últimos tienen efecto dual, inhibiendo la recaptación de tanto de serotonina como de noradrenalina. Estos fármacos se dosifican fácilmente y tienen menos efectos secundarios por lo que son más seguros, sin embargo, su efecto analgésico es menor que la de los ADT. En psiquiatría son fármacos de primera línea para el tratamiento de la psicopatología asociada. Partiendo de la hipótesis de que la depresión y la ansiedad se correlacionan con un déficit de monoaminas43, noradrenalina y dopamina, los antidepresivos ejercerían su acción aumentando los niveles de estas monoaminas. Los ISRS más usados son citalopram, escitalopram, fluoxetina, sertralina y paroxetina que mejoran la depresión, la ansiedad y la hipervigilancia. Su efecto secundario gastrointestinal más frecuente es la diarrea por lo que se usan más para el manejo de dolor abdominal en pacientes en los que el hábito intestinal predominante es el estreñimiento44. La fluoxetina tiene más acción estimulante, por lo que es útil es pacientes con depresión y dolor, tiene una vida media más larga de hasta 9 días por lo que se puede retirar sin titular, el resto de ISRS tienen vida media aproximada de 20h. La paroxetina tiene más efecto anticolinérgico y causa más sedación y estreñimiento. Las dosis habituales recomendadas de los ISRS son, para el citalopram de 20 a 40mg/día, escitalopram de 10 a 20mg/día, sertralina de 50 a 100mg/día, fluoxetina de 50 a 100mg/día y paroxetina de 20 a 40mg/día. Respecto a los IRNS la dosis recomendada para venlafaxina oscila desde los 75 a 300mg/día y para duloxetina de 60 a 120mg/día. Para conseguir dosis antiálgicas noradrenérgicas se requieren dosis de duloxetina de 90 a 120mg/día y de venlafaxina de 225 a 300mg/día42 (tabla 3).
Posología, efectos adversos y contraindicaciones de los neuromoduladores usados en el dolor abdominal funcional
| Antidepresivos tricíclicos (ADT) | Inhibidores de la recaptación de serotonina (IRS) | Inhibidores de la recaptación de serotonina y noradrenalina (IRSN) | |
|---|---|---|---|
| Fármaco | Amitriptilina 10-75mg/dNortriptilina 10-50mg/dClomipramina 10-75mg/d | Paroxetina 20-40mg/dEscitalopram 10-20mg/dSertralina 50-100mg/dFluoxetina 20-40mg/dCitalopram 20-40mg/d | Duloxetina 60-120mg/dVenlafaxina 75-300mg/d |
| Efecto | Mejoría del dolor +++Reduce la sensibilidad visceralDisminuye el tránsito de colon | Mejoría del dolor +Mejoría del estado de bienestarAumenta el tránsito de colon | Mejoría del dolor+++ |
| Efectos secundarios | SueñoEstreñimientoAumento de pesoOjos/boca secaDisfunción sexual | InsomnioDiarrea/sensibilidadAgitaciónPérdida de pesoCefalea | NáuseasAgitaciónSomnolenciaEstreñimientoMareoAlteración hepática |
| Efecto sobre el sueño | +++ | + | ++ |
| Comorbilidad psiquiátrica | Segunda línea a dosis altas +++ | ++ | +++ |
| Inicio de efecto | 2-6 semanas | 4-6 semanas | 4-6 semanas |
| Eficacia | Buena | Moderada | Moderada |
| Reajuste dosis | Sí | No | Sí |
Los gabapentinoides son usados como anticonvulsivantes, en psiquiatría por su efecto ansiolítico y para el manejo del dolor de causa neuropática o en algunas entidades como la fibromialgia. Cuatro estudios incluidos en el metaanálisis más reciente45 han evaluado el efecto de los gabapentinoides en el manejo del dolor en el SII con resultados parcialmente satisfactorios. Lee et al.46 concluyeron en que la gabapentina mejoraba la hipersensibilidad rectal (medida mediante baróstato rectal) en pacientes con SII. Los estudios que evaluaron pregabalina47,48 presentaron resultados similares en la evaluación de la hipersensibilidad que se correlacionaron con una mejoría en escalas clínicas. Sin embargo, Iturrino et al.49 no identificaron diferencias en la sensibilidad rectal de los pacientes que recibieron pregabalina.
Antipsicóticos atípicosQuetiapina y olanzapina son nuevos antipsicóticos que presentan la ventaja de no presentar los efectos extrapiramidales típicos de los antipsicóticos clásicos, ya que además de su acción de bloqueo de la dopamina, actúan sobre diversos receptores serotoninérgicos que contrarrestan estos efectos. Estos fármacos pueden usarse en combinación con otros neuromoduladores como los antidepresivos, cuando los efectos de estos últimos en solitario no son suficientes para controlar el dolor. Debido a los efectos secundarios de estos fármacos, se aconseja utilizarlos en un contexto de tratamiento multidisciplinar con el soporte de psiquiatras familiarizados en el manejo del dolor visceral y los trastornos funcionales digestivos42. Levosulpirida es un antipsicótico atípico que además de sus efectos como antiemético, ha mostrado una reducción en la sensibilidad visceral en pacientes con dispepsia funcional50.
Fármacos con acción indirecta sobre el dolorOpioides de acción periféricaEn España existen 2 opioides aprobados para el manejo del SII-D: eluxalodina y loperamida. Eluxadolina es un agonista mixto de los receptores opioides mu y kappa y antagonista de los receptores opioides delta. El estudio IBS-300151 evaluó el uso 75-100mg de eluxadolina al día en pacientes con SII-D, definiendo como variable principal la mejoría en una variable compuesta formada por mejoría del dolor y en la consistencia de las heces. Los resultados frente placebo fueron favorables para eluxadolina, sin embargo, no hubo diferencias en el control del dolor de forma aislada entre ambos grupos. Loperamida es un agonista de los receptores opioides mu, presentes en el sistema nervioso entérico, promoviendo una disminución en la peristalsis y la secreción intestinal. Hovdenak et al.52 evaluaron el efecto de loperamida 4mg en paciente con SII; los pacientes con SII-D o SII-M mejoraron el número de deposciones y su consistencia, pero sin ningún efecto sobre el dolor abdominal.
LinaclotidaLinaclotida es un fármaco secretagogo que actúa sobre el GMP cíclico favoreciendo la secreción intestinal. Además de este efecto, estudios en animales de experimentación han demostrado una reducción de la transmisión de estímulos periféricos nociceptivos a la médula espinal, por lo que reduce la sensibilidad visceral53. Ensayos clínicos aleatorizados han demostrado que linaclotida reduce el dolor abdominal en pacientes con SII y predominio de estreñimiento54,55. Sin embargo, en pacientes sin estreñimiento su uso está limitado ya que producen fácilmente diarrea.
RifaximinaRifaximina es un antibiótico derivado de la rifampicina, activo frente microorganismos gran positivos, negativos y protozoos. Su farmacocinética es única, ya que tiene una absorción sistémica mínima, permitiendo limitar su efecto al tracto gastrointestinal56. Su efecto se basa en su efecto antibiótico, eubiótico y, posiblemente, antiinflamatorio/inmunomodulador. Su efecto sobre el dolor abdominal se ha asociado a una disminución de la fermentación intestinal como consecuencia de una reducción en el número de bacterias fermentadoras. El papel de la rifaximina en el dolor abdominal relacionado con el SII-D fue evaluado en dos estudios fase III, doble-ciego, controlados con placebo TARGET 1 y TARGET 2 en 201157. El uso de rifaximina 550mg/3 veces al día/durante 2 semanas mejoró el dolor abdominal en un 40,8% de los pacientes, frente al 31,7% de pacientes con placebo (p<0,001). Posteriormente se evaluó el re-tratamiento de aquellos pacientes respondedores a un primer ciclo de rifaximina, con buenos resultados en la mejoría del dolor abdominal58.
Protectores de la barrera mucosa intestinalEste grupo de fármacos generan un film protector (barrera física) en la mucosa intestinal, impidiendo el contacto de esta con antígenos alimentarios o moléculas proinflamatorias. En España disponemos comercializado Gelsectan®; un estudio reciente de Trifan et al.59 demostraron su superioridad frente placebo en un estudio doble ciego, en pacientes con SII-D en el número de deposiciones, dolor abdominal, distensión abdominal y calidad de vida. Asimismo, un estudio multicéntrico español de práctica clínica real mostró eficacia y seguridad de este compuesto sobre el dolor abdominal60.
Otros fármacosLa ebastina es un antagonista del receptor H1 de la histamina que ha mostrado reducción del dolor abdominal en pacientes con IBS61,62. Otros fármacos como el ibodutant63 y el tenapanor64 han mostrado buenos efectos sobre dolor abdominal en ensayos clínicos, pero estos fármacos no están en el mercado español actualmente. Diferentes ensayos con cannabinoides han dado resultados dispares sobre su efecto sobre el dolor abdominal17.
PsicoterapiaEl Grupo Roma definió como terapia dirigida al eje intestino-cerebro (Brain gut behavior theraphy [BGBT]) como aquella intervención no farmacológica, impartida por un facultativo capacitado con el objetivo de mejorar los síntomas digestivos65. Esta definición incluye la terapia cognitivo-conductual (TCC), la hipnosis y las terapias de reducción de estrés basadas en mindfulness, entre otras. Un reciente metaanálisis evaluó que las terapias más efectivas en la reducción de los síntomas fueron la TCC y la hipnosis66. En 5 estudios que incluyeron 278 pacientes comparando hipnosis con un grupo control (generalmente constituido por pacientes que permanecían en lista de espera para el tratamiento) se demostró que la hipnosis mejoró los síntomas digestivos, incluyendo el dolor abdominal (RR de no mejorar del 0,74; IC 95%: 0,63-0,87)67. Pese a que estos tratamientos se han mostrado efectivos en la reducción de síntomas digestivos del SII, es poca la evidencia existente sobre su efecto aislado en el dolor abdominal. Una gran limitación de estas terapias en nuestro ámbito sanitario es su escasa accesibilidad, lo cual condiciona la utilización de esta opción terapéutica ampliamente validada por la comunidad científica. La creación de equipos multidisciplinarios que incorporen a psicólogos con especial formación en este tipo de trastornos debería de ser prioritaria para paliar estos déficits.
Infiltración de raíces nerviosasLa infiltración de raíces del plexo celíaco se ha utilizado con éxito para el alivio del dolor abdominal, especialmente en pacientes con enfermedad pancreática68. Esta técnica está reservada para pacientes con dolor refractario que no responde a otros tratamientos, y suele indicarse en el seno de equipos multidisciplinares y unidades especializadas en el manejo del dolor.
Intensificación de la terapiaEn general, la mayor parte de pacientes presentan un dolor abdominal leve, bien aislado o en el contexto de otro trastorno funcional digestivo, y el tratamiento se podrá iniciar con las medidas de primera línea, y escalarlo a fármacos neuromoduladores cuando estas medidas no son suficientes. Sin embargo, algunos pacientes no van a responder bien a esta estrategia, especialmente cuando presenten dolor más intenso, en ocasiones invalidante, y en estos casos se deberá de intensificar el tratamiento.
En general, cuando un paciente presenta dolor moderado/grave, recomendaremos iniciar el tratamiento con neuromoduladores, bien como monoterapia o asociados a antiespasmódicos. En caso de mala respuesta, las guías internacionales aconsejan en primer término un aumento de la dosis, y si se produjesen efectos secundarios un cambio a otro tipo de neuromodulador42. Por ejemplo, si un paciente presenta efectos adversos a un ADT se puede cambiar a un IRNS. Cuando estas medidas no sean suficientes, se aconseja hacer terapia combinada. En función de la gravedad del dolor y de la disponibilidad en cada centro, se puede iniciar una intervención psicológica con terapia conductivo conductual, o añadir gabapentinoides y/o antipsicóticos atípicos como la quetiapina, con aumentos de dosis si la respuesta no es la esperada. Lo ideal en estos casos es combinar fármacos con diferentes mecanismos de acción. Finalmente, si la respuesta a estas medidas es insatisfactoria se puede plantear una infiltración de raíces nerviosas.
ConclusionesEl dolor abdominal funcional es un síntoma muy frecuente, que puede producirse bien de forma aislada, como un SDAMC, como acompañado de otros síntomas digestivos, como por ejemplo un SII. El primer paso en el manejo de estos pacientes será hacer un diagnóstico diferencial con causas orgánicas de dolor abdominal crónico. En este sentido, la anamnesis y la exploración física son de capital importancia para valorar síntomas asociados y signos sugestivos de otras enfermedades. En algunos casos será necesario realizar exploraciones complementarias para descartar otras causas de dolor abdominal crónico.
Una vez establecido el diagnóstico de dolor funcional, el tratamiento debe de individualizarse para cada paciente. En casos de dolor invalidante se puede iniciar una terapia combinando fármacos con diferentes mecanismos de acción, mientras que en casos menos graves se aconseja una terapia con introducción progresiva de fármacos en función de la respuesta clínica (Fig. 3B). En primer lugar, mediante consejos generales sobre hábitos de vida, y utilizando sustancias espasmolíticas, como el aceite de menta piperita, anticolinérgicos/antimuscarínicos, o antagonistas de los canales de calcio. Si el paciente persiste con dolor a pesar de este tratamiento, el siguiente paso será añadir agentes neuromoduladores, como los ADT o los ISRS o IRSN. Finalmente, cuando fallan todas estas medidas debemos plantear tratamientos de tercera línea, como los gabapentinoides y antipsicóticos atípicos, además de intervenciones psicológicas como la terapia cognitivo conductual. En pacientes con dolor muy intenso refractario a todo tipo de tratamientos, las infiltraciones de raíces nerviosas podrían rescatar a estos pacientes refractarios.
FinanciaciónEste documento ha sido elaborado por la Asociación Española de Neurogastroenterologia con la financiación de los laboratorios Tillotts Pharma. Los laboratorios Tillotts Pharma no han participado ni influenciado en ningún modo la elaboración del documento.
Conflicto de interesesJS: Becas de investigación de Bayer y Salvat laboratorios. Consultor/ponente con Menarini, Casen Recordati, Reckit Benkiser y Norgine. CCR: Consultor/ponente con Medtronic. AA, EB, LGP, VM, BSF, no tienen ningún conflicto de intereses.








![Mecanismos implicados en la generación de señales nociceptivas viscerales en una aferente sensorial. El esquema muestra los mecanismos generadores de señales nociceptivas en condiciones normales, y los mecanismos de sensibilización periférica. En el epitelio intestinal, los mecanismos sensoriales generadores de señales nociceptivas dependen de interacciones complejas que implican múltiples niveles de señalización, en muchos casos con acciones bidireccionales y mecanismos de retroalimentación. En condiciones normales, la generación de señales nociceptivas depende de la activación de diferentes canales iónico (canales de Na+, TRP, ASIC, P2X, etc.). La actividad de estos canales aumenta en estados de sensibilización, y contribuye a los cambios de excitabilidad que caracterizan estos estados. Los mecanismos de sensibilización implican la activación de receptores de membrana (generalmente receptores acoplados a proteínas G [GPCR], como receptores para bradiquininas, prostaglandinas, PAR, histamina, serotonina, neurotropinas tipo NGF, sustancia P o CGRP) por ligandos específicos. Este proceso depende de interacciones de tipo neuroinmune en las cuales participan células inmunes (mastocitos, linfocitos, células dendríticas, macrófagos y neutrófilos), el sistema nervioso entérico (neuronas entéricas y glía entérica) y el epitelio intestinal (células epiteliales y células enteroendocrinas, respondiendo básicamente a estímulos químicos y mecánicos). A este sistema de interacciones se ha adicionado recientemente la microbiota como un componente activo. Así derivados microbianos pueden penetrar en el epitelio y actuar como ligandos directos de receptores o modificar la actividad neuroinmune local. En determinadas circunstancias se pueden producir cabios fenotípicos persistentes en las neuronas sensoriales. Estos cambios mantienen los estados de sensibilización a largo plazo y pueden afectar la actividad sináptica en la médula espinal, pudiendo generar estados de sensibilización a nivel central (médula espinal). En conjunto estos procesos parecen ser especialmente importantes mediando la sensibilización que acompaña a estados inflamatorios o infecciosos. Fuente: Modificado a partir de: Knowles et al.70 y Martínez4. Mecanismos implicados en la generación de señales nociceptivas viscerales en una aferente sensorial. El esquema muestra los mecanismos generadores de señales nociceptivas en condiciones normales, y los mecanismos de sensibilización periférica. En el epitelio intestinal, los mecanismos sensoriales generadores de señales nociceptivas dependen de interacciones complejas que implican múltiples niveles de señalización, en muchos casos con acciones bidireccionales y mecanismos de retroalimentación. En condiciones normales, la generación de señales nociceptivas depende de la activación de diferentes canales iónico (canales de Na+, TRP, ASIC, P2X, etc.). La actividad de estos canales aumenta en estados de sensibilización, y contribuye a los cambios de excitabilidad que caracterizan estos estados. Los mecanismos de sensibilización implican la activación de receptores de membrana (generalmente receptores acoplados a proteínas G [GPCR], como receptores para bradiquininas, prostaglandinas, PAR, histamina, serotonina, neurotropinas tipo NGF, sustancia P o CGRP) por ligandos específicos. Este proceso depende de interacciones de tipo neuroinmune en las cuales participan células inmunes (mastocitos, linfocitos, células dendríticas, macrófagos y neutrófilos), el sistema nervioso entérico (neuronas entéricas y glía entérica) y el epitelio intestinal (células epiteliales y células enteroendocrinas, respondiendo básicamente a estímulos químicos y mecánicos). A este sistema de interacciones se ha adicionado recientemente la microbiota como un componente activo. Así derivados microbianos pueden penetrar en el epitelio y actuar como ligandos directos de receptores o modificar la actividad neuroinmune local. En determinadas circunstancias se pueden producir cabios fenotípicos persistentes en las neuronas sensoriales. Estos cambios mantienen los estados de sensibilización a largo plazo y pueden afectar la actividad sináptica en la médula espinal, pudiendo generar estados de sensibilización a nivel central (médula espinal). En conjunto estos procesos parecen ser especialmente importantes mediando la sensibilización que acompaña a estados inflamatorios o infecciosos. Fuente: Modificado a partir de: Knowles et al.70 y Martínez4.](https://static.elsevier.es/multimedia/02105705/0000004700000008/v3_202410150442/S0210570524001456/v3_202410150442/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)


