La pancreatitis crónica se asocia a calidad de vida deteriorada, elevada incidencia de comorbilidades, complicaciones graves y mortalidad. Los costes sanitarios son enormes. Algunas sociedades médicas han elaborado guías clínicas basadas en evidencia científica, pero el nivel de evidencia para cada aspecto de la enfermedad suele ser bajo y, consecuentemente, las recomendaciones tienden a ser vagas o débiles.
En los presentes documentos de posicionamiento de la Societat Catalana de Digestologia y la Societat Catalana de Pàncrees hemos buscado redactar declaraciones bien definidas orientadas al clínico, basadas en revisiones actualizadas de la literatura y acuerdos de expertos. El objetivo es proponer el uso de terminología común y circuitos diagnóstico/terapéuticos racionales basados en el conocimiento actual. Para este fin se revisaron 51 secciones relacionadas con pancreatitis crónica por 21 expertos de 6 especialidades diferentes para generar finalmente 88 declaraciones que buscan armonizar conceptos y formular recomendaciones precisas.
La parte 2 de esta serie de documentos discute temas sobre tratamiento y seguimiento. La aproximación terapéutica debe incluir la evaluación de factores etiológicos, manifestaciones clínicas y complicaciones. La complejidad de estos pacientes requiere un estudio detallado individualizado en comités multidisciplinares donde todas las opciones (conservadoras, endoscópicas, de radiología intervencionista y quirúrgicas) sean sopesadas. Deberían constituirse unidades especializadas de pancreatología. Las indicaciones quirúrgicas son dolor refractario, complicaciones locales y sospecha de neoplasia. El tratamiento enzimático está indicado si existe evidencia de insuficiencia exocrina o tras cirugía pancreática. La respuesta debe evaluarse mediante parámetros nutricionales y síntomas. Se debe planificar un programa de seguimiento para cada paciente.
Chronic pancreatitis is associated with impaired quality of life, high incidence of comorbidities, serious complications and mortality. Healthcare costs are exorbitant. Some medical societies have developed guidelines for treatment based on scientific evidence, but the gathered level of evidence for any individual topic is usually low and, therefore, recommendations tend to be vague or weak.
In the present position papers on chronic pancreatitis from the Societat Catalana de Digestologia and the Societat Catalana de Pàncrees we aimed at providing defined position statements for the clinician based on updated review of published literature and on multidisciplinary expert agreement. The final goal is to propose the use of common terminology and rational diagnostic/therapeutic circuits based on current knowledge. To this end 51 sections related to chronic pancreatitis were reviewed by 21 specialists from 6 different fields to generate 88 statements altogether. Statements were designed to harmonize concepts or delineate recommendations.
Part 2 of these paper series discuss topics on treatment and follow-up. The therapeutic approach should include assessment of etiological factors, clinical manifestations and complications. The complexity of these patients advocates for detailed evaluation in multidisciplinary committees where conservative, endoscopic, interventional radiology or surgical options are weighed. Specialized multidisciplinary units of Pancreatology should be constituted. Indications for surgery are refractory pain, local complications, and suspicion of malignancy. Enzyme replacement therapy is indicated if evidence of exocrine insufficiency or after pancreatic surgery. Response should be evaluated by nutritional parameters and assessment of symptoms. A follow-up program should be planned for every patient with chronic pancreatitis.
Éste es el segundo de una serie de 3 artículos orientados en resaltar los conceptos principales y las actuaciones recomendadas por la Societat Catalana de Digestologia (SCD) y la Societat Catalana de Pàncrees (SCPanc) sobre aspectos clínicos de la pancreatitis crónica (PCr). El objetivo es proponer una terminología común y unos circuitos diagnósticos y terapéuticos racionales basados en el conocimiento actual. El número de apartados revisados, el número de especialistas participantes y su composición cualitativa ya se especificaron en el primer documento dedicado a etiología y diagnóstico de la PCr1.
De la revisión actualizada de los apartados se confeccionó un manuscrito preliminar que fue discutido por todo el grupo. Donde se detectaron discrepancias el texto se editó para poder alcanzar más del 90% de consenso. El documento fue posteriormente presentado a las 2 sociedades promotoras para su aprobación. Las frases precedidas de la abreviación SCD-SCPanc señalan la posición de las 2 sociedades en los diferentes apartados, ya sea para enfatizar un concepto o para manifestar una recomendación.
Tratamiento de la pancreatitis crónicaSCD-SCPanc 1. La aproximación terapéutica a todo paciente con PCr debe incluir una valoración detallada de los posibles factores etiológicos, de las manifestaciones clínicas y de las complicaciones.
SCD-SCPanc 2. Como regla general, la eliminación de factores etiológicos se acompaña de una mejor evolución de la enfermedad.
Los pacientes que dejan de beber y de fumar tienen mejor pronóstico2,3. Aquellos que mantienen sus hábitos tóxicos tienen una evolución acelerada de la enfermedad, mas brotes de pancreatitis, forman calcificaciones más rápidamente y tienden a desarrollar insuficiencia endocrina. Dejar de fumar (o de beber) puede ser esencial para minimizar futuros brotes de pancreatitis en pacientes con mutaciones genéticas o con pancreatitis del surco.
El adecuado tratamiento de una hipertrigliceridemia evita pancreatitis repetidas y episodios de pancreatitis necrosante.
La resolución definitiva de una obstrucción ductal se acompaña de una mejor evolución4.
El tratamiento de la pancreatitis autoinmune mejora los síntomas y puede revertir las lesiones morfológicas. En algunos casos se ha documentado mejoría de la insuficiencia exocrina y de la endocrina.
Actualmente todavía no disponemos de tratamientos específicos que reviertan las anomalías derivadas de las alteraciones genéticas asociadas a la PCr.
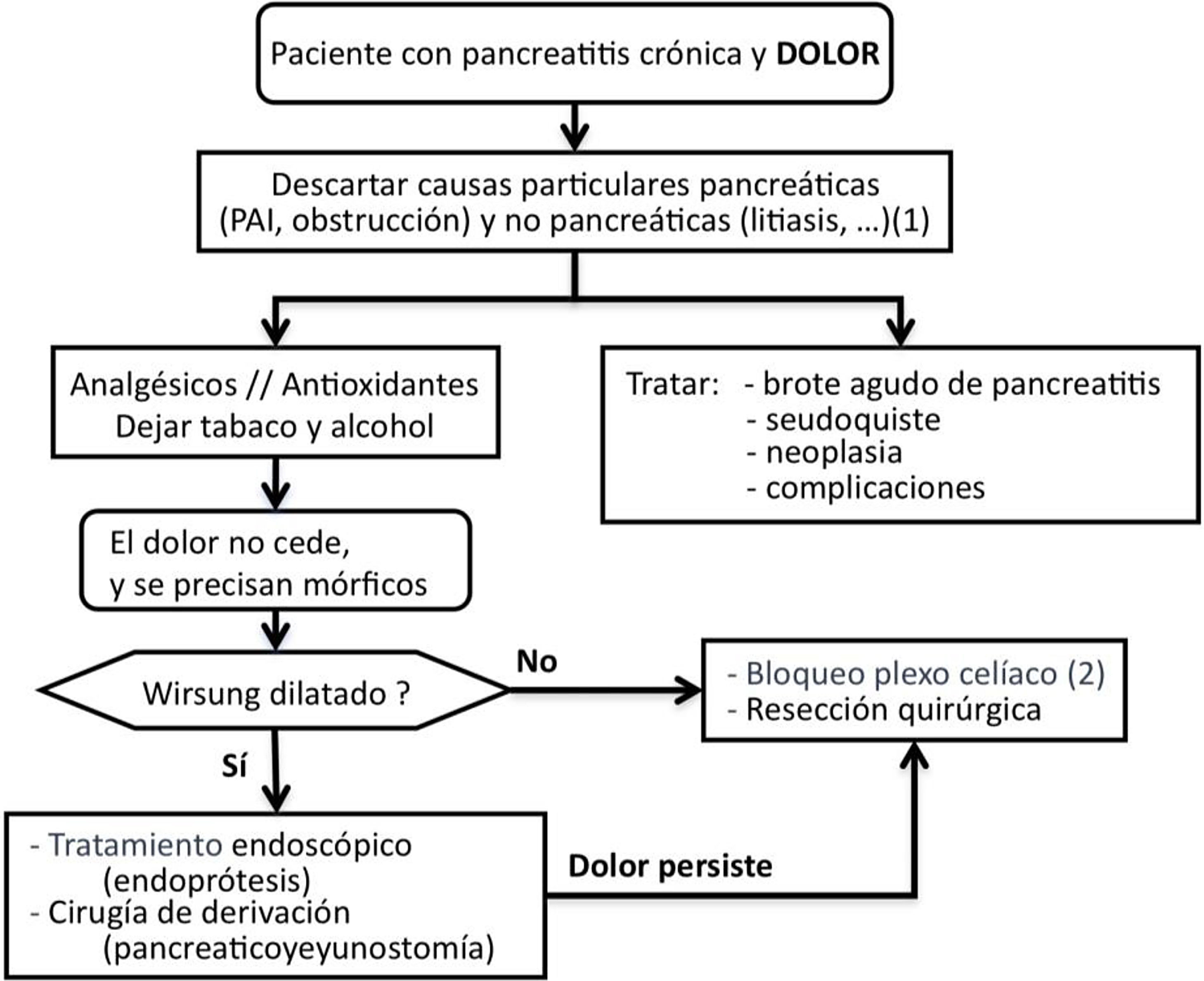
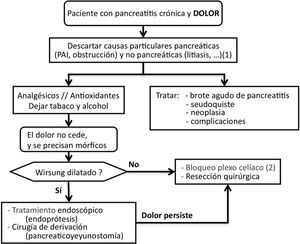
Tratamiento del dolorSCD-SCPanc 3. Aconsejamos planificar el tratamiento del dolor con una combinación escalonada y racional de modalidades terapéuticas (Diagrama 1).
SCD-SCPanc 4. Recomendamos que la pauta analgésica siga las indicaciones de la escalera de la OMS empleando dosis eficaces a intervalos adecuados y ajustando las dosis a la intensidad del dolor.
Se debe tratar el dolor con fármacos efectivos en dosificaciones terapéuticas e investigar causas que necesiten actuaciones específicas (tabla 1).
Complicaciones asociadas a pancreatitis crónica que pueden causar o exacerbar dolor
| - Brote agudo de pancreatitis |
| - Seudoquiste y complicaciones asociadas (hemorragia, infección, rotura, compresión) |
| - Obstrucción ductal |
| - Hemorragia intraductal (hemosuccus pancreaticus)a |
| - Estenosis duodenal y dificultad de vaciamiento gástrico |
| - Ulcus duodenal y litiasis biliarb |
| - Estenosis colónica |
| - Colangitis agudac |
| - Neoplasias sólidas o quísticasd |
| - Dismotilidad digestiva |
El dolor en la PCr puede tener un origen determinado o reconocer componentes multifactoriales (inflamación, aumento de la presión parenquimatosa o ductal, sensibilización neurogénica). Es por ello que las estrategias de tratamiento, incluidas las farmacológicas, deben tener presente los posibles componentes del dolor para diseñar un abordaje lo más racional posible.
Siempre es aconsejable tipificar el dolor del paciente, en especial antes de iniciar cualquier medida terapéutica para así poder evaluar mejor su eficacia. Se pueden usar escalas unidimensionales (escala numérica del 0 al 10, escala analógica visual) o multidimensionales (inventario breve de dolor, cuestionario de dolor de McGill). El estudio sensorial cuantitativo (quantitative sensory testing [QST]) puede detectar si se ha desarrollado sensibilización central del dolor crónico pancreático (segmentario o difuso), y así orientar mejor el tratamiento5–7.
Los factores etiológicos asociados a la PCr pueden influir en la respuesta al tratamiento3. Por ello se debe recomendar siempre dejar de beber alcohol y de fumar.
Aparte de tratar factores etiológicos (en especial obstrucción ductal, tabaco, alcohol y autoinmunidad) conviene aconsejar una dieta sana y promover el ejercicio como medidas de tratamiento a largo plazo. Los antioxidantes pueden resultar beneficiosos en pacientes no fumadores2,8.
La utilidad del tratamiento con enzimas pancreáticos es controvertida. Se acepta hacer un tratamiento de prueba de 2 meses, pero esta recomendación es débil.
La pauta analgésica se suele iniciar con el primer escalón de la escalera de la OMS2,3,8,9.
Como el dolor en la PCr es irregular e intermitente es importante monitorizar las pautas analgésicas. Toda medicación administrada en ausencia de dolor es una sobredosificación innecesaria.
Podemos empezar con paracetamol 500 a 1.000mg cada 4-6h (≤4g/día) vigilando la aparición de toxicidad hepática, cuyo riesgo es mayor en pacientes alcohólicos. El uso de metamizol (0,5-2g/6-8h, con un máximo diario de 8g) está cuestionado por su implicación en el desarrollo de discrasias sanguíneas.
Los antiinflamatorios no esteroideos son efectivos, pero pueden inducir lesiones gastroduodenales e insuficiencia renal, por lo que no se aconseja su empleo prolongado.
Paracetamol asociado a codeína (60mg/4-6h) o tramadol (50-150mg/4-6h) tiene mayor potencia analgésica. El tramadol afecta menos la motilidad digestiva que la codeína.
La adición de antidepresivos, anticonvulsivantes o de pregabalina (25-75mg/día) se ha mostrado eficaz en pacientes seleccionados, pero induce frecuentes efectos adversos. Antes de aplicar esta modalidad de tratamiento se puede realizar (en centros que tengan estandarizada la prueba) un estudio sensorial cuantitativo que es capaz de detectar cambios neuroplásticos de sensibilización central del dolor7. Estos cambios anticipan una mala respuesta a la aproximación farmacológica clásica del dolor y justifican la introducción de otros fármacos como pregabalina10.
Si tampoco se llega a controlar el dolor se pasa al escalón siguiente que consiste en la administración restringida en el tiempo de opiáceos mayores, como morfina oral 10-40mg/4h, ajustando siempre la dosis a la intensidad del dolor. Como alternativas podemos emplear morfina MST, 10-40mg/8-12h; oxicodona, 10-40mg/12h, o buprenorfina, 0,2-0,4mg/6-8h sublingual o 0,3-0,6mg/6-8h im. En caso de prescripción de opiáceos hemos de ser muy cuidadosos con la sobredosificación en unos pacientes que ya suelen tener tendencias adictivas (fumadores, enólicos) y con la aparición de efectos secundarios (depresión respiratoria, estreñimiento).
Como la intensidad de dolor es variable e intermitente, no se aconsejan opiáceos de liberación prolongada (parches) por el riesgo de habituación y dependencia. Por otro lado, se ha observado que la respuesta a opciones más agresivas para el tratamiento del dolor (como intervenciones quirúrgicas de derivación o de resección) tienen peores resultados en pacientes que ya han iniciado tratamiento con opiáceos.
La estimulación de la médula espinal11 puede tener un efecto beneficioso en el control del dolor crónico pancreático y en la reducción del uso de opioides.
Si no se identifican causas tratables, el dolor no se controla con analgesia convencional y se requiere el empleo de mórficos, están indicados tratamientos invasivos como actuaciones sobre la conducción neural del dolor, intervenciones endoscópicas o quirúrgicas. Las intervenciones invasivas se reservan para aquellos pacientes con frecuentes ataques de dolor y cambios morfológicos evidentes (masa inflamatoria, dilatación de Wirsung, etc.). Además, estas modalidades de tratamiento se aconseja que se realicen en centros especializados con contrastada experiencia.
Tratamiento endoscópico del dolorSCD-SCPanc 5. En fases tempranas de la enfermedad se puede plantear una aproximación endoscópica como primera opción de tratamiento invasivo del dolor. Esta aproximación está reforzada ante la aparición o el aumento del dolor que se acompaña de cambios morfológicos o de progresión de la enfermedad establecida.
SCD-SCPanc 6. Recomendamos que se considere el tratamiento endoscópico de forma prioritaria cuando existan contraindicaciones quirúrgicas (cardiopatía o broncopatía severas, hipertensión portal segmentaria) y haya colecciones, estenosis o litiasis accesibles. La presencia de una masa inflamatoria desaconseja el tratamiento endoscópico.
Antes de indicar una intervención quirúrgica derivativa es aceptable considerar primero un tratamiento endoscópico y evaluar los resultados. Este es un punto de decisión que ha generado mucho debate en los últimos 10 años porque varios estudios prospectivos aleatorizados han demostrado mejores resultados en el control del dolor empleando técnicas quirúrgicas4. Por otro lado, una cirugía precoz razonada (p. ej., sobre una obstrucción ductal fibrosa) puede resolver el dolor de forma definitiva y evitar el desarrollo de sensibilización central.
Sin embargo, el tratamiento endoscópico puede llegar a ser definitivo, o bien se puede emplear como puente antes de una cirugía agresiva. Además, no es infrecuente que los pacientes presenten contraindicaciones relativas o absolutas a la cirugía, como en caso de hipertensión portal segmentaria o cardiopatía o broncopatía severas, y en estos casos las aproximaciones endoscópicas cobran mayor protagonismo12.
Los procedimientos endoscópicos consisten en colocación de prótesis en el conducto principal tras esfinterotomía pancreática y dilatación de estenosis, fragmentación y eliminación de litiasis intraductales, y drenaje de colecciones, siempre que se sospeche que estas enfermedades sean el origen de los síntomas.
Las estenosis y litiasis con indicación endoscópica óptima son las situadas en el área cercana a la papila, mientras que las más proximales son menos accesibles. Las prótesis colocadas con intención de dilatar estenosis o de drenar el conducto principal o una colección se pueden recambiar a intervalos establecidos. La mejoría del dolor a largo plazo se sitúa entre el 50 y el 60%12. Si hay dilatación del conducto principal secundaria a estenosis o litiasis distal que no son abordables vía transpapilar se puede intentar acceder al conducto principal mediante punción transgástrica guiada por ultrasonografía endoscópica (USE) en centros especializados.
Si existe una masa inflamatoria en la cabeza del páncreas las intervenciones endoscópicas no suelen ser efectivas en el tratamiento del dolor.
Algunas actuaciones endoscópicas se explicarán con un más de detalle al abordar las complicaciones de la PCr.
Tratamiento quirúrgico del dolorSCD-SCPanc 7. La indicación quirúrgica se establece cuando otros procedimientos han fracasado, el paciente requiere opioides mayores de forma continuada o existe sospecha de neoplasia.
SCD-SCPanc 8. La técnica quirúrgica a emplear se decide en función de:
- –
Presencia de dilatación ductal (>5mm de diámetro o dilatación difusa) y de estenosis/litiasis ductales
- –
Presencia y localización de una masa inflamatoria, sobre todo a nivel de la cabeza pancreática. Se considera patológico un aumento superior a 40mm en el diámetro anteroposterior de la cabeza
- –
Afectación y estenosis de tejidos peripancreáticos (vía biliar, duodeno, colon, confluente venoso mesentérico-portal)
- –
Presencia de hipertensión portal
Repetidos estudios indican que las modalidades quirúrgicas son las más efectivas para el tratamiento del dolor persistente en pacientes con PCr. Son más efectivas que las aproximaciones endoscópicas, pero no están exentas de complicaciones y pueden ser técnicamente difíciles, especialmente si existe hipertensión portal. Incluso se ha llegado a recomendar una actuación quirúrgica precoz con el fin de obtener un mayor beneficio4, antes que se establezca una sensibilización central del dolor y antes de que se presenten complicaciones que pueden dificultar las técnicas quirúrgicas. Los mejores resultados se consiguen durante los primeros 3 años desde la aparición del dolor y cuando todavía no se ha iniciado tratamiento con opioides2,4,13-15.
Las opciones se agrupan en 3 categorías: resectivas, derivativas y mixtas.
Técnicas derivativasEstán indicadas cuando el tamaño de la cabeza pancreática es normal y existe dilatación del conducto de Wirsung>5mm.
La modalidad más empleada es la pancreaticoyeyunostomía latero-lateral en «Y» de Roux: intervención de Puestow modificada o Partington-Rochelle. Se realiza apertura longitudinal del conducto de Wirsung en la cara anterior, extracción o fragmentación de posibles litiasis y anastomosis latero-lateral con asa de yeyuno desfuncionalizada. Presenta buenos resultados, con una mortalidad del 1-4% y una morbilidad inferior al 30%16. Se consiguen mejorías clínicas sobre el dolor del 75%.
Estudios comparativos con colocación de prótesis endoscópicas han mostrado superioridad del tratamiento quirúrgico17,18.
Técnicas resectivasSe indican ante un aumento de tamaño de la cabeza pancreática de más de 40mm o en caso de pancreatitis del surco. Tienen buenos resultados a largo plazo en cuanto al control del dolor. Podemos considerar 3 modalidades:
- 1.
Duodenopancreatectomía cefálica (técnica de Whipple). Es el procedimiento mas empleado
- 2.
Duodenopancreatectomía cefálica con preservación pilórica (técnica de Traverso)
- 3.
Pancreatectomía cefálica con preservación duodenal (técnica de Beger). En este caso la efectividad contra el dolor es elevada (90%), pero a costa de una alta morbilidad (40%)
En el procedimiento de Whipple la resección de la cabeza pancreática va asociada a la extirpación del duodeno y de la vía biliar distal. No está exenta de complicaciones, con una mortalidad asociada cercana al 5%.
Técnicas mixtasEstán indicadas en caso de lesiones fibroinflamatorias en la cabeza pancreática con dilatación ductal asociada13. La más utilizada es la resección parcial cefálica con pancreaticoyeyunostomía latero-lateral (técnica de Frey). Tiene buenos resultados (90% efectividad), menor morbilidad (23%) y menor mortalidad (0,4%).
La pancreatectomía total se plantea de forma excepcional cuando otros procedimientos han fracasado o en pacientes con dolor intratable que no presentan dilatación ductal ni afectación inflamatoria focal. Provoca la aparición de una diabetes de difícil control que el autotrasplante de islotes puede mitigar, pero no eliminar del todo ya que las necesidades de insulina a los 5 años son del 55 y del 90% a los 8 años19,20.
Actuaciones sobre la conducción neural del dolorSCD-SCPanc 9. La anulación de la transmisión neural se plantea como una alternativa a los tratamientos endoscópicos y quirúrgicos. Solo aconsejamos su aplicación en centros especializados y cuando otros intentos terapéuticos han fracasado o son inviables.
Es una modalidad poco atractiva porque tan solo disminuye (que no a elimina) el dolor en un 60-70% de casos durante los primeros meses, su efectividad desaparece con el tiempo y no está exenta de efectos secundarios.
Se utilizan 2 modalidades:
- 1.
Bloqueo o neurolisis del plexo celíaco. Punción dirigida por tomografía computarizada (TC) o USE hacia el plexo celíaco, donde se infiltra bupivacaína y corticoides (bloqueo) o bupivacaína y alcoholización (neurolisis)21
- 2.
Esplacnicectomía toracoscópica. Se seccionan los haces neurales a nivel del tórax
La efectividad del bloqueo del plexo celíaco en la PCr no suele pasar del 60%, y la mayoría de pacientes siguen requiriendo analgésicos. Además, la reducción del dolor que se consigue no suele durar más de 3 meses2,21,22. Es un procedimiento que puede acompañarse de efectos secundarios molestos, como hipotensión postural y diarrea.
Otras técnicas podrían ser efectivas en casos seleccionados: estimulación espinal11, estimulación magnética transcraneal y acupuntura.
Tratamiento de la insuficiencia exocrinaSCD-SCPanc 10. Está justificado administrar tratamiento enzimático sustitutivo en pacientes con esteatorrea sintomática, en caso de evidencia documentada de insuficiencia pancreática exocrina (IPEx), o después de cirugía pancreática.
SCD-SCPanc 11. Recomendamos iniciar la suplementación con 40.000-50.000UI de lipasa en cada comida principal y 20.000-25.000UI en desayuno y merienda. En caso de pancreatectomía total o parcial, insuficiencia pancreática grave o cáncer de páncreas las dosis requeridas pueden ser mayores.
SCD-SCPanc 12. La respuesta al tratamiento la evaluamos mediante control de peso, parámetros nutricionales, vitaminas liposolubles y valoración de síntomas, y no con monitorización de la grasa fecal.
SCD-SCPanc 13. Si la respuesta no es óptima, hemos de considerar incrementar la dosis de enzimas, inhibir la secreción ácida y descartar sobrecrecimiento bacteriano.
La secreción habitual de lipasa en cada comida principal es de unas 90.000UI. La ausencia total de páncreas se acompaña de esteatorrea franca, ya que menos del 15% de la lipasa se produce fuera del páncreas y esta cantidad de lipasa es del todo insuficiente para digerir el contenido graso de una dieta equilibrada. La presencia de esteatorrea por IPEx es un motivo universalmente aceptado para administrar tratamiento enzimático sustitutivo. Si existe evidencia de IPEx documentada por alguno de los métodos de diagnóstico descritos en la parte 1 de la presente serie también está indicado iniciar tratamiento enzimático, pero el grado de recomendación es menor3,8.
Después de la cirugía pancreática, la presencia de IPEx puede ser difícil de demostrar (argumentos también explicados en la parte 1 de esta serie) y se considera suficiente tener un alto grado de sospecha clínica para iniciar tratamiento enzimático23.
Si existe esteatorrea importante o malnutrición evidente, podemos sustituir parcialmente el aporte de lípidos por triglicéridos de cadena media de fácil absorción. Pero la IPEx sin esteatorrea o malnutrición evidente se puede acompañar de déficits de vitaminas liposolubles, magnesio, selenio, cinc, vitamina B12 y otros microelementos que hemos de normalizar con tratamiento adecuado24. Las discusiones sobre las indicaciones de tratamiento enzimático y sobre la conveniencia o no de añadir suplementos nutricionales suelen originarse en motivos económicos que se apoyan en datos macroscópicos (diarrea, peso, índice de masa corporal), obviando los efectos nocivos a largo plazo de una mala calidad de absorción de nutrientes y vitaminas sobre diversos sistemas (osteoporosis, sarcopenia, alteraciones neurológicas y cardiovasculares, etc.).
La administración de enzimas pancreáticos reduce la malabsorción de nutrientes, estabiliza el peso corporal, mejora los síntomas y la calidad de vida de los pacientes con IPEx y puede tener un impacto positivo en su supervivencia25.
Una vez establecida la indicación de tratamiento enzimático sustitutivo se ha de decidir la dosis a administrar. La dosis dependerá de la situación clínica de cada paciente y de la respuesta obtenida. En un paciente con PCr y elastasa fecal inferior a 50μg/g de heces es aconsejable iniciar el tratamiento con 50.000 unidades de lipasa durante cada comida principal y 25.000 en cada comida secundaria24,26,27 para aportar al menos el 10% de las necesidades de lipasa en cada comida.
Hemos de adaptar la dosificación a las costumbres dietéticas del paciente y la respuesta la evaluaremos con parámetros nutricionales24. Si no es satisfactoria podemos aumentar la dosis de enzimas hasta llegar a doblarlas. Los pacientes que tienden a requerir mayor aporte de enzimas son aquellos que tienen una insuficiencia pancreática grave y los intervenidos de una duodenopancreatectomia cefálica en presencia de PCr.
Para optimizar la respuesta se puede inhibir la secreción ácida gástrica (que anula la actividad enzimática) y tratar un posible sobrecrecimiento bacteriano que es particularmente frecuente en algún subgrupo de pacientes con PCr24, como por ejemplo aquellos que han sido sometidos a cirugía digestiva previa26,27.
Ocasionalmente puede ser necesaria la administración de suplementos nutricionales por vía oral o a través de sondas de alimentación entérica24.
La PCr suele ser una enfermedad evolutiva, así que las necesidades enzimáticas pueden incrementarse con el tiempo o como consecuencia de brotes de pancreatitis aguda.
A pesar de administrar un aporte enzimático correcto y conseguir estabilidad o ganancia ponderal no es infrecuente que tengamos que suplementar los pacientes con vitaminas liposolubles24. Debemos monitorizar los niveles plasmáticos de estas vitaminas para actuar en consecuencia y estar atentos a la enfermedad crónica ocasionada (osteoporosis, dermatitis, neuropatía, etc.). Aconsejamos una dieta sana rica en calcio, suplementar vitaminas liposolubles y micronutrientes deficitarios, evitar alcohol y tabaco, y practicar ejercicio regularmente.
Tratamiento de la insuficiencia endocrinaSCD-SCPanc 14. La evolución de la PCr suele conducir hacia una disminución notable de la reserva endocrina, y por ello los fármacos hipoglucemiantes secretagogos no son muy efectivos. El tratamiento de elección en la mayoría de los casos es la insulina. Puede coexistir variable resistencia a insulina y en estos casos se puede emplear metformina. El uso correcto de enzimas pancreáticos en presencia de insuficiencia exocrina puede ayudar al control de la respuesta insulínica.
SCD-SCPanc 15. Es preciso alertar sobre la aparición de hipoglicemias secundarias al tratamiento e instruir en su manejo.
El paradigma establecido de la PCr como una enfermedad fibroinflamatoria progresiva nos induce a pensar en un proceso de destrucción inexorable de los islotes pancreáticos que lleva al desarrollo de un déficit marcado de la reserva endocrina. Si bien este escenario se cumple frecuentemente, no siempre es así. A menudo se puede añadir un componente de resistencia periférica a la insulina propiciado por el propio fenómeno inflamatorio subyacente.
Estas consideraciones tienen importancia a la hora de acometer el tratamiento de diabetes mellitus en estos pacientes. Si existe resistencia insulínica concomitante se puede iniciar el tratamiento con metformina. Y en estos casos el ejercicio físico puede ayudar.
La digestión y la absorción de nutrientes puede ser importante para estimular la secreción de incretinas (GIP y GLP-1) y los niveles de insulina posprandiales. Por tanto, un tratamiento adecuado de la insuficiencia exocrina con enzimas pancreáticos puede repercutir favorablemente en la insuficiencia endocrina, como se ha demostrado en la PCr asociada a fibrosis quística28.
Existe escasa información sobre el riesgo-beneficio de análogos de GLP1 o glucosúricos en el contexto de PCr, y por ello estos fármacos no se consideran de elección.
Tras algunas intervenciones (resolución de obstrucción, abstinencia alcohólica, corticoides en pancreatitis autoinmune), la diabetes mellitus puede llegar a mejorar.
Si existe franca insulinopenia (péptido C bajo en presencia de hiperglicemia) el tratamiento de elección es la insulina29,30. La diabetes asociada a la PCr suele ser más lábil, con mayor riesgo de hipoglicemia debido al déficit concomitante de glucagón. Es conveniente que los pacientes sepan prevenir y corregir la hipoglicemia mediante hidratos de carbono de acción rápida, y que dispongan de glucagón para administración intramuscular en casos de hipoglicemia grave. Hay que desconfiar del uso racional de insulina por parte de pacientes alcohólicos, población en la que el riesgo de hipoglicemia es muy elevado, tanto por el alcoholismo como por la ingesta alimentaria inadecuada.
Tratamiento quirúrgico de la pancreatitis crónicaSCD-SCPanc 16. Las indicaciones fundamentales de la cirugía son el dolor refractario, las complicaciones locales y la sospecha de malignidad.
SCD-SCPanc 17. La complejidad de estos pacientes hace recomendable que se evalúe cada caso con detalle en comités multidisciplinarios donde se ponderen actuaciones conservadoras, endoscópicas, de radiología intervencionista o quirúrgicas.
SCD-SCPanc 18. En la decisión y la técnica quirúrgica intervienen factores como edad, gravedad de comorbilidades, presencia de hipertensión portal segmentaria, factores etiológicos (enolismo, tabaco, base genética), desarrollo de insuficiencia exocrina y/o endocrina, tipos de complicaciones locales y grado de sospecha de neoplasia.
Las indicaciones quirúrgicas han de estar orientadas hacia enfermedades concretas sobre las que se anticipe un beneficio claro de las intervenciones, como en el caso del tratamiento del dolor, de complicaciones locales y de la sospecha de malignidad13. Siempre se ha de tener en cuenta la mortalidad y la morbilidad asociada a cada tipo de intervención. La PCr asintomática no tiene indicación quirúrgica, ni tampoco la aparición de insuficiencia exocrina o endocrina.
Algunas enfermedades pueden ser abordadas inicialmente por endoscopia, como la estenosis biliar o duodenal. En el drenaje de colecciones se han de evaluar todas las aproximaciones posibles (endoscópicas, radiológicas y quirúrgicas) e implementar la que se considere más adecuada tras una valoración multidisciplinar.
La morfología de la glándula y la presencia de calcificaciones, masa inflamatoria, dilatación ductal o presencia de hipertensión portal segmentaria condicionan la selección de la técnica quirúrgica. Las diferentes modalidades quirúrgicas ya se han descrito en el apartado dedicado al tratamiento quirúrgico del dolor en la PCr. Si existe masa inflamatoria en cabeza pancreática se ha de plantear una técnica de resección. En algunas ocasiones se pueden realizar técnicas combinadas. La aproximación quirúrgica a un paciente con hipertensión portal segmentaria ha de hacerse de forma individualizada. En estos casos cualquier técnica de resección puede complicarse con hemorragia intraoperatoria de alto débito. En estos casos se da preferencia a técnicas de derivación o mixtas, como la técnica de Frey, y así evitar resecciones arriesgadas de la cabeza pancreática. La cirrosis hepática evolucionada es una contraindicación relativa de la cirugía pancreática, especialmente si se asocia a cavernomatosis portal. La indicación y la realización de cirugía pancreática en pacientes de alto riesgo debe ser cuidadosamente evaluada por comités multidisciplinares en centros especializados.
Dado el alto riesgo de cáncer de páncreas se ha llegado a proponer practicar resección profiláctica en pacientes con mutaciones en PRSS113.
Listado de indicaciones y técnicas quirúrgicas orientadas a la enfermedad subyacente:
- –
Dolor refractario al tratamiento médico: derivación, resección o combinación de ambas (ya expuestas en el apartado dedicado al tratamiento del dolor pancreático)
- –
Sospecha de neoplasia pancreática: la cirugía con resección oncológica es la primera opción
- –
Obstrucción gástrica o duodenal: gastroenteroanastomosis
- –
Obstrucción de la vía biliar: hepático-yeyunostomía
- –
Seudoquiste sintomático: derivación a tubo digestivo
- –
Fístula pancreática intratable: se ha de hacer una valoración individualizada
- –
Hemorragia por hipertensión portal secundaria a trombosis esplénica: esplenectomía con o sin pancreatectomía corporo-caudal
Las complicaciones posquirúrgicas han de conocerse para poder ser identificadas y tratadas a tiempo. Pueden ser perioperatorias o tardías.
Complicaciones perioperatorias: fístula externa (10-20%, más frecuente en pancreatectomías distales), lesión esplénica y esplenectomía, colecciones peripancreáticas, abscesos, lesiones vasculares y formación de seudoaneurismas, hemorragia, trombosis venosas y embolismos, dehiscencia suturas y agravación de comorbilidades.
Complicaciones tardías31: hemorragia diferida (por seudoaneurisma), ascitis quilosa, colangitis aguda, síndrome del asa aferente, IPEx23 (30-49%) y endocrina (4-17%), vaciamiento gástrico enlentecido (10%), sobrecrecimiento bacteriano, asincronía postcibal (IPEx funcional), estenosis de anastomosis pancreato-entéricas (2-11%) con inducción de dolor posprandial y pancreatitis aguda recurrente32, úlceras y carcinoma en anastomosis gastroyeyunales. La diabetes mellitus es más frecuente tras la pancreatectomía distal que tras la duodenopancreatectomía cefálica (25 vs. 16%)33.
Cada una de estas complicaciones requiere un abordaje específico cuya discusión escapa del objetivo de la presente revisión. Merece la pena señalar que algunas de estas complicaciones son difíciles de resolver y suponen un reto constante para el pancreatólogo, como las colangitis agudas repetidas o las infrecuentes, pero alarmantes pancreatitis agudas recurrentes por estenosis de la unión pancreato-entérica. Estas estenosis se pueden resolver mediante dilatación con balón, pero a menudo no se puede identificar la anastomosis estenosada mediante un enteroscopio. Las alternativas son la punción del conducto pancreático dilatado dirigida por USE con posterior dilatación de la estenosis y colocación de prótesis, o una reintervención quirúrgica.
Calidad de vida, consumo de recursos sanitarios y mortalidadSCD-SCPanc 19. La PCr se asocia a deterioro de la calidad de vida y a graves complicaciones.
SCD-SCPanc 20. La PCr se asocia también a una elevada incidencia de comorbilidades.
SCD-SCPanc 21. La mortalidad asociada a la PCr es desproporcionalmente elevada.
SCD-SCPanc 22. El coste sanitario de los pacientes con PCr es elevado.
SCD-SCPanc 23. Se hace necesaria la constitución de unidades especializadas de pancreatología.
La PCr es una enfermedad grave que tiene un fuerte impacto en la calidad de vida (QoL) a la que influyen en especial el dolor y el deterioro funcional de la glándula. Además, tiene una manifiesta tendencia a producir complicaciones a largo plazo, algunas de las cuales pueden suponer un riesgo vital34,35. Hasta un 33% de los pacientes tienen baja laboral permanente36. Los pacientes que desarrollan IPEx tras cirugía pancreática tienen una peor calidad de vida23.
Existen diversos cuestionarios validados que pueden evaluar la QoL en estos pacientes (SF-36; SF-12; EORTC QLQ-C30, GIQLI, etc.). En ensayos clínicos los más utilizados son el QLQ-C30 y el SF-36. Ninguno ha sido diseñado específicamente para la PCr.
Ya sea por los hábitos tóxicos del paciente, por el deterioro nutricional crónico o por el desarrollo de diabetes, los pacientes con PCr tienen tendencia a desarrollar comorbilidades importantes durante su evolución que pueden contribuir a empeorar la QoL o incluso ser causa de la muerte. Entre las comorbilidades frecuentemente asociadas a la PCr destacan accidentes vasculares cerebrales, arteriopatía, EPOC, ulcus péptico, diabetes mellitus, insuficiencia renal crónica, osteoporosis y neoplasias37.
La mortalidad en la PCr establecida es 3,6 veces superior a la población general, con tasas globales superiores al 35% (55% si se evalúa a los 20 años del diagnóstico inicial)38. El cáncer es una de las causas frecuentes de mortalidad38,39. El consumo de alcohol y tabaco también reducen la supervivencia. Son responsables del 60-75% de muertes de causa extra-pancreática, como por ejemplo por cáncer de pulmón o esófago, cirrosis hepática o infarto de miocardio34,37. Finalmente, la acción aditiva de complicaciones, comorbilidades y diabetes socavan aún más la supervivencia global de estos pacientes3.
El gasto en atención médica que generan los pacientes con PCr es muy elevado. Los ingresos hospitalarios son frecuentes debido a brotes agudos y a complicaciones40,41. Los costes por ingreso son cada vez más altos35, con un índice de reingresos del 30% a los 30 días (la mitad tienen relación con la enfermedad pancreática41–43).
A esto hay que añadir los costes por pérdida de función pancreática endocrina y exocrina, y por el tratamiento del dolor. Una estimación de costes directos e indirectos sería de 88.613€ por paciente/año40.
Dado que los pacientes con PCr necesitan una aproximación multidisciplinar sanitaria y social, una coordinación integral entre los diferentes profesionales para optimizar recursos, garantizar la adherencia a los tratamientos instaurados y conseguir un seguimiento que anticipe y evite complicaciones de la enfermedad, se hace necesario la constitución de unidades especializadas de pancreatología. Mediante estas unidades, y con la complicidad de los profesionales adscritos, se persigue reducir la tasa de complicaciones, mejorar la calidad de vida de estos pacientes, reducir la mortalidad asociada y optimizar los recursos sanitarios.
Seguimiento de pacientes con pancreatitis crónicaSCD-SCPanc 24. En pacientes con enfermedad estable aconsejamos realizar controles clínicos y analíticos cada 6-12 meses. Debemos dar prioridad a los pacientes que presenten un cambio en el patrón del dolor, pérdida de peso y/o ictericia. Si aparecen complicaciones el seguimiento ha de ser individualizado.
SCD-SCPanc 25. Se ha de valorar del estado nutricional de los pacientes, y ajustar la dosis de enzimas pancreáticos o de suplementos vitamínicos en caso necesario.
El objetivo del seguimiento es la detección del desarrollo de insuficiencia endocrina, de insuficiencia exocrina o de complicaciones. No está establecido con qué periodicidad han de hacerse los controles. Una regla prudente sería hacer controles clínicos y analíticos cada 6 o 12 meses en pacientes con enfermedad estable24. En la analítica hemos de incluir parámetros nutricionales, vitaminas liposolubles, micronutrientes, vitamina B12, ácido fólico, ferritina y hemoglobina glicada24. Es aconsejable también determinar elastasa fecal cada 24 meses si no había IPEx previa, o si aparece deterioro nutricional, pérdida de peso o ha habido nuevos brotes de pancreatitis.
En caso de aparición de síntomas o sospecha de complicaciones debemos solicitar pruebas de imagen. En pacientes que ya presenten complicaciones el seguimiento ha de ser individualizado y dependerá del tipo y gravedad de la complicación (ver parte 3 de esta serie).
Es importante hacer valoraciones del estado nutricional incluyendo medidas de índice de masa corporal y de sarcopenia24. También se ha de comprobar si se necesitan suplementos vitamínicos y hacer recomendaciones dietéticas. Hemos de comprobar que el paciente se adhiera bien al tratamiento, en particular a la dosificación de enzimas. En caso de resultados subóptimos es el momento de valorar aumentar la dosis o introducir algún otro cambio terapéutico.
Es conveniente practicar una densitometría ósea basal, y cada 2 años si se detecta osteopenia36.
El curso clínico es impredecible. No existe un modelo para evaluar la enfermedad, gravedad, progresión o predicción de resultados de tratamiento. El abandono del alcohol y del tabaco reduce las reagudizaciones, el dolor, la progresión, el riesgo de complicaciones, el riesgo de cáncer y prolonga la vida44.
Diagnóstico precoz del cáncer de páncreasSCD-SCPanc 26. En caso de establecer una indicación de diagnóstico precoz aconsejamos realizar USE y resonancia magnética (RM) en el cribado inicial y dejar la RM para el seguimiento, volviendo a utilizar USE con punción dirigida si aparecen lesiones sospechosas. El cribado y la vigilancia deberían realizarse en centros especializados en enfermedad pancreática.
Actualmente diversos grupos de expertos recomiendan cribado y vigilancia únicamente en casos de pancreatitis hereditaria46, iniciando las investigaciones a partir de los 40-45 años (o 15 años antes del caso de cáncer más joven aparecido en la familia) con vigilancia en intervalos de 1-3 años.
En el resto de pacientes las diversas sociedades médicas no recomiendan ni cribado ni vigilancia. Pero el riesgo de desarrollo de cáncer en PCr oscila entre ×2 y ×15 (incluso ×27)47 y resulta que varios comités proponen programas de cribado en otras enfermedades con riesgos de tan solo ×5 o ×1048,49. Este riesgo es mayor en casos de diagnóstico reciente de PCr, fumadores, portadores de mutaciones genéticas, diabetes reciente o pacientes de edad avanzada47.
Tampoco existe consenso en la literatura sobre qué pruebas realizar para descartar neoplasia en el contexto de una PCr. Las lesiones pequeñas son de difícil identificación con las pruebas de imagen disponibles en un trasfondo de PCr. Sería de gran utilidad disponer de marcadores serológicos sensibles y específicos, condición que no acaba de cumplir el CA 19.9.
FinanciaciónPara la elaboración del presente documento no hemos recibido ninguna forma de financiación.
Conflicto de interesesXavier Molero es consultor para Amadix Advanced Marker Discovery SL (Acera de Recoletos 2, 1B, 47004 Valladolid) en el proyecto de investigación sobre cáncer de AMD-CPA-2016-01.
Xavier Molero es beneficiario de una beca de investigación fundamental sobre fibrosis quística en ratones por parte de Vertex Pharmaceutical Inc., 50 Northern Avenue, Boston, MA 02210, EE. UU.
Ningún otro autor declara ningún tipo de conflicto de intereses.