INTRODUCCIÓN
El término «microcirculación» engloba la pequeña vasculatura, tanto sanguínea como linfática. La microcirculación es necesaria para abastecer a cada célula del organismo de nutrientes y oxígeno para la realización de sus actividades biológicas y, además, se encarga de mantener la homeostasis de los tejidos y de la vigilancia del sistema inmunitario. El desarrollo de los vasos sanguíneos se origina en la embriogénesis mediante el proceso de vasculogénesis, a partir de las células pluripotenciales especializadas llamadas angioblastos1-5. Otro proceso distinto es la angiogénesis, que también da lugar a la formación de nuevos vasos sanguíneos, pero a partir de otros preexistentes, ya sea en la etapa adulta o en la embriogénesis. La angiogénesis se lleva a cabo mediante diversos mecanismos, en los que la membrana basal y extracelular, la migración, la adhesión y la proliferación de las células endoteliales (CE) son esenciales6-8. A su vez, los vasos neoformados se engrosan y se desarrollan en vasos de mayor calibre, lo que se denomina arteriogénesis9-11. De forma paralela al desarrollo de los vasos sanguíneos y de la mayoría de los órganos12, los vasos linfáticos comienzan también a desarrollarse en la etapa embrionaria alrededor de la mitad del período de gestación, aunque existen diversas hipótesis sobre su génesis13-16. La neoformación de vasos linfáticos a partir de vasos sanguíneos o linfáticos preexistentes se denomina linfangiogénesis17-21.
La angiogénesis fisiológica tiene lugar en el ciclo menstrual, en el desarrollo embrionario, en la reparación de los tejidos y en el desarrollo y crecimiento de los huesos22, sin embargo una regulación anómala y descontrolada de este proceso podría conducir a diversas enfermedades: artrosis, artritis reumatoide, retinopatía diabética u otras enfermedades inflamatorias6,7,23. Por eso, la regulación del proceso angiogénico es muy importante para una correcta armonía entre las actividades biológicas del organismo.
En estos últimos años el proceso de neovascularización (tanto sanguínea como linfática) ha adquirido una mayor importancia, ya que se lo considera parte imprescindible para el crecimiento tumoral y la diseminación metastásica4,24,25. En las enfermedades en las que existe un desarrollo vascular anormal, el problema reside en que, tras la acción proangiogénica, el organismo no recupera un estado de equilibrio entre las moléculas proangiogénicas y antiangiogénicas, tal y como ocurre en condiciones fisiológicas, sino que este balance continúa tendiendo hacia los mediadores que favorecen la formación de nuevos vasos; podría decirse que el organismo pierde el control en la regulación del proceso angiogénico.
La enfermedad inflamatoria intestinal (EII) es un transtorno inflamatorio recurrente que principalmente engloba 2 entidades clínicas, ambas de etiología desconocida: la colitis ulcerosa (CU) y la enfermedad de Crohn (EC). En estos últimos años se ha profundizado notablemente en el conocimiento de su patogenia, y uno de los enfoques en su estudio se dirige hacia el papel que puede tener el nuevo desarrollo vascular (angiogénesis y linfangiogénesis, principalmente) en la patogenia de las EII.
Como el proceso inflamatorio parece íntimamente ligado al angiogénico26,27, sería importante abordar el estudio del desarrollo vascular en la EII, para dilucidar si está implicado en la patogenia de esta enfermedad o en su progresión a formas más graves.
En el presente artículo se pretende revisar los conocimientos que, aunque escasos, existen hasta ahora sobre la implicación de la formación de nuevos vasos en la patogenia de la CU y la EC. Para ello se ha efectuado una búsqueda bibliográfica en Internet hasta noviembre de 2005 empleando el motor de búsqueda PubMed, con los siguientes descriptores o palabras clave (en todos los campos de búsqueda): (ulcerative colitis OR Crohn's disease OR inflammatory bowel disease) AND (angiogenesis OR lymphangiogenesis OR vasculogenesis OR vascular development OR VEGF OR vascular endothelial growth factor).
EL DESARROLLO VASCULAR
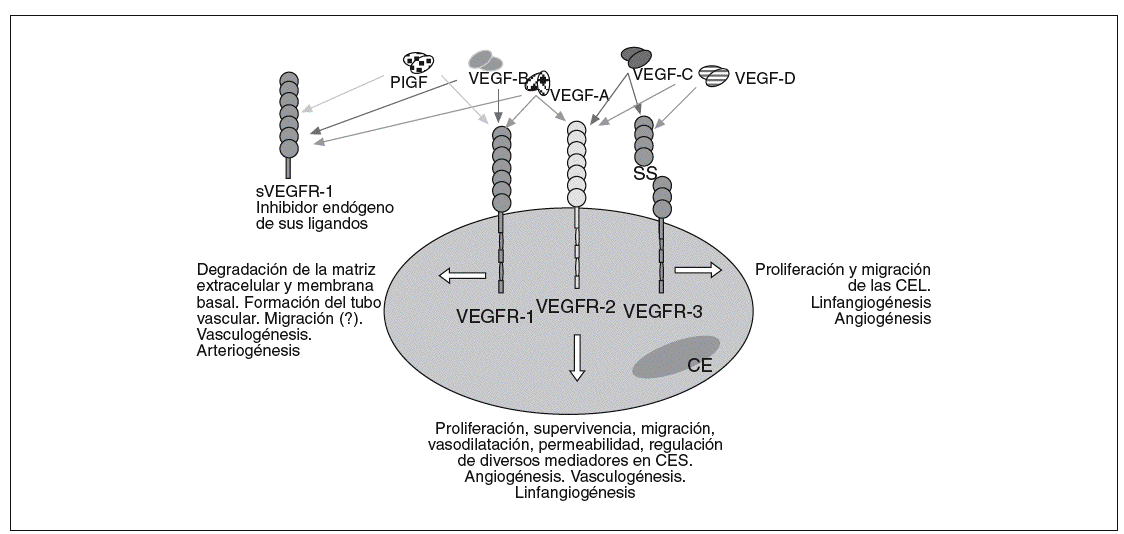
La clave en el proceso de angiogénesis y linfangiogénesis reside en las CE, los pericitos y los mediadores que influyen en sus actividades biológicas. De ahí que gran parte de los trabajos de investigación en el campo del desarrollo vascular se hayan dirigido al estudio de estos últimos. Entre estos mediadores destacan los miembros de la familia génica del factor de crecimiento del endotelio vascular (VEGF)9,28, cuyo papel es relevante en la vasculogénesis2,3, angiogénesis29, arteriogénesis10,11 y linfangiogénesis30-32, debido a su implicación tanto en la proliferación y supervivencia como en la migración e invasión de las CE (fig. 1). Hasta la fecha, en humanos se han identificado 5 miembros de esta familia génica23,29,33: VEGF-A (VEGF), VEGF-B, VEGF-C, VEGF-D y PlGF (tabla I).
Fig. 1. Unión de los miembros de la familia génica del factor de crecimiento del endotelio vascular (VEGF) con sus receptores en las células endoteliales. CE: célula endotelial; CES: células endoteliales de los vasos sanguíneos; CEL: células endoteliales de los vasos linfáticos; PIGF: factor de crecimiento placentario; sVEGFR-1: receptor del factor de crecimiento del endotelio vascular 1 soluble; VEGFR-1: receptor del factor de crecimiento del endotelio vascular 1.
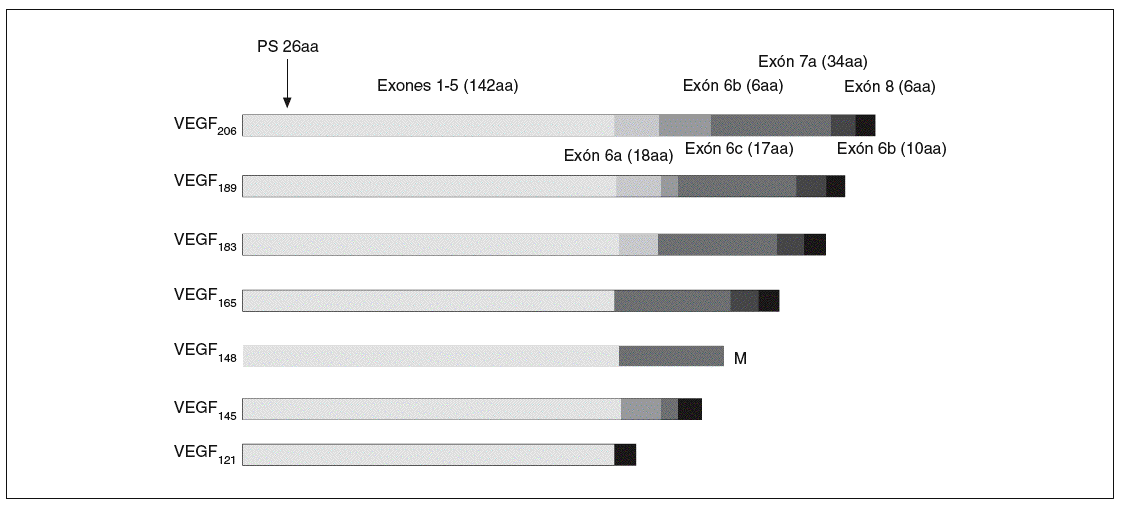
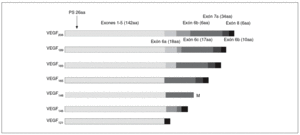
El ARNm del VEGF-A da lugar, mediante un procesamiento alternativo, a las distintas isoformas28,29,34: VEGF121, VEGF145, VEGF148, VEGF165, VEGF183, VEGF189, y VEGF206 (fig. 2). Estas isoformas son secretadas en forma de homodímeros unidos covalentemente, y cada una de ellas tiene distintas propiedades bioquímicas dependiendo, en gran parte, de su capacidad de unión a la heparina29,35. Las CE representan la diana preferencial del VEGF-A, que mediante la unión con sus receptores de membrana tipo tirosincinasa28, VEGFR-1 (o Flt-1) y VEGFR-2 (o Flk-1) y sus correceptores, la integrina *Vß5, la neuropilina 1 y la VE-cadherina, desencadena una transducción de señales que da lugar a sus numerosos y variados efectos biológicos29: supervivencia36 y antiapoptosis37, proliferación, migración38, regulación génica y expresión de proteínas y otros factores, permeabilidad y vasodilatación. El VEGF-A parece estar regulado por estímulos como la hipoxia35, factores de crecimiento, mutaciones de p53, óxido nítrico y por distintas citocinas inflamatorias40. Este factor de crecimiento tiene un papel muy importante en el desarrollo vascular fisiológico (embriogénesis, crecimiento del esqueleto y formación de huesos endocondriales, reparación de tejidos o ciclo menstrual), pero también está implicado en el desarrollo vascular patológico (tumores sólidos y metástasis41, síndromes de neovascularización ocular, inflamación9 o enfermedades del aparato reproductor femenino29).
Fig. 2. Isoformas del gen del factor de crecimiento del endotelio vascular A (VEGF-A). PS: péptido señal; aa: aminoácidos.
El VEGF-B, tras su interacción con el receptor, VEGFR-1 y con el correceptor neuropilina-1, lleva a cabo sus funciones, aún poco definidas9. Lo que sí se conoce hasta el momento es que este miembro de la familia génica del VEGF no tiene una gran potencia mitogénica y que parece estar implicado en la degradación de la matriz extracelular, ya que indirectamente activa el plasminógeno42. Por su parte, la expresión de VEGF-B no parece estar regulada por la hipoxia43.
El VEGF-C y el VEGF-D son sintetizados en forma de prezimógenos, que mediante procesamiento proteolítico dan lugar a la proteína madura y activa, la cual tiene una elevada afinidad por el receptor de VEGF, VEGFR-3 o Flt-49. Tras la unión con dicho receptor y con el correceptor, neuropilina 2, se desencadena el proceso linfangiogénico17,43,44. La forma completamente madura de estas proteínas también se une y activa al VEGFR-245, aunque con una menor afinidad46, y puede inducir el crecimiento de los vasos sanguíneos, es decir, la angiogénesis.
De los datos de la bibliografía se podría concluir que el VEGF-A está implicado en el proceso de angiogénesis y que tanto el VEGF-C como el VEGF-D están más relacionados con la linfangiogénesis20,47, aunque no exclusivamente. De hecho, existen estudios recientes que relacionan el VEGF-A con la formación de vasos linfáticos. La manera en que VEGF-A lleva a cabo este proceso aún está por dilucidarse, ya que podría tener lugar a través de su interacción con VEGFR-248 desencadenando directamente la linfangiogénesis, o de forma indirecta, de modo que el VEGF-A regularía la expresión de VEGF-C (que interacciona con VEGFR-3 y da lugar a la formación de vasos linfáticos)49. El VEGF-C y el VEGF-D también pueden dar lugar a la formación de vasos sanguíneos tras su unión con VEGFR-3 y VEGFR-250-52. De hecho, se ha observado que existe una modulación por parte del conjunto VEGF-C/VEGFR-3 de la actividad desencadenada por VEGFR-2, lo que indica una posible interacción entre las señales de transducción de ambos receptores46.
El factor de crecimiento placentario (PlGF), que también tiene distintas isoformas, podría en un principio mediar la arteriogénesis9, aunque también tiene una gran importancia en el proceso de formación de vasos sanguíneos de menor calibre53. Interacciona con VEGFR-1 y puede incluso heterodimerizar9 y actuar especialmente en situaciones patológicas de forma sinérgica con el VEGF-A4,35.
Aparte de la familia de genes del VEGF, existen otros reguladores implicados en el desarrollo vascular7,9,29,54, como son el factor de crecimiento fibroblástico básico51, los factores de crecimiento transformador alfa y beta, el factor de crecimiento hepatocitario, algunas citocinas proinflamatorias, las angiopoyetinas y sus receptores y el factor de crecimiento derivado de plaquetas, entre otros muchos.
ANGIOGÉNESIS Y ENFERMEDAD INFLAMATORIA INTESTINAL
La neoformación de vasos requiere diversos mecanismos y la modificación de cualquiera de ellos podría conducir a una angiogénesis patológica55. Dichos mecanismos podrían clasificarse en:
1. Activación del proceso angiogénico. En la EII, el proceso angiogénico se iniciaría con una inclinación de la balanza entre mediadores proangiogénicos y antiangiogénicos a favor de los primeros, de modo que las CE, que normalmente están quiescentes, se activarían. La activación de dichas células conlleva la secreción de ciertas citocinas y factores de crecimiento que conducen a la célula hacia la proliferación, la migración y la invasión necesarias para la formación de los nuevos endotelios.
Diversos estudios apuntan a que la señal activadora que altera el equilibrio en el espacio y en el tiempo de las múltiples señales reguladoras podría ser la hipoxia, que a su vez estimula el factor inducible por hipoxia. Este factor promueve la expresión de varios tipos de genes relacionados con la angiogénesis (como los miembros de la familia VEGF y sus receptores), con la supervivencia celular e inhibición de la apoptosis y con el metabolismo glucídico56,57. En relación con la EII, se ha observado la sobreexpresión del factor inducible por hipoxia en el suero de pacientes con EC y CU57. Además de regular estos genes, el factor inducible por hipoxia también promueve la síntesis de óxido nítrico que, en conjunto con otros factores proangiogénicos, actúa en los vasos dilatándolos aumentando así su permeabilidad, lo que permite la extravasación de células inflamatorias y proteasas.
2. Degradación de la membrana basal. Dentro del grupo de las proteasas cabe destacar las denominadas metaloproteasas de la matriz (MMP), que degradan la matriz extracelular58. Se ha estudiado la concentración de algunas de estas MMP y de sus inhibidores en pacientes con EII, y se han observado valores incrementados de las primeras y disminuidos de los segundos en el suero de dichos enfermos59-62.
3. Proliferación y migración de las CE. Las CE, gracias a la acción de las integrinas y las moléculas de adhesión, migran por el espacio que se ha creado tras la degradación de la matriz extracelular38,63. Simultáneamente, las CE siguen secretando y sintetizando factores de crecimiento proangiogénicos, que junto a las citocinas liberadas por monocitos/macrófagos actúan de forma paracrina, endocrina y autocrina, activando otras CE. De este modo se origina un mecanismo de retroalimentación positivo, y se produce la diferenciación, la migración y la proliferación de los endoteliocitos. Las nuevas CE se ordenan, se tunelizan y se ramifican, dando lugar al nuevo vaso.
4. Estabilización de los vasos. El proceso angiogénico terminaría con la estabilización de los vasos gracias al reclutamiento de pericitos64, que, a su vez, sintetizan péptidos vasoactivos, factores de crecimiento, citocinas y la matriz extracelular.
Tras la estabilización y estructuración de la nueva red vascular, la angiogénesis fisiológica llegaría a su fin y el balance entre los mediadores angiogénicos volvería a su normalidad, es decir, al equilibrio entre los factores proangiogénicos y antiangiogénicos. Sin embargo, en la angiogénesis patológica, en concreto en los procesos neoplásicos, no se produce la estabilización y reestructuración habituales, sino que la morfología de la vasculatura es abundante y carece de la jerarquía convencional. En ocasiones, las CE pueden formar pequeños tabiques en el interior de los vasos neoformados. Los pericitos se distribuyen aleatoriamente, son más escasos y están distanciados de las CE, y se crea un espacio intercelular. La membrana basal también es anormal, ya que tiene en diversas regiones varias capas, que hacen que su grosor aumente64,65.
Existen estudios, relativamente recientes, que han evaluado los valores en suero o en mucosa de distintos mediadores del desarrollo vascular en la EII, como se resume a continuación:
1. VEGF. Como se ha mencionado previamente, este factor de crecimiento desencadena múltiples efectos que favorecen el desarrollo vascular y podrían promover la inflamación mediante el aumento de la permeabilidad vascular, ya que de esta forma facilitaría la extravasación de leucocitos a la zona lesionada. En suero, y con el empleo del método cuantitativo de ELISA (Enzyme-Linked Immunosorbent Assay), la mayoría de los autores observan un incremento de las concentraciones de VEGF en pacientes con CU y EC activa en comparación con controles sanos66-68. Algunos grupos demuestran incluso una correlación de estos valores con la actividad clínica de la enfermedad69 o con el flujo sanguíneo intramural, medido con la técnica Doppler color en el caso de pacientes con EC68. Por otra parte, parece que los valores de VEGF entre pacientes con EII quiescente y controles sanos no varían de forma significativa67. Se han observado concentraciones elevadas de este factor de crecimiento en presencia de fístulas, aun en ausencia de manifestaciones clínicas, endoscópicas e histológicas67. También mediante la técnica ELISA se ha detectado en el sobrenadante del cultivo de las biopsias de mucosa de colon70 y de células periféricas mononucleares sanguíneas71, un aumento en las concentraciones de VEGF en pacientes con EC y CU activa, en comparación con pacientes en remisión y controles sanos, sin diferencias significativas en estos últimos 2 grupos. No obstante, otros autores no han podido demostrar diferencias en la expresión de VEGF en células mononucleares sanguíneas entre los distintos grupos activos y remisión de pacientes con CU72. Mediante el uso de técnicas de inmunohistoquímica, se ha detectado una mayor expresión de VEGF sobre las CE66 y fibroblastos y dentro del epitelio. También se ha observado una acumulación de leucocitos que producen VEGF en la mucosa inflamada73, aunque no se ha evidenciado expresión de VEGF en células inflamatorias66. Mediante Western blot, reacción en cadena de la polimerasa-transcriptasa inversa (RT-PCR) e inmunohistoquímica con anticuerpos específicos, se ha estudiado la expresión de algunas de las proteínas que intervienen en la cascada de señalización de VEGF-Ets-1, como son el VEGF y sus receptores y el factor de transcripción Ets-1, en la mucosa colónica de pacientes con EII. Así, todos ellos estaban expresados de forma elevada en la mucosa inflamada de los pacientes con CU, pero no en el caso de los pacientes con EC74. Sin embargo, cabe mencionar que hay también trabajos que concluyen que la CU podría no ser una enfermedad dependiente del VEGF72,75.
En conclusión, y tras analizar los resultados obtenidos por diversos grupos, parece haber un acuerdo en la implicación del VEGF en el desarrollo de la CU y la EC, ya sea regulando una angiogénesis fisiológica (la reparación de la mucosa dañada) o patológica, la cual favorecería la inflamación crónica característica de estas enfermedades.
2. Factor de crecimiento fibroblástico básico. Promueve la angiogénesis y diversos procesos biológicos, como la proliferación de células mesenquimales y la progresión tumoral. En pacientes con CU existe una elevada secreción de este factor por parte de la mucosa intestinal, que varía según su localización anatómica y que está en estrecha relación con los marcadores bioquímicos de inflamación y de permeabilidad76. Asimismo, algunos autores han observado concentraciones elevadas en suero de niños con EC y además estos valores se correlacionaron positivamente con la actividad clínica de la enfermedad; sin embargo, no se apreció esta correlación en los niños con CU77. En cambio, otros autores han observado que las concentraciones séricas de este factor están significativamente elevadas tanto en pacientes con CU como con EC66, coincidiendo con los resultados anteriormente citados76. El aumento de los valores en suero también se ha correlacionado con el grosor de la pared intestinal68. Finalmente, mediante la técnica de inmunohistoquímica se ha detectado sobreexpresión de este factor en las CE de la mucosa colónica de pacientes con EII66.
3. El factor de crecimiento hepatocitario. Es una proteína esencial para la regeneración de la mucosa intestinal dañada78. Se han observado concentraciones elevadas de este factor en suero de niños o adultos jóvenes con EII en comparación con controles sanos79. Además, estos valores se han correlacionado directamente con la actividad de la enfermedad79. Dicho aumento en las concentraciones del factor de crecimiento hepatocitario en suero indica que éste puede mediar la angiogénesis y la permeabilidad vascular en la mucosa inflamada en niños con EII79. Recientemente, diversos estudios han demostrado que la administración del factor de crecimiento hepatocitario recombinante o terapia génica para éste disminuye la gravedad de la EII en modelos experimentales animales78,80.
4. Factor de crecimiento derivado de plaquetas de la célula endotelial. Es un mitógeno endotelial que tiene actividad quimiotáctica para las CE in vitro y es angiogénico in vivo81. Parece estar implicado en la remodelación de la vasculatura existente en fases tempranas del desarrollo tumoral82. Está muy expresado en varios tipos de cánceres83-85 y en tejidos inflamados en enfermedades como la artritis reumatoide y la psoriasis, en las que la angiogénesis es esencial86,87. En la mucosa inflamada de pacientes con EII parece haber una mayor expresión de este mitógeno predominantemente sobre macrófagos y fibroblastos, y además se ha descrito una correlación entre la expresión de este factor y el grado de inflamación, lo que indica un papel relevante en la angiogénesis y en la reparación tisular presentes en las enfermedades inflamatorias88.
5. Factor de crecimiento placentario (PlGF). Se han constatado concentraciones séricas significativamente elevadas de este factor en niños con EII activa, tanto con EC como con CU, en comparación con aquellos que están en remisión89. Por el contrario, en adultos no se han observado diferencias en las concentraciones séricas de este factor entre pacientes con CU y controles sanos72.
6. Factor de necrosis tumoral alfa. Es una citocina multifuncional que parece regular la expresión de VEGF. Se encuentra muy expresada en suero, mucosa y deposiciones de enfermos con EII90,91, lo que podría estar asociado a un polimorfismo presente en el promotor del gen que afecta a la interacción entre los factores de transcripción de OCT-1 y NF-*B necesarios para su activación en monocitos92. En pacientes con CU se han observado concentraciones elevadas en suero de los receptores I y II del factor de necrosis tumoral alfa, que se correlacionan con la actividad de la enfermedad93.
7. Angiogenina. Es una proteína plasmática de unos 14 kDa con actividad angiogénica y ribonucleolítica94,95. De forma indirecta genera plasmina, que degrada la laminina y la fibronectina de la membrana basal96. La destrucción de dicha membrana es un requisito para que se pueda producir la migración de las CE durante la neovascularización97. En enfermos con CU no se han observado concentraciones elevadas de angiogenina en comparación con controles sanos72, aunque sí se ha descrito que los pacientes con estadios tempranos de la enfermedad tienen concentraciones inferiores que aquéllos con una larga evolución98.
8. Moléculas de adhesión. Los valores séricos de moléculas de adhesión solubles, como la E-selectina, la P-selectina, la molécula de adhesión del endotelio vascular y la molécula de adhesión intercelular son menores en pacientes con EII en períodos de remisión, lo que podría indicar una disfunción del proceso angiogénico y de la reparación de heridas72.
9. MMP. Parece que tanto las MMP como sus inhibidores son expresados por células inflamatorias y fibroblásticas, predominantemente en la base de las úlceras de áreas inflamadas, pero escasamente en mucosa inflamada intacta, lo que indica que estas moléculas están implicadas en la remodelación de tejidos y la angiogénesis y que promueven la extravasación de leucocitos hacia el área inflamada en la base ulcerosa tanto de la CU como de la EC61.
LINFANGIOGÉNESIS Y ENFERMEDAD INFLAMATORIA INTESTINAL
El proceso de linfangiogénesis tiene en la actualidad una gran importancia, ya que parece estar implicado en el crecimiento tumoral y en la diseminación metastásica48. De hecho, la linfangiogénesis alrededor de tumores sólidos podría promover las metástasis linfáticas mediante la intravasación de células tumorales en los vasos linfáticos9.
El edema representa una característica clínicamente evidente de las enfermedades inflamatorias, como las EII. Se produce cuando la cantidad de fluido proveniente de los vasos sanguíneos inflamados excede la capacidad de drenaje de los vasos linfáticos99. En estas condiciones, y con la participación de determinados mediadores, podría favorecerse la proliferación de los vasos linfáticos (linfangiogénesis) como consecuencia de la inflamación. En cualquier caso, los mecanismos moleculares que inducen la formación de estos vasos linfáticos y las consecuencias biológicas y funcionales que ello tiene en la edad adulta están todavía por dilucidarse.
Poco se conoce sobre el fenómeno de linfangiogénesis en la EII. Según la bibliografía revisada, existe únicamente un estudio que ha evaluado la presencia de nuevos vasos linfáticos en la mucosa afectada de CU de larga evolución100. Los autores concluyen que la inflamación crónica no parece conducir a la neoformación de vasos linfáticos. Así, señalan que la ligera linfangiogénesis observada en la mucosa colónica afectada podría deberse a los cambios estructurales en ella100.